猪TGFβR和TGFβ1基因多态性与产活仔数的关联分析
2016-04-11徐梦思黄涛马亮王斌虎刘丽
徐梦思++黄涛++马亮++王斌虎++刘丽娟++翟腾蛟++马力鹏

摘要:为探讨猪转化生长因子β1(TGFβ1)及其受体(TGFβRⅠ)基因多态性与大白猪和长白猪产活仔数的相关性。采用PCR-SSCP方法检测了[WTBX][STBX]TGFβ1[WTBZ][STBZ]第6内含子和TGFβR[QX(Y15]Ⅰ[QX)]第7内含子中与猪繁殖力相关的2个突变位点在大白猪和长白猪(共计232头)中的单核苷酸多态性,同时分析多态位点基因型与大白猪和长白猪产活仔数的关联性。结果发现:[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第7外显子上游的第9位碱基存在C→T突变,在大白猪和长白猪中均检出CC和TT 2种基因型,且不同基因型对2猪种产活仔数的影响差异不显著(P>0.05);TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子第808位碱基存在A→G突变,在大白猪中检出AA、AG、GG 3种基因型,长白猪中未检出GG基因型,大白猪中GG型母猪产活仔数极显著高于AA型(P<0.01),长白猪中,AA型和AG型产活仔数的影响差异不显著(P>0.05)。研究结果表明,[WTBX][STBX]TGFβ1基因的突变位点对大白猪和长白猪的产活仔数没有显著影响,TGFβR[QX(Y15]Ⅰ[QX)]基因多态位点与母猪产活仔数显著相关,可作为猪分子遗传育种的候选基因,加快猪育种进程。
关键词:猪;基因;TGFβR[QX(Y15]Ⅰ[QX)]基因;PCR-SSCP;产活仔数
中图分类号: S828.2文献标志码: A
文章编号:1002-1302(2016)02-0038-04
收稿日期:2015-03-20
基金项目:国家自然科学基金(编号:30901014、31460586);留学回国人员科研启动基金。
TGFβ1是转化生长因子家族的重要成员之一,具有促进细胞生长、分化、迁移,参与免疫调节、细胞外间质形成、创伤愈合、组织修复、胚胎发育等生物学功能[1]。其受体TGFβRⅠ属于丝氨酸/苏氨酸激酶受体家族,在大多数细胞和组织中普遍表达,其胞内区具有丝氮酸/苏氨酸激酶结构域,即GS区,具有激酶活性。在TGFβ/SMAD信号通路的信号转导是由有活性的TGFβ1首先和TGFβRⅡ结合形成异源二聚体复合物,该异源二聚体能够使TGFβRⅠGS区的丝氨酸和苏氨酸磷酸化,激活TGFβRⅠ激酶,活化的TGFβRⅠ激酶再与下游的SMADs蛋白家族发生磷酸化,从而将配体信号跨膜转导入细胞核中,进而引起一系列的生物学效应[2]。TGFβ1与其受体TGFβRⅠ直接参与下丘脑-垂体-卵巢轴的调控,在促进卵子成熟,黄体形成,及子宫内膜及滋养细胞的增殖与分化方面起着重要的作用[3]。
已有研究证实,TGFβ1与动物繁殖有着密切的关系,TGFβ1在卵巢细胞内的表达随着动物物种、卵泡发育阶段的不同而有所差异,但在多种动物卵泡发育阶段都呈时空性表达[4];Wimmers 等通过 PCR-SSCP 检测到皮特兰猪、柏林小型猪,在TGFβ1第 5 外显子的 798 碱基(AF461808)存在1个单核苷酸多态(SNP)[5];武艳萍等研究发现大白猪[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因多态性与产仔数间呈显著关联(P<0.05)[6];王嘉博发现[WTBX][STBX]TGFβ1[WTBZ][STBZ] 基因T4位点的 AA 型总产仔数最高,对母猪生产性状的影响极显著,对仔猪出生体质量及断奶体质量影响不显著[7]。李海晶等研究发现大白猪TGFβR[QX(Y15]Ⅰ[QX)]基因多态性与产仔数间呈显著关联(P<0.05)[8]。根据以上TGFβR[QX(Y15]Ⅰ[QX)]基因和[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因对繁殖的影响,本试验以TGFβR[QX(Y15]Ⅰ[QX)]和[WTBX][STBX]TGFβ1[WTBZ][STBZ]作为候选基因进行研究,选取大白猪111头,长白猪121头为研究材料,采用PCR-SSCP技术,对猪[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6内含子和TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子进行多态性检测,分析其多态性与猪产仔数之间的关联性,为进一步提高猪繁殖性能,实现猪的遗传改良提供理论依据。
1材料与方法
1.1试验材料
本试验选取健康无病的大白猪111头和长白猪121头,分别来自新疆科盛种猪场和新疆142团种猪场,用耳号钳采集耳组织样本0.1 g,置于70%乙醇溶液中,-80 ℃保存备用。
1.2试验试剂
Taq MIX,购自CWBIO公司;DNA marker、DNA提取试剂盒、胶回收试剂盒,购自TIANGEN公司;pGEM-T Vector、T4 DNA连接酶,购自Promega公司;大肠杆菌DH5α感受态细胞,为石河子大学动物遗传育种与繁殖实验室保存。
1.3猪耳组织DNA的提取
取猪耳组织,用灭菌小剪刀充分剪碎,处理样品过程中需注意剪刀的消毒,避免交叉污染。根据TIANGEN动物组织DNA提取试剂盒操作步骤提取猪耳组织基因组DNA。
1.4PCR-SSCP引物设计
根据已知的猪[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6内含子区的1 156 bp序列(序列:AJ621785中的第1 043位点)[6]和TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子区的1 259 bp序列中突变位点(序列:DQ519377中的第65 753位点)[8],利用Primer 50软件设计扩增[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]的特异性上下游引物。引物由北京华大生物工程技术服务有限公司合成,引物序列(表1)。
1.5PCR扩增
以猪耳组织DNA为模板,使用Taq Mix试剂进行PCR扩增,PCR反应体系为20 μL:Mix 10 μL,上下游引物各0.8 μL(10 μmol/L),DNA 1 μL,补ddH2O 至总反应体系为20 μL。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,退火30 s,72 ℃延伸30 s,共35个循环;72 ℃终延伸5 min;保存4 ℃。PCR产物经2.0%琼脂糖凝胶电泳检测。
1.6PCR-SSCP
根据PCR产物片段的大小,[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因分别使用10%和12%非变性聚丙烯酰胺凝胶进行检测。取 3 μL 扩增条带明亮单一、片段大小符合预期的PCR产物和 8 μL Loading buffer,瞬时离心混匀。PCR仪98 ℃变性 10 min 后迅速冰浴10 min,取10 μL变性后的PCR产物上样。120 V稳压电泳12 h,银染显带,确定纯合子和杂合子带型,并拍照记录。
1.7PCR产物的克隆测序
利用普通琼脂糖回收试剂盒对PCR-SSCP检测到的同一引物不同带型的PCR产物进行回收,将纯化产物与pGEM-T载体连接,连接体系为:2×Rapid Ligation buffer 5 μL,PCR 产物3 μL,pGEM-T Vector 1 μL,T4 DNA Ligase 1 μL,PCR仪中16 ℃连接过夜。然后将连接产物转化到大肠杆菌DH5α感受态细胞,涂布平板,37 ℃过夜培养,挑选阳性菌落,37 ℃扩大培养8 h,将选取的阳性菌株送交北京华大生物工程技术服务有限公司测序。
1.8数据统计
根据PCR-SSCP银染显影带型的显示,统计计算等位基因的基因频率和基因型频率,利用SPSS 17.0软件中的 One-way ANOVA方法进行方差分析,LSD法进行组间差异显著性检验,分析[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]不同基因型与大白猪和长白猪产活仔数性状的相关性,不同基因对应的产活仔数用平均值±标准差表示。
2结果与分析
2.1PCR-SSCP检测结果
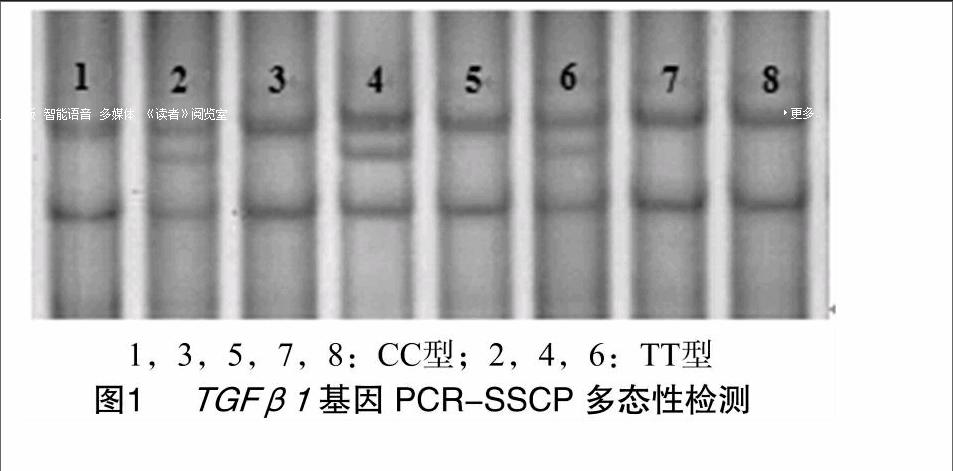
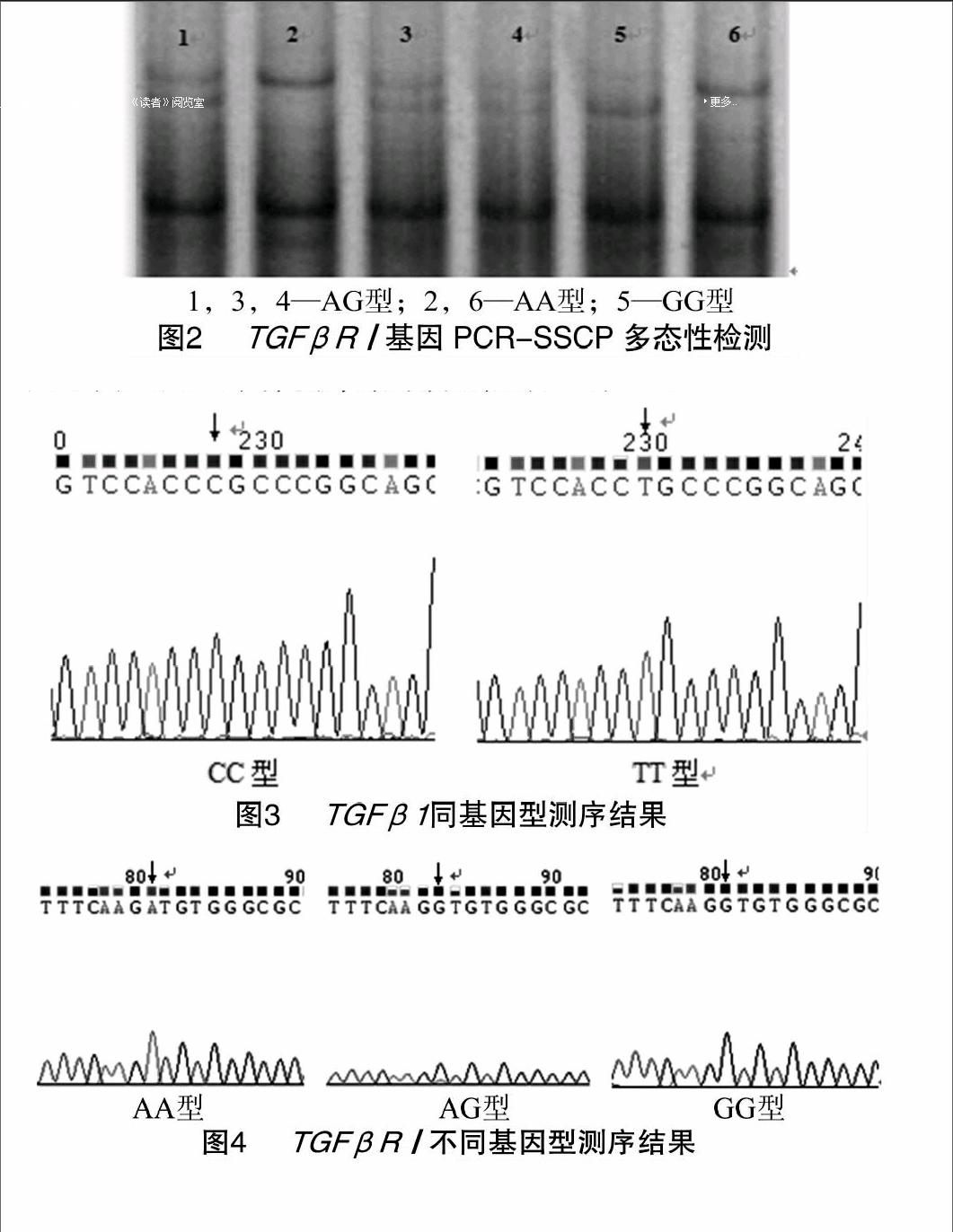
对猪耳组织DNA用[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6内含子和TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子特异性引物扩增,对扩增产物分别进行10%和12%非变性聚丙烯酰胺凝胶电泳检测。在2个猪种[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因引物扩增片段均上发现1个突变位点,检测到2种基因型,分别命名为CC型和TT型,结果见图1;在2个猪种TGFβR[QX(Y15]Ⅰ[QX)]基因引物扩增片段上均发现1个突变位点,大白猪中检测到3种基因型,长白猪中检测到2种基因型,分别命名为AA型、AG型及GG型,结果见图2。
2.2测序结果及分析
经SSCP分型后,将不同基因型个体的PCR产物用普通琼脂糖胶回收试剂盒纯化回收后连接pGEM-T载体,转化大肠杆菌DH5α送样测序。测序结果经DNAMAN和Chrimas软件分析后,发现在[WTBX][STBX]TGFβ1[WTBZ][STBZ]引物扩增片段的第156碱基处发生了C→T突变,此突变位点位于[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第7外显子上游的第9位碱基(序列:AJ621785中的第1 043位点)。TGFβR[QX(Y15]Ⅰ[QX)]引物扩增片段的第112碱基处发生了A→G突变,此突变位点位于TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子第808位碱基(序列:DQ519377中的第65 753位点)。[WTBX][STBX]TGFβ1[WTBZ][STBZ] 和TGFβR[QX(Y15]Ⅰ[QX)]基因不同基因型个体测序结果分别见图3、图4。
2.3不同猪种[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因的等位基因和基因型频率分析
对[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因在大白猪和长白猪中的基因频率和基因型频率进行统计(表2、表3),[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因在大白猪和长白猪中均检测到CC、TT 2种基因型,未检测到CT基因型,等位基因C占优势。TGFβR[QX(Y15]Ⅰ[QX)]基因在大白猪中检测到AA、AG、GG 3种基因型,等位基因A占优势;在长白猪中检测到AA、AG 2种基因型,未检测到GG基因型,等位基因A占优势。
2.4[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]不同基因型对猪产活仔数的影响
利用SPSS 17.0软件对统计结果进行One-way ANOVA分析,LSD法进行组间差异显著性检验,分析[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]各突变位点不同基因型与母猪产活仔数性状的相关性,不同基因对应的产活仔数用平均值±标准差表示。结果(表4)显示[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因在大白猪和长白猪中,CC型和TT型产活仔数之间均没有显著差异(P>0.05),产活仔数趋势均为TT>CC。TGFβR[QX(Y15]Ⅰ[QX)]基因大白猪中,GG型和AG型产活仔数极显著高于AA型(P<0.01),GG型产活仔数显著高于AG型(P<0.05),产活仔数趋势为GG>AG>AA;长白猪中,AA型和AG型产活仔数之间差异不显著,产活仔数趋势为AG>AA。
2.5[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]合并基因型对猪产活仔数的影响
将检测出的[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因 C→T突变位点与TGFβR[QX(Y15]Ⅰ[QX)]基因A→G突变位点合并基因型,在检测猪群中则存在CCAA、CCAG、CCGG、TTAA、TTAG和TTGG 6种合并基因型。以[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因和TGFβR[QX(Y15]Ⅰ[QX)]基因的合并基因型为参数对不同猪种产活仔数进行分析,大白猪群中TTGG合并基因型的产活仔数最高,为11.54头/胎,平均比最低的CCAA合并基因型的产活仔数多1.81头/胎。长白猪中4种合并基因型产活仔数的平均值之间相差较小(表5)。
3讨论与结论
繁殖性状是猪的重要经济性状之一,它的优劣不仅直接影响母猪的繁殖生产力,而且直接影响养猪生产的经济效益[9-10]。近年来,转化生长因子β超家族成员在动物繁殖中的作用被广泛研究,TGFβ1和TGFβRⅠ作为转化生长因子β超家族重要成员,它们在动物繁殖中的作用也受到越来越多的关注。
TGFβ1是一种具有多种生物学功能的细胞因子,在正常的组织、细胞和转化细胞中均存在。TGFβ1可以通过调节基因表达来发挥维持机体正常生理过程和生命活动的重要作用。现已有研究表明TGFβ1在卵巢组织中高表达,与卵泡发育、颗粒细胞的增殖、分化和排卵有关[11]。TGFβ1参与颗粒细胞与膜细胞以及颗粒细胞与卵母细胞之间的双向通话[12]。因而我们将[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因作为繁殖性状的候选基因,参考武艳萍等、王嘉博发现的研究结果设计引物,[HJ1.4mm]利用单链构象多态性聚合酶链技术对该基因第6内含子多态性进行检测,在第7外显子上游的第9位碱基检测出C→T突变,这与武艳萍等人的研究结果一致。对C→T突变进行分析发现,在大白猪和长白猪中导致出现TT、CC 2种基因型,且2个群体中均为C等位基因占优势,T和C等位基因频率相差较大,说明[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因C→T突变的等位基因频率和群体遗传特征在不同品种中较为一致。并对所检测出的SNP位点的不同基因型与猪产活仔数进行了关联性分析,大白和长白经产母猪的产活仔数均表现为TT>CC,在大白猪种中该位点TT型母猪的产活仔数比CC型多0.43头/胎(P>0.05),在长白猪种中该位点TT型母猪的产活仔数比CC型多0.20头/胎(P>0.05)。在这2个品种中T等位基因有利于提高母猪的产活仔数,这反映出[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因可能与猪产活仔数性能密切相关,表明该位点的T基因可以作为猪高产活仔数的一个[HJ]遗传标记。
TGFβRI在卵巢不同发育阶段中均有表达,通过自分泌/旁分泌机制参与卵巢颗粒细胞增殖、卵母细胞成熟和类固醇生成,调节数种关键的颗粒细胞酶,对保持卵巢内的理想环境起着十分重要的作用[13]。目前国内外对猪TGFβR[QX(Y15]Ⅰ[QX)]基因多态性的报道还很少,本研究借鉴李海晶等的研究结果,设计引物,利用PCR-SSCP方法对该基因第7内含子进行多态性检测,检测1个SNP位点,即TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子第808位碱基(序列:DQ519377中的第65753位点)存在A→G突变,这与李海晶等的研究结果存在一定的差异,前人在TGFβR[QX(Y15]Ⅰ[QX)]基因第7内含子中检测出2个SNP位点,并且就 A→G 突变,测序样本中只出现了1种纯合子和1种杂合子,本研究在大白猪群体中检测出AA、AG、GG 3种基因型,而在长白猪群体中只检测出AA、AG 2种基因型。这说明在群体中是存在GG基因型的,长白猪群体中未检出可能是由于GG型出现的比率本身就较低,扩大样本数量可能会检测出。对A→G突变进行分析发现,在大白猪和长白猪2个群体中均为A等位基因占优势,A和G等位基因频率相差较大。分析不同基因型与猪产活仔数之间的关联性,发现大白经产母猪产活仔数表现为GG>AG>AA,长白经产母猪产活仔数表现为AG>AA,大白猪中GG型比AG型和AA型母猪产活仔数分别高出1.83头/胎和3.18头/胎,GG型与AG型母猪产活仔数之间差异显著(P<0.05),与AA型之间差异极显著(P<0.01);而长白猪中AG型比AA型母猪产活仔数高出0.30头/胎,差异不显著(P>0.05)。在这2个品种中G等位基因有利于提高母猪的产活仔数,结合前人的研究结果可进一步证实TGFβR[QX(Y15]Ⅰ[QX)]基因多态性与猪产活仔数显著相关,该基因可以用于猪分子遗传育种的候选基因。
[HS2][HT8.5H]参考文献:[HT8.SS][HJ1.7mm]
[1][ZK(#]Lastres P,Letamendía A,Zhang H,et al. Endoglin modulates cellular responses to TGFβ 1[J]. The Journal of Cell Biology,1996,133(5):1109-1121.
[2]Mulsant P,Lecerf F,Fabre S,et al. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(9):5104-5109.
