大负荷运动对大鼠骨骼肌线粒体融合和分裂蛋白的影响
2016-04-08刘晓然于滢王蕴红阎守扶王瑞元李俊平
刘晓然 于 滢 王蕴红 阎守扶 王瑞元 李俊平

摘要:观察大负荷运动后不同时间点骨骼肌线粒体融合与分裂蛋白的变化,分析与探究线粒体融合与分裂之间的关系及其生理意义。方法:56只SD大鼠经适应后分安静对照组(8只)和运动组(48只),运动模型为一次中大强度离心跑台运动,-16°,20 m/min,90 min。运动大鼠分别在运动后即刻、6 h、12 h、24 h、48 h和72 h(各时间点8只)取比目鱼肌。Western blotting方法分析骨骼肌Mfn1、Mfn2、Opa1、Fis1和Drp1的蛋白表达。结果:Mfn1蛋白在运动后即刻表达升高,而后降低,72 h为最低点;Mfn2蛋白在运动后呈先降后升的变化趋势;Opa1蛋白在运动后表达先降低后升高,24 h为最高点,而后逐渐降低;Drp1蛋白在运动后表达升高,6 h出现高峰,而后逐渐降低;Fis1蛋白在运动后表达升高,12 h为最高点,而后在48 h和72 h表达降低。结论:一次大负荷运动后大鼠骨骼肌线粒体融合、分裂失衡,主要表现为线粒体分裂增强、线粒体融合抑制;而在运动恢复期,骨骼肌线粒体融合、分裂之间重塑平衡状态。
关键词: 大负荷运动;骨骼肌;线粒体;动力学;融合;分裂
中图分类号: G 804文章编号:1009783X(2016)02016705文献标志码: A
Abstract:The purpose of this study was to investigate the changes of mitochondrial fusion and fission in skeletal muscle induced by highload exercise,and to analyze the relations of mitochondrial fusion and fission.Methods:56 SD rats were divided into two groups:control group (8) and exercise group (48).The rats should run on the treadmill,16 °,20m / min,90 minutes.The soleus were taken after exercise immediately,6 hours,12 hours,24 hours,48 hours and 72hours from the rats in exercise groups.WB was used to detect the protein expressions of Mfn1,Mfn2,Opa1,Fis1 and Drp1.Results:The expression of Mfn1 protein increased after the exercise,and then decreased gradually.And the lowest appeared at 72hour after the exercise.There were not remarkable changes of the expression of Mfn2 protein.The expression of Opa1 protein decreased after the exercise,and then increased gradually.And the highest appeared at 24hour after the exercise.The expression of Fis1 protein increased after the exercise,and the peak was at 12hour.But the expressions decreased at 48hour and 72hour after the exercise.Conclusion:A bout of highload exercise leads to imbalanced mitochondrial fission and fusion in skeletal muscle,shown by the enhanced mitochondrial fission and the declined mitochondrial fusion.And the balance of mitochondrial fusion and fission rebuilds after the exercise.
Keywords:highload exercise;skeletal muscle;mitochondria;dynamics;fusion;fission
生物体的很多生命活动,例如细胞能量代谢、发育和凋亡等,都与线粒体繁复的网络结构有着密切的关系。线粒体是一种高度动态的细胞器,其形态时刻都处于变化中。它通过不断的融合分裂,使其形态、分布、数量等都发生着改变,进而通过其氧化磷酸化产生ATP以适应运动过程能量需求的变化[1]。线粒体融合和分裂的动态过程通常被称为线粒体动力学(mitochondrial dynamics),它对细胞能量代谢和收缩功能的维持起着至关重要的作用[2]。
现已发现一些线粒体动力学相关蛋白参与线粒体融合、分裂的精细调控。参与线粒体融合的蛋白主要包括线粒体融合蛋白1/2(Mfn1/2,mitofusin1/2)和视神经萎缩相关蛋白1(optic atrophy1,Opa1)。Mfn1和Mfn2位于线粒体外膜,主要调节线粒体外膜的融合;Opa1 主要调节线粒体内膜的融合。线粒体分裂相关蛋白则包括动力相关蛋白1(dynaminrelated protein 1,Drp1)和分裂蛋白1(fission protein1,Fis1)。两者共同参与线粒体外膜的分裂程序。
目前,大量研究发现,适应强度的运动训练可降低骨骼肌线粒体分裂蛋白的激活,线粒体融合趋向增强[3],而关于大负荷强度运动对线粒体融合分裂的调控尚未见报道。本课题组在前期研究中已发现,大负荷运动可导致骨骼肌线粒体在形态结构和功能上均有一定程度的损伤[4],而线粒体形态结构和功能与线粒体融合、分裂之间的联系密不可分;故本研究以骨骼肌线粒体动力学为研究视角,建立大鼠大负荷运动模型,观察一次运动后不同时间点线粒体融合蛋白(Mfn1、Mfn2和Opa1)、分裂蛋白(Drp1和Fis1)的表达变化,分析线粒体融合、分裂之间的关系及其生理意义,从而为探究大负荷运动导致的骨骼肌线粒体功能损伤提供更丰富的理论支持。
1材料(对象)与方法
1.1实验动物与分组
雄性SD大鼠56只,SPF级,体重(196.16±6.96)g,由北京维通利华实验动物技术有限公司提供,在北京体育大学科研实验中心小动物房内进行饲养和运动训练。分笼饲养,自由饮食和饮水,室温(22±2)℃,相对湿度30%~60%,12 h光照/12 h熄灯模拟日昼交替。
根据运动后不同时间点,将实验动物分为7个组别,即安静对照组(NC)、运动后即刻组(Ep0 h)、运动后6 h组(Ep6 h)、运动后12 h组(Ep12 h)、运动后24 h组(Ep24 h)、运动后48 h组(Ep48 h)和运动后72 h组(Ep72 h),每组8只,见表1。
1.2运动模型的建立
运动模型为一次中大强度离心跑台运动,正式实验前对运动组大鼠进行适应性跑台训练3 d。第1天坡度0°,16 m/min,10 min;第2天坡度-5°,16 m/min,15 min;第3天坡度-10°,16 m/min,30 min;第4天休息;第5天正式实验,坡度-16°,20 m/min,90 min。
1.3测试样本采集与处理
取材时间点设置为运动后的0、6、12、24、48和72 h。取材大鼠经腹腔注射2%戊巴比妥钠(0.25 mL/100 g),腹主动脉取血,快速分离出比目鱼肌,用锡纸包好,保存于液氮中,取材完成后将样本全部保存至-80 ℃冰箱备用。
1.4Western blotting检测
蛋白提取:取适量样品置于液氮研磨,称取0.1 g组织,以1∶9加入预冷的裂解液,匀浆,冰上孵育20 min,4 ℃离心,12 000 r/min,20 min,取上清。
蛋白定量:采用BCA 测试法定量蛋白浓度。
取20 μg总蛋白配制成上样体系,置95 ℃沸水中 5 min,上样前离心。配制分离胶10%,以及5%积层胶。积层胶90 V,40 min;分离胶120 V,通过预染蛋白Marker来确定电泳停止时间。电泳后采用湿法进行蛋白质电转印,300 mA,90~120 min。5% BSA封闭液室温孵育2 h。以5% BSA封闭液稀释一抗Mfn1(1∶500,abcam公司)、Mfn2(1∶1 000,abcam公司)、Opa1(1∶1 000,abcam公司)、Drp1(1∶10 000,Cell Signaling公司)、Fis1(1∶1 000,abcam公司)和GAPDH(1∶1 000,abcam公司),4 ℃ ,过夜。以5% BSA封闭液稀释二抗(1∶5 000,中杉金侨公司),室温孵育2 h。用ECL 发光试剂与膜在暗室中反应、曝光。X光片进行扫描后经ipp 6.0软件对目的蛋白质进行光密度相对定量分析,将每个条带与相应样品的GAPDH条带光密度值进行比较,计算出目的条带的相对含量值。
1.5数据统计法
所有数据用SPSS 13.0统计软件包处理,数据均以平均值±标准差(X±SD)的形式表示。一次性运动的实验数据采用双因素方差分析(Twoway ANOVA),对处理因素(安静对照和运动)和不同的取材时间因素(运动后即刻、6、12、24、48和72 h)的主效应以及两者的交互作用进行分析。如两因素交互作用不显著(P>0.05),则进一步建立非饱和模型进行分析;如两因素交互作用显著,则采用SNKq检验对不同组别间进行比较,并参考Bonferron法与Tukey法的比较结果。统计学显著性水平定为P<0.05。
2结果
2.1一次大负荷运动对骨骼肌线粒体融合蛋白表达的影响
2.1.1大负荷运动后骨骼肌Mfn1蛋白表达的变化
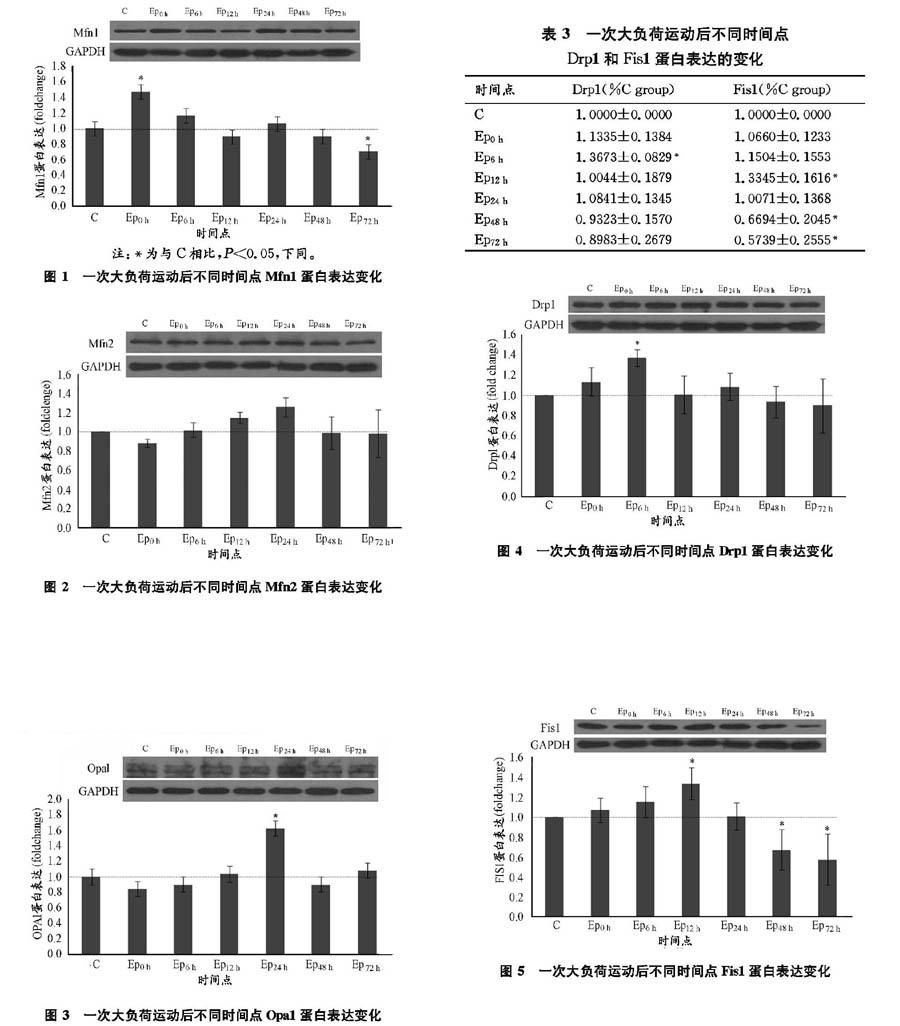
实验结果(表2,图1)显示,骨骼肌Mfn1蛋白表达在一次大负荷运动后即刻显著升高了47.39%(P<0.05),运动后6、12、24、48 h蛋白表达均无明显变化,但在运动后72 h Mfn1表达显著降低了29.73%(P<0.05)。
2.1.2大负荷运动后骨骼肌Mfn2蛋白表达的变化
实验结果(表2,图2)所示,骨骼肌Mfn2蛋白表达在一次大负荷运动后即刻有下降趋势,而在运动后6、12、24 h蛋白表达却有升高趋势,运动后48 h和72 hMfn2表达已基本降至安静对照水平。
2.1.3大负荷运动后骨骼肌Opa1蛋白表达的变化
实验结果(表2,图3)显示,骨骼肌Opa1蛋白表达在一次大负荷运动后即刻、6 h和12 h无明显变化,但在运动后24 h蛋白表达显著升高了62.49%(P<0.05),而运动后48 h和72 hOpa1表达已基本降至安静对照水平。
2.2一次大负荷运动对骨骼肌线粒体分裂蛋白表达的影响
2.2.1大负荷运动后骨骼肌Drp1蛋白表达的变化
实验结果(表3,图4)显示,骨骼肌Drp1蛋白表达在一次大负荷运动后即刻有升高趋势,并在运动后6 h显著升高36.73%(P<0.05),但在运动后12 h、24 h、48 h和72 hDrp1蛋白均无明显变化。
2.2.2大负荷运动后骨骼肌Fis1蛋白表达的变化
实验结果(表3,图5)显示,骨骼肌Fis1蛋白表达在一次大负荷运动后即刻和6 h有升高趋势,并在运动后12 h显著升高了33.45%(P<0.05),在运动后48 h和72 hFis1表达分别显著降低了33.06%(P<0.05)和42.61%(P<0.05)。
3讨论
3.1运动与骨骼肌线粒体融合
线粒体融合是一个复杂的生物过程,主要步骤包括:锚定、外膜融合、内膜融合和基质融合。Mfn1、Mfn2和Opa1在线粒体融合中发挥着各自的作用,且三者之间也存在着相互作用。Mfn1和Mfn2主要调节线粒体外膜的融合。Koshiba等[5]和Pich等[6]的研究发现:Mfn1和Mfn2的C端α螺旋区域可形成同源或异源二聚体,使2个临近线粒体相互靠近,从而融合。Opa1主要调节线粒体内膜的融合。Opa1常以溶解形式定位于线粒体膜间隙或贴附于线粒体内膜,介导线粒体内膜的融合,而且其促融合作用依赖于Mfn1的参与[7]。
各种不同的生理刺激,例如冷环境暴露[8]、运动[910]和限制进食[11]等都可诱发线粒体动力学的改变。Mfn1/2表达上调可引起线粒体融合,使之趋于网络化,而抑制Mfn1/2表达,线粒体则由网络化趋向于分裂成单个线粒体[7]。Ngoh等[12]发现,诱导小鼠心肌Mfn2基因沉默可导致线粒体碎片化。Chen等[13]将H9C2细胞采用局部缺血的方式处理后可引起Opa1蛋白丢失,致线粒体片断化。
本实验发现,骨骼肌Mfn2和Opa1蛋白表达在运动后即刻均有表达下调的趋势。这说明,一次大负荷运动可能会导致骨骼肌线粒体融合抑制。Picard等[9]的研究报道,C57小鼠经过3 h转轮跑后趾长伸肌、红腓肠肌和白腓肠肌的Mfn2和Opa1的蛋白表达均降低。孙卫东等[14]的实验也观察到大鼠骨骼肌线粒体Mfn2基因表达在一次急性运动过程中逐渐降低。实验中还观察到,Mfn1蛋白表达在运动后即刻显著升高了47.39%,有悖于Mfn2和Opa1的变化。Picard等检测比目鱼肌时也观察到Mfn2和Opa1的高表达[9]。究其可能原因,一是与比目鱼肌以慢氧化型肌纤维类型为主有关,二是骨骼肌中Mfn2蛋白水平较高[15],故Mfn1蛋白需大量表达才能与Mfn2形成二聚体结构。
在实验中发现运动后6、12和24 h,Mfn1、Mfn2和Opa1蛋白均有不同程度的表达上调,其中Opa1在运动后24 h显著升高了62.49%,说明骨骼肌线粒体已处于恢复状态,趋向于线粒体融合。Cartoni等[16]的研究认为,人体在运动锻炼24 h后骨骼肌细胞内Mfn1、Mfn2的mRNA表达显著上升。漆正堂等[17]的实验结果说明,大强度间歇性运动后24 h Mfn2基因转录和蛋白表达水平均升高。而陶小平等[18]在实验中发现,一次定量大负荷运动后30、70和110 min Mfn2基因和蛋白表达均有不同程度的下降,而运动后110 min能基本恢复。本实验结果显示,运动后48 h和72 h Mfn2和Opa1蛋白表达均已恢复至安静对照水平。运动负荷的大小与骨骼肌线粒体融合抑制程度呈正相关。
3.2运动与骨骼肌线粒体分裂
线粒体分裂是一个在进化中高度保守[19]的由一系列蛋白精确调控的复杂生物过程。受线粒体外膜分子Fis的趋化,Drp1从胞质转位至线粒体外膜,并富集于潜在的分裂位点,围绕线粒体形成指环结构,并通过水解GTP改变分子间的距离或角度,逐渐压缩直至线粒体断裂,产生2个独立的线粒体。有研究发现线粒体分裂蛋白Drp1的突变可导致线粒体变长,抑制Drp1的表达可导致线粒体融合增强[19]。Smirnova等[20]发现Drp1突变体的过表达导致了核周围簇状线粒体的产生,并增加了线粒体间的连通性。Toshiyuki等[21]研究观察到线粒体分裂蛋白Fis1和Drp1的沉默,可使3T3-L1前体脂肪细胞中的甘油三酯浓度下降,线粒体中Mfn 2和Opa1沉默,可提高甘油三酯浓度;同时还观察到线粒体出现片段化,而且,Ashrafian等[22]研究发现,Drp1基因半敲除的小鼠心肌线粒体数量减少,ATP缺失。
本实验发现,骨骼肌Drp1蛋白在运动后6 h表达显著增加了36.73%,Fis1蛋白在运动后12 h表达也显著增加了33.45%。这说明,一次大负荷运动后可能会诱导骨骼肌线粒体趋向分裂。刘慧君等[23]的实验表明,以中等强度分别运动60 min和90 min,大鼠骨骼肌线粒体分裂蛋白Drp1 mRNA及蛋白表达较安静组显著升高,而且Drp1和Fis1蛋白的表达峰值分别出现在运动后6 min和12 min。从蛋白表达峰值的时序性上观察,Mfn1/2和Opa1蛋白表达也是在运动后6 min或12 min出现低点。数据清晰地表明,线粒体融合蛋白Mfn1/2和Opa1蛋白和分裂蛋白Drp1和Fis1蛋白表达呈现相反的动态变化。
在实验中还观察到,Drp1蛋白和Fis1蛋白在运动后24 h已基本恢复到安静对照水平,这与Ding的实验结果一致,Fis1的转录水平和蛋白含量在运动进行至120~150 min时均明显增加,且持续到整个恢复期直至运动后24 h[24],而且,在运动后48 h和72 h,Drp1蛋白有明显的表达下调趋势,Fis1蛋白表达分别显著降低了33.06%和42.61%。由此说明在运动后48~72 h,骨骼肌线粒体动力学趋于融合,在线粒体融合和分裂之间重塑平衡。
4结论
1)一次大负荷运动后大鼠骨骼肌线粒体融合、分裂失衡,主要表现为线粒体分裂增强、线粒体融合抑制,而在运动恢复期,骨骼肌线粒体融合、分裂之间重塑平衡状态。
2)线粒体动力学是线粒体运动适应的一种早期机制,线粒体融合、分裂参与了细胞对能量需求的快速应答。一次大负荷运动干扰了骨骼肌线粒体动力学平衡,可能导致线粒体功能降低,骨骼肌能量代谢障碍。
参考文献:
[1]OTERA H,MIHARA K.Molecular mechanisms and physiologic functions of mitochondrial dynamics[J].J Biochem,2011,149(3):241.
[2]LIESA M,PALACN M,ZORZANO A.Mitochondrial dynamics in mammalian health and disease[J].Physiol Rev,2009(89):799.
[3]FEALY C ,MULYA A,LAI N,et al.Exercise training decreases activation of the mitochondrial fission protein dynaminrelated protein1 in insulinresistant human skeletal muscle[J].J Appl Physiol,2014(117):239.
[4]刘晓然.离心运动后大鼠骨骼肌微管蛋白和线粒体的关联及针刺干预研究[D].北京:北京体育大学,2013.
[5]KOSHIBA T,DETMER S A,KAISER J T,et al.Structural basis of mitochondrial tethering by mitofusin complexes[J].Science,2004,305(5685):858.
[6]PICH S,BACH D,BRIONES P,et al.The CharcotMarieTooth type 2A gene product,Mfn2,upregulates fuel oxidation through expression of OXPHOS system[J].Hum Mol Genet,2005,14(11):1405.
[7]CIPOLAT S,MARTINS B O,DAL Z B,et al.OPA1 requires mitofusin 1 to promote mitochondrial fusion[J].Proc Natl Acad Sci USA,2004,101(45):15927.
[8]SHABALINA I G,HOEKS J,KRAMAROVA T V,et al. Cold?tolerance of UCP1ablated mice:a skeletal muscle?mitochondria switch toward lipid oxidation with marked UCP3 upregulation not associated with increased basal,fatty acid or ROSinduced uncoupling or enhanced GDP effects[J].Biochim Biophys Acta,2010,1797(6):968.
[9]PICARD M,GENTIL B J,MCMANUS M J,et al.Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle[J].J Appl Physiol,2013,115(10):1562.
[10]KONOPKA A R,SUER M K,WOLFF C A,et al.Markers of human skeletal muscle mitochondrial biogenesis and quality control:effects of age and aerobic exercise training[J].J Geronotol A Biol Sci Med Sci,2014,69(4):371.
[11]SHEN W,HAO J,FENG Z,et al.Lipoamide or lipoic acid stimulates mitochondrial biogenesis in 3T3L1 adipocytes via the endothelial NO synthasecGMPprotein kinase G signalling pathway[J].Br J Pharmacol,2011,162(5):12113.
[12]NGOH G A,PAPANICOLAOU K N,WALSH K.Loss of mitofusin 2 promotes endoplasmic reticulum stress[J].J Biol Chem,2012,287(24):20321.
[13]CHEN L,GONG Q,STICE J P,et al.Mitochondrial OPA1,apoptosis,and heart failure[J].Cardiovasc Res,2009,84(1):91.
[14]孙卫东,丁虎,刘晓然,等.骨骼肌线粒体对细胞能量需求的快速应答:mfn1/2与fis1基因在急性运动中的动态表达[J].中国运动医学杂志,2008,27(5):544.
[15]CHEN H,CHAN D C.Emerging functions of mammalian mitochondrial fusion and fission[J].Hum Mol Genet,2005,14(2):283.
[16]CARTONI R,LEGER B,HOCK M B,et al.Mitofusins 1/2 and ERR alpha expression are increased in human skeletal muscle after physical exercise[J].J Physiol London,2005,567(1):349.
[17]漆正堂,郭维,张媛,等.不同运动方式对大鼠骨骼肌线粒体融合分裂基因及Mfn2、Drp1蛋白表达的影响[J].中国运动医学杂志,2011,30(2):143.
[18]陶小平,彭雄辉.一次大负荷运动后大鼠心肌能量代谢及线粒体形态动力学的变化研究[J].北京体育大学学报,2014,37(3):64.
[19]ONG S B,SUBRAYAN S,LIM S Y,et al.Inhibiting mitochondrial fission protects the heart against ischemia /reperfusion injury[J].Circulation,2010,121(18):2012.
[20]SMIMOVA E,GRIPARIC L,SHURLAND D L,et al.Dynaminrelated protein Drp1 is required for mitochondrial division in mammalian cells[J].Mol Biol Cell,2001,12 (8):2245.
[21]TOSHIYUKI K,HANA N,HIROFUMI S,et al.Possible role of mitochondrial remodelling on cellular triacylglycerol accumulation[J].J Biochem,2009,146(6):787.
[22]ASHRAFIAN H,DOCHERTY L,LEO V,et al.A mutation in the mitochondrial fission gene Dnm1l lead s to cardiomyopathy[J].PLoS Genet,2010,6(6):1001000.
[23]刘慧君,姜宁,赵斐,等.急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系[J].天津体育学院学报,2010,25(2):118.
[24]DING H,JIANG N,LIU H,et al.Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle[J].Biochim Biophys Acta,2010,1800(3):250.
[25]CAMPELLO S,SCORRANO L.Mitochondrial shape change:orchestrating cell pathophysiology[J].EMBO,2010,11(9):678.
