卵巢腺癌组织中TRAIL及其受体的表达及意义
2016-04-08李晓兰
李晓兰
(三峡大学第二人民医院,湖北宜昌 434000)
卵巢腺癌组织中TRAIL及其受体的表达及意义
李晓兰
(三峡大学第二人民医院,湖北宜昌 434000)
目的观察卵巢腺癌组织中肿瘤坏死因子相关凋亡诱导配体(TRAIL)及其受体的表达变化并探讨其临床意义。方法60例卵巢腺癌患者根据FIGO分期标准分为Ⅰ期30例(早期组)、Ⅱ期以上30例(晚期组),对照组为同期因子宫及宫颈病变同时切除卵巢并经病理证实为正常卵巢组织者30例,采用Western blot法检测各组卵巢组织TRAIL及其死亡受体4(DR4)、DR5、诱骗受体1(DcR1)、DcR2蛋白。结果各组TRAIL蛋白相对表达量组间比较差异均无统计学意义,P均>0.05;DR4、DR5蛋白相对表达量早期组<对照组<晚期组,DcR1、DcR2蛋白相对表达量晚期组>早期组、对照组,P均<0.05;早期组、对照组DcR1、DcR2蛋白比较,P均>0.05。结论卵巢腺癌组织中存在TRAIL及其受体失衡,其在卵巢腺癌的发生、发展中起重要作用。
卵巢腺癌;肿瘤坏死因子相关凋亡诱导配体;死亡受体;诱骗受体
卵巢癌是女性生殖系统的常见恶性肿瘤,发病率较高,病死率居妇科恶性肿瘤首位。目前临床常用的治疗方法有卵巢肿瘤细胞减灭术和化疗等,但晚期卵巢癌患者的5年生存率仍较低[1~3]。肿瘤坏死因子相关凋亡诱导配体(TRAIL)是人心肌cDNA文库中克隆出来的,因其具有强大的诱导肿瘤细胞凋亡的能力,而对正常组织细胞基本无影响,因此被认为是一种更安全且极具有潜力的抗肿瘤因子,成为近年研究热点。目前,已发现死亡受体4(DR4)、DR5、诱骗受体1(DcR1)、DcR2和骨保护素(OPG)5种TRAIL受体[4,5]。2010年1月~2015年1月,我们观察了不同阶段卵巢癌组织中TRAIL及其受体DR4、DR5、DcR1、DcR2的表达变化,旨在探讨其在卵巢癌发生、发展中的作用。
1 资料与方法
1.1临床资料收集我院同期收治的卵巢腺癌患者60例,年龄30~75岁;均经病理诊断证实为浆液性卵巢腺癌,根据FIGO(2009)分期标准分为Ⅰ期30例(早期组)、Ⅱ期以上30例(晚期组)。对照组为同期因子宫及宫颈病变同时切除卵巢者30例,年龄30~75岁,均经病理证实为正常卵巢。三组年龄具有可比性。
1.2卵巢组织TRAIL及DR4、DR5、DcR1、DcR2检测采用Western blot法。取三组卵巢组织,-80 ℃冰箱保存。取出组织,TBS洗涤2~3次,采用Bradford方法测定蛋白浓度;SDS-PAGE电泳,转膜,一抗、二抗免疫反应;化学发光,凝胶图像分析,将胶片进行扫描(EPSON V300扫描仪)存档;Alpha软件处理系统分析目的条带的光密度值,以目的条带的光密度值代表卵巢组织TRAIL及DR4、DR5、DcR1、DcR2的相对表达量。
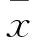
2 结果
早期组、晚期组、对照组TRAIL蛋白的相对表达量分别为1.03±0.04、1.01±0.03、1.00±0.02,组间比较差异均无统计学意义,P均>0.05。早期组、晚期组、对照组DR4蛋白的相对表达量分别为0.58±0.03、1.25±0.03、1.00±0.02,组间比较,P均<0.05。早期组、晚期组、对照组DR5蛋白的相对表达量分别为0.73±0.03、1.49±0.11、1.00±0.04,组间比较,P均<0.05。早期组、晚期组、对照组DcR1蛋白的相对表达量分别为1.02±0.05、1.78±0.04、1.00±0.02。早期组与对照组间差异无统计学意义,其余组间比较,P均<0.05。早期组、晚期组、对照组DcR2蛋白的相对表达量分别为1.00±0.01、1.98±0.09、1.00±0.05,早期组与对照组间差异无统计学意义,其余组间比较,P均<0.05。
3 讨论
TRAIL是TNF家族的新成员,是一种凋亡诱导配体,它能够选择性地诱导肿瘤细胞凋亡,而使正常细胞逃逸其杀伤作用[6]。TRAIL可以与DR4、DR5相互作用,选择性诱导多种组织来源的肿瘤细胞株发生凋亡; 而正常细胞因表达的 DcR1、DcR2无完整胞内死亡结构域,能抑制 TRAIL诱导的凋亡[7,8]。DR4 可以导致p53 非依赖性的凋亡,并伴有Caspase8、10和Caspase3、6、7 的剪切。DR4 可以通过不同的信号通路激活JNK和NF-κB ,NF-κB 的活化可以抵抗细胞凋亡,但它并不足以使细胞逃逸死亡的命运[9]。DR5 主要分布于外周血淋巴细胞和骨骼肌细胞。DR5 是p53 的下游靶位,其介导的p53 依赖性调节在人和鼠中有高度的保守性, 并可以在野生型p53 表达的细胞内被DNA 损伤剂诱导表达[10]。DR5 的表达受阿霉素、TNF-α和一些DNA 损伤剂的调节, 但与其他受p53 调节的基因不同的是,DR5 不受紫外线照射的的调节[11~13]。DR5 能够以组织特异性方式激活NF-κB。DR4、DR5均可通过其胞外区与TRAIL结合并活化后,通过其胞内死亡区引发和传导凋亡信号,通过激活Caspase蛋白酶解级联反应而发生TRAIL 诱导的凋亡。DcR1 和DcR2 的基因都位于8p21~22。DcR1和DcR2 的胞外区均有两个与DR4、DR5 高度同源的富含半胱氨酸的重复序列,能够与TRAIL结合[14,15]。但是,DcR1 无胞内区; DcR2 的胞内死亡区不完整, 即呈无功能的截断状态。因此,DcR1 和DcR2 与TRAIL 结合后都不能传导凋亡信号。DcR1 和DcR2 在多种组织有广泛的表达, 它们通过与DR4、DR5 竞争性结合TRAIL 而使正常细胞逃逸TRAIL 介导的凋亡[16]。
本研究发现,早期组、晚期组、对照组TRAIL蛋白的相对表达量组间比较差异均无统计学意义,而TRAIL受体在卵巢腺癌的不同病理阶段发生变化。早期卵巢腺癌组织中DR4、DR5表达降低,DcR1、DcR2表达水平无变化,可使肿瘤细胞凋亡发生免疫耐受,发生凋亡逃逸;晚期卵巢腺癌组织中DR4、DR5、DcR1、DcR2表达均升高,而TRAIL未见明显变化。说明肿瘤组织中存在TRAIL及受体失衡,导致肿瘤细胞生长迅速,且易发生转移,在卵巢腺癌的发生、发展中起重要作用。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] 闫晓华. TRAIL基因多态性与卵巢癌的相关性探讨[J].山东医药,2012,52(19):4-6.
[3] Rogalska A, Marczak A. Epothilone B induces human ovarian cancer OV-90 cell apoptosis via external pathway[J]. Phytomedicine,2015,22(2):700-712.
[4] Lin JY, Ke YM, Lai JS, et al. Tanshinone IIA enhances the effects of TRAIL by downregulating survivin in human ovarian carcinoma cells[J]. Phytomedicine, 2015,22(10):929-938.
[5] Cullen SP, Martin SJ. Fas and TRAIL death receptors as initiators of inflammation: Implications for cancer[J].Anticancer Drugs, 2015,26(9):26-34.
[6] James MA, Seibel WL, Kupert E, et al. A novel, soluble compound, C25, sensitizes to TRAIL-induced apoptosis through upregulation of DR5 expression[J]. Anticancer Drugs, 2015,26(5):518-530.
[7] Khondoker MA, Nicola JL, Nicholas RF, et al. Alveolar epithelial cells in idiopathic pulmonary fibrosis display upregulation of TRAIL, DR4 and DR5 expression with simultaneous preferential over-expression of pro-apoptotic marker p53[J]. Int J Clin Exp Pathol, 2014,7(2):552-564
[8] Venhar G, Konac E, Nuray VL, et al. Effects of AG490 and S3I 201 on regulation of the JAK/STAT3 signaling pathway in relation to angiogenesis in TRAIL resistant prostate cancer cells in vitro [J]. Onocl Letter, 2014(7):755-763.
[9] 李晓兰,孟运莲.肿瘤坏死因子相关凋亡诱导配体及受体与妊娠[J].国际妇产科学杂志,2009,36(3):189-192.
[10] 李晓兰,王倩倩,黎莉,等.沙眼衣原体感染后大鼠蜕膜中TRAIL及受体的表达[J].中国妇幼保健,2010,24(25):3477-3480.
[11] Hu JK, Yang K, Li CM, et al. The expression of TRAIL and its receptors in gastric cancer and the apoptotic effect of rh-TRAIL on SGC7901 cells [J]. Oncol Rep, 2009,21(3):681-688.
[12] Kang YH, Park MG, Noh KH, et al. Low serum TNF-related apoptosis-inducing ligand (TRAIL) levels are associated with acute ischemic stroke severity[J]. Atherosclerosis, 2015,240(1):228-233.
[13] Straughn J, Macco Jr P, Liver GO, et al. Ant-i tumor activity of TRA-8 ant-i death receptor 5 (DR5 ) monoclonal antibody in combination with chemotherapy and radiat ion therapy in a cervical cancer model[J] . Gynecol Oncol, 2006,101(1):46-54.
[14] Shin D, Kwon HY, Sohn EJ, et al. Upregulation of death receptor 5 and production of reactive oxygen species mediate sensitization of PC-3 prostate cancer cells to TRAIL induced apoptosis by vitisin A[J] . Cell Physiol Biochem, 2015,36(3):1151-1162.
[15] Liu H, Yang E, Lu X, et al. Serum levels of tumor necrosis factor-related apoptosis-inducing ligand correlate with the severity of pulmonary hypertension[J]. Pulm Pharmacol Ther, 2015,15(7):1094-1102.
[16] Zhang C, Liu S, Wu J. Association of the polymorphism of TRAIL with the risk and severity of lumbar disc degeneration in chinese han population[J]. Genet Test Mol Biomarkers, 2015(17):1151-1162.
湖北省自然科学基金面上项目(2015CFB574);湖北省宜昌市自然科学基金项目(A11301-39)。
10.3969/j.issn.1002-266X.2016.18.018
R737.31
B
1002-266X(2016)18-0053-02
2016-01-21).
