脊髓损伤后慢性中枢性疼痛大鼠脊髓背角浅层组织NR-1表达及意义
2016-04-08王建设丛静谢永刚
王建设,丛静,谢永刚
(1威海市文登中心医院,山东威海264200;2烟台毓璜顶医院)
脊髓损伤后慢性中枢性疼痛大鼠脊髓背角浅层组织NR-1表达及意义
王建设1,丛静1,谢永刚2
(1威海市文登中心医院,山东威海264200;2烟台毓璜顶医院)
目的观察脊髓损伤(SCI)后慢性中枢性疼痛(CCP)大鼠脊髓背角浅层组织中N-甲基-D-天冬氨酸(NMDA)受体亚单位NR-1的表达变化,并分析其意义。方法32只大鼠中随机取16只采用改良重物坠击脊髓法建立SCI模型,造模6 d时出现CCP 8 只(CCP组)、未出现CCP 8只(SCI组);另取8只仅暴露脊髓不行打击(假手术组),8只不做任何处理者为对照组。造模14 d采用免疫组化法检测各组大鼠脊髓背角浅层组织NR-1蛋白。结果CCP组、SCI组、假手术组、对照组脊髓背角浅层NR-1蛋白相对表达量分别为0.13±0.01、0.08±0.01、0.07±0.01、0.07±0.02,CCP组NR-1相对表达量明显高于其余各组(P均<0.05),SCI组、假手术组、对照组间差异无统计学意义。结论SCI后CCP大鼠脊髓背角浅层存在NR-1高表达,NR-1可能参与了SCI后CCP的发生、发展。
脊髓损伤;慢性中枢性疼痛;N-甲基-D-天冬氨酸;受体亚单位
脊髓损伤(SCI)是脊柱损伤最严重的并发症,可引起脊柱功能性或器质性损害,导致患者出现运动及感觉功能障碍。SCI后运动功能的恢复是临床治疗的重点,但其伴发的慢性中枢性疼痛(CCP)常被忽略,临床缺少有效治疗方法[1]。N-甲基-D-天冬氨酸(NMDA)受体亚单位NR-1是传导疼痛信号的主要受体,其在SCI后CCP发生发展中作用的相关报道较少。 2014年4月~2015年10月,我们观察了SCI后CCP大鼠脊髓背角浅层组织NR-1蛋白的表达,并分析其意义,旨在为SCI后CCP的诊治提供依据。现报告如下。
1 材料与方法
1.1材料健康雄性2~4周龄SD大鼠32只,由烟台毓璜顶医院动物中心提供,体质量220~250 g,室温20~24 ℃、12 h明暗循环下饲养1周。NR-1一抗稀释度1∶400,Zymed公司,美国)及生物素标记的羊抗兔二抗(稀释度1∶200,Santa Cruz公司,美国),7371型机械测痛仪购自美国IITC公司,37400型热测痛仪购自香港万浩科技有限公司。
1.2动物分组及干预32只大鼠中随机取16只采用改良重物坠击脊髓法[2]建立SCI模型:10%水合氯醛3 mL/kg腹腔注射麻醉大鼠,切开背部皮肤分离肌肉,咬骨钳咬除脊椎L1节段椎板,分离3~4 mm切口充分暴露脊髓。400 g/cm(下落高度20 cm、打击重量20 g)打击力度打击脊髓1次,打击完后缝合切口,注射青霉素(8万单位/次,1次/d,连续3 d)预防切口感染。术后行手法排尿持续到大鼠能自主排尿,防止出现SCI术后尿潴留。大鼠脊髓受到打击时出现肢体抽动即视为造模成功,16只大鼠均造模成功。造模6 d时根据文献[2]判定出现CCP 8只(CCP组)、未出现CCP 8只(SCI组),另取8只大鼠仅暴露脊髓不行打击(假手术组),8只不做任何处理者为对照组。
1.3脊髓背角浅层组织NR-1蛋白检测采用免疫组化法。分别于造模14 d取各组大鼠,腹腔注射麻醉后处死。以L1棘突为中心分离暴露脊髓,并取L1节段邻近脊髓组织各1 cm。将所取组织常规固定、脱水、石蜡包埋,组织切片后进行抗原修复。滴加1∶400 NR-1一抗室温孵育过夜,PBS冲洗3次,5 min/次;生物素标记的1∶200稀释的兔抗小鼠二抗,室温下孵育30 min,DAB显色,苏木素复染,封片。NR-1阳性表达为脊髓背角浅层呈淡黄色加深。采用HMIAS-2000型全自动彩色图像分析系统测出切片底色灰度值,然后自动进行免疫反应区域的彩色分割,测定光密度。所有切片均在同一光度下测定,测定3次,取平均值,以光密度作为NR-1蛋白相对表达量。
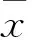
2 结果
CCP组、SCI组、假手术组、对照组脊髓背角浅层组织NR-1蛋白相对表达量分别为0.13±0.01、0.08±0.01、0.07±0.01、0.07±0.02,CCP组NR-1相对表达量明显高于其余各组(P均<0.05),SCI组、假手术组、对照组间差异无统计学意义。
3 讨论
CCP是SCI后发生的一种顽固性疼痛,表现为损伤平面以下持续的自发痛和诱发痛。既往研究发现,中枢痛觉敏化是导致CCP的最初原因。多数学者认为,其发生发展与SCI后所引起的感觉通路失平衡及递质或受体失衡有关,然而其具体作用机制目前尚不明确。目前,临床常使用外周电刺激及传统的药物止痛疗法治疗SCI后CCP,但效果较差。
脊髓背角浅层是整个脊髓背角中神经活性受体含量丰富且种类繁多的部位,以往研究认为其为传导痛觉的第一站[3]。脊髓背角神经元可接受外周感觉神经的传入,将神经信号换元处理后传递至海马,最终将神经冲动传递到大脑皮层感觉区。NMDA受体是一种典型的兴奋性氨基酸受体,可调控神经元树突、轴突结构的发育,参与突触可塑性的形成,是学习和记忆过程中的重要受体。其包含很多受体亚单位,其中NR-1是传导疼痛信号的主要受体亚单位[3,4]。NR-1含有一个结合甘氨酸的位点,是构成离子通道的基本亚单位。以往研究发现,NMDA受体的激活能够激活一系列与痛觉信号传递密切相关的信号通路,该受体功能被激活是引起神经病理性疼痛中枢敏化的关键机制之一,NR-1是其重要组成部分[5~8]。脊髓背角浅层受损后,由NR-1亚单位激活所诱发的突触长时程增强,导致异常痛觉过敏的发生[9,10]。脊髓损伤后,由炎症反应所介导的过氧化反应可以导致痛觉过敏的发生。该过程主要是通过诱导脊髓背角浅层NMDA受体亚单位NR-1的磷酸化而产生,而NR-1受体的激活与其磷酸化密切相关[11,12]。研究发现,大鼠脊髓内注射NMDA受体激动剂可升高大鼠兴奋性氨基酸的分泌、上调NMDA受体NR-1的表达水平,导致大鼠出现理毛、自噬等过度修饰行为及机械痛和热痛觉过敏现象[13~15]。本研究发现,CCP组NR-1相对表达量明显高于其余各组,SCI组、假手术组、对照组间差异无统计学意义。说明SCI后CCP的发生与脊髓背角浅层NR-1蛋白的激活密切相关,推测其可能作用机制为:①SCI可导致脊髓背角浅层受体失平衡,导致兴奋性受体NR-1大量产生;②SCI后的炎性反应导致过氧化物大量产生并进一步使受体磷酸化,NR-1被大量激活。
综上所述,SCI后CCP大鼠脊髓背角浅层组织存在NR-1表达升高,NR-1可能参与了SCI后CCP的发生、发展。
[1] 吕国蔚.痛觉过敏的中枢敏感化机制及其分子基础[J].中国疼痛医学杂志,1996,2(2):114-117.
[2] 戴红,肖忠新,胥小汀,等. 一种新的实验性脊髓损伤中枢性疼痛动物模型的建立[J].中国康复医学杂志,2002,17(1):18-22.
[3] Hawwa N, Baliki M,Atweh SF, et al. Attenuation of neuropathic pain by segmental and suppaspinalactivationof the dorsal column system in awake rats[J]. Neuro Sci, 2002,18(3):541-553.
[4] 吴江,黄德樱,程洁,等. 电刺激坐骨神经对新生期大鼠脊髓背角浅层及海马CA1区突触可塑性及c-fos蛋白表达的影响[J]. 中华医学杂志,2012,92(41):2938-2942.
[5] Wu J, Hu Q, Huang D, et al. Effect of electrical stimulation of sciatic nerve on synaptic plasticity of spinal dorsal horn and spinal c-fos expression in neonatal juvenile and adult rats[J]. Brain Res, 2012,1448(45):11-19.
[6] Xie YG, Mu HJ, Li Z,et al. Supression of chronic central pain by superoxide dismutase in rats with spinal cord injury:inhibition of the NMDA receptor implicated[J]. Exp Ther Med,2014,8(4):1137-1141.
[7] Kwak KH, Han CG, Lee SH, et al. Reactive oxygen species in rats with chronic postischemia pain[J]. Acta Anaest Scand,2009, 53(6):648-656.
[8] Cavanaugh DJ, Lee H, Lo L, et al. Distinct subsets of unmyelinated primary sensory fibers mediate behavioral responses to noxious thermal and mechanical stimuli[J]. Proc Natl Acad Sci USA, 2009,106(22):9075-9080.
[9] Bennett AD, Everahart AW, Hulsebosch CE. Intrathecal NMDA and non NMDA receptor antagonists reduce mechanical but not thermal allodynia in a rodent model of chronic central pain after spinal cord injury[J]. Brain Res, 2009,859(21):72-78.
[10] Biber K, Laurie DJ, Berthele A,et al.Expression and signaling of group I metabotropic glutamate receptors in astrocytes and microglia[J]. Neuro,2003,72(12): 1671-1680.
[11] Muscoli C, Mollace V, Wheatley J, et al. Superoxide-mediated nitration of spinal manganese superoxide dismutase: a novel pathway in N-methyl-D-aspartate-mediated hyperalgesia[J]. Pain, 2010,111(21):96-103.
[12] Gao X, Kim HK, Chung JM. Reactive oxygen species (ROS) are involved in enhancement of NMDA receptor phosphorylation in animal models of pain[J]. Pain, 2007,131(26):262-271.
[13] Kim K, Ha M, Jung K, et al. Reactive oxygen species and NMDA receptor mediated central sensitization in hindlimb ischemia reperfusion injury-induced neuropathic pain rats [J]. Korean J Anest, 2009,56(12):186-194.
[14] Hulsebosch CE, Hains BC, Crown ED, et al. Mechanisms of chronic central neuropathic pain after spinal cord injury[J]. Brain Res Rev,2009,60(15):2002-2013.
[15] 刘舒佳,李建军,高峰.脊髓损伤后中枢性疼痛的研究[J]. 中国康复理论与实践,2009,15(2):114-116.
谢永刚(E-mail: xyglzxrx@sina.cn)
10.3969/j.issn.1002-266X.2016.18.013
R651.2
A
1002-266X(2016)18-0040-02
2015-12-15)
