实验活动6一定溶质质量分数的氯化钠溶液的配制
2016-04-07石磊
石磊


本实验涉及以氯化钠固体配制6%的溶液,再稀释成3%的溶液两个活动,这是8个基础化学实验中唯一的一个定量实验,旨在通过实验活动进一步理解溶质质量分数的概念,同时练习使用两种不同的方法配制一定溶质质量分数的溶液。
一、用固体氯化钠配制50 g 6%的氯化钠溶液
1.计算
根据溶质质量分数的计算公式和密度公式,可得如下几个变形公式:溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,溶剂体积=溶剂质量÷溶剂密度。据此算出,需要固体氯化钠3 g,水47 mL。
2.称量
利用托盘天平称量所需的氯化钠,然后放入烧杯里。需要注意的是:①称量前要将游码调至零点,然后调节天平平衡;②两个托盘上各放一张大小相同的同种纸;③先将游码移到3 g刻度处(100 g天平的最小砝码是5 g),再向左盘逐渐加入氯化钠,直至天平平衡(若称量未知质量的药品,则先加药品后放砝码);④称量结束,砝码放回砝码盒,游码归零。
3.量取
用50 mL量筒量取所需的47 mL水,倒入盛有氯化钠的烧杯里。需要注意的是:①量取液体时,所用量筒的规格应略大于或等于所需液体的体积;②读数时,视线要与量筒内液体凹液面的最低处保持水平;③量取的液体倒出后,量筒壁上的残液无需冲洗出来,因为量筒是“量出”容器,在制造时已考虑到液体壁挂;④不能直接在量筒里配制溶液。
4.溶解
溶解时要用玻璃棒不断轻轻搅拌,以使氯化钠充分溶解。
5.装瓶贴标
将配制好的6%的氯化钠溶液装入试剂瓶(细口瓶),塞好瓶塞,贴上标签,并放到试剂柜中。
二、用6%的氯化钠溶液配制50 g 3%的氯化钠溶液
已配好的溶质质量分数为6%的氯化钠溶液,其密度约为1.04 g/mL。
1.计算
设需要6%的氯化钠溶液的质量为x,根据溶液在稀释前后溶质的质量不变,得:x×6%=50 g×3%,x=25 g,这些氯化钠溶液的体积是:25 g÷1.04 g/mL=24 mL。需要水的质量是:50 g-25 g=25 g,这些水的体积是:25 g÷1 g/mL=25 mL。
2.量取
先用25 mL量筒量取24 mL溶质质量分数是6%的氯化钠溶液,倒入烧杯里;再用25 mL量筒量取25 mL水,倒入盛有6%的氯化钠溶液的烧杯里。
3.混匀
用玻璃棒轻轻搅拌,使溶液混合均匀。
4.装瓶贴标
将配制好的3%的氯化钠溶液装入试剂瓶(细口瓶),塞好瓶塞,贴上标签,并放到试剂柜中。
三、疑难解答
1.配制一定溶质质量分数的溶液的实际意义
一定溶质质量分数的溶液在工农业生产、日常生活中具有重要的意义。例如,农业上用10%~20%的氯化钠溶液选种,既能选出颗粒饱满的种子(瘪种子的密度一般比食盐水小,良种的密度一般比食盐水大),又能利用食盐水杀菌;在给农作物喷洒农药时,药液的浓度偏小不能杀死病害虫,偏大又会毒害庄稼和树木。再如,医疗上用的生理盐水是溶质质量分数为0.9%的氯化钠溶液,因为人体血液里氯化钠的溶质质量分数也是0.9%,这样才能确保盐水与血液的渗透压相等,若生理盐水的浓度偏大或偏小对人的生命都会造成危害;而用于两栖类的生理盐水中,溶质的质量分数是0.67%~0.70%,这样其渗透压才能与两栖类体内血液近似。还有,汽车电瓶中用的是22%~28%的稀硫酸,该浓度的硫酸溶液能保证电能与化学能正常转化。此外,配制无土栽培营养液、化学试剂等,都需要准确配制一定溶质质量分数的溶液。
2.配制溶液时引起溶质质量分数误差的主要原因
造成溶质质量分数偏低的主要原因是溶质少了或溶剂多了,具体有:①称量溶质时,违反了“左物右码”的原则,造成实际称取的固体质量小于理论值;②称量好的固体没有全部倒入烧杯,有部分散落在烧杯外或沾在了纸上;③量取溶剂时仰视读数(读数比实际值偏小),造成实际取用的溶剂体积比理论值偏大;④药品中含有杂质等。
造成溶质质量分数偏大的主要原因是溶质多了或溶剂少了,具体有:①量好的溶剂倒入烧杯时,有部分洒在了烧杯外;②量取溶剂时俯视读数(读数比实际值偏大),造成实际取用的溶剂体积比理论值偏小等。
四、例题导学
【例1】(2015·福州)实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液。下列说法正确的是()
A.用50 mL量筒量取水
B.将固体放于托盘天平的右盘称取
C.将固体直接投入量筒中溶解
D.将配好的溶液装入贴有标签(见图2)的试剂瓶中,塞好瓶塞
【解析】配制100.0 g 3.0%的硝酸钾溶液,需要硝酸钾3 g,水97 g(相当于97 mL)。固体应放在左盘称取,应用100 mL量筒量取水,在烧杯里进行溶解操作;配制好的溶液装入试剂瓶后,要贴上标签,标签上必须注明溶液名称、溶液浓度。
【答案】D
【例2】(2015·呼和浩特)已知:水的密度为1.0 g/mL。实验室配制50 g溶质质量分数为5%的氯化钠溶液:
(1)需要称取氯化钠2.5 g,需要量取水。
(2)配制的操作示意图见图3,该实验的正确操作顺序为 (填字母)。
(3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。
①氯化钠固体不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时有少量溶液洒出
【解析】(1)需要水的质量为50 g-2.5 g=47.5 g,体积为47.5 g÷1.0 g/mL=47.5 mL。(2)配制一定溶质质量分数溶液的主要步骤是计算、称量、量取、溶解,据此并读图可知,该实验的正确操作顺序为CBDEA。(3)氯化钠固体不纯,含有杂质,实际称取的氯化钠偏少;称量时砝码端忘垫质量相同的纸片,会使称取的氯化钠偏少;量取水时仰视读数,会使量取的水偏多;装瓶时有少量溶液洒出,溶质的质量分数不受影响。endprint
【答案】(1)47.5 mL(2)CBDEA(3)①②③
五、对点训练
1.实验室配制50 g溶质质量分数为15%的氯化钠溶液,下列说法中,错误的是()
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50 mL的量筒量取42.5 mL蒸馏水
2.实验室中配制100 mL 10%的稀硫酸,一般不需要使用的仪器是()
A.烧杯B.托盘天平
C.量筒D.玻璃棒
3.要配制100 g 溶质质量分数为10%的氯化钠溶液,下列操作中,正确的是()
A.将10 g氯化钠固体直接放在天平的托盘上称量
B.量取90 mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
4.现用溶质质量分数为98%的浓硫酸(密度是1.84 g/mL),配制560 g溶质质量分数为14%的稀硫酸。下列有关叙述正确的是()
A.配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯
B.配制稀硫酸时,一定不能用天平称量所需浓硫酸的质量
C.将80 g 98%的浓硫酸沿烧杯内壁缓缓倒入480 mL水中,并不断搅拌
D.将480 mL水缓缓倾倒入盛有80 g 98%浓硫酸的量筒中,并不断搅拌
5.小红在中考实验操作考试中,抽到的考题是配制50 g 10%的氯化钠溶液。下列是小红的主要操作过程,其中会导致溶液中氯化钠质量分数大于10%的是()
A.在称量前,指针稍向左偏移便进行称量
B.用量筒量取水时俯视读数
C.溶解时烧杯中已有少量水未倒干净
D.装瓶时部分溶液洒出
6.图4为配制50 g溶质质量分数为10%的氯化钠溶液的操作过程。下列有关操作与目的分析均正确的是()
选项操作目的
A用剩的食盐放回原试剂瓶避免浪费
B天平调平后在左、右托盘中各垫一张相同的纸保证称取的食盐质量更准确
C用50 mL量筒替代天平量取所需的水更加简便
D溶解时用玻璃棒搅拌增加食盐的溶解能力
7.要配制100 g 5%的NaCl溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是()
A.烧杯、试管、玻璃棒
B.烧杯、胶头滴管、玻璃棒
C.烧杯、胶头滴管、漏斗
D.烧杯、酒精灯、玻璃棒
8.要配制50 g溶质质量分数为20%的食盐溶液,现提供溶质质量分数为40%的食盐溶液,20 g溶质质量分数为15%的食盐溶液,及足够多的固体食盐和水。请选用上述药品,设计三种配制方案填入下表。
配制方案(只要求说明配制时所需要的各种药品用量)
方案一
方案二
方案三
9.几种硫酸溶液在20 ℃时的密度和溶液的质量分数对照关系,见下表所列:
密度/g·mL-11.141.221.301.401.50
溶质的质量分数/%2030405060
(1)98毫升20%硫酸溶液中含硫元素多少克? (结果保留一位小数,下同)
(2)向50毫升密度为1.5克/毫升的硫酸溶液中加入多少毫升水能配成40%的硫酸溶液?
(3)把10毫升30%的硫酸溶液和20毫升50%的硫酸溶液相混合,求所得硫酸溶液的密度数值范围。
10.生产、生活中常需配制溶液。
(1)配制一瓶图5所示溶液,需氯化钠g。
氯化钠注射液
【成分】氯化钠、水
【规格】100 mL质量分数0.9%
【密度】1.0 g/cm3
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?(填序号);请说明偏小的原因:。
①用量筒量取水时仰视读数
②往烧杯中加水时有水溅出
③称量含不溶性杂质的氯化钠来配制溶液
④将配制好的溶液往试剂瓶中转移时有少量溅出
11.配制并稀释一定质量分数的Na2SO4溶液。
(1)配制50 g质量分数为6%的Na2SO4溶液。
①计算:需要Na2SO4 3.0 g,水47.0 g。
②称量:用托盘天平称量3.0 g Na2SO4。天平调零后,分别在天平左、右托盘放上质量相同的纸片,先,然后,至托盘天平恰好平衡。
③量取:用量筒量取47.0 mL水。请在图6中画出47.0 mL水的液面位置。
④溶解。
(2)稀释溶液。(由于整个配制过程中溶液很稀,其密度可近似看作1 g/mL)
①取1 mL 6%的Na2SO4 溶液加水稀释至100 mL,得到溶液a;
②若用3.0 g Na2SO4 配制与溶液a浓度相同的溶液,其所配溶液体积是mL。
12.3%的硼酸溶液可用于清洗皮肤的小面积创伤。现配制300 g质量分数为3%的硼酸溶液,实验操作如下:
(1)称量硼酸固体的质量:在图7中分别标出所选砝码的质量和游码的示数。
(2)量取水的体积:用量筒量取mL水(ρ水≈1 g/cm3)。endprint
(3)溶解:用到的玻璃仪器是。
(4)装瓶、贴标签:在图8的标签中填上相应的内容。
13.图9是配制100 g质量分数为18%的蔗糖溶液的实验操作示意图。
(1)图①②④中相同仪器的名称是。
(2)用图9中所示的序号表示正确配制该溶液的操作顺序:。
(3)称量时如果用质量为25.1 g的烧杯盛放蔗糖,在托盘天平上已放40 g的砝码,则天平上的游码位置应是图10中的(填字母)。
(4)量取水时需用到d和(填字母,下同)仪器,溶解时需用到e和仪器。
a.烧杯b.10 mL量筒c.100 mL量筒
d.滴管 e.玻璃棒 f.药匙g.蒸发皿
(5)若称取的蔗糖中含有杂质,则所配制的溶液溶质质量分数会(填“偏大”“偏小”或“无影响”)。
14.图11是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用图中序号表示配制溶液的正确操作顺序:。
(2)图②中用来取用NaCl的仪器是。
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码在标尺位置见图12,则称取的NaCl质量为g。
(4)称量NaCl质量完毕放回砝码时,发现10 g砝码有缺损,若其他操作步骤正确,则所配溶液的溶质质量分数(填“大于”“小于”或“等于”)10%。
15.化学兴趣小组同学在实验室配制溶液。
(1)小强同学要在实验室配制15%的氯化钠溶液50 g,需要氯化钠的质量为克,该同学按图13所示步骤依次操作:
其中操作错误的步骤是(填字母);E中玻璃棒的作用是。若图13A中砝码的质量为5 g,游码为2.5 g,则小明称得的氯化钠质量实际为克。
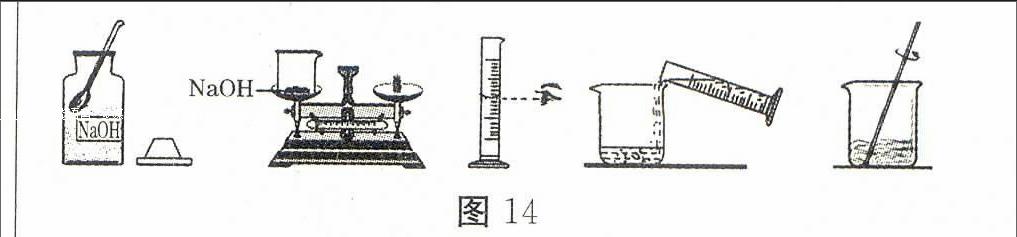
(2)小宁需要配制80 g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,图14是配制该氢氧化钠溶液的实验操作示意图:
【实验步骤】①计算:需要氢氧化钠固体g,水mL(水的密度以1.0 g/cm3计)。
②称量:用托盘天平称取氢氧化钠固体,用规格为(填“10”“50”或“100”)mL的量筒量取所需要的水,倒入盛有氢氧化钠的烧杯中。
③溶解:用玻璃棒搅拌,使氢氧化钠固体完全溶解。
【拓展思维】假如小宁想用上述配制的氢氧化钠溶液完全中和溶质质量分数为10%的盐酸,至少消耗盐酸的质量是多少?(反应的化学方程式为NaOH+HCl=NaCl+H2O)
附:对点训练参考答案
1.C2.B3.D4.C5.B6.C7.B
8.需10 g食盐和40 mL水需25 g 40%的食盐溶液和25 mL水需20 g 15%的食盐溶液、7 g食盐固体和23 mL水(合理即可)
9.(1)7.3 g(2)36.5 mL(3)1.30~140 g/mL
10.(1)0.9(2)①③操作①使溶剂的质量偏大,操作③使溶质的质量偏小
11.(1)②在右盘添加3 g砝码(或移动游码至3 g)向左盘中添加硫酸钠固体③见图15(2) 5000
12.(1)54(2)291(3)烧杯、玻璃棒(4)硼酸3%
13.(1)烧杯(2)⑤③①④②(3)B(4)ca(5)偏小
14.(1)②⑤①④③(2)药匙(3)18.2
(4)小于
15.(1)7.5A、B加快氯化钠的溶解2.5(2)【实验步骤】①872②100【拓展思维】73 gendprint
