实验活动5金属的物理性质和某些化学性质
2016-04-07朱红杰
朱红杰


本实验旨在引导同学们通过对比实验、控制变量等科学方法,探究常见金属的物理性质和活动性强弱,进一步加深对金属性质的认识,并初步学会设计实验验证金属活动性顺序。
一、金属的物理性质
金属都有明显的光泽,都能导电;大部分金属呈现银白色;不同的金属硬度不同,合金的硬度高于组成它们的纯金属。
1.金属的光泽和颜色
(1)实验操作:先用砂纸打磨掉镁条、锌片、铝片、铁片、铜片表面的氧化膜,然后观察它们的颜色和光泽。
(2)实验结论:
镁条铝片铁片铁粉铜片
颜色银白色银白色银白色黑色紫红色
光泽金属光泽金属光泽金属光泽没有光泽金属光泽
2.金属的硬度
(1)实验操作:采取“相互刻画”的方法,比较铜片和铝片、铜片和黄铜片的硬度,观察到铜片容易在铝片上刻出痕迹,黄铜片容易在铜片上刻出痕迹;采用“弯折”的方法,比较铁丝、铜丝、钢丝的硬度,观察到铜丝比铁丝容易弯折,铁丝比钢丝容易折弯。
(2)实验结论:铜的硬度比铝大,黄铜的硬度比铜大;铁比铜硬,钢比铁硬。
3.金属的导电性
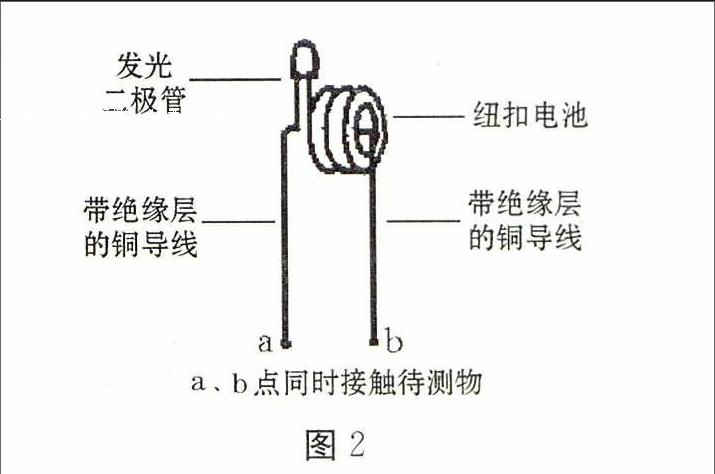
(1)实验操作:利用图2实验装置(将a、b接触点同时接触待测物表面,若二极管发光则导电),分别测量铜片、铝片、衣服、纸张的导电性,发现铜片、铝片均导电,而衣服、纸张不导电。
(2)实验结论:金属能导电。
二、金属的化学性质
金属能与氧气发生化合反应,能与酸溶液发生置换反应,也能与盐溶液发生置换反应。
1.金属与氧气反应
(1)实验操作:用坩埚钳分别夹持铜片、镁条,在酒精灯火焰上加热。观察到镁条剧烈燃烧、发出强光,铜片不燃烧,表面变黑。
(2)实验结论:绝大多数金属能与氧气发生化合反应,但是反应的难易程度不一样。
2.金属与酸溶液反应
(1)实验操作:向5支试管中分别放入大小、外形一样的镁、铝、锌、铁、铜,再分别倒入5 mL稀盐酸或稀硫酸。观察到铜的表面几乎没有变化,镁、铝、锌、铁表面均冒出气泡,放出气泡的快慢:镁>铝>锌>铁。
(2)实验结论:活泼金属能与酸溶液发生置换反应,而且反应的剧烈程度不一样。
3.金属与盐溶液反应
(1)实验操作:将铁片插入硫酸铜溶液中,将铜片插入硝酸银溶液中,并将观察的结果填入下表。
实验步骤实验现象有关的化学方程式
铁片插入硫酸铜溶液中铁片表面覆盖一层色固体,溶液由蓝色变为色
将铜片插入硝酸银溶液中铜片表面覆盖一层色固体,溶液由无色变为色
[红浅绿Fe+CuSO4=FeSO4+Cu银白蓝Cu+2AgNO3=Cu(NO3)2+2Ag]
(2)实验结论:相对活泼的金属能将不活泼金属从其盐溶液里置换出来。
三、疑难解答
1.铁丝(或铁片)呈银白色而铁粉呈黑色的原因
块状铁(如铁丝、铁片)的晶体结构较完整,当光线照射到铁块表面时,大部分可见光发生镜面反射,因此显示出银白色;铁粉没有规则的几何外形,照射在其表面的可见光几乎全部被吸收,所以呈黑色。其实,不仅仅是铁粉,大多数金属的粉末都是黑色的。
2.利用金属与酸溶液反应比较金属活动性时要控制变量的原因
利用金属与酸溶液发生置换反应比较金属活动性强弱时,一般通过反应的剧烈程度得出结论,而反应的剧烈程度与反应物的接触面有直接关系。例如,将铁粉、铁片分别与10%的稀盐酸反应,铁粉放出气体的速率快;将铁片分别与10%的稀盐酸、20%的稀盐酸反应,20%的稀盐酸放出气体的速率快;相同的铁片与相同浓度的盐酸反应时,温度高的盐酸放出气体的速率快。因此,利用金属与酸溶液反应比较金属活动性强弱时必须控制变量。
3.比较金属活动性强弱的常用方法
金属与氧气反应的难易和剧烈程度,金属与酸溶液能否发生置换反应及反应剧烈程度,能反映金属活动性强弱;金属与盐溶液能否发生置换反应,能直接反映出金属活动性的强弱。
一次性验证三种金属活动性强弱的最佳试剂组合是:活泼金属,活动性居中金属的盐溶液,不活泼金属(简称“金、盐、金”);或活泼金属的盐溶液,活动性居中的金属,不活泼金属的盐溶液(简称“盐、金、盐”)。
4.有关金属发生置换反应的注意事项
(1)金属与酸溶液的置换反应。
铁与酸溶液发生置换反应时,生成的是+2价的亚铁盐,如铁跟稀盐酸反应的化学方程式是Fe+2HCl=FeCl2+H2↑。具有氧化性的酸不能与金属发生置换反应,像HNO3、浓H2SO4因有氧化性,它们与活泼金属反应不能生成H2,酸中的氢一般转化为水,如4Zn+10HNO3(稀)=4Zn(NO3)2+N2O↑+5H2O。
(2)金属与盐溶液的置换反应。
金属与盐溶液发生置换反应时,反应物盐要溶于水,反应才能发生,如铁虽比铜活泼,但铁与CuCO3并不能发生反应,因为CuCO3不溶于水。金属与盐溶液发生置换反应时,反应生成的盐也要溶于水,反应才能持续进行,如Pb+CuSO4=PbSO4+Cu,因为PbSO4不溶于水,沉淀下来会覆盖在固体铅的表面,慢慢隔绝了铅与CuSO4的接触,使反应自行停止。非常活泼的金属(如K、Na、Ca等)不能与盐溶液发生置换反应,如把钠投进CuSO4溶液里,先发生的反应是2Na+2H2O=2NaOH+H2↑,后发生的反应是2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,总反应是2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑,它不属于置换反应。铁与盐溶液发生置换反应时生成的是+2价的亚铁盐,如铁跟CuSO4溶液反应,生成的盐是FeSO4。endprint
(3)盐溶液中多个置换反应并存的问题。
如在Cu(NO3)2、AgNO3的混合溶液里加入锌,由于锌与银的金属活动性相差较大,所以锌先与AgNO3溶液反应:Zn+2AgNO3=Zn(NO3)2+2Ag,等到AgNO3反应完全,才开始与Cu(NO3)2反应:Zn+Cu(NO3)2=Zn(NO3)2+Cu。再如,在AgNO3溶液里同时加入铁、铜,因为铁与银的金属活动性相差较大,所以铁先与AgNO3溶液反应:Fe+2AgNO3=Fe(NO3)2+2Ag,等到铁消耗完全,铜才开始与AgNO3反应:Cu+2AgNO3=Cu(NO3)2+2Ag。
四、例题导学
【例1】(2015·菏泽)下列有关金属的叙述,正确的是()
A.硬币、不锈钢锅都是合金材料,合金比各成分金属具有更优良的性能
B.铝、铁、铜都是银白色固体,都能够导电
C.镁、铝都是活泼金属,相同质量时与足量的盐酸反应放出氢气的体积相同
D.铁在空气中燃烧,冒出浓烈的黑烟,放出热量,生成黑色粉末
【解析】硬币、不锈钢都属于合金,合金比各成分金属具有更高的硬度、更好的防腐性;铜是紫红色,而非银白色;相同质量的镁、铝与足量的盐酸反应时,金属铝放出的氢气多;铁在氧气中燃烧,火星四射,放出热量,生成黑色固体。
【答案】A
【例2】(2015 ·荆门)某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份。
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象。
步骤3:将另一份光亮的镁条置于热水中,观察到有气泡产生。
(1)将镁条用砂纸打磨至光亮的原因是。
(2)经百度可知,活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱的碱性也越强。某同学向步骤3的烧杯中滴加酚酞溶液,观察到镁条的表面有明显的红色出现。该反应的化学方程式为,反应类型是(基本反应类型)。
(3)步骤2和3对比可知,影响镁与水的反应速率的一个因素是。
(4)根据以上信息,若将金属钠加到硫酸铜溶液中,可能观察到的现象是。
【解析】(1)镁条表面有一层氧化膜,为了防止其对实验的干扰,所以应在实验前把它除去。(2)把镁放到热水中,镁可以与水反应生成氢氧化镁和氢气。(3)对比步骤2和3可知,在其他条件不变的情况下,温度对镁与水的反应速率有很大的影响。(4)由于钠的化学性质比较活泼,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与溶液中的硫酸铜反应,生成氢氧化铜蓝色沉淀和硫酸钠溶液。
【答案】(1)除去表面的氧化膜(氧化镁) (2)Mg+2H2O △ Mg(OH)2+H2↑置换反应(3)温度(4)有气体产生,溶液中产生蓝色沉淀
五、对点训练
1.金属和金属材料在日常生活中被广泛应用。下列对金属或合金的利用是由金属的活动性决定的是()
A.用铁回收含铜离子废液中的铜
B.用铝合金制作门窗框架
C.用锡合金作保险丝
D.用铜丝作电缆
2.下列物质中,不属于合金的是()
A.不锈钢B.氧化汞
C.黄铜D.生铁
3.下列可用于验证Fe、Cu、Ag三种金属的活动性顺序的一组药品是()
A.Fe、Cu、H2SO4溶液
B.Cu、Ag、FeSO4溶液
C.Fe、Ag、CuSO4溶液
D.Ag、FeSO4溶液、CuSO4溶液
4.下列事实不能证明金属甲的金属活动性比金属乙强的是()
A.自然界中甲元素只以化合物形式存在,乙元素存在单质形式
B.甲能与盐酸反应生成H2而乙不能
C.甲能从乙的盐溶液中置换出乙
D.化合物中甲元素显+2价而乙元素显+3价
5.在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。有关判断正确的是()
A.滤渣中一定有银,没有铜和锌
B.滤渣中一定有银和锌,可能有铜
C.滤液中一定有硝酸锌、硝酸铜、硝酸银
D.滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
6.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中,不正确的是()
A.铅锑合金的熔点低、电阻率大,常用于制造发热体
B.铜具有良好的导电性,常用于制造电缆
C.铝合金轻而坚韧,可作汽车、飞机和火箭的材料
D.不锈钢抗腐蚀性好,常用于制造医疗器械
7.下列关于铁、铝、铜的说法正确的是()
A.其表面都能形成致密的氧化膜
B.都能与稀盐酸或稀硫酸反应
C.都能与氧气发生化合反应
D.化学性质都很活泼
8.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入m克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为m克。据此,下列说法不正确的是()
A.取反应后的滤液观察,滤液可能呈蓝色
B.取反应后的滤液滴加稀盐酸,有白色沉淀产生
C.取滤渣滴加稀硫酸,可能有气泡产生
D.滤渣中的物质至少有两种
9.用三块相同的铝片(均已去除氧化膜)进行如下实验:实验1:取第一块铝片,放入稀硫酸中,有明显的现象;实验2:取第二块铝片,放入硫酸铜溶液中,铝片表面有红色物质析出;实验3:取第三块铝片,放入浓硫酸中,没有明显的现象;实验4:将实验3中的铝片取出,洗净后放入硫酸铜溶液中,没有明显的现象。endprint
下列说法不正确的是()
A.在实验1中可以观察到铝片表面有气泡产生
B.由实验2可以得出金属铝比铜活泼
C.铝片与浓硫酸不能发生化学反应
D.浓硫酸与稀硫酸的化学性质有差别
10.下列现象和事实,可用金属活动性作合理解释的是()
①金属镁在空气中比铝更容易燃烧,说明镁比铝的活动性强②金属铝比金属锌更耐腐蚀,说明锌比铝的活动性强③用硫酸铜与石灰水配制农药波尔多液时,不能用铁制容器④尽管金属的种类很多,但在自然界中仅有少量金属以单质形式存在
A.①②B.①③④
C.③④D.①②③④
11.向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图3所示。下列说法正确的是()
A.取a点溶液,滴加稀盐酸,无白色沉淀
B.c点溶液中溶质为Zn(NO3)2
C.若取b~c段固体,滴加稀盐酸,无气泡产生
D.d点时的固体有2种
12.金属及合金是重要的工业及建筑材料,某些金属离子是人体不可或缺的元素。
(1)下表是A、B、C三种金属的部分物理性质:
性质金属导电性(100为标准)密度(g/cm3)熔点(℃)硬度(10为标准)
A998.9210833
B612.706602.9
C177.8615355
①三种金属中最不适宜作导线的是(填字母),高压输电线不用金属A而选用金属B,主要原因是。
②C的合金通常可以做菜刀、锤子等,其合金的硬度(填“>”“<”或“=”)5。
(2)老火靓汤强身健体,猪骨汤是其中之一。
煲制猪骨汤的主要原料:猪骨、鸡脚、甜玉米、胡萝卜、鸡骨草等。
①猪骨汤包含的营养素中除了蛋白质、油脂、水、无机盐外,还有等。
②猪骨汤中因为含有较丰富的(用离子符号表示),所以老年人饮用可以预防。
13.不锈钢材料中含有的金属铬(Cr)能提高钢的抗氧化性和耐腐蚀性。为了解金属铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,小娟与小涛进行了如下探究活动。
【猜想与假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Cr、Al、Cu;
猜想二:Al、Cr、Cu;
猜想三:。
【实验与探究】(1)小娟的实验:取大小相同的铝、铬、铜三种金属片(用砂纸打磨光亮):
实验步骤实验现象解释与结论
分别取三支试管,向其中加入等质量、等浓度的稀硫酸,然后将铝、铬、铜三种金属分别插入三支试管中
铝片表面产生气泡较快;铬片表面产生气泡较缓慢,溶液变蓝色;铜片无明显现象
猜想成立。铬与稀硫酸反应生成蓝色的硫酸亚铬(CrSO4)溶液,该反应的化学方程式为
(2)小涛的实验:小涛只选用了三种药品进行实验,也得出了三种金属在金属活动性顺序中的相对位置关系。则他选用的三种药品可能是。
【总结与归纳】由上述实验得出,比较金属活动性强弱的方法有:①;②。
14.小明把过量锌粒加入有盐酸的试管中,发现随着反应的进行,产生气体的速度逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也先随之升高,最后下降至室温。于是,小明设计实验来探究“一定质量的某种金属和同体积盐酸反应快慢的影响因素”。测得实验数据如下:
某金属与同体积盐酸溶液反应实验数据表
盐酸溶液浓度反应开始时酸溶液的温度反应开始到2分钟产生的气体体积反应结束共产生气体体积
5%20 ℃10 mL60 mL
10%20 ℃19 mL118 mL
15%20 ℃28 mL175 mL
5%35 ℃28 mL60 mL
10%35 ℃72 mL118 mL
15%35 ℃103 mL175 mL
(1)分析实验数据得出,一定质量的某种金属和同体积盐酸反应,影响金属和酸反应快慢的主要因素有、。
(2)可以通过比较实验数据来确定金属和酸反应的快慢。
(3)过量锌粒加入盐酸中,反应开始的一段时间,反应速率逐渐加快,而不是逐渐减慢。请分析原因:。
附:对点训练参考答案
1.A2.B3.C4.D5.D6.A7.C
8.B9.C10.B11.B
12.(1)①C高压输电线一般较粗且架设较高,因此需要导电性较好而密度又不大的金属②>(2)①维生素、糖类②Ca2+骨质疏松
13.【猜想与假设】Al、Cu、Cr【实验与探究】(1)二Cr+H2SO4=CrSO4 +H2↑(2)Al、CrSO4溶液、Cu【总结与归纳】通过金属与酸反应比较通过金属与盐溶液反应比较
14.(1)盐酸溶液的浓度反应开始时酸溶液的温度(2)相同时间内产生的气体体积(3)温度对反应速率的影响大于盐酸溶液浓度对反应速率的影响endprint
