高产洛蒙真菌素的洛蒙德链霉菌S015的诱变筛选
2016-04-07张春晓胡洪波彭华松张雪洪
张春晓,钱 玮,王 威,胡洪波,彭华松,张雪洪
(上海交通大学生命科学技术学院微生物代谢国家重点实验室,上海200240)
高产洛蒙真菌素的洛蒙德链霉菌S015的诱变筛选
张春晓,钱 玮,王 威*,胡洪波,彭华松,张雪洪
(上海交通大学生命科学技术学院微生物代谢国家重点实验室,上海200240)
摘 要:通过洛蒙真菌素的结构类似物吩嗪-1-羧酸(Phenzine-1-catboxylic acid,PCA)对1株洛蒙真菌素的产生菌——洛蒙德链霉菌野生菌株S015诱变,筛选到突变株S015-P34,其洛蒙真菌素的产量达到了(106" 0± 4" 4)mg/L,是野生株的3" 2倍;通过作用于核糖体的抗生素利福平和庆大霉素分别对菌株S015诱变,筛选到突变株S015-R6和S015-G11,洛蒙真菌素的产量分别达到了(103" 4±0" 1)mg/L和(81" 2±2" 5)mg/L,是野生株的3" 2倍和2" 5倍;最后,结合PCA和利福平的复合抗性筛选,得到突变株S015-R6-46,洛蒙真菌素的产量为(168" 0±2" 2)mg/L,是野生型菌株的5" 1倍;又通过添加0" 1 mmol/L FeCl3发酵培养,使突变株S015-R6-46的洛蒙真菌素产量达到(258" 7±5" 7)mg/L。这试验结果可为其他产吩嗪类活性物质的链霉菌的高产菌株的诱变筛选提供参考。
关键词:洛蒙德链霉菌;诱变;筛选;洛蒙真菌素;吩嗪类化合物
吩嗪类化合物是一类含氮杂环化合物,易溶于乙醚、苯等,几乎不溶于水[1]。天然吩嗪类化合物主要存在于假单胞菌和链霉菌的代谢产物中[2-5]。目前已经发现的100多种天然吩嗪类化合物,几乎对细菌和真菌都有抑菌活性[6-7],例如,荧光假单胞菌产生的吩嗪-1-羧酸(Phenazine-1-carboxylic,PCA),以其为主要成分研发的新型微生物源农药,2011年获得农药登记证(PD20110315F130),能够有效防治水稻纹枯病、小麦根部腐蚀的小麦全蚀病、西瓜枯萎病等[8-10]。铜绿假单胞菌合成的吩嗪-1-甲酰胺(Phenaizne-1-carboximade,PCN)则对西红柿枯萎病等病原菌有显著的抑制作用[11]。某些天然吩嗪类化合物还具有抗肿瘤、抗疟疾、抗寄生虫等功效[2],在农业、医药等领域引起了广泛的关注与研究。
由于天然吩嗪类化合物在野生菌株中的产量普遍较低,限制了其应用。因此,筛选高产菌株、提高吩嗪类化合物的产量是目前天然吩嗪类化合物研究的热点之一。菌种的诱变选育是筛选高产菌株的简单实用的方法之一[12]。除了常用的物理诱变和化学诱变,用具有特定作用靶点的抗生素作为诱变剂进行诱变育种,通常能得到更多的正向突变菌株。Ochi等的研究发现,鸟苷四磷酸(ppGpp)对抗生素合成起着重要作用:破坏ppGpp的合成基因(relA),使ppGpp无法积累时,抗生素的合成量也会减少[13-17]。利福平、庆大霉素等抗生素,都能模拟ppGpp的作用,Lai等[18]发现利福平的抗性突变能够提高变铅青链霉菌次级代谢物的产量。微生物通过反馈抑制和反馈阻遏限制代谢产物的过量积累,通过筛选抗高浓度自身代谢终产物或其结构类似物的抗反馈或抗阻遏突变型,也是获得高产突变菌株的一种有效途径[19]。
洛蒙真菌素(Lomofungin)是一种酸性的橄榄黄色吩嗪类化合物[20],天然的洛蒙真菌素是由美国Upjohn公司的Bergy博士等人首次在洛蒙德链霉菌的发酵产物中纯化得到[21]。洛蒙真菌素可以抑制金黄色葡萄球菌、肺炎双球菌、枯草芽孢杆菌等细菌及终极腐霉、油菜菌核病原菌、酵母菌、星形诺卡氏菌等多种真菌的菌体生长[20,22-23],是极具潜力的具有杀菌功能的生防制剂。洛蒙德链霉菌S015是本实验室从上海周边土壤中筛选到的一株可生物合成洛蒙真菌素的活性链霉菌,前期工作已对其发酵条件进行了初步优化[24]。为了进一步提高其产量,本研究通过洛蒙真菌素的结构类似物PCA的抗性诱变,结合能模拟ppGpp作用的抗生素(利福平,庆大霉素)的抗性诱变,筛选洛蒙真菌素菌株的高产菌株。
1 材料与方法
1.1 试验材料
1" 1" 1 菌株 菌株:洛蒙德链霉菌S015(Streptomyces lomondensis S015,CCTCC No:M2013140),由本实验室保存。
1" 1" 2 培养基 MS培养基:黄豆饼粉30 g,溶于1 L水,煮沸后用纱布过滤,将滤过的液体再次定容至1 L,甘露醇20 g,琼脂20 g(固体用),121℃,20 min高温灭菌。
YM培养基:葡萄糖4 g,麦芽提取物10 g,酵母提取物4 g,溶于1 L蒸馏水中,调pH至7" 3,115℃,20 min高温灭菌。
1" 1" 3 试剂 60%甘油(体积浓度):甘油60 mL,加水混匀,定容到100 mL,121℃,20 min高温灭菌;PCA:本实验室保存;硫酸庆大霉素:生工生物;利福平:生工生物;盐酸,丁酮:分析纯,上海国药集团;甲酸,乙腈:HPLC色谱纯,上海国药集团。
1" 1" 4 仪器 THZ-C恒温振荡器培养箱:江苏太仓市实验设备厂;Centrifuge 5804R型以及Centrifuge Mini Spin型高速离心机:Eppendorf美国;1260型高效液相色谱:Agilent美国;隔水式恒温培养箱(GNP-9080):上海精宏实验设备有限公司;SHENSHENG旋转蒸发仪:上海申胜生物技术有限公司;压力蒸汽灭菌锅(YXQ-LS-SⅡ):上海博迅有限公司医疗设备厂;精密天平(PL2001,EL104):美国Mettlor Toledo。
1.2 试验方法
1" 2" 1 菌种培养 菌株种子培养参见[20]。摇瓶发酵:取面积约1 cm2的平板孢子,直接接种至含有50 mL/250 mL YM发酵培养基中。180 r/min,28℃恒温培养。
1" 2" 2 细胞干重和洛蒙真菌素产量测定 取5 mL发酵液,12 000 r/min离心5 min,沉淀用水洗后放置60℃烘箱中,烘至恒重后用精密电子天平测干重。
上清液用6 mol/L HCl调节pH到2" 0,加入5 mL丁酮,振荡萃取3—5 min后,于12 000 r/min离心5 min。取上层有机相,用真空旋转干燥仪于33℃蒸干丁酮。样品溶于5 mL比例为1∶1的乙腈、0" 1%甲酸水溶液,0" 45 μm的微孔滤膜过滤后,用于测定洛蒙真菌素的产量。
洛蒙真菌素的HPLC检测方法:以0" 1%甲酸水(A)和乙腈(B)做流动相,1—4 min,A∶B=8∶2;4—20 min,A∶B=6∶4;20—30 min,A∶B=8∶2。流速为1 mL/min;检测波长为270 nm,柱温为30℃,进样20 μL。柱子型号:Agilent Eclipse Plus C18 column,250 mm×4" 6 mm。
标准曲线:配制质量浓度分别为10 g/mL、20 g/mL、30 g/mL、50 g/mL、75 g/mL、100 g/mL、150 g/mL的样品进行HPLC检测,用于制作标准曲线。
1" 2" 3 PCA耐受性筛选 制备单孢子悬浮液:取28℃培养6—7 d的新鲜菌株平板,用灭过菌的棉签将孢子刮下,将其加入10 mL无菌水,采用经过灭菌的脱脂棉过滤后,重新定容至10 mL孢子悬液。充分振荡使孢子分散成单孢子悬液。用无菌水按10-1梯度稀释至孢子量浓度约为104个/mL,备用。
添加外源PCA:将适量PCA溶于灭过菌的蒸馏水中,过滤除菌,添加至孢子悬液中,并形成PCA终浓度为5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL的孢子悬液,于4℃冰箱过夜处理。将过夜处理后的添加不同质量浓度PCA的孢子悬浮液,100 μL涂布于相同PCA质量浓度的黄豆饼粉(MS)固体培养基平板上,待其生长3—4 d后,观察其生长情况。
摇瓶发酵复筛:配制50 mL YM发酵培养基(每瓶添加10 g玻璃珠以打散菌体),取添加PCA固体培养基平板上的单菌落,至复筛摇瓶中经液体种子培48 h后液体发酵培养,96 h后检测洛蒙真菌素的产量。
1" 2" 4 抗生素抗性筛选 最小抑菌质量浓度确定:将制备的孢子悬液100 μL分别涂布于利福平终浓度为0" 5 μg/mL、1" 0 μg/mL、1" 5 μg/mL、2" 0 μg/mL、2" 5 μg/mL及庆大霉素终浓度为5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、60 μg/mL的MS培养基上,观察出发菌株对利福平及庆大霉素的敏感性,确定两种抗生素对洛蒙德链霉菌的最小抑菌质量浓度(MIC,Minimum inhibitory concentration最小抑菌浓度)。在两种抗生素的MIC下筛选抑菌活性提高的抗性菌株。
抗性筛选:将适量利福平及庆大霉素分别溶于无菌蒸馏水中,过滤除菌。添加至制备好的孢子悬浮液中,并形成利福平终浓度为0" 5 μg/mL、1" 0 μg/mL的孢子悬浮液,以及庆大霉素终浓度为5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的孢子悬浮液,于4℃冰箱过夜处理。将过夜处理后的添加不同质量浓度抗生素的孢子悬液100 μL分别涂布于相同抗生素质量浓度的黄豆饼粉(MS)固体培养基平板上,待其生长3—4 d后,观察其生长情况。
摇瓶发酵复筛:配制50 mL YM发酵培养基(每瓶添加10 g玻璃珠以打散菌体),取庆大霉素以及利福平平板的单菌落,至复筛摇瓶中经液体种子培养48 h后液体发酵培养,96 h后检测洛蒙真菌素的产量。
1" 2" 5 复合条件的抗性筛选 将PCA处理后的高产菌株在黄豆饼粉培养基上划线传代,稳定地遗传五代后,将孢子以1" 2" 3方法收集,采用1" 2" 4方法使用利福平进行复合筛选。
将利福平处理后的高产菌株在黄豆饼粉培养基上划线传代,稳定地遗传五代后,将孢子以1" 2" 3方法收集,采用1" 2" 3方法使用PCA进行复合筛选。
1" 2" 6 FeCl3发酵优化复合筛选菌株 将复合筛选后的高产菌株接种至添加含有0" 01 mmol/L、0" 1 mmol/L、0" 5 mmol/L FeCl3YM发酵培养基中发酵培养,96 h检测洛蒙真菌素的产量。
2 结果与分析
2.1 结构类似物PCA的耐受性筛选
分别用终浓度为5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL的PCA固体培养基平板对野生株S015进行耐受性筛选,固体培养4 d后,经过菌落计数,得到菌株的致死率如表1所示。

表1 PCA质量浓度对菌株S015致死率的影响Table 1 Effect of PCA concentration on lethality of strain S015
在PCA质量浓度为50 μg/mL和100 μg/mL的平板上,各获得约100个单菌落。分别挑取各单菌落发酵并测定洛蒙真菌素的产量,其中产量最高的三株菌株(S015-P02、S015-P14和S015-P34)发酵培养96 h后菌株的细胞生长及产物合成情况见图1。从图1可以看出,诱变处理后单菌落发酵时的菌株生长与野生株有明显区别,培养96 h后细胞干重约为4 g/L;但洛蒙真菌素的合成有显著变化,其中突变株S015-P34(100 mg/L PCA诱变)发酵96 h后洛蒙真菌素的产量最高,达到了(106" 0±4" 4)mg/L,比野生株的产量提高了约3倍。

图1 PCA诱变对洛蒙德链霉菌S015细胞生长和洛蒙真菌素合成的影响Fig.1 Effects of PCA on strain S015 and its mutants’cell growth and lomofungin yields
2.2 抗生素对菌株的抗性筛选
用终浓度分别为0" 5 μg/mL、1" 0 μg/mL、1"5 μg/mL、2"0 μg/mL和2"5 μg/mL的利福平和终浓度为5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL和60 μg/mL的庆大霉素对野生株S015进行抗性筛选,固体培养4 d后,经过菌落计数,得到菌株的致死率如表2所示。
根据表2结果,在利福平质量浓度为0" 5 μg/mL和1" 0 μg/mL的平板上,各获得约120个单菌落。分别挑取各单菌落发酵并测定洛蒙真菌素的产量,其中产量最高的3株菌株(S015-R6,S015-R19,S015-R28)发酵培养96 h后菌株的细胞生长及产物合成情况见图2。诱变处理后的菌株生长与野生株没有明显区别,但洛蒙真菌素的合成有显著变化,从图2可以看出,其中突变株S015-R6(1" 0 μg/mL利福平)发酵96 h后洛蒙真菌素的产量最高,达到了(103" 4±0" 1)mg/L,比野生株的产量提高了约3倍。同样,在庆大霉素质量浓度为20 μg/mL和50 μg/mL也各获得约100个单菌落。挑取各单菌落发酵96 h,产量最高的3株菌株(编号为S015-G11,S015-G36,S015-G58)的生长没有明显变化,洛蒙真菌素的最高产量达到(81" 2±2" 6)mg/L(S015-G11),比野生株的产量提高了约2倍(图3)。
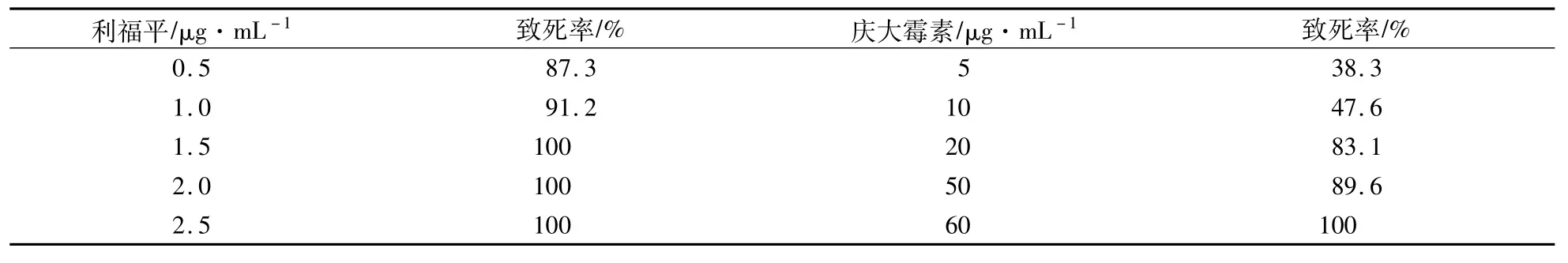
表2 抗生素质量浓度对洛蒙德链霉菌致死率的影响Table 2 Effect of antibiotic concentration on lethality of strain S015
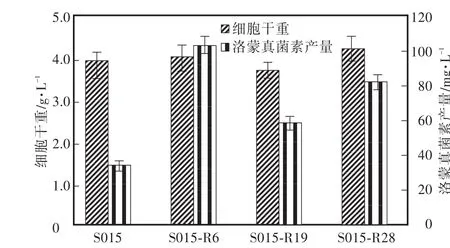
图2 利福平诱变对洛蒙德链霉菌细胞生长和产物合成的影响Fig.2 Effects of rifampicin on strain S015 and its mutants’cell growth and lomofungin yields
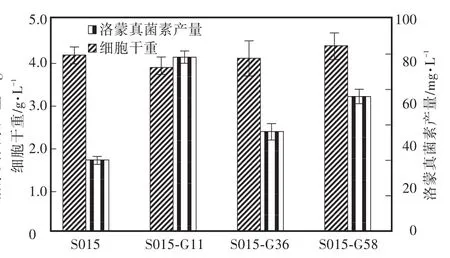
图3 庆大霉素诱变对洛蒙德链霉菌细胞生长和产物合成的影响Fig.3 Effects of gentamicin on strain S015 and its mutants’cell growth and lomofungin yields
2.3 复合条件对菌株的复合诱变
由于PCA和抗生素的诱变机理不同,为了进一步提高菌株的产物合成能力,对菌株进行了PCA和抗生素(利福平)的复合诱变,结果见图4。用1" 0 μg/mL的利福平对PCA诱变后的高产株S015-P34进行进一步的诱变处理,对得到的96株单菌落进行发酵培养,其中菌株S015-P34-61发酵中洛蒙真菌素的产量最高,为(141" 4±5" 8)mg/L,是S015-P34的1" 5倍。用100 μg/mL的PCA对利福平诱变后的高产株S015-R6进行进一步的诱变处理,对得到的103株单菌落进行发酵培养,其中菌株S015-R6-46发酵中洛蒙真菌素的产量最高,为(168" 0±2" 2)mg/L,是S015-R6的1" 7倍。
2.4 FeCl3发酵优化复合筛选菌株
通过添加不同离子量浓度的FeCl3对野生菌S015和复合筛选后的突变菌株S015-R6-46进行发酵优化,结果见图5。与野生株相同[20],对突变株S015-R6-46添加0" 1 mmol/L的FeCl3培养96 h,洛蒙真菌素的产量最高,为(258" 7±5" 7)mg/L,是未添加的1" 5倍。
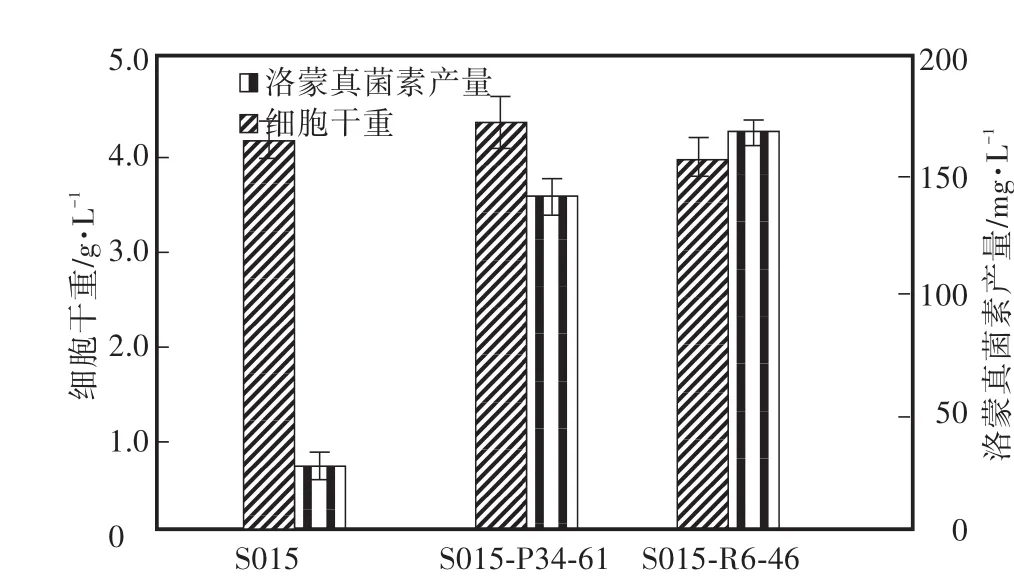
图4 复合筛选对洛蒙德链霉菌细胞生长和产物合成的影响Fig.4 Effects of compound screening on strain S015 and its mutants’cell growth and lomofungin yields
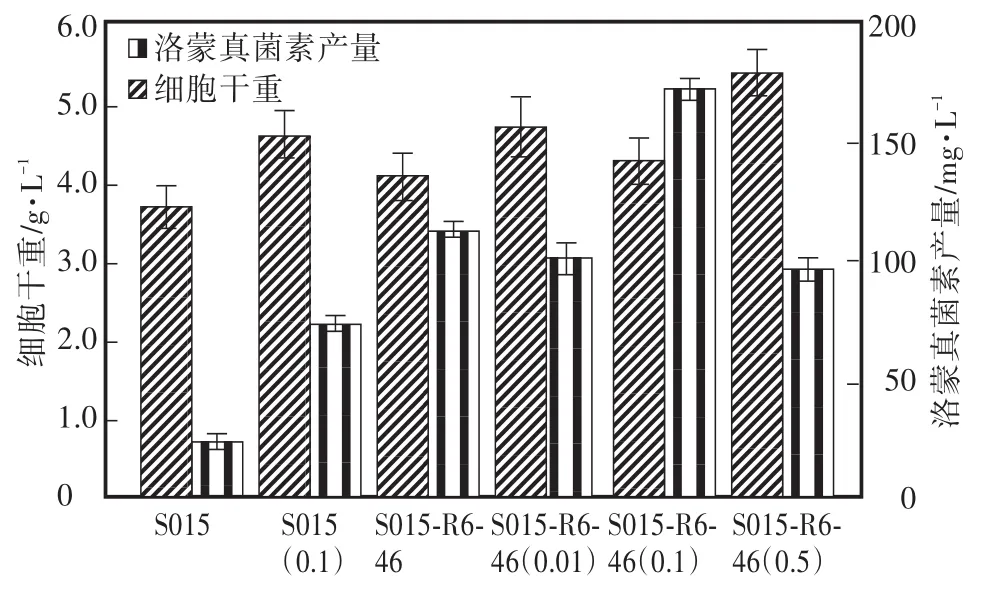
图5 FeCl3量浓度对复合筛选后突变菌株中洛蒙德链霉菌细胞生长和产物合成的影响Fig.5 Effects of FeCl3concentration on strain S015 and its mutants’cell growth and lomofungin yields
前期的工作中,通过改变添加离子的种类和浓度,已经对野生株S015进行了发酵优化[20]。本研究的结果显示,在突变株S015-R6-46的培养基中添加FeCl3,同样可以提高洛蒙真菌素的产量,最佳的FeCl3添加量为0" 1 mmol/L,突变株S015-R6-46的产量达到了(258" 7±5" 7)mg/L。
3 讨论
本试验主要进行了PCA以及抗生素对洛蒙德链霉菌的抗性筛选,试验验证洛蒙德链霉菌S015在添加外源PCA或者利福平以及庆大霉素诱变后,洛蒙真菌素的产量均有不同程度的提高。
根据链霉菌的生物合成途径和代谢调节理论,通过对洛蒙真菌素产生菌洛蒙德链霉菌添加结构类似物PCA,进行推理选育,以期筛选出解除自身次级代谢产物对抗生素合成的自我阻遏。在高质量浓度的PCA压力下,突变株不仅能够继续生长并不受影响,并且产抗生素的能力较野生型有了较大提高。在添加PCA质量浓度为100 μg/mL的压力下,洛蒙真菌素的产量从(33" 1±6" 2)mg/L提高到了(106" 0±4" 4)mg/L。沈剑峰等[25]在卡那霉素链霉菌中,通过采用自身代谢产物卡那霉素结构类似物西索米星进行抗性筛选,得到了突变菌株,较出发菌株产量提升了40%。刘连碧等[26]通过链霉素抗性筛选的方法使得天蓝淡红链霉菌SIPI1482的抗生素产量(柔红霉素)提高了1" 5倍。同时在后续的验证中,突变株依旧保持高于野生型菌株约3倍的洛蒙真菌素产生量,可见其稳定性较好。
在利用抗性筛选方法筛选高产菌株部分,本试验采用了利福平以及庆大霉素这两种作用于核糖体附近的抗生素。引入利福霉素以及庆大霉素的抗性突变,洛蒙真菌素的产量均发生了较为明显的变化:培养96 h后菌株产量分别达到了(103" 4±0" 1)mg/L和(81" 2±2" 5)mg/L。Hu等[27]在变铅青链霉菌中利用庆大霉素进行抗性筛选,获得Actionorhodin(Act)和Undecylprodigosin(Red)合成增加的高产抗性株。
此外,从细胞量的结果来看,添加高质量浓度利福平和庆大霉素后,突变株与野生型菌株相比并没有太大的变化,可见核糖体工程并不是通过改变细胞的生长以提高洛蒙真菌素的产量的。HosoyaY等[15]通过对一些ppGpp合成基因(relC)突变的链霉菌的分析,发现依赖ppGpp启动菌体产抗生素途径可以被链霉素抗性突变所代替。也就是说,核糖体特定位点的突变能够导致核糖体结构的改变,从而使菌株在不含有ppGpp的情况下,最终提高次级代谢产物的产量。
在庆大霉素的筛选中,添加50 mg/mL庆大霉素后洛蒙真菌素的产量反而比添加20 mg/mL庆大霉素低,推测原因可能是不同质量浓度的庆大霉素作用在核糖体的位点会有不同。在对天蓝色链霉菌(S.coelicolor)和变铅青链霉(S.lividans)这两种链霉菌遗传学的模式菌株的研究中发现,高质量浓度和低质量浓度链霉素对S.lividans突变的作用位点是不同的,导致介导抗生素的产生机制发生变化,从而使抗生素的最终产量发生变化[27]。
在后续的试验中,可以有针对性的对突变株进行遗传分析,对可能引起突变的基因进行PCR扩增,分析突变前后的变化,确定其是否带有核糖体蛋白突变。并将复合筛选的高产菌株进行基因工程改造,以期进一步提高洛蒙真菌素的产量。
参 考 文 献
[1]金颖,胡洪波,张雪洪,等"假单胞菌产生的抗生素研究[J]"上海农业学报,2006,21(3):106-109"
[2]Laursen J B,Nielsen J" Phenazine natural products:biosynthesis,synthetic analogues,and biological activity[J]" Chemical Reviews,2004,104 (3):1663-1686"
[3]Mavrodi D V,Blankenfeldt W,Thomashow L S" Phenazine compounds in fluorescent Pseudomonas spp" biosynthesis and regulation[J]" Annu" Rev" Phytopathol,2006,44:417-445"
[4]Turner J M,Messenger A J" Occurrence,biochemistry and physiology of phenazine pigment production[J]" Advances in Microbial Physiology,1986,27:211-275"
[5]Mavrodi D V,Parejko J A,Mavrodi O V,et al" Recent insights into the diversity,frequency and ecological roles of phenazines in fluorescent Pseudomonas spp"[J]" Environmental Microbiology,2013,15(3):675-686"
[6]梁文平,郑斐能,王仪,等" 21世纪农药发展的趋势绿色农药与绿色农药制剂[J]"农药,1999,38(9):1-2"
[7]邹芳慧,陈志强,任卫东,等"面向二十一世纪的生物农药[J]"化学工程师,2003(6):44-45"
[8]方运玲,孙爽,何亚文,等"微生物源农药申嗪霉素的研制与应用[J]"农药学学报,2014,16(4):387-393"
[9]许煜泉"绿色微生物源抗菌剂申嗪霉素(M18)[J]"山东农药信息,2005(3):26-27"
[10]Puopolo G,Masi M,Raio A,et al" Insights on the susceptibility of plant pathogenic fungi to phenazine-1-carboxylic acid and its chemical derivatives[J]" Natural Product Research,2013,27(11):956-966"
[11]Chincholkar S,Thomashow L" Microbial phenazine:biosynthesis,agriculture and health[M]//Lugtenberg B,Girard G" Role of phenazine-1-carboxamide produced by Pseudomonas chlororaphis PCL1391 in the control of tomato foot and root rot" New York:Springer,2013:163-175"
[12]陈代杰,朱宝泉"工业微生物菌种选育与发酵控制技术[M]"上海:上海科学技术文献出版社,1995"
[13]Ochi K" Metabolic initiation of differentiation and secondary metabolism byStreptomyces griseus:significance of the stringent response(ppGpp)and GTP content in relation to A factor[J]" Journal of Bacteriology,1987,169(8):3608-3616"
[14]Ochi K" A relaxed(rel)mutant of Streptomyces coelicolor A3(2)with a missing ribosomal protein lacks the ability to accumulate ppGpp,A-factor and prodigiosin[J].Journal of General Microbiology,1990,136(12):2405-2412"
[15]Hosoya Y,Okamoto1 S,Muramatsu H,et al" Acquisition of certain streptomycin-resistant(str)mutations enhances antibiotic production in bacteria[J]" Antimicrobial Agents and Chemotherapy,1998,42(8):2041-2047"
[16]Shima J,Hesketh A,Okamoto S,et al" Induction of actinorhodin production by rpsL(encoding ribosomal protein S12)mutations that confer streptomycin resistance in Streptomyces lividans and Streptomyces coelicolor A3(2)[J]" Journal of bacteriology,1996" 178(24):7276-7284"
[17]Liu K,Bittner A N,Wang J D" Diversity in(p)ppGpp metabolism and effectors[J]" Current Opinion in Microbiology,2015,24:72-79"
[18]Lai C,Xu J,Tozawa Y,et al" Genetic and physiological characterization of rpoB mutations that activate antibiotic production in Streptomyces lividans[J]" Microbiology,2002,148(11):3365-3373"
[19]杜润泮,赵静岩"卡那霉素链霉菌耐高浓度自身代谢产物的高产菌株的选育[J]"抗生素,1983,8(1):24-28"
[20]Johnson L E,Dietz A" Lomofungin,a new antibiotic produced by Streptomyces lomondensis sp" n"[J]" Applied Microbiology,1969,17(5):755-759"
[21]Bergy M" Lomofungin,a new broad spectrum antibiotic" Isolation and characterization[J]" The Journal of Antibiotics,1969,22(3):126-128"
[22]Dhanasekaran D,Thajuddin N,Panneerselvam A" Fungicides for Plant and Animal Diseases[M]//Dhanasekaran D,Thajuddin N,Panneerselvam A" Applications of Actinobacterial Fungicides in Agriculture and Medicine" Rijeka:InTech,2011:29-54"
[23]Yacoub A T,Velez A P,Khwaja S I,et al" Streptomyces pneumonia in an immunocompromised patient:a case report and a review of literature [J]" Infectious Diseases in Clinical Practice,2014,22(4):e113-e115"
[24]王华盛,贝晓宇,张雪洪,等"洛蒙德链霉菌S015中吩嗪类活性产物洛蒙真菌素的分离纯化,结构鉴定及发酵优化[J]"上海交通大学学报:农业科学版,2014,32(2):48-54"
[25]沈剑锋,樊伟明"西索米星在卡那霉素链霉菌育种中的应用[J]"中国医药工业杂志,2012,42(12):899-901"
[26]刘连碧,曹进新,朱春宝,等"链霉素抗性筛选法在柔红霉素产生菌S.coeruleorubidus var" zhengding SIPI 1482菌种选育中的应用[J]"中国医药工业杂志,2000,31(8):345-346"
[27]Hu H F,Zhang Q,Zhu B Q" Enhanced antibiotic production by inducing low level of resistance to gentamicin[J]" Chinese Journal of Natural Medicines,2008,6(2):146-152"
(责任编辑:程智强)
Induced mutation and selection of Streptomyces lomondensis S015 producing high lomofungin yield
ZHANG Chun-xiao,QIAN Wei,WANG Wei*,HU Hong-bo,PENG Hua-song,ZHANG Xue-hong
(State Key Laboratory of Microbial Metabolism,School of Life Sciences and Biotechnology,Shanghai Jiaotong University,Shanghai 200240,China)
Abstract:A mutant strain S015-P34 was selected from a wild lomofungin-producing Streptomyces lomondensis strain S015 through mutagenesis induced by phenzine-1-catboxylic acid(PCA),and its lomofungin yield reached(106" 0±4" 4)mg/L and 3" 2 times of the wild strain’s;Mutant strains S015-R6 and S015-G11 were selected from the strain S015 through mutagenesis induced by rifampicin and gentamicin antibiotics,and their lomofungin yields were respectively(103" 4±0" 1)mg/L and(81" 2±2" 5)mg/L and respectively 3" 2 times and 2" 5 times of the wild strain’s;The PCA-induced mutagenesis was combined with the rifampicin-induced mutagenesis and a mutant strain S015-R6-46 was obtained,with the lomofungin yield being(168" 0±2" 2)mg/L and 5" 1 times of the wild strain’s" The optimization of S015-R6-46 culture medium showed that the lomofungin yield could reach(258" 7±5" 7)mg/L via addition of 0" 1 mmol/L FeCl3" The above experimental results could be used for reference in induced mutation and selection of streptomycete strains producing high phenazine yields"
Key words:Streptomyces lomondensis;Induced mutation;Screening;Lomofungin;Phenazine compounds
*通信作者:王威(1972—)女,博士,副教授,研究方向:发酵与代谢工程。E-mail:weiwang100@sjtu" edu" cn
作者简介:张春晓(1989—)女,硕士,研究方向:微生物资源与代谢。E-mail:lnzcx@sina" cn
基金项目:国家自然科学基金(31270084);国家973计划项目(2012CB721005);国家863计划项目(2012AA022107)
收稿日期:2015-02-02
文章编号:1000-3924(2016)01-066-06
中图分类号:S182
文献标识码:A
