MRI三维重建在肝转移瘤微波消融术中的应用
2016-04-07杨楠楠奚玉来许志强王忠敏
杨楠楠 贡 桔 陆 健 夏 宁 奚玉来 许志强 王忠敏
MRI三维重建在肝转移瘤微波消融术中的应用
杨楠楠 贡 桔 陆 健 夏 宁 奚玉来 许志强 王忠敏
目的:探讨计算机辅助MRI三维重建在肝转移瘤微波消融术前计划及术后随访中的作用。方法:2015年8月至2016年5月我院收治符合肝微波消融适应证的肝转移瘤患者16例(21个病灶)。术前采用MRI及后处理站进行多维度、多序列(T1WI增强、T2WI及DWI)3D重建观察目标病灶及周围环境,综合多方面因素考虑制订术前穿刺及消融计划;术中实时利用3D重建技术,以垂直于穿刺针平面进行实时追踪并评估穿刺途径及消融范围,术后采用同一平面利用T2WI、T1WI增强及DWI成像评估术后消融范围及效果。结果:手术均顺利完成,无明显并发症,随访至术后1~3个月未见明显复发征象。其中14例术前行肝脏CTA检查(检出病灶17个),与CTA相比,T1WI-MRI 3D重建显示病灶周边血管(三级及三级以上分支)为29/30,显示率为99%;所有病例未见明显胆管扩张,术前T2WI显示病灶邻近1cm内二级胆管分支共12例。根据术前规划、模拟穿刺途径,与实际穿刺途径符合100%,术后3D重建显示消融范围完全覆盖肿瘤边界。结论:计算机辅助MRI评价体系可有效评价目标病灶的大小及周边环境,为术前拟定手术方案提供依据;术中可有效引导穿刺并实施多维度展现术区变化,评估消融范围;术后及随访可有效多序列展示消融边界及信号变化,提供多方位信息。
磁共振成像;微波消融;肝转移瘤
介入能量消融治疗目前被认为是肝脏肿瘤标准治疗手段之一,特别在小肝癌以及肝转移性肿瘤中应用广泛[1]。影像引导下微波消融(microwave ablation, MWA)作为一种微创介入治疗方法,目前已广泛用于治疗全身多种实体器官肿瘤[2]。其中理想的成像手段不仅要清晰完整地显示肿瘤信息以及肿瘤周边解剖情况,并且能做到实时、多维度多信息监测介入治疗过程,为术后疗效评价提供有效信息。现阶段多种成像手段(CT/MR/US/PET)等各具优势,其中MRI具有软组织分辨率佳、多维度多序列成像等优点,具有广泛的应用前景[3]。肝转移瘤多数形态不规则,并不完全垂直于人体各个轴面,并且在各个轴面上长度不一致;而微波消融理论范围是一个沿着穿刺长轴的椭圆体[4];传统基于人体垂直的轴面显示方式上,肿瘤及消融范围均多为不规则形状,对于消融范围的判断较难。因此,本研究利用计算机辅助MRI 3D后处理图像评价方法,探讨其在肝转移瘤微波消融术中的应用。
方法
1. 入组标准
2015年8月至2016年5月我院收治符合肝微波消融适应证的肝转移瘤患者16例(21个病灶)。入组标准:经临床病理及影像学证实肝内肿瘤,不符合肿瘤切除标准,肝内肿瘤数量不多于3个。排除标准:①一般情况差,难以耐受微创手术;②全身广泛转移;③凝血功能差,有出血倾向;④预期生存时间小于3个月。其中男10例,女6例,病灶分布于S3段3例、S4段3例、S5段2例、S6段5例、S7段3例、S7/8段1例、S8段4例,共计21病灶。
2. 仪器及方法
2.1 MRI:西门子1.5T Avanto,术前采用常规MRI平扫(包括T1WI、T2WI),多b值DWI成像(b=50, 500, 800, 1000)以及增强MRI成像;术中采用T1-VIBE(TR=3.58ms TE=1.42ms)引导穿刺,T2WI确认针尖位置及与周围血管关系;术后即时采用T2WI、多b值DWI成像确认消融范围;术后1周内及术后1个月、3个月采用常规MRI平扫(包括T1WI、T2WI),多b值DWI成像(b= 50,500, 800, 1000)以及增强MRI成像复查。所有数据自动传递至工作站后处理。
2.2 微波消融设备:所有手术采用微波消融设备 (FORSEA; Qinghai Microwave Electronic Institute, Nanjing, China) 。根据手术目标肿瘤大小分别采用60W/5min、80W/5min穿刺消融;采用稳流泵 (BT01-100 LanGePump; LanGe Steady Flow Pump, Baoding ,China) 进行水冷循环,50~60ml/min。磁共振引导下微波消融术由2名有5年以上经验的主治医师实施。
2.3 图像处理 ①手术前后图像采用西门子后处理工作站syngo.via;术前采用3D显像多序列多维度显示病灶,由手术医师及影像医师共同确认手术穿刺途径。沿手术穿刺途径方向显示并统计目标病灶最大长径(沿手术穿刺途径方向),最大横径(垂直穿刺途径平面),根据测量结果,拟定微波消融方案。②术中:图像实时传递入手术室内工作站,实时三维成像,评估进针角度及目标病灶范围(沿手术穿刺途径方向及垂直穿刺途径平面,并于术前拟定路线实时对比调整),引导穿刺并评估消融范围;③术后随访:所有图像自动传入后处理工作站,经过3D重建多序列多维度评估手术区域大小,评估最大径面,以及手术径面(沿手术穿刺途径方向及垂直穿刺途径平面),对比术前图像,评估手术区域覆盖,以及对比消融灶大小。所有处理图像由1名高级职称医师以及1名低级职称医师分别判断,争议之处共同讨论后决定。
结果
1. 一般结果
术顺,无明显严重并发症,8名患者术后有局部疼痛,6名有轻度发热,均于术后1周内缓解。随访观察至术后1~3个月未见明显复发征象。
2. 术前穿刺途径及消融计划
其中14例术前行肝脏CTA检查(检出病灶17个),与CTA相比,术前T1WI MRI增强3D重建显示病灶周边血管(三级及三级以上分支)为29/30,显示率为99%,29例血管在术后回访中均通畅;所有病例未见明显胆管扩张,术前T2WI显示病灶邻近1cm内二级胆管分支共12例。根据术前规划、模拟穿刺途径,与实际穿刺途径符合100%(21/21)。
3. 术区MRI信号变化

图1 A.显示术前T1WI增强,紫色线表示术前规划穿刺途径,右上红色框面表示垂直于穿刺途径层面; B.为术后消融范围,紫色线为实际消融途径,右上红色框面表示垂直于穿刺途径层面。

图2 橘色范围为理论微波消融范围,呈一个以穿刺针为中心的椭圆体;黄色示不规则肿瘤体,示意图示沿垂直于穿刺针层面,平面上理论消融范围为一以穿刺针为中心的正圆形范围,直观地展现了理论消融范围与肿瘤关系,有利于评估消融范围。
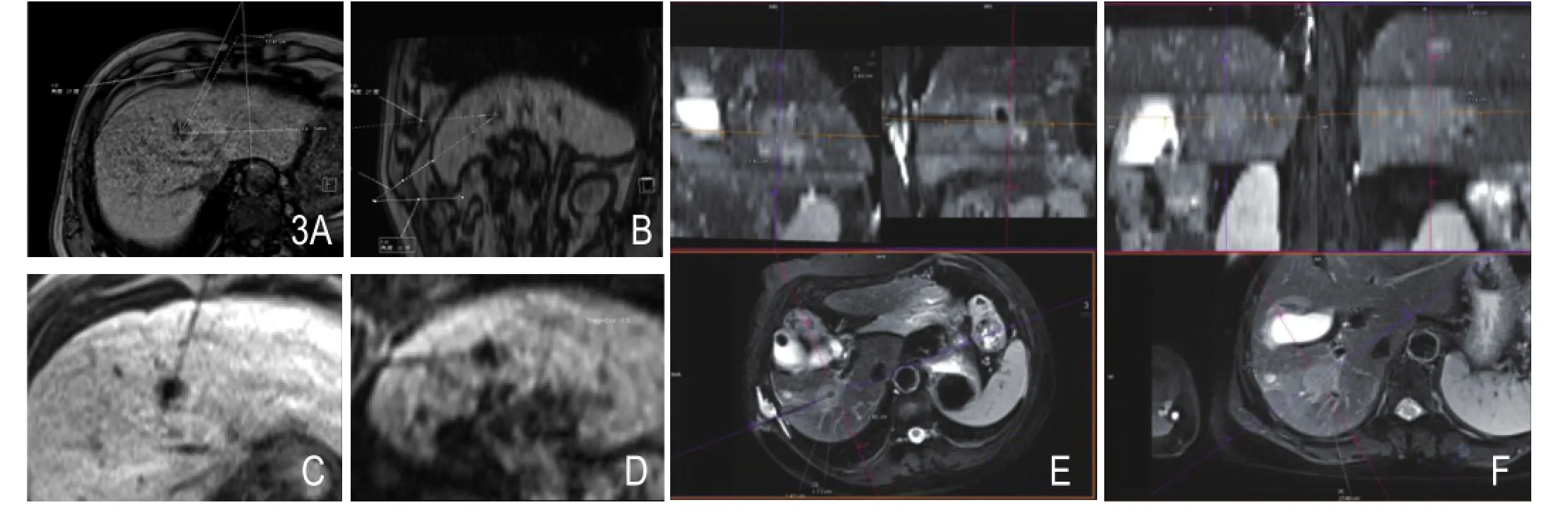
图3 A、B.术前共同讨论后得出最佳穿刺途径,其中白色线标识距离、角度等。 C、D.为实际穿刺途径,与术前规划一致。E.为术中T2WI显示穿刺针位置与病灶及周围血管关系,黑色线影为穿刺针影。F.为术前沿规划途径及垂直平面显示病灶。
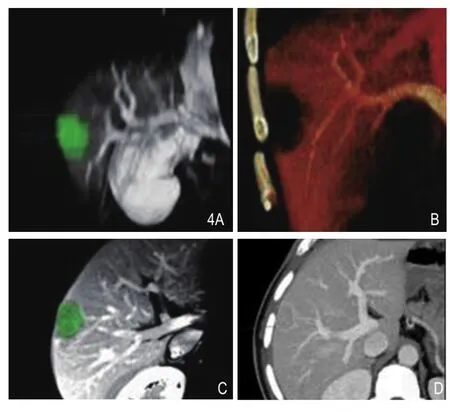
图4 3D三维T1WI增强重建图像(A、C)与CTA相比(B、D)相比,绿色标识部分为肿瘤,可见在3D-MRI重建与CTA均可显示病灶周主要血管及与病灶相对位置。
与术前图像病灶T1WI低T2WI高DWI高信号相比,术后即时消融区域T1WI、T2WI、DWI信号减低,周围见环状T1WI高、T2WI高、DWI高信号区;术后1个月消融区域呈现T2WI低、周环形高信号,DWI仍呈高-低-高三环征象,信号范围较前缩小。术后3D重建(图1)术前对比,可见消融范围大体呈现为长轴于穿刺途径平行的椭圆形,垂直于穿刺途径的横断面显示消融区域包绕原病灶边缘血管,消融后术前显示29例血管均通畅。
讨论
近年来以射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation, MWA)为代表的局部热消融技术发展迅速,其中MWA具有治疗温度升高更快、消融范围更大、治疗时间更短、受热沉降效应的影响更小等特点[5]。同时在术前、术中、术后影像学评估中,MRI在术前病灶探测、定位方面具有独特的优势[6]。目前动态增强CT和动态增强MRI被视为肝恶性肿瘤原位治疗后标准评价流程。另外,学界提出了适用于肝脏肿瘤改良方法mRECIST(modified RECIST)标准,加入了肿瘤内部坏死评估及生物代谢指标[7-8]。其中DWI可用于早期评估肿瘤内部坏死,可早于肿瘤体积变化,从而在评估肿瘤疗效有很好的应用前景[9]。MRI可以提供多种信号变化以及在辅助软件帮助下实现实时3D建模,对于肿瘤定位以及实时肿瘤检测十分必要。在引导穿刺的过程中,由于MRI具备多方位成像能力,可显示穿刺针全长以及在3D成像软件的辅助之下可有效呈现穿刺针与病灶的关系。
多数肝脏转移瘤形态不规则,并不完全垂直于人体各个轴面,并且在各个轴面上长度不一致;而理论上微波消融范围是一个沿着穿刺针的椭圆体。然而研究表明最佳消融范围需要在各个位面保证消融范围完全覆盖肿瘤实质,并且超出肿瘤实质边缘5~10mm[11-12]。因此,传统基于人体轴面的显示方式,对于临床医师想象重建能力要求颇高,由于肿瘤不规则以及对组织热传导不均,以及穿刺途径及展现立面不一致导致在各个观察图层上肿瘤范围及消融范围并不连贯,容易造成实际消融范围与需要范围不一致,从而导致术后肿瘤残余[13]。因此,最佳观测面为垂直于沿肿瘤最长轴的观测平面(图2),然后最佳穿刺途径尽量符合肿瘤长轴。本研究与术前3D多方位展现并计算肿瘤体积、长短轴,结合周围血管以及体表穿刺途径等综合情况,尽量使穿刺长轴接近或平行于肿瘤长轴,规划最佳穿刺途径,并依据测量大小计划消融功率时间等,并在术中实时3D多平面(包括穿刺针垂直平面)评估穿刺针点及消融范围。图3A/B显示在手术进行前规划穿刺途径,与实际穿刺途径(图3C、D)一致。
T1WI-vibe成像迅速,本研究中单次成像耗时约20s,且穿刺针在T1WI呈低信号与周围呈等高信号的肝组织对比强烈。故选用T1WI-vibe为术中序列,快速确定穿刺针位置(图3C、D)。另外,在T1WI序列中,可部分显示病灶周边微小血管及胆管形态,从而帮助小病灶定位。在T2WI序列图像上,肝内病灶成高信号,与穿刺针的低信号反差较大。并且消融灶在MRI上呈T1WI高信号、T2WI低信号,与周围组织对比明显,穿刺针在T2WI呈低信号,与稍高信号病灶对比明显,因此,T2WI可用于术中评估穿刺针与肿瘤边界及周围血管关系及距离,从而精确调整穿刺针位置及选择微波功率(图3E、F)。
热消融疗法主要原理是利用局部热效应引起局部病灶凝固坏死。病灶的病理改变引起MRI上信号变化,其中病灶周坏死凝固带在T1WI呈稍高信号,消融范围灶T1WI上呈现低-高-低环形结构,对应病灶坏死-凝固-周围炎性反应层次结构[14]。由于肿瘤细胞有完整细胞膜使扩散受限而呈高信号,而坏死肿瘤由于细胞膜被破坏使水的扩散增加而呈低信号故DWI可将消融凝固性坏死、肝充血、肉芽组织、存活肿瘤、肝脏正常组织区分开,可做为准确地评价消融术后局部疗效和及时检出残存/复发的肿瘤的基础,指导临床的进一步治疗[15]。Hoffmann等认为术前、后及时DWI成像范围对比可用于非增强扫描中消融范围的确认,并且相对于T1WI对于周边炎性反应更加灵敏,不应与术后局部肿瘤残留混淆[9]。本研究发现术后消融区域呈现DWI高-低-高信号三环征象,笔者认为,中央为坏死液化区域,低信号带为热效应固化无活性带,周边为正常肝组织炎性反应区。随着时间推移,病灶整体呈现收缩式变化。
术前3D重建(图4)可清晰显示目标病灶及计划消融范围内血管,术后3D不仅能多位面对比评价消融区域,也可清晰显示消融病灶周血管、胆管变化。消融后范围沿垂直于穿刺途径层面观察,并不呈现均匀的圆形,这与实际肝脏不同组织热传导效率不一导致。文献报道,在大血管旁由于血管流动效应导致血管周消融效率减低。另外,微波消融其他局部能量治疗具有更少的热沉积效应,对周围血管损伤较小,本研究所显示消融范围内29例血管术后均通畅,与文献报道相符。
计算机辅助MRI评价体系可有效评价目标病灶的大小及周边环境,为术前拟定手术方案提供依据;术中可有效引导穿刺并实施多维度展现术区变化,评估消融范围;术后及随访可有效多序列展示消融区域变化及信号变化,提供多方位信息。
[ 1 ]中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委员会与中华医学会肝病学分会肝癌学组. 肝癌局部消融治疗规范的专家共识. 中华肝脏病杂志, 2011, 19: 257-259.
[ 2 ]Ong SL, Gravante G, Metcalfe MS, et al. Efficacy and safety of microwave ablation for primary and secondary liver malignancies: a systematic review. Eur J Gastroenterol Hepatol, 2009, 21: 599-605.
[ 3 ]Goldberg SN, Charboneau JW, Bodd GR, et al. Image-guided tumor ablation: proposal for standardization of terms and reporting criteria. Radiology, 2003,228: 335-345.
[ 4 ]Wang X , Sofocleous CT, Erinjeri JP,et al. Margin size is an independent predictor of local tumor progression after ablation of colon cancer liver metastases. Cardiovasc Intervent Radiol, 2013,36 : 166-175.
[ 5 ]Wright AS, Sampson LA, Warner TF, et al. Radiofrequency versus microwave ablation in a hepatic porcine model. Radiology, 2005,236: 132-139.
[ 6 ]Clasen S, Rempp H, Hoffmann R, et al. Image-guided radiofrequency ablation of hepatocellular carcinoma (HCC): Is MR guidance more effective than CT guidance? Eur J Radiol, 2014, 83 : 111-116.
[ 7 ]Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). Eur J Cancer, 2009,45 : 228-247.
[ 8 ]Lencioni R, Llovet JM. Modifed RECIST (mRECIST) Assessment for Hepatocellular Carcinoma. Semin Liver Dis, 2010, 30: 52-60.
[ 9 ]Hoffmann R, Rempp H, Schraml C, et al. Diffusion-weighted imaging during MR-guided radiofrequency ablation of hepatic malignancies: analysis of immediate pre- and post-ablative diffusion characteristics. Acta Radiol, 2015,56: 908-916.
[10]Kuang M, Lu MD, Xie XY, et al. Liver cancer: increased microwave delivery to ablation zone with cooled-shaft antenna--experimental and clinical studies. Radiology, 2007, 242 : 914-924.
[11]Gillams AR ,Lees WR. Five-year survival in 309 patients with colorectal liver metastases treated with radiofrequency ablation. Eur Radiol, 2009,19 : 1206-1213.
[12]Zhang YJ, Liang HH, Chen MS, et al. Hepatocellular carcinoma treated with radiofrequency ablation with or without ethanol injection: a prospective randomized trial. Radiology, 2007, 244 : 599-607.
[13]Bilchik AJ, Wood TF, Allegra D, et al. Cryosurgical ablation and radiofrequency ablation for unresectable hepatic malignant neoplasms: a proposed algorithm. Arch Surg, 2000,135: 657-662;discussion 662-664.
[14]Breen MS, Lazebnik RS, Fitzmaurice M, et al. Radiofrequency thermal ablation: correlation of hyperacute MR lesion images with tissue response. J Magn Reson Imaging, 2004,20 : 475-486.
[15]郑晓林, 徐辉雄,吕明德,等. MR扩散加权成像对经皮肝脏消融灶组织成分定性研究的初探. 中华放射学杂志, 2006,40 : 417-422.
Computer Assisted MRI 3D Reconstruction in Planning and Evaluating Treatment Response of Liver Metastasis Microwave Ablation
YANG Nan-nan, GONG Ju, LU Jian, XIA Ning, XI Yu-lai, XU Zhi-qiang, WANG Zhong-min
Purpose:To verify the feasibility of MRI three-dimensional (3D) reconstruction in planning and evaluating the treatment response of liver metastasis microwave ablation (MWA).Methods:From Aug 2015 to May 2016, according to the selection criteria, 16 patients (21 lesions) were enrolled. MRI exam (T1WI, T2WI, multi-b value DWI) were performed before the operation and also for the follow-up. All data were transferred to the workstation, and post-procession was done.Results:Till 1-3 month after operation, no serious or fatal complication, no recurrence was observed. The operation trace was 100% matched with the 3D reconstruction planning. Compared with CTA, 99% (29/30) small vessels were shown by MRI. No biliary duct dilation was shown in all cases;MRI showed 12 normal biliary ducts. Post-operation signal change and ablation margin were shown by MRI 3D reconstruction.Conclusion:MRI 3D reconstruction is feasible and effective in the treatment planning and evaluating the treatment response of MWA for liver metastasis.
Magnetic resonance imaging, Microwave ablation, Liver metastasis
R814.42
A
1006-5741(2016)-06-0525-06
2016.08.31;修回时间:2016.09.05)
中国医学计算机成像杂志,2016,22:525-530
上海交通大学瑞金医院卢湾分院放射科
通信地址:上海市黄浦区重庆南路149号,上海210020
王忠敏(电子邮箱:wangzhongmin@foxmail.com)
国家自然简直学基金No.81271612
Chin Comput Med Imag,2016,22:525-530
Department of Radiology, Luwan Branch, Ruijin Hospital, Shanghai Jiaotong University
Address:149 Chongqing South Rd.,Shanghai 210020,P.R.C.
Address Correspondence to WANG Zhong-min(E-mail:wangzhongmin@ foxmail.com)
Foundation item:Natural Scionce Foundation of China No.81271612
