经穴注射BMSCs联合中药对下肢缺血大鼠促血管生成相关因子的影响
2016-04-06凤叶永生董雨董建勋王伏声丁毅荣培晶徐旭英
黄 凤叶永生董 雨董建勋王伏声丁 毅荣培晶徐旭英
(1首都医科大学附属北京中医医院疮疡血管外科,北京,100010;2北京中医药大学,北京,100029;3中国中医科学院针灸研究所,北京,100700)
经穴注射BMSCs联合中药对下肢缺血大鼠促血管生成相关因子的影响
黄 凤1叶永生2董 雨1董建勋1王伏声1丁 毅1荣培晶3徐旭英1
(1首都医科大学附属北京中医医院疮疡血管外科,北京,100010;2北京中医药大学,北京,100029;3中国中医科学院针灸研究所,北京,100700)
摘要目的:观察经穴注射骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)联合益气活血中药对糖尿病(Diabetes Mellitus,DM)大鼠缺血后肢骨骼肌中促血管生成因子的表达情况。方法:80只SD大鼠1∶7随机分为2组:正常假手术组10只,其余70只一次性腹腔注射链脲佐菌素(Streptozotocin,STZ,50. 0 mg/kg)制成DM大鼠模型,再等比例随机分为7组,即DM假手术组、DM缺血组、益气活血中药组、局部注射BMSCs组、局部注射BMSCs+中药组、穴位注射BMSCs组、穴位注射BMSCs+中药组,每组10只。应用RT-PCR法检测大鼠后肢骨骼肌中VEGF、bFGF mRNA的表达。结果:穴位注射BMSCs+中药组术侧VEGF mRNA表达量较DM假手术组升高(P<0. 05);DM假手术组、局部注射组、穴位注射组术侧bFGF mRNA表达量较健侧升高(P<0. 05);局部注射+中药组、穴位注射+中药组术侧bFGF mRNA表达量较正常血糖假手术组、DM假手术组、DM缺血组升高(P<0. 05);穴位注射+中药组健侧bFGF mRNA表达量较正常血糖假手术组、DM假手术组、DM缺血组、中药组、局部注射组升高(P<0. 05)。结论:穴位注射BMSCs结合益气活血中药可明显促进血管生成因子VEGF、bFGF的表达,益气活血中药可能促进穴位注射BMSCs的成活率从而提高促血管生成因子VEGF、bFGF的表达。
关键词糖尿病下肢缺血;血管内皮生长因子VEGF;碱性成纤维细胞生长因子bFGF;穴位注射;骨骼间充质干细胞
The Effect of Acupolnt Injectlon of BMSCs Comblned wlh Chlnese Medlclne on VEGF/bFGF of Dlabetlc Rats wlth Lower Llmbs Ischemlc
Huang Feng1,Ye Yongsheng2,Dong Yu1,Dong Jianxun1,Wang Fusheng1,Ding Yi1,Rong Peijing3,Xu Xuying1
(1 Beijing Hospital of Traditional Chinese Medicine Affiliated to Capital University of Medicine Sciences,Beijing 100010,China;2 Beijing University of Chinese Medicine,Beijing 100029,China;3 Institute of Acu-Mox,China Academy of Chinese Medical Sciences,Beijing 100700,China)
Abstract Objectlve:To observe the expression of angiogenesis factor in skeletal muscle of diabetic rats with lower limbs ischemia during acupoint injection of bone marrow mesenchymal stem cells(BMSCs)with Qi-tonifying and Blood-activating Chinese medicine. Methods:Eighty Sprague Dawley(SD)rats were randomly divided into 2 groups,10 rats in the normal blood sugar control (NMC)grooup. The other 70 rats were intraperitoneally injected Streptozotocin(50. 0 mg/kg)to make DM model,then were randomly divided into 7 groups equally,namely diabetes control(DMC)group,diabetes ischemic(DMI)group,Qi-tonifying and Blood-activating(QB)group,local injection BMSCs(L-BMSCs)group,L-BMSCs+QB group,acupoint injection BMSCS (Acu-BMSCs)group,and Acu-BMSCs+QB group. Using RT-PCR method to detect the expression of VEGF and bFGF mRNA in muscular tissue. Results:The expression of VEGF mRNA on the operation side in Acu-BMSCs+QB group was higher than DMC group(P<0. 05). The expression of bFGF mRNA on the operation side in DMC,L-BMSCs,Acu-BMSCs groups were higher than the uninjured side(P<0. 05),and those in L-BMSCs,Acu-BMSCs+QB groups were higher than NMC,DMC,DMI groups(P<0. 05). The expression of bFGF mRNA on the uninjured side in Acu-BMSCs+QB group was higher than NMC,DMC,DMI,QB,L-BMSCs groups(P<0. 05). Concluslon:The expression of VEGF,bFGF were positively affected by acupoint injection of BMSCs combined with QB,which means QB Chinese herb could improve the expression of angiogenesis factor by increasing the survival rate of BMSCs injected in acupoint.
Key Words Diabetic;Lower limb ischemia;VEGF;bFGF;Acupoint injection;BMSCs
糖尿病下肢缺血是一种发病率高、发病较重的缺血性病变。2007年流行病学调查显示,我国7个大中城市50岁以上伴有一个以上危险因素的糖尿病患者19. 47%患有PAD,其中男性占到18. 3%,女占到20. 4%,70岁以上PAD患病率更高,达31. 9%[1]。目前,外科血管重建术可在一定时间内改善缺血肢体灌注量,但却存在手术并发症和死亡率的风险,且重建的血管再度狭窄率也较高。药物治疗虽可改善症状,但并不能彻底改善局部灌注。寻求最终改善缺血组织的灌注,提高患者的生活质量,降低致残率的有效治疗方法仍是临床工作亟待解决的问题。近年来,干细胞疗法应用于临床与实验促进血管生成的研究[2]为这一疾病的治疗提供了新的思路,并具有广阔的临床应用前景,因此,研究干细胞疗法在治疗DM下肢缺血中的意义、机制和具体应用有着十分重要的临床意义和研究价值。
1 材料与方法
1. 1 动物 SPF级雄性大鼠80只,体重为200~ 220 g雄性SD大鼠,购买于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》。
1. 2 药品与试剂 提纯试剂盒Z3100,GoScript试剂盒(A5000),GoTaq qPCR Master Mix(A6001),Promega(北京)生物技术有限公司;PCR引物合成,北京诺赛基因组研究中心有限公司;Mx3000P荧光定量PCR仪,Agilent StratageneInc. USA;链脲佐菌素(S0130),Sigma;益气活血方由首都医科大学附属北京中医医院中药制剂室制备。
1. 3 仪器 紫外分光光度计(Pharmacia Biotech),GeneQuant;PCR扩增仪(GeneAmp9700),Applied Biosystems;Rea-Time PCR(Mx3000P),Agilent Technologies Stratagene。
1. 4 动物分组与造模方法
1. 4. 1 动物分组 80只SD大鼠,先后随机分为8组,分组情况及干预方法如表1。

表1 分组情况及干预方法
1. 4. 2 造模方法 经普食普水适应喂养1周后,以1∶7随机分为2组,正常假手术组10只,其他70只大鼠在禁食6 h后左下腹腹腔注射STZ 50. 0 mg/kg(溶于0. 1 mmol/L、pH值=4. 2的柠檬酸钠-柠檬酸缓冲溶液)以制备糖尿病模型[3]。于造模后3、7、14、28 d尾静脉采血针取血检测随机血糖浓度,以血糖值>16. 0 mmol/L作为糖尿病模型制备成功标准。
糖尿病模型造模1个月后,将糖尿病造模成功血糖值>16. 0 mmol/L的大鼠,等比例随机分组后按要求行以下方法制备左后肢缺血模型。
术前大鼠用浓度为350 mg/kg水合氯醛麻醉(麻醉剂量:10 mL/kg),经常规备皮、消毒、铺巾,经左侧腹股沟韧带中点(摸到股动脉搏动后)做一个1 ~1. 5 cm的纵行皮肤切口暴露股动脉。
正常血糖假手术组与糖尿病大鼠假手术组:游离股动脉,不行结扎、也不切除动脉术,直接缝合切口。
糖尿病大鼠后肢缺血模型:大鼠左侧后肢缺血模型。游离股动脉后,用1号线结扎近端股动脉,切除股动脉、远端隐动脉和所有侧支血管。术毕,5-0缝合线缝合皮肤,建立糖尿病大鼠左侧后肢缺血模型。
1. 4. 3 穴位注射 取穴:凡局部注射取缺血组织与正常假手术组织交界处等距离选取5个点为注射部位,注射标记的BMSCs,每只共注射100 μL 1×106个细胞[4],每处注射20 μL;假手术组、模型对照组注射等量1×PBS+蒸馏水灌胃;中药治疗各组分别选用相应中药灌胃。
穴位如表2[5]。

表2 注射穴位及定位
1. 5 RT-PCR法测VEGF、bFGF在大鼠下肢缺血骨骼肌中的表达 大鼠麻醉后,取每组大鼠术侧后肢骨骼肌50~100 mg,将取得的新鲜组织迅速放入已标记无RNA酶冻存管,立即放入液氮储存,后转入-80℃冰箱保存。Trizol一步法提取总RNA。反转录体系:总RNA2 μg,Oligo(dT)1 μg,引物1 μg,加入Nuclease-Free Water至10 μL,反应条件:70℃、5 min终止反应后,立即行PCR反应。引物序列:GAPDH上游5'-TCCATCAAGGGAGTGTGTGC-3',下游5'TCCGTGACCGGTAAGTGTTG-3';VEGF上游5'-GTCACCGTCGACAGAACAGT-3',下游5'-GACCCAAAGTGCTCCTCGAA3';bFGF上游5'-TCCATCAAGGGAGTGTGTG-3',下游5'-TCCGTGACCGGTAAGTGTTG-3';PCR反应体系:cDNA 2 μL,引物0. 8 μL,GoTaq qPCR Master Mix 10 μL,加Nuclease-Free Water至20 μL,反应条件:95℃预变性10 min;95℃引物退火15 s,60 ℃1 min;熔解曲线95℃15 s,60℃15 s,95℃15 s,共40个循环。
1. 6 统计学方法 采用MxPro Mx3005P 4. 0软件分析曲线,根据标准曲线将各样品测得的Ct值换算成拷贝数,分析各组检测样本中目的基因拷贝数相对于阳性定量参考样品的基因拷贝数,分析方法利用2-△△Ct方法,比较组间基因拷贝数。实验数据用SPSS 19. 0统计软件分析比较,计量资料采用(± s)的形式表示,多样本均数间比较采用单因素方差分析,P<0. 05有统计学意义。
2 结果
半定量逆转录-聚合酶链反应(RT-PCR)检测大鼠后肢术侧、健侧骨骼肌中VEGF mRNA和bFGF mRNA的表达水平。
2. 1 各组大鼠后肢骨骼肌中VEGF mRNA表达量的比较 经t检验,术侧与健侧VEGF mRNA表达量无统计学意义(P>0. 05),无统计学意义。
经ANOVA检验,与DM假手术组比较,穴位注射BMSCs+中药组术侧VEGF mRNA表达量明显升高(P<0. 05),差异有统计意义(见表3,图1)。
表3 各组大鼠后肢骨骼肌中VEGF mRNA表达量分析(-±s)
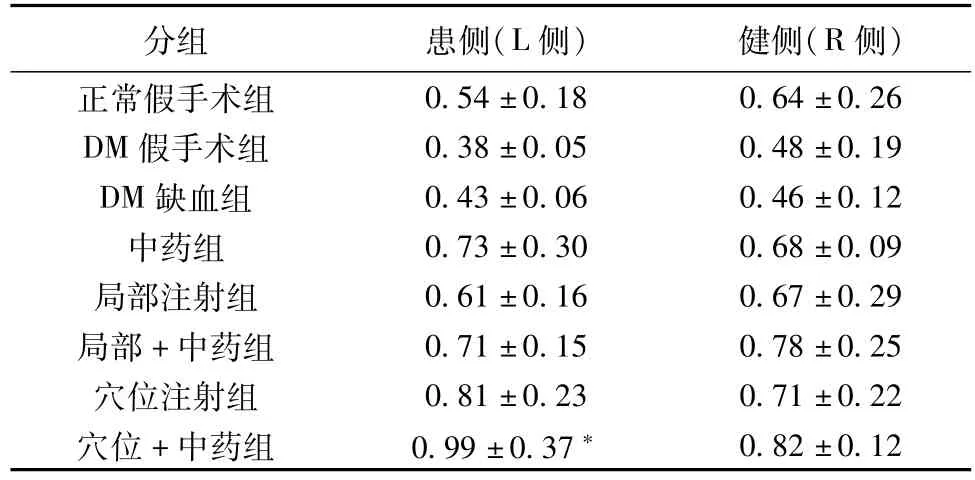
表3 各组大鼠后肢骨骼肌中VEGF mRNA表达量分析(-±s)
注:经ANOVA检验:与DM假手术组比较,*P<0. 05。
分组 患侧(L侧) 健侧(R侧)正常假手术组0. 54±0. 18 0. 64±0. 26 DM假手术组 0. 38±0. 05 0. 48±0. 19 DM缺血组 0. 43±0. 06 0. 46±0. 12中药组 0. 73±0. 30 0. 68±0. 09局部注射组 0. 61±0. 16 0. 67±0. 29局部+中药组 0. 71±0. 15 0. 78±0. 25穴位注射组 0. 81±0. 23 0. 71±0. 22穴位+中药组 0. 99±0. 37*0. 82±0. 12
2. 2 各组大鼠后肢骨骼肌中bFGF mRNA表达量的比较 经t检验,与健侧比较,DM假手术组、局部注射组、穴位注射组术侧bFGF mRNA表达量明显升高(P<0. 05),差异有统计学意义。

图1 各组大鼠后肢骨骼肌中VEGF、bFGF mRNA表达量组内与组间比较图
经ANOVA检验,与正常血糖假手术组、DM假手术组、DM缺血组比较,局部注射+中药组、穴位注射+中药组术侧bFGF mRNA表达量明显升高(P <0. 05);且穴位注射+中药组较中药组明显升高(P<0. 01),差异均有统计意义(见表4,图1)。
穴位注射+中药组健侧bFGF mRNA表达量明显较正常血糖假手术组、DM假手术组、DM缺血组、中药组、局部注射组升高(P<0. 05),差异有统计学意义(见表4,图1)。
表4 各组大鼠后肢骨骼肌中bFGF mRNA表达量分析(-±Se)

表4 各组大鼠后肢骨骼肌中bFGF mRNA表达量分析(-±Se)
注:经t检验:与健侧比较,*P<0. 05,**P<0. 01。经ANOVA检验:与正常假手术组比较,△P<0. 05;与DM假手术组比较,▲P<0. 05;与DM缺血组比较,□□P<0. 01;与中药组比较,■P<0. 05;与局部注射组比较,○P<0. 05。
分组 患侧(L侧) 健侧(R侧)正常假手术组1. 79±0. 63 1. 03±0. 10 DM假手术组 1. 53±0. 19* 1. 05±0. 29 DM缺血组 1. 81±0. 33 0. 75±0. 14中药组 2. 62±1. 03 1. 08±0. 18局部注射组 4. 23±1. 09* 0. 90±0. 48局部+中药组 5. 43±2. 38△▲□ 1. 12±0. 32穴位注射组 4. 40±0. 88* 1. 13±0. 42穴位+中药组 6. 05±2. 56△▲□■ 2. 03±0. 15△▲□□■○
3 讨论
缺血组织血管新生过程复杂,需要各种因子之间相互协同或制约作用从而形成新的血管。VEGF是目前最重要的、促血管生成作用最强的血管生长因子之一。VEGF是血管内皮细胞特异性的有丝分裂原,可促进内皮细胞增殖,改变细胞外基质的成分,促进血管的新生[6]。VEGF主要分布在血管内皮细胞,属于胞浆内表达抗原,可产生血管基底膜分解所需要的蛋白酶及特定的整合素,从而促进内皮细胞的增殖和迁移[7];促进骨髓源性的EPCs聚集和活化,提高小血管通透性,使血浆蛋白外渗并形成细胞外基质,引起内皮细胞和基质细胞的转移[8],抑制内皮细胞的凋亡[9],其两种旁分泌因子具有维持血管内皮的完整性和修复内皮损伤的作用。局部应用VEGF可产生全身效应。
研究证明,体内许多组织都分布和表达bFGF,尤其是血管内皮细胞、血管平滑肌和高度血管化的器官[10-11]。bFGF亦是体内发现的最为有效的促血管形成因子之一[12-13],可促进血管内皮细胞和平滑肌细胞有丝分裂,促进VEGF的产生和诱导细胞内的VEGFR-2的表达增强VEGF的促血管生成作用。
本实验发现,术侧与健侧比较,VEGF mRNA、 bFGF mRNA表达量均不同程度升高趋势,说明在结扎离断大鼠后肢股动脉造成骨骼肌缺血缺氧时,便会刺激内皮细胞分泌VEGF、bFGF等因子,使促血管生成因子表达升高。穴位注射BMSCs+中药组术侧VEGF mRNA、bFGF mRNA表达量较DM缺血模型组明显升高,说明经穴注射BMSCs联合中药比单纯穴位注射BMSCs、局部注射BMSCs或单用中药更能刺激VEGF、bFGF的分泌,说明穴位注射BMSCs联合中药对促进DM缺血后肢骨骼肌中VEGF、bFGF等促血管因子的表达量,以此推测对促进毛细血管新生、改善DM后肢缺血有积极作用。
文献报道注射干细胞通常分为以下几种:肌肉注射[14]、动、静脉管腔内灌注[15]等方式,但管腔注射容易因为远端血管闭塞性病变而降低药物到达局部的效果,且血流容易将细胞冲到其他非治疗部位而引起不必要的血管增生性损伤,另外其操作难度亦较大。本课题组在原有干细胞移植的方法(局部肌肉注射、静脉注射与动脉注射)基础之上不断探索、创新,提出辨证循经注射BMSCs联合中药以提高BMSCs存活率、分化能力以及疗效的观点。
对于经穴注射BMSCs联合益气活血中药促进VEGF、bFGF表达增加的原因,大致归纳为以下几点:一是刺激经穴亦可起到调节脏腑功能的作用,从而起到一定的调节血糖的作用,对后肢缺血情况的改善起到一定的作用,从而也提高了注射后BMSCs的存活率;二是穴位注射有产生药理作用速度快、作用强,与同药等剂量下静脉注射者相当或超过,治疗优于皮下或肌肉注射[16],经穴给药除选择足三阴、三阳经,取“宁失其穴,勿失其经”的理论外,亦选择缺血局部穴位进行注射,除起到经穴效应外,亦取其局部效应,即经络理论之“局部取穴”,加快了药物的吸收过程,提高了细胞的存活率,亦使细胞直达病所,发挥疗效;另外,联合益气活血中药,对促进血液循环、调畅经络气血、增强细胞活性、滋养血管神经组织、提高大鼠整体功能亦有促进作用。
参考文献
[1]管街,刘志明,李光伟,等. 50岁以上糖尿病人群周围动脉闭塞性疾病相关因素分析[J].中华医学杂志,2007,87(1):23-27.
[2]MorishitaR,AokiM,HashiyaN,etal. Safety evaluation of clinical gene therapy using hepatocyte growth factor to treat Peripheral arterial disease[J]. Hypertension,2004,44(2):203-209.
[3]Takako G,Naoto F,Akira AKI,et al. Search for appropriate experimental methods to create stable hind-limb ischemia in mouse[J]. Tokai J ExpClin Med,2006,3(31):128-132.
[4]Juha P. Laurilaa,Lilja Laatikainena,et al. Human embryonic stem cell derived mesenchymal stromal cell transplantation in at hind limb injury model[J]. Cytotherapy,2009,11(6):726 - 737.
[5]华兴邦,李辞荣,周浩良,等.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[6]Werner Risau. Angiogenic growth factors[J]. Pro In growth factorRes,1990(2):71.
[7]Leung DW,Cachianes G,Kuang WJ,et al. Vascular endothelial growth factor is a secreted angiogenic mitogen[J]. Science,1989,246 (4935):1306-1309.
[8]Keck PJ,Hauser SD,Krivi G,et al. Vascular permeability factor,an endothelial cellmitogen related to PDGF[J]. Science,1989(246):1309 - 1312.
[9]Cross MJ,Claesson-Welsh L. FGF and VEGF function in angiogenesis:signaling pathways,biological responses and therapeutic inhibition [J]. Trends PharmacolSci,2001,22(4):201-207.
[10]Werner Risau. Angiogenic growth factors[J]. Pro In growth factorRes,1990(2):71.
[11]Montesano R,Vassalli JD,Baird A,et al. Basic fibroblast growth factor induces angiogenesis in vitro[J]. Proc Natl AcadSci USA,1986,83(19):7297-7301.
[12]Detillieux KA,Sheikh F,Kardami E,et al. Biological activities of fibroblast growth factor-2 in the adult myocardium[J]. Cardiovasc Res,2003,57(1):8-19.
[13]Pu LL,Holme KR,Symes JF. Heparinase enhances collateral vessel development in the ischemic limb[J]. IntSurg,2002,87(4):260-268.
[14]MorishitaR,AokiM,HashiyaN,etal. Safetyevaluationof clinical gene therapy using hepatocyte growth factor to treat peripheral arterial disease[J]. Hypertension,2004(44):203-209.
[15]Sharif F,Daly K,Crowley J,et al. Current status of catheter-and stent-based gene therapy[J]. Cardiovase Res,2004(64):208-216.
[16]诸毅晖,陈玉华.论穴位注射的穴药效应[J].中国针灸,2005,25(1):46-48.
(2015-11-12收稿 责任编辑:洪志强)
中图分类号:R587. 2
文献标识码:A dol:10. 3969/j. issn. 1673-7202. 2016. 02. 030
通信作者:徐旭英,Tel:(010)52176058,E-mail:xxying7341@126. com;荣培晶,Tel:(010)64089302,E-mail:drrongpj@163. com
作者简介:第一黄凤(1984—),女,内蒙古乌海,博士研究生,主治医师,研究方向:中医药治疗周围血管疾病的临床与基础研究,Tel:(010)52176642,E-mail:hf2061043@163. com
基金项目:北京市自然科学基金面上项目(编号:7122084);北京市卫生系统高层次卫生技术人才培养计划(编号:2013-3-080);北京市科委首都临床特色应用研究(编号:Z131107002213117);北京市中医药科技年度规划项目(编号:WZF2012-02);国家中医药管理局中医外科重点学科
共同第一作者:叶永生(1982—),男,中国香港,博士研究生,医师,研究方向:中医基础理论研究,E-mail:drneil@live. hk
