针刺单穴及腧穴配伍对糖尿病胃轻瘫大鼠胃窦Cajal间质细胞影响
2016-04-06李亚勤于波李铁赵宗江杨美娟王富春
李亚勤于 波李 铁赵宗江杨美娟王富春
(1长春中医药大学针灸推拿学院,长春,130117;2北京中医药大学,北京,100029)
针刺单穴及腧穴配伍对糖尿病胃轻瘫大鼠胃窦Cajal间质细胞影响
李亚勤1于 波1李 铁1赵宗江2杨美娟2王富春1
(1长春中医药大学针灸推拿学院,长春,130117;2北京中医药大学,北京,100029)
摘要目的:探讨针刺单穴及腧穴配伍对糖尿病胃轻瘫(Diabetic gastroparesis,DGP)大鼠胃窦Cajal间质细胞(Interstitial Cells of Cajal,ICC)的影响。方法:选取雄性SD大鼠50只,随机分为正常组、模型组、多潘立酮组、足三里组、中脘+足三里组,每组10只。以链脲佐菌素(STZ)腹腔注射诱导DGP大鼠模型。采用免疫组化技术观察各组大鼠ICC含量的改变。结果:与正常组相比,模型组大鼠胃窦组织ICC含量明显减少(P<0. 01);与模型组比较,多潘立酮组(P<0. 01)、足三里组(P<0. 05)、中脘+足三里组(P<0. 01)大鼠胃窦ICC含量明显提高,且中脘+足三里组优于足三里组(P<0. 05)。结论:针刺促进DGP大鼠胃窦ICC含量恢复,腧穴配伍组优于单穴组。
关键词糖尿病胃轻瘫;针刺;腧穴配伍;Cajal间质细胞
Effect of Acupuncture at Slngle Acupolnt and Comblned Acupolnts on Antral Interstltlal Cells of Cajal ln Dlabetlc Gastroparesls Model Rats
Li Yaqin1,Yu Bo1,Li Tie1,Zhao Zongjiang2,Yang Meijuan2,Wang Fuchun1
(1 College of Acupuncture-Moxibustion and Tuina of Changchun University of TCM,Changchun 130117,China;2 Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objectlve:To explore the effects of acupuncture at single acupoint and combined acupoints on antral interstitial cells of Cajal(ICC)in diabetic gastroparesis model rats. Methods:50 SD male rats were randomly divided into 5 groups with 10 rats in each,namely normal group,diabetic gastroparesis model rats group(the model group),domperidone group,acupuncture at ST36 group and acupuncture at ST36+CV12 group. The rats were intraperitoneally injected with steptozotocin to set diabetic gastroparesis model. Treatments for each group lasted for 5 weeks. Numbers of ICC were detected by immunohistochemical methods. Results:The number of ICC in the model group were significantly reduced(P<0. 01),compared with normal group,while numbers of ICC in domperidone group(P<0. 01),acupuncture at ST36 group(P<0. 05)and ST36+CV12 group(P<0. 01)were improved significantly,compared with the model group. Numbers of ICC in the acupuncture at ST36+CV12 group was increased remarkably superior to the acupuncture at ST36 group(P<0. 05). Concluslon:Acupuncture could improve the numbers of antral interstitial cells of Cajal in diabetic gastroparesis model rats,and acupuncture at combined acupoints was better than that of the single acupoint.
Key Words Diabetic gastroparesis;Acupuncture;Acupoint combination;Interstitial cells of Cajal
糖尿病胃轻瘫(Diabetic gastroparesis,DGP)是以胃动力低下为主要特点的糖尿病继发症状之一,病理生理特点主要是胃电节律异常、胃肠转运时间延长、排空延迟[1],临床表现为恶心、腹胀、厌食、早饱等[2]。广泛的临床研究证明[3-7]针刺对缓解DGP症状有良好的效果,具有疗效持久、不良反应小等优势,然而,针刺治疗DGP选穴优化研究却少见,因此,本实验以链脲佐菌素(STZ)诱导DGP模型[8],观察针刺单穴及腧穴配伍对DGP大鼠胃窦Cajal间质细胞含量影响的效应差异,并对其机制进行探讨。
1 材料与方法
1. 1 材料
1. 1. 1 实验动物 清洁级雄性SD大鼠50只,体重180~200 g(购自斯贝福(北京)实验动物科技有限公司,许可证编号:SCXK(京)2011-0004)。
1. 1. 2 试剂与仪器 针灸针(华佗牌,苏州医疗用品厂有限公司出品,批号:140020);电子诊疗仪(SDZ-II型,华佗牌,苏州医疗用品厂有限公司出品,产品标准号:YZB/苏0691-2013);多潘立酮片(10 mg/片,哈药集团三精制药诺捷有限责任公司产品,批号:1312024);链脲佐菌素(STZ,Sigma,批号:S0130);c-kit(sc-168,SANTA CRUZ,批号:B0813);GFVisionTM III抗鼠/兔通用型免疫组化检测试剂盒(基因科技(上海)有限公司,批号:GK500705)。
1. 2 方法
1. 2. 1 分组与造模 将50只大鼠置于洁净通风橱中,室温(23±2)℃,相对湿度60%,自然光照条件,自由饮水,普通饲料喂养。适应性喂养10 d禁食12 h后,按体质量区段随机取10只大鼠作为正常组,余40只大鼠以链脲佐菌素(50 mg/kg)腹腔注射,以血糖≥16. 7 mmol/L者为糖尿病大鼠,常规喂养8周后为DGP大鼠造模成功。将造模成功大鼠随机分为模型组、多潘立酮组、足三里组、中脘+足三里组,每组10只。
1. 2. 2 治疗方法 各治疗组大鼠分别予以如下操作:针刺组:将大鼠置于自制鼠套中固定,分别取足三里(双侧)、中脘+足三里(双侧),取穴参照《实验针灸学》《大鼠穴位图谱的研制》提供的腧穴位置,采用比较解剖学确定大鼠腧穴。使用0. 25 mm×40 mm针灸针,刺入5~7 mm,连接电针,参数选为连续波,频率为30 Hz,强度为3 mA,刺激时间为15 min,1次/d,5 d为1个疗程,每疗程间隔2 d,共5个疗程。多潘立酮组:参照动物剂量换算公式确定灌胃剂量,处理时间同针刺组。疗程结束后观察指标。
1. 2. 3 观察指标及检测方法
1. 2. 3. 1 一般状态 观察大鼠的精神状态,包括体质量、饮食、皮毛及活动情况等。
1. 2. 3. 2 胃组织HE染色和免疫组化 无菌摘取胃脏,取胃窦部分常规固定、石蜡包埋、切片,4℃保存。HE染色方法:切片常规脱蜡,自来水冲洗,苏木精液染色7 min,自来水冲洗后1%盐酸乙醇分色数秒,自来水稍洗后0. 5%伊红液染色3 min,蒸馏水稍洗后常规脱水,中性树胶封片。C-kit阳性ICC免疫组化染色方法:切片于室温放置30 min后,常规脱蜡,0. 01 mmol/lPBS漂洗5 min×3次,0. 01%Triton溶液37℃孵育15 min,PBS漂洗5 min×3次,3% H2O2-CH3OH室温下避光孵育10 min,PBS漂洗5 min×3次,抗原修复液中加热15 min,以不沸腾为度,冷却1 h后PBS漂洗5 min×3次,20%蛋清稀释液37℃孵育20 min,PBS漂洗5 min×1次,10%山羊血清封闭,37℃孵育20 min后轻轻甩去,滴加一抗c-kit(1∶300)4℃过夜。滴加HRP标记复合物(抗兔/鼠),37℃孵育25 min,PBS漂洗5 min×3次,滴加显色剂DAB工作液,室温避光孵育15 min,自来水冲洗10 min,蒸馏水3 min,苏木素复染3 min后自来水冲洗15 min,常规脱水,中性树胶封片。
1. 3 图像分析统计 免疫组化结果用NIS-ElementsBR3. 1图像分析软件进行图像分析,各组图像分析数据采用(±s)表示,应用SPSS 20统计软件进行统计分析,组间比较用单因素方差分析,P<0. 05差异有统计学意义。
2 结果
2. 1 一般状态 模型组大鼠精神萎靡、毛发干枯、活动迟缓、饮食减退、体型消瘦及尿量减少,第9周时出现溃疡、白内障等多种糖尿病并发症,治疗组以上情况均有不同程度的改善,尤中脘+足三里组明显。
2. 2 DGP大鼠胃窦病理形态 HE染色结果如图1;免疫组化c-kit阳性ICC染色结果:正常组大鼠胃窦组织有大量棕黄色颗粒,主要分布在环肌与纵肌层之间肌间神经丛周围,并围绕神经节细胞形成类似“鞘样”结构;模型组大鼠胃窦肌间少量棕黄色颗粒,染色浅;多潘立酮组大鼠胃窦肌间中等量棕黄色颗粒,染色浅;足三里组鼠胃窦肌间中等量棕黄色颗粒,染色浅;中脘+足三里组鼠胃窦肌间大量棕黄色颗粒,染色深。与模型组比较,多潘立酮组、中脘+足三里组(P<0. 01)、足三里组(P<0. 05)表达明显增多,有统计学意义,见表1、图2。
3 讨论
随着经济的发展,人们生活方式的大幅改变以及人口老龄化,糖尿病的发病率日益升高,DGP作为糖尿病的常见并发症,其发生率亦有增加趋势,严重威胁国民身心健康。DGP多见于糖尿病病情控制欠佳、病程长、胰岛素依赖性患者,其发生机理较为复杂,现代医学认为与高血糖、自主神经功能紊乱、胃肠道激素分泌失常、肌间神经丛型一氧化氮合酶表达缺失、ICC网络功能紊乱、氧化应激等有关[9-11]。其中,ICC网络破坏是胃肠动力学领域的研究热点,在DGP发病中其关键性作用[12]。
ICC是分布于胃肠道神经末梢及平滑肌之间的一种特殊间质细胞[13],ICC以网络状分布在胃肠道,一般将它们分为4类:1)黏膜下ICC(ICC-SM),位于黏膜与环形肌之间;2)肌间ICC(ICC-MY),位于环形肌和纵行肌之间;3)肌内ICC(ICC-IM)散布在平滑肌细胞之间;4)深层肌丛(ICC-DMP),在小肠,ICC-IM浓集在环形肌深部肌丛内,称为ICC-DMP。

表1 各组大鼠胃窦肌间c-kit阳性ICC含量(面积/μm2)
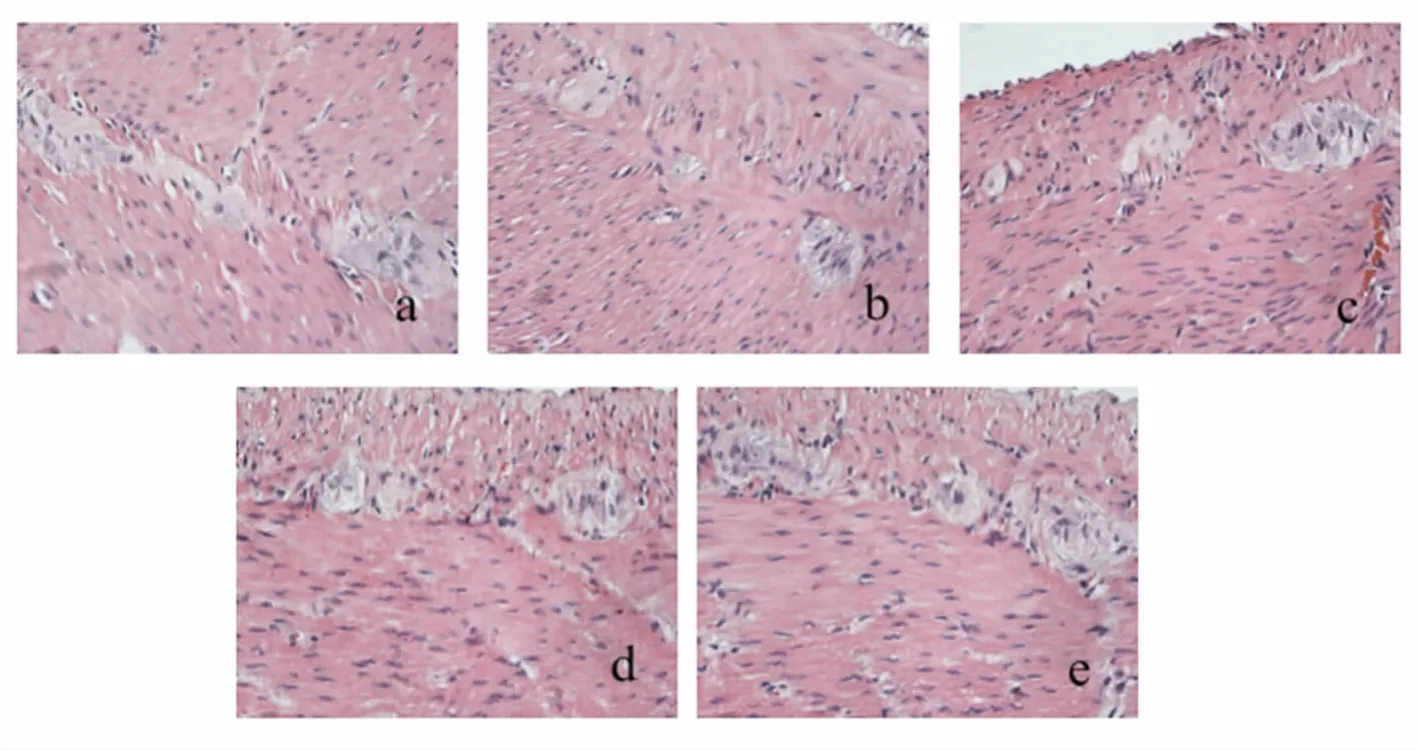
图1 胃窦HE染色(×400)

图2 胃窦c-kit阳性ICC表现(×400)
在胃肠道的不同部位,ICC的分布也有所差异。胃底仅有IC-IM,而胃体、胃窦分布有IC-IM、ICMY[14]。ICC与肠神经系统、平滑肌共同组成复杂的胃肠运动控制系统[15]。ICC是胃肠道平滑肌慢波电位的起搏者和传导者[16],慢波是胃肠道的基本电节律,调控着胃肠运动发生的时间、地点、频率和方向。起搏电位产生于有ICC-MY的Auerbach's神经节区域,ICC-MY能自发地产生小波幅的短暂的去极化电位,即单元电位(unitary potenti-al)[17],是Ca2+从内源性Ca2+库释放,激活Ca2+活化的Cl通道所致[18]。起博电位的产生是单元电位释放频率变化的结果[19]。在胃ICC-MY,两次起博间期,单元电位的释放频率逐步加快,多个单元电位在局部总和产生初始部分。初始部分使ICC-MY网络去极化,进一步加快单元电位的释放频率,产生起博电位的平台部分,ICC产生的起搏电位经平滑肌细胞补充后形成完整的慢波。ICC不仅引起平滑肌的自发节律性收缩,还提供了电活动的传播途径,以保证慢波协调性播散[16,20];除此之外,ICC对肠神经信号的传递具有调节作用[20-21],研究发现ICC与平滑肌纤维混合并存于肌间,ICC与肠神经元亦紧密连接,ICC胞体和肠神经元形成突触样连接,与平滑肌细胞形成似缝隙连接,提示ICC可能受肠神经元支配、传递和调节各种神经递质,进而调控胃肠平滑肌收缩运动,ICC在肠神经元和平滑肌细胞之间可能起桥梁作用[22]。因此,ICC的缺失或处于病生理条件时可出现胃肠道平滑肌反射能力减弱的现象[23],糖尿病小鼠胃体、胃窦内ICC明显减少,以胃窦远端最明显,不仅如此,胃肠动力障碍性疾病,例如慢传输性便秘、Hirschsprung病、慢性假性肠梗阻,甚至炎症性肠病等也伴随ICC数目减少、形态和超微结构的改变[24-27],胃肠动力的恢复亦伴随ICC增殖[28]。
ICC的基因表达产物C-kit的发现或许是间质细胞生理学方面最重要的进展[29]。Kit受体的标记物或C-kit mRNA已经成为在不同物种的肠道内研究ICC的有效工具。C-kit抗体在消化道仅标记ICC和肥大细胞,具有较高的特异性,后者形圆,甲苯胺蓝染色时因异染呈红紫色,可与之鉴别,但数目较少,仅占4%,大部分可以忽略不计。ICC特异性表达C-kit免疫组织化学法可以观察胃肠道ICC的分布与密度,对于深入研究ICC具有极为重要的意义。
DGP患者胃排空时间大于正常人2个平均标准差,严重影响患者的生活质量及血糖控制[30-33],目前常规疗法为服用促动力药物,如多潘立酮、西沙必利、莫沙必利、胃复安等,以及胃电刺激、手术等,存在耐药性、神经系统、心血管系统副作用、感染风险、营养不良等问题[34]。针灸针对该疾病虽属一种替代疗法,但因其安全性、经济性等优势,已经被广泛的应用[35]。中医文献中无DGP的病名,多根据其主要临床症状归入“呕吐”“痞满”“反胃”“嘈杂”等范畴[36],病位主要在胃,涉及肝脾,属虚实夹杂之证。临床研究证明,针灸能够改善糖尿病胃轻瘫患者的胃排空功能,缓解腹部症状,增强食欲,并且鲜有不良反应的报道[37]。实验研究显示,电针可改善胃轻瘫大鼠Cajal间质细胞的超微结构,减轻线粒体损伤,促进ICC和胆碱能神经再生,网络结构的恢复[38-39],并可使胃电主频和主功率、ICC表达含量升高,从而改变已经紊乱的胃电节律,达到改善胃肠动力的作用。
研究发现,针刺治疗DGP以足三里穴运用频率最高,其次为中脘穴,刺激足三里、中脘能有效地降低胃张力,解除贲门、幽门的迟缓关闭,使胃动力障碍患者的胃电图不规则波减少,使胃电节律趋于正常[40]。《灵枢·邪气藏府病形》认为“合治内府”,胃的合穴是足三里,中脘为胃腑之气聚积之处,内通于胃腑之气,与胃腑有着密切的横向联系,故可用于治疗脾胃疾患,如胃脘痛,胃胀,呕吐,反胃,吞酸,纳呆,食不化等。导师王富春教授在国内首次提出“合募配穴治疗六腑病”的理论[41],以及的“同功穴”新概念[42],即为针对某一症状,具有相同主治作用的一类腧穴,对腧穴配伍的协同增效作用进行了进一步诠释。
目前,针刺对于DGP的研究尚处于证明其有效性阶段,鲜有针刺选穴对DGP影响效应差异的对比研究。本实验取足三里组与中脘+足三里组进行比较,以观察单穴与腧穴配伍对于DGP大鼠胃窦Cajal影响。研究发现,针刺治疗组可改善DGP大鼠一般情况,改善大鼠饮食减退、体型消瘦及尿量减少等情况,尤中脘+足三里组明显;中脘+足三里组较足三里组c-kit免疫组化染色阳性面积增加,阳性染色强度明显增强,减轻了DGP大鼠胃窦ICC的病理损害,延缓了DGP的病程进展,说明腧穴配伍组对于DGP的针刺效果优于单穴组,进而说明“合募配穴”发挥了协同增效作用。提示针刺单穴及腧穴配伍对DGP大鼠作用效应差异可能是通过Cajal间质细胞的数目,影响胃慢波的产生,使胃电节律紊乱减轻从而产生正常蠕动,并促进肠神经系统与平滑肌间的信息传递,从而促进平滑肌收缩能力的恢复而实现的,这为针刺防治DGP,为腧穴配伍理论进一步发展提供了现代分子生物学实验依据。
参考文献
[1]Gautam A,Baluch A,Kaye A,et al. Modern strategies for the anesthetic management of the patient with diabetes[J]. Middle East J Anesthesiol,2009,20(2):187-197.
[2]Kassander P,Asymptomatic gastric retention in diabetics(gastroparesis diabeticorum)[J]. Ann Intern Med,1958,40:797-812.
[3]Wang CP,Kao CH,Chen WK,et al. A single-blinded,randomized Pilot study evaluating effects of electroacupuncture in diabetic Patients with symptoms suggestive of gastroparesis[J]. Altern Compliment Med,2008,14(7):833-839.
[4]Kim KH,Kim TH,Choi JY,et al. Acupuncture for symptomatic relief of gastroparesis in a diabetic haemodialysis patient[J]. Acupunct Med,2010,28(2):101-103.
[5]Pfab F,Winhard M,Nowak-Machen M,et al. Acupuncture in critically ill patients improves delayed gastric emptying:a randomized controlled trial[J]. Anesth Analg,2011,112(1):150-155.
[6]兰亚平,韩玉爱.益气养胃方结合针刺治疗糖尿病性胃轻瘫32例[J].中医研究,2010,23(4):74-75.
[7]史庆卫,张林,李瑛,等.针刺胃俞募穴治疗糖尿病胃轻瘫疗效观察[J].上海针灸杂志,2014,33(5):402-404.
[8]Wang XY,Huizinga JD,Diamond J,et al. Loss of intramuscular andsubmuscular interstitial cells of Cajal and associated enteric nerves is related to decreased gastric emptying in streptozotocin-induced diabetes[J]. Neurogastroenterol Motil,2009,6(30):1-13.
[9]Ma J,Rayner CK,Jones KL,et al. Diabetic gastroparesis:diagnosis and management[J]. Drugs,2009,69(8):971-986.
[10]Kashyap P,Farrugia G. Oxidative stress:key player in gastrointestinal complications of diabetes[J]. Neurogastroenterology Motility,2011,23(2):111-114.
[11]Chandrasekharan B,Anitha M,Blatt R,et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative tress[J]. Neurogastroenterol Motil,2011,23 (2):131-136.
[12]Huizinga JD,Liu LW,Fitzpatrick A,et al. Deficiency of intramuscular ICC increase fundic muscle excitability but does not impede nitrergic innervation[J]. Am J Physiol Gastrointest Liver Physiol,2008,294(2):G589-G594.
[13]Sanders KM,Ordög T,Koh SD. Development and plasticity of interstitial cells of Cajal[J]. Neurogastroenterol Motil,1999,11:311-338.
[14]Kito Y,Suzuki H. Electrophysiological properties of gastric pacemaker potentials[J]. J Smooth Muscle Res,2003,39(5):163-73.
[15]Huizinga JD. Physiology and pathophysiology of the interstitial cell of Cajal:from bench to bedside II Gastric motility:lessons from mutant mice on slow waves and innervation[J]. Am J Physiol Gastrointest Liver Physiol,2001,281(5):G1129.
[16]Lee JC,Thuneberg L,Berezin I. Generation of slow waves in membrance potencial is an intrinsic property of interstitial cells of Cajal [J]. AM J Physiol,1999,227:G409-423.
[17]Edwards FR,Hirst GDS,Sanders KM,et al. Unitary nature of regenerative potentials recorded from circular smooth muscle of guinea-pig antrum[J]. J Physiol,1999,519:235-250.
[18]Hirst GDS,Bramich NJ,Teramoto N,et al. Regenerative component of slow waves in the guinea-pig gastric antrum involves a delayed increase in[Ca2+]i and Cl-_channels[J]. J Physiol,2002,540(Pt 3):907-919.
[19]Hirst GDS,Edwards FR. Generation of slow waves in the antral region of guinea-pig stomach-a stochastic process[J]. J Physiol,2001,535(Pt 1):165-180.
[20]Ward SM,Beckett EA,Wang X,et al. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons[J]. J Neurosci,2000,20:1393-1403.
[21]童卫东,刘宝华. Cajal间质细胞与结肠动力紊乱[J].中华胃肠外科杂志,2007,10(2):189-191.
[22]孙金山,江逊,仝海霞,等. BALB/c小鼠溃疡性结肠炎远段结肠Cajal间质细胞超微结构变化[J].实用儿科临床杂志,2008,23 (7):519-521.
[23]Ward SM,Brennan MF,Jackson VM,et al. Role of PI3-kinase in the development of interstitial cells and pacemaking in murine gastrointestinal smooth muscle[J]. J Physiol,1999,516(Pt3):835-846.
[24]Lyford GL,He CL,Soffer E,et al. Pan-colonic decrease in interstitial cells of Cajal in patients with slow transit constipation[J]. Gut,2002,51:496-501.
[25]Horiguchi K,Keef KD,Ward SM. Distribution of interstitial cells of Cajal in tunica muscularis of the canine rectoanal region[J]. Am J Physiol Gastrointest Liver Physiol,2003,284:G756-G767.
[26]Isozaki K,Hirota S,Miyagawa J,et al. Deficiency of c-kit+cells in patients with a myopathic form of chronic idiopathic intestinal pseudo-obstruction[J]. Am J Gastroenterol,1997,92:332-334.
[27]Porcher C,Baldo M,Henry M,et al. Deficiency of interstitial cells of Cajal in the small intestine of patients with Crohn's disease[J]. Am J Gastroenterol,2002,97:118-125.
[28]王广勇,李兆申,高峻,等. Cajal间质细胞和肠神经元在急性坏死性胰腺炎豚鼠小肠组织中的改变[J].胰腺病学,2007,7(6):394-397.
[29]Huizinga JD,Thuneberg L,Kluppel M,et al. W/Kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity[J]. Nature,1995,373(6512):347-349.
[30]Talley NJ,Young L,Bytzer P,et al. Impact of chronic gastrointestinal symptoms in diabetes mellitus on health-related quality of life[J]. Am J Gastroenterol,2001,96:71-76.
[31]Yanagida H,Yanase H,Sanders KM,et al. Intestinal surgicalresection disrupts electrical hythmicity,neural responses,and interstitial cell networks[J]. Gastroenterology,2004,127:1748-1749.
[32]Yanagida H,Sanders KM,Ward SM. Inactivation of inducible nitric oxide synthase protects intestinal pacemaker cells from postoperative damage[J]. J Physiol,2007,582(Pt 2):755-765.
[33]Chang IY,Glasgow NJ,Takayama I,et al. Loss of interstitial cells of Cajal and development of electrical dysfunction in murine small bowel obstruction[J]. J Physiol,2001,536(Pt 2):555-568.
[34]Aljarallah BM. Management of diabetic gastroparesis[J]. Saudi J Gastroenterol,2011,17(2):97-104.
[35]Lee LA,Chen J,Yin J. Complementary and Alternative Medicine for Gastroparesis[J]. Gastroenterol Clin North Am,2015,44(1):137-150.
[36]国家中医药管理局,中医病证诊断疗效标准[M].南京:南京大学出版社,1994:11-12.
[37]Yang M,Li X,Liu S,et al. Meta-analysis of acupuncture for relieving non-organic dyspeptic symptoms suggestive of diabetic gastroparesis[J]. BMC Complement Altern Med,2013,13:311.
[38]邓晶晶.针刺对结肠吻合术后Cajal间质细胞修复与再生的影响[J].世界华人消化杂志,2010,18(36):3863-3868.
[39]包永欣,刘德宝,龙岩,等.电针对糖尿病胃轻瘫大鼠胃Cajal间质细胞超微结构的影响[J].中国中医药科技,2010,17(1):6.
[40]郑士立,葛佳伊.温针灸治疗糖尿病胃轻瘫40例疗效观察[J].中国中医药科技,2010,17(3):247-248.
[41]王富春,景宽.特定穴在临床中的配伍应用[J].辽宁中医,1989,13(10):34.
[42]王富春. Discussion on“Analogiczl acupoints”[J]. World Journal of Acupuncture-Moxibustion,2015,8(1):24-27.
(2016-01-12收稿 责任编辑:洪志强)
中图分类号:R224. 2
文献标识码:A dol:10. 3969/j. issn. 1673-7202. 2016. 02. 007
通信作者:王富春(1961—),男,教授,博士研究生导师,研究方向:特定穴理论与临床研究,E-mail:fuchenwang420@126. com
作者简介:李亚勤(1990—),女,长春中医药大学2013级硕士研究生,研究方向:特定穴理论与临床研究,E-mail:liyaqin19902008@126. com
基金项目:国家重点基础研究发展计划(“973”计划)项目(编号:2014CB543100);吉林省卫生厅项目(编号:2014Q048)
