淹渍对花椰菜根系活力和叶片光合特性的影响*
2016-04-06侯奇奇杨再强史五一袁雨晖
侯奇奇,杨再强**,史五一,袁雨晖,顾 薇
(1. 南京信息工程大学气象灾害预报预警与评估协同创新中心,南京210044;2. 上海市崇明县气象局,崇明 202150)
淹渍对花椰菜根系活力和叶片光合特性的影响*
侯奇奇1,杨再强1**,史五一2,袁雨晖2,顾 薇2
(1. 南京信息工程大学气象灾害预报预警与评估协同创新中心,南京210044;2. 上海市崇明县气象局,崇明 202150)
摘要:以上海崇明岛花椰菜品种“崇花120天”为试材,于2014年8-11月人工气候室开展盆栽试验,将花椰菜植株根部分别淹水处理3、6、9、12、15d,以正常灌溉为对照(CK),测定花椰菜的根系活力和叶片光合参数等指标。结果表明:(1)随着淹渍胁迫时间的延长,花椰菜的根系活力呈不同程度的降低。当淹渍胁迫超过9d后,根系活力趋于0;(2)与CK相比,淹渍胁迫3、6、9、12和15d时,叶片最大净光合速率分别下降4.90%、68.13%、78.71%、90.92%和98.68%,与此同时,光补偿点降低、光饱和点也随之增大;(3)淹渍胁迫下花椰菜气孔导度、蒸腾速率和胞间CO2浓度明显下降,淹渍胁迫初期,气孔限制值增大。说明胁迫初期影响花椰菜净光合速率下降的因素为气孔限制因子。(4)淹渍胁迫前6d各项指标下降明显,之后趋于稳定,可以确定淹渍胁迫第6天为致灾临界指标。
关键词:根系活力;气孔导度;蒸腾速率;气孔限制值
侯奇奇,杨再强,史五一,等.淹渍对花椰菜根系活力和叶片光合特性的影响[J].中国农业气象,2016,37(1):51-58
花椰菜(Brassica oleracea L.var.botrytis L.)是十字花科芸薹属甘蓝种的一个变种,是重要的栽培蔬菜之一。目前国内的花椰菜栽培面积约15万hm2[1],主要分布在长江流域及其以南地区,而崇明岛则是该地区最大的花椰菜主产地之一。近年来,随着全球气候变化的加剧,台风暴雨等极端天气事件呈现出频度高,危害加重、复杂多变的趋势,花椰菜经常受到淹渍胁迫,给产量和品质造成严重影响。研究淹渍胁迫下花椰菜根系活力及其光合特性的变化,对花椰菜耐涝性品种的选育,以及早期灾害防御具有重要意义。
水分是影响作物生长的关键因子之一,水分不足或过多都会对作物的生理及其形态带来影响。国内外关于涝害对植物生长发育和生理特性的研究有较多报道。陈永华等[2-4]研究表明,淹涝胁迫使水稻气生根减少,植株生长缓慢,叶片老化脱落,有效穗数、结实率、千粒重降低,最终导致产量下降。刘祖贵等[5-6]采用人工控制试验研究淹涝胁迫对不同生育期夏玉米光合特性及其产量的影响,得出涝害发生时期和持续时间与夏玉米产量性状之间的关系。周自强等[7-8]同时研究淹涝胁迫和不同氮形态作用对苗期玉米根系以及氮代谢底物的影响,分析不同供氮形态下玉米对淹涝胁迫的生理响应。张艳军等[9-10]通过研究渍涝胁迫对棉花各项生理的影响,认为在淹渍胁迫下,棉花的光合作用受到抑制,碳氮平衡遭到破坏,干物质积累量降低,最终导致棉花品质和产量下降。大豆在淹渍胁迫下,根系发生腐烂,不定根生成,叶绿素含量下降,光合作用降低,使生物量和产量下降[11]。卢雪琴等[12]对淹水条件下硬穗钝叶草、地毯草、宽叶和细叶百喜草、香根草等5种禾本科植物的光合特性进行研究,分析比较不同作物的耐淹性。
前人关于淹渍胁迫对大田作物有较多研究,而关于花椰菜的淹渍机理及灾害指标少有报道,本试验采用控制试验的方法,系统研究在淹渍条件下花椰菜根系活力及其叶片光合特性的变化,以期为对花椰菜田间管理和灾害防御提供科学依据。
1 材料与方法
1.1 试验设计
试验于2014年8-11月在南京信息工程大学农业气象试验站人工气候室(TPG-1260,Australian)进行,以上海崇明花椰菜品种“崇花120天”为试材,选取籽粒饱满、大小均匀的花椰菜种子于2014 年8月15日在农业气象试验站Venlo温室内播种育苗,待花椰菜长出3~5片真叶时(2014年9月26日),选取生长健壮且大小均匀的花椰菜幼苗移栽至塑料盆中,盆上口直径35cm,底直径30cm,深35cm。为更符合种植实际,盆中土壤为壤质黏土,呈弱酸性,待植株第6片真叶完全展开时开始进行渍涝处理(2014年10月9日)。淹渍时间分别为3、6、9、12和15d,分别用T-3、T-6、T-9、T-12和T-15表示,每处理3盆。试验开始时,每个盆中加水至水面高出盆内土壤表面1cm,于10月9日9:00将T-15处理和对照(CK)组花椰菜植株放入人工气候箱,之后每隔2d依次放入T-12、T-9、T-6、T-3淹渍处理组,于10月24日上午9:00开始进行测定,试验期间早晚适当加水,以保持试验期间盆内水面高度一致。CK为正常水分管理,保持土壤湿润即可,3盆重复。人工气候室设置环境温度为23℃/17℃,相对空气湿度为72%,光合有效辐射为800μmol·m-2·s-1,其它管理措施同正常生长栽培。
1.2 测定项目与方法
1.2.1 光合参数测定
于10月24日9:00-11:00,选取花椰菜功能叶片(从上往下第3片叶)进行测定,采用便携式光合作用测定系统(Li-6400,USA)观测净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(gs,mol·m-2·s-1)和胞间CO2浓度(Ci,μmol·mol-1)。得出叶片水分利用效率(WUE,μmol·mmol-1)和气孔限制值(Ls)[13],即

式中,Ca为空气CO2浓度(μmol·mol-1),由Li-6400测得。测定期间设定参比室中叶片温度为25℃,光照强度从强到弱的顺序依次设定为1800、1600、1400、1200、1000、800、600、400、200、150、100、50、0μmol·m-2·s-1。
1.2.2 根系活力测定
采用TTC方法测定根系活力[14]。于10月9日上午将根系采用冲水法采样后洗净,用吸水纸吸干根部表面水分,称取根样品0.5g,分别放入小烧杯中,加入0.4%TTC溶液和0.1mol·L-1磷酸缓冲液等量混合液10mL,把根充分浸没在溶液中,37℃条件下暗处保温1h,再加入1mol·L-1硫酸2mL,以停止根系反应,把根取出,吸干水分后与10mL乙酸乙酯和少量石英砂研磨,提取TTF(三苯甲腙)。将红色TTF提取液移入试管中,用分光光度计在485nm下比色,以乙酸乙酯为空白作参比读出光密度,查标准曲线,求得四氮唑还原量MT(μg),计算四氮唑还原强度ST,用以表征根系活力,其计算式为

式中,M为根重(g),t为保温时间(h)。
1.3 数据处理
试验数据运用Excel、SPSS软件进行相关统计分析,使用Photosynthesis Work Bench程序进行光合作用光响应曲线拟合。
2 结果与分析
2.1 淹渍对花椰菜根系活力的影响
根系是植物吸收土壤水分和营养物质的主要器官,根系活力是反映植物根系吸收能力的一项主要指标。由图1可见,植株根系活力与淹渍胁迫时间呈极显著负相关(P<0.01),未受淹渍处理的对照CK,花椰菜的根系活力最大,受淹后根系活力明显下降。随着淹渍时间的延长,根系活力下降幅度逐渐加大,淹渍3、6、9、12和15d后各处理中根系活力分别比CK处理下降26.69%、32.17%、80.50%、95.82%、96.08%。其中,淹渍9d后根系活力急剧降低,12、15d后根系活力很小,趋于0。可见,淹渍导致花椰菜根系严重缺氧,根系活力显著下降;1cm水层淹渍9d后根系活力急速下降,12d后接近于0,说明此时根系已基本死亡。

图1 不同处理花椰菜根系活力的比较Fig. 1 Comparison of root activity of the cauliflower among different treatments注:小写字母表示处理间在0.05水平上的差异显著性。短线表示均方差。下同Note: Lowercase indicates the difference significance among treatments at 0.05 level. The short bar is mean square error. The same as below
2.2 淹渍对花椰菜光合参数的影响
由图2可见,不同淹渍天数处理中花椰菜叶片净光合速率随光照强度变化的趋势一致。当光照强度低于200μmol·m-2·s-1时,所有处理叶片的净光合速率均随光照强度的增大呈直线增大,但不同处理增加的斜率不同,随着淹渍胁迫时间延长,增加斜率逐渐降低。之后随着光强的继续增大,净光合速率增大的趋势减缓。CK处理叶片净光合速率随光强变化的趋势与各淹渍处理一致,但在光照强度达到1000μmol·m-2·s-1后趋于稳定,不再随着光强的增大而增大;淹渍3d处理的花椰菜叶片的净光合速率在光强高于400μmol·m-2·s-1后趋于平稳;当淹渍胁迫超过6d,植株在淹渍胁迫下,光合机制受到伤害,最大光合速率大幅下降,淹渍胁迫6d时叶片的最大光合速率与CK相比降低68.44%,淹渍9、12、15d处理下,叶片净光合速率趋近0。
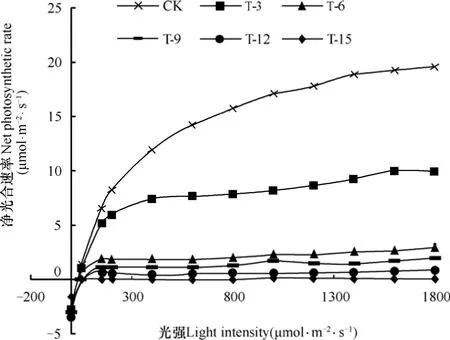
图2 不同处理花椰菜叶片净光合速率光响应曲线的比较Fig. 2 Comparison of net photosynthetic rate light response curve of the cauliflower among treatments
表1为淹渍胁迫下花椰菜叶片光响应曲线特征参数,光补偿点(LCP)是植物的光合速率与呼吸速率相等时的光照强度,光饱和点(LSP)是指光合速率不受光照强度增大的影响且趋于最大光合速率时的光照强度,光补偿点和光饱和点分别表示作物对弱光照和强光照的利用能力。由表可知,光补偿点与淹渍胁迫时间呈正相关,而光饱和点则与胁迫呈显著负相关(P<0.05),随着淹渍胁迫时间的延长,光补偿点呈增大趋势,淹渍6d时,光补偿点较CK增大33.33%;光饱和点则随着淹渍时间的延长急剧下降,淹渍3、6、9、12和15d时花椰菜叶片光饱和点与CK相比分别下降35.50%、84.69%、96.52%、98.37%、99.67%。其中,淹渍6d后,光饱和点下降超过80%,光合机制受到严重破坏,光合作用受抑制。最大光合速率(Pmax)直接反映植物光合作用的强弱。淹渍胁迫下,Pmax随胁迫时间延长而降低(P<0.01)。淹渍胁迫超过3d后,Pmax急剧下降,超过9d后,Pmax下降变缓,并趋于稳定,淹渍胁迫第15天时,最大光合速率仅0.18μmol·m-2·s-1,较CK下降了98.71%。表观量子效率(AQE)即植物在弱光阶段光响应曲线的斜率,是表征植物光合作用的重要参数。由表可见,AQE最小值出现在CK,为0.06,淹渍胁迫6d后AQE出现明显增大,当淹渍9d时AQE为0.26,之后持续保持稳定,说明在淹渍胁迫下,植株的光合作用机制受到明显破坏,淹渍9d条件下,花椰菜的光合作用过程几乎停止。

表1 不同处理叶片净光合速率光响应曲线特征参数的比较(平均值±均方差)Table 1 Comparison of the characteristic parameters of net photosynthetic rate light response curve of cauliflower among treatments (mean±SD)
气孔导度表示植物叶片气孔的张开程度,气孔的张开程度对植物的光合、呼吸作用及其蒸腾作用有着直接影响。图3a为淹渍胁迫下花椰菜叶片气孔导度的变化,由图可见,随着胁迫时间的延长,气孔导度下降幅度不断加大,各处理叶片气孔导度与CK相比其差异显著(P<0.05),淹渍处理3、6、9、12和15d时的花椰菜叶片气孔导度分别下降81.13%、93.45%、97.85%、97.18%、98.92%,但各胁迫处理间差异并不显著。淹渍胁迫下花椰菜胞间CO2浓度(Ci)见图3b,由图可知,淹渍胁迫导致Ci下降,淹渍胁迫时间达到9d时Ci下降程度达到显著水平。当淹渍超过9d后,Ci下降趋势变平缓,最小值98.56μmol·mol-1出现在淹渍胁迫15d时,较CK的319.05μmol·mol-1下降69.11%。图3c为淹渍胁迫对花椰菜蒸腾速率(Tr)的影响。由图可知,花椰菜的蒸腾速率受淹渍胁迫的变化与气孔导度的变化相类似,Tr在淹渍处理初期就出现显著下降,淹渍第9d后下降趋势变平缓,第15天时出现最小值0.08μmol·m-2·s-1,较CK的4.43μmol·m-2·s-1下降98.19%。说明在淹渍处理下,花椰菜植株的气孔导度、胞间CO2浓度以及蒸腾速率均出现明显下降,随着淹渍时间的延长,花椰菜受胁迫影响加重甚至停止生长。
2.3 淹渍对花椰菜水分利用效率和气孔限制值的影响
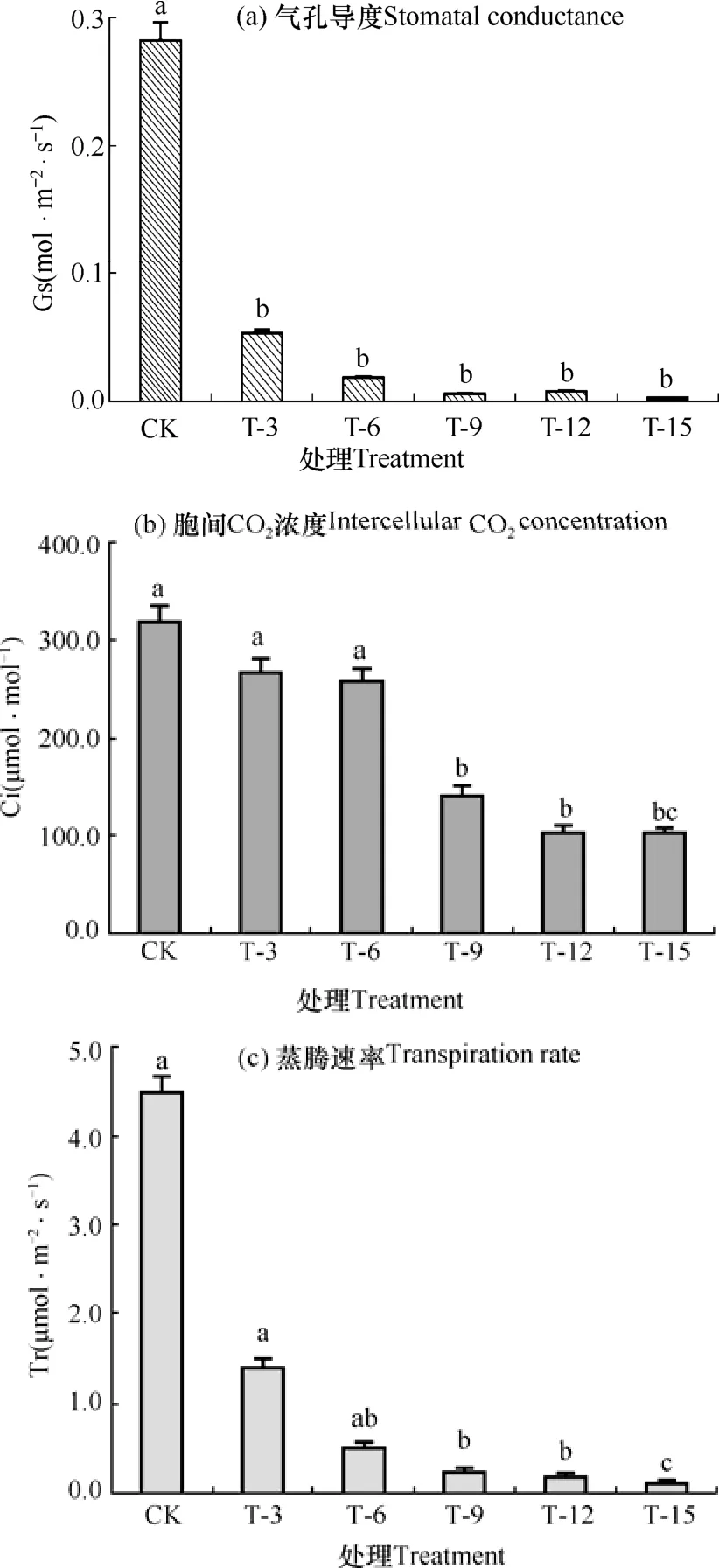
图3 不同处理叶片气体交换参数的比较Fig. 3 Comparison of leaf gas exchange parameters of the cauliflower among treatments
通常叶片净光合速率与蒸腾速率的比值Pn/Tr被称为水分利用效率,用来表征作物水分吸收利用过程效率。淹渍胁迫对花椰菜水分利用效率WUE的影响见图4a,由图可见,各处理中,当光强低于400μmol·m-2·s-1时,花椰菜叶片的水分利用效率随着光强的增大呈直线增大,当光强大于400μmol·m-2·s-1后,WUE增大趋势变缓慢,最后趋于稳定;淹渍前9d的水分利用效率均高于CK,其中淹渍第9天时的WUE最高,其次是淹渍第3天;当淹渍胁迫超过9d后,花椰菜叶片的水分利用率出现显著下降,淹渍胁迫15d时达到最低值,说明植株叶片在淹渍胁迫下受到伤害。本试验中水分利用效率从高到低依次为T-9>T-3>T-6>CK>T-12>T-15。气孔限制是指当叶片气孔导度下降时,CO2进人叶片阻力增大,胞间CO2浓度降低,导致光合速率下降。淹渍胁迫下,花椰菜叶片气孔限制值(Ls)的变化如图4b所示,由图可见,光强低于200μmol·m-2·s-1时,各处理花椰菜叶片的Ls随着光强的增大而增大,当光强高于500μmol·m-2·s-1后,Ls趋于稳定。由图还可见,花椰菜叶片Ls与淹渍胁迫时间呈正相关,淹渍胁迫第3天时,Ls显著增大,仅淹渍胁迫第6天时,花椰菜叶片Ls值略低于CK,之后随着淹渍胁迫时间的延长,淹渍处理下Ls均高于CK。
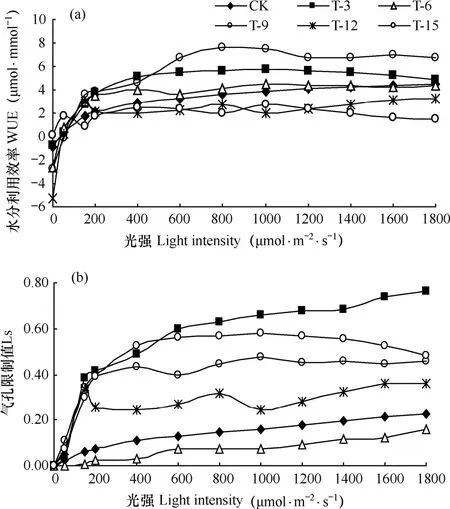
图4 不同处理叶片水分利用效率(a)和气孔限制值(b)的比较Fig. 4 Comparison of water use efficiency (a) and stomatal limitation value (b) of the cauliflower among treatments
3 讨论与结论
淹涝胁迫的实质是由淹渍引起的低氧胁迫从而影响植株的生长发育。根系是受涝渍逆境直接伤害的器官,根系活力是植株根部吸收、合成、氧化以及还原能力的综合体现,是反映根系生命力的综合指标,可以在本质上反映植株根系生长与外界土壤环境之间的动态关系[15-17]。试验结果表明,淹渍胁迫下,花椰菜植株根系活力明显下降,且随着胁迫时间延长,根系活力下降越显著,这与前人研究结果基本一致[18-21]。说明淹渍条件下,土壤孔隙减小,氧气浓度降低,导致植物根部缺氧,植株根系有氧呼吸受到抑制,呼吸代谢紊乱,水分和营养离子的吸收以及营养物质的运输能力减弱,植株正常代谢过程受到抑制,根系活力急剧下降,影响植株的正常生长发育。
气孔是植物体与外界环境交换二氧化碳、氧气以及水分的主要通道,直接影响植株的水分状况和CO2的同化作用[22-23]。研究结果显示,淹渍胁迫下,花椰菜叶片气孔导度(gs)、蒸腾速率(Tr)以及胞间CO2浓度(Ci)均出现不同程度的降低,这与前人的研究结果一致[24-25],然而,田琳等[6]发现在水涝胁迫下,夏玉米气孔导度和蒸腾速率均明显降低,而胞间CO2浓度则明显增加,这可能是由于水分胁迫降低夏玉米净光合速率、蒸腾速率和气孔导度,增大了胞间CO2浓度。试验结果表明,淹渍胁迫下花椰菜叶片蒸腾速率明显降低,蒸腾作用是植物根系吸水的主要动力,蒸腾作用的降低使花椰菜根系吸水减少,植株正常生理代谢受到抑制,从而影响其正常生长发育。
随着淹渍胁迫时间的延长,花椰菜叶片光饱和点持续降低,同时光补偿点增大,最大净光合速率显著下降。这与前人研究结果一致[26-28]。前人研究认为,淹渍导致植株光合速率下降的原因主要包括两个方面:一方面可能与淹渍胁迫导致植物气孔关闭,从而导致叶片对CO2的吸收减少,植物对碳的获取受到限制,光合作用的底物减少,从而降低其净光合速率[29]。Kozlowski[30]研究认为,淹渍初期Pn下降主要是由于气孔导度的下降而引起的,而中长期淹渍胁迫下,光合速率的下降则与羧化效率下降、表观量子效率变化、叶绿素的降解以及光合产物叶片水平积累等光合生理生态过程有关。另一方面,淹渍胁迫导致植物净光合速率下降的原因还可能与非气孔因素有关[31-33]。Chen等[34]研究认为,淹渍条件下导致植物光合速率下降的因素可能包括羧化效率的下降,乙烯的产生以及光化学活性的下降。Ushimaru等[35]发现淹水植物的叶片保护酶活性下降,大量自由基穿透质体膜进入叶绿体,使叶绿体降解,叶绿素含量降低,电子传递系统和光合磷酸化受抑,细胞分裂素(CTK)含量下降,抑制了光合碳循环中磷酸甘油醛脱氢酶(GAPDH)活性,使光合作用受到抑制。本试验中,在淹渍胁迫下,花椰菜叶片的气孔导度出现显著降低,同时胞间CO2浓度下降,净光合速率显著降低,气孔限制值在淹渍初期显著增大,而当淹渍胁迫时间超过6d后,Ls变化较为复杂,说明在淹渍胁迫初期,Pn的降低主要是由气孔限制引起的,淹渍虽未引起叶片失水,但仍然使得叶片气孔出现收缩甚至闭合,气孔阻力增大,叶片与外界水气交换受到阻碍,CO2进出气孔受到限制,从而导致胞间CO2浓度降低,进行光合作用的底物供应不足,使得光合作用的进行受到限制。淹渍时间较长时,引起花椰菜叶片Pn下降的因素还有待探讨。
本研究证实淹渍胁迫下,花椰菜的根系活力出现明显下降,叶片净光合速率降低,光系统活性受到严重伤害,且花椰菜受胁迫程度与淹渍时间呈正相关。在淹渍胁迫前6d,花椰菜叶片最大净光合速率和植株根系活力均下降显著,之后趋于稳定,因此,可以认为6d是花椰菜致灾临界指标,淹渍胁迫超过9d后,植株受到严重伤害,根系腐烂,但本研究仅以花椰菜品种“崇花120天”为试材,研究结果对其它品种是否适用还需进一步验证。
参考文献References
[1]徐敏.光温胁迫对花椰菜生长发育的影响[D].杭州:浙江大学,2004:3-4. Xu M.Effects of light and temperature stress on the growth and development of Cauliflower (Brassica oleracea var. botrytis L)[D].Hangzhou:Zhejiang University,2004:3-4.(in Chinese)
[2]陈永华,赵森,严钦泉,等.不同淹涝胁迫强度对杂交稻和常规稻农艺性状和生化特性的影响[J].中国水稻科学,2006,20(5): 512-516. Chen Y H,Zhao S,Yan Y Q,et al.Effects of different submergence stresses on agronomic traits and biochemical characteristics in hybrid and traditional rice[J].Chinese J Rice Sci,2006,20(5):512-516.(in Chinese)
[3]宁金花,陆魁东,霍治国,等.拔节期淹涝胁迫对水稻形态和产量构成因素的影响[J].生态学杂志, 2014,33(7):1818-1825. Ning J H,Lu K D,Huo Z G,et al.Effects of waterlogging stress on rice morphology and yield component at the jointing stage[J].Chinese Journal of Ecology,2014,33(7):1818-1825.(in Chinese)
[4]宁金花,霍治国,陆魁东,等.不同生育期淹涝胁迫对杂交稻形态特征和产量的影响[J].中国农业气象,2013,34(6):678-684. Ning J H,Huo Z G,Lu K D,et al.Effects of water logging on morphological characteristics and yield of hybrid rice during growth stages[J].Chinese Journal of Agrometeorology, 2013,34(6):678-684.(in Chinese)
[5]刘祖贵,刘战东,肖俊夫,等.淹涝胁迫对夏玉米光合特性参数及产量的影响[J].灌溉排水学报, 2014,33(6):41-46. Liu Z G,Liu Z D,Xiao J F,et al.Effects of waterlogging stress on photosynthetic characteristic parameters and yield of summer maize[J].Journal of Irrigation and Drainage,2014,33(6):41-46.(in Chinese)
[6]田琳,谢晓金,包云轩,等.不同生育期水分胁迫对夏玉米光合生理特性的影响[J].中国农业气象, 2013,34(6):655-660. Tian L,Xie X J,Bao Y X,et al.Effects of moisture stress on photosynthetic characteristics of summer maize leaf during growth stages[J].Chinese Journal of Agrometeorology,2013,34(6):655-660.(in Chinese)
[7]周自强,王福友,陈建飞,等.淹涝胁迫和氮形态对苗期玉米糖、氮代谢底物量的影响[J].中国生态农业学报,2013,21(6): 715-719. Zhou Z Q,Wang F Y,Chen J F,et al.Effect of water-logging and nitrogen form on substrates of sugar and nitrogen metabolism in maize(Zea mays L.)at seedling stage[J].Chinese Journal of Eco-Agriculture,2013,21(6):715-719.(in Chinese)
[8]刘盼盼,伍大利,王福友,等.淹涝胁迫和供氮形态耦合对苗期玉米根系的影响[J].西北农林科技大学学报(自然科学版),2012,40(9):133-140,146. Liu P P,Wu D L,Wang F Y,et al.Effect of water-logging and nitrogen forms on roots of maize(Zea mays L.) plants at seedling stage[J].Journal of Northwest A&F University (Nat. Sci. Ed),2012,40(9):133-140,146.(in Chinese)
[9]张艳军,董合忠.棉花对淹水胁迫的适应机制[J].棉花学报,2015,27(1):80-88. Zhang Y J,Dong H Z.Mechanisms for adapting to waterlogging stress in cotton[J].Cotton Science,2015,27(1):80-88.(in Chinese)
[10] 刘凯文,苏荣瑞,朱建强,等.棉花苗期叶片关键生理指标对涝渍胁迫的响应[J].中国农业气象, 2012,33(3):442-447. Liu K W,Su R R,Zhu J Q,et al.Dynamic responses of main physiological indices cotton leaf to waterlogging stress at seedling stage[J].Chinese Journal of Agrometeorology,2012,33(3):442-447.(in Chinese)
[11] 韩亮亮,周琴,陈卫平,等.淹水对大豆生长和产量的影响[J].大豆科学,2011,30(4):589-595. Han L L,Zhou Q,Chen W P,et al.Effects of flooding on growth and yield of soybean[J].Soybean Science,2011,30(4): 589-595.(in Chinese)
[12] 卢雪琴,夏汉平,彭长连.淹水对5种禾本科植物光合特性的影响[J].福建林学院学报,2004,24(4): 374-378. Lu X Q,Xia H P,Peng C L.The effects of submergence on the photosynthetic characteristics of five grasses[J].Journal of Fujian College of Forestry,2004,24(4):374-378.(in Chinese)
[13] Bassman J B,Zwier J C.Gas exchange characteristics of Populus trichocarpa,Populus deltoides and Populus trichocarpax P.deltoides clones[J].Tree Physiology,1991,8(2): 145-149.
[14] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:58-61. Gao J F.Plant physiology experimental guidance[M].Beijing: Higher Education Press,2006:58-61.(in Chinese)
[15] 连洪燕,权伟,卢建国.淹水胁迫对石楠幼苗根系活力和光合作用影响[J].林业科技开发,2009, 23(2):51-54. Lian H Y,Quan W,Lu J G.Effect of waterlogging stress on root activity and photosynthesis of three kinds of Photinia seedlings[J].China Forestry Science and Technology,2009,23(2):51-54.(in Chinese)
[16] 斯琴巴特尔,吴红英.不同逆境对玉米幼苗根系活力及硝酸还原酶活性的影响[J].干旱地区农业研究,2001,19(2): 67-70. Sechenbater,Wu H Y.Effect of different stress on roots activity and nitrate reductase activity in Zea mays L[J].Agricultural Research in the Arid Areas,2001,19(2): 67-70.(in Chinese)
[17] 曲复宁,王云山,张敏,等.高温胁迫对仙客来根系活力和叶片生化指标的影响[J].华北农学报, 2002,17(1):127-131. Qu F N,Wang Y S,Zhang M,et al.Influence of high temperature stress on root vitality and leaf biochemical indexes of cyclamen[J].Acta Agriculturae Boreali-Sinica,2002,17(1): 127-131.(in Chinese)
[18] 刘登望,王建国,李林,等.不同花生品种对旱涝胁迫的响应及生理机制[J].生态学报,2015, 35(11):1-10. Liu D W,Wang J G,Li L,et al. Responses of different peanut cultivars to drought and waterlogging stress and physiological mechanism[J].Acta Ecologica Sinica,2015,35(11):1-10.(in Chinese)
[19] 周灵芝.低氧胁迫对厚皮甜瓜生长和产量的影响[D].南宁:广西大学,2007:17-21. Zhou L Z.Effect of hypoxia stress on growth and yield of melon(Cucumis melon L)[D]. Nanning:Guangxi University,2007:17-21.(in Chinese)
[20] 辛俊亮,黄白飞,杨中艺,等.铺地木蓝对不同程度淹水胁迫的生理响应[J].草业学报,2012,21(3):177-183. Xin J L,Huang B F,Yang Z Y,et al.Physiological response of Indigo feraspicata to different flooding stress[J].Acta Prataculturae Sinica,2012,21(3):177-183.(in Chinese)
[21] 张根峰,张翼.渍涝胁迫对芝麻生理指标及产量性状的影响[J].作物杂志,2010,(1):84-86. Zhang G F,Zhang Y.Effect of waterlogging stress on physiological indices and yield traits of sesame[J].Crops,2010,(1):84-86.(in Chinese)
[22] 刘泽彬,程瑞梅,肖文发,等.水淹胁迫对植物光合生理生态的影响[J].世界林业研究,2013,26(3):33-38. Liu Z B,Cheng R M,Xiao W F,et al.Effect of water-logging on photosynthetic and physioecological characteristics of plants[J].World Forestry Research,2013,26(3):33-38.(in Chinese)
[23] 关义新,戴俊英,林艳.水分胁迫下植物叶片光合的气孔和非气孔限制[J].植物生理学通讯,1995, 31(4):293-297. Guan Y X,Dai J Y,Lin Y.The photosynthetic stomatal and nonstomatal limitation of plant leaves under water stress[J].Plant Physiology Communications,1995,31(4):293-297.(in Chinese)
[24] 张雪芹,谢志南,欧阳海波,等.淹水对番木瓜光合和叶绿素荧光特性的影响[J].中国南方果树, 2011,40(3):29-32. Zhang X Q,Xie Z N,Ouyang H B,et al.Effects of water-logging on photosynthesis and chlorophyll fluorescence characteristics of Carica papa L[J].China Southern Fruit,2011,40(3):29-32.(in Chinese)
[25] 李金才,董琦,余松烈.不同生育期根际土壤淹水对小麦品种光合作用和产量的影响[J].作物学报,2001,27(4):434-441. Li J C,Dong Q,Yu S L,et al.Effect of waterlogging at different growth stages on photosynthesis and yield of different wheat cultivars[J].Acta Agronomica Sinica,2001,27(4):434-441.(in Chinese)
[26] 赵可夫.植物对水涝胁迫的适应[J].生物学通报,2003,38(12):11-14. Zhao K F.Plant adaptation to waterlogging stress[J].Bulletin of Biology,2003,38(12):11-14.(in Chinese)
[27] 刘泽彬,程瑞梅,肖文发,等.土壤淹水条件下香附子光响应过程的模型比较[J].西北林学院学报, 2014,29(4):40-45. Liu Z B,Cheng R M,Xiao W F,et al.Comparison of light response model of photosynthesis in leaves of Cyperus routundus under soil flooding conditions[J].Journal of Northwest Forestry University,2014,29(4):40-45.(in Chinese)
[28] 衣英华,樊大勇,谢宗强,等.模拟淹水对池杉和栓皮栎光合生理生态过程的影响[J].生态学报,2008,28(12):6025-6033. Yi Y H,Fan D Y,Xie Z Q,et al.The effects of waterlogging on photosynthesis related ecophysiological processes in the seedlings of Quercus variabilis and Pterocarya stenoptera[J]. Acta Ecologica Sinica,2008,28(12):6025-6033. (in Chinese)
[29] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
[30] Kozlowski T T.Responses of woody plants to flooding and salinity[J].Tree Physiology, 1997,(1):1-29.
[31] Meyer S,de Kouchkovsky Y.ATPase state and activity in thylakoids from normal and water-stressed lupin[J].FEBS Letters,1992,303(2-3):233-236.
[32] 战伟,沙伟,王淼,等.降水和温度变化对长白山地区水曲柳幼苗生长和光合参数的影响[J].应用生态学报,2012,23(3): 617-624. Zhan W,Sha W,Wang M,et al.Effects of the variations in precipitation and temperature on photosynthetic parametersand growth of Fraxinus mandshurica seedlings in Changbai Mountains of Northeast China[J].Chinese Journal of Applied Ecology,2012,23(3):617-624. (in Chinese)
[33] Gunasekera D,Berkowitz G A.Use of transgenic plants with ribulose-1,5-bisphosphate carboxylase/oxygenase antisense DNA to evaluate the rate limitation of photosynthesis under water stress[J].Plant Physiology,1993,103(2):629-635.
[34] Chen H,Qualls R G,Blank R R.Effect of soil flooding on photosynthesis,carbohydrate partitioning and nutrient uptake in the invasive exotic Lepidium latifolium[J].Aquatic Botany,2005,82(4):250-268.
[35] Ushimaru T,Ogawa K,Ishida N,et al.Changes in organelle superoxide dismutase isoenzymes during air adaptation of submerged rice seedlings:differential behavior of isoenzymes in plastids and mitochondoria[J].Planta,1995,196:606-613.
Effect of Waterlogging Stress on Root Activity and Leaf Photosynthesis Character of Cauliflower
HOU Qi-qi1, YANG Zai-qiang1, SHI Wu-yi2, YUAN Yu-hui2, GU Wei2
(1. Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology,Nanjing 210044, China; 2.Chongming County Meteorological Bureau, Chongming 202150, Shanghai)
Abstract:Took cauliflower variety of Chonghua as a material, the artificial environment control experiment was conducted in Nanjing University of Information Science and Technology from August to November in 2014. The waterlogging was treated as five levels: 3, 6, 9, 12, 15 days, took normal irrigation as control (CK),the root activity and photosynthetic parameters of cauliflower were measured. The results showed that the root activity presented a declining trend with the increase of waterlogging days. When the experiment lasted for more than 9 days, the root activity tended to 0, when the experiment lasted for 3, 6, 9, 12 and 15 days, the maximum net photosynthetic rate decreased 4.90%, 68.13%, 78.71%, 90.92% and 98.68%, respectively, meanwhile, light compensation point decreased and light saturation point increased. Stomatal conductance, transpiration rate and intercellular CO2concentration decreased significantly under waterlogging stress, but stomatal limitation increased at the beginning of the stress, that is stomatal limitation resulted in the decrease of net photosynthetic rate at early stress. The study confirmed that all indices declined obviously during the early 6 days and then tended to stabilization, so the 6thday was the critical indicator of Chonghua cauliflower.
Key words:Root activity; Stomatal conductance; Transpiration rate; Stomatal limitation value
作者简介:侯奇奇(1994-),女,硕士生,主要研究方向为设施农业气象灾害。E-mail:1005600646@qq.com
基金项目:国家公益性行业(气象)科研专项(GYHY201506001);“十二五”国家科技支撑计划项目(2014BAD10B07);国家自然科学基金面上项目(41275117)
* 收稿日期:2015-05-15**通讯作者。E-mail:yzq@nuist.edu.cn
doi:10.3969/j.issn.1000-6362.2016.01.007
