溶藻弧菌肽聚糖和vp28-siRNA对凡纳滨对虾白斑综合征病毒的抑制作用
2016-04-06朱卫卫邱德全鲁义善简纪常广东海洋大学水产学院广东省水产经济动物病原生物学及流行病学重点实验室广东省教育厅水产经济动物病害控制重点实验室广东湛江524025
朱卫卫,邱德全,甘 桢,鲁义善,简纪常(广东海洋大学 水产学院 //广东省水产经济动物病原生物学及流行病学重点实验室 //广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524025)
溶藻弧菌肽聚糖和vp28-siRNA对凡纳滨对虾白斑综合征病毒的抑制作用
朱卫卫,邱德全,甘桢,鲁义善,简纪常
(广东海洋大学 水产学院 //广东省水产经济动物病原生物学及流行病学重点实验室 //广东省教育厅水产经济动物病害控制重点实验室,广东湛江524025)
摘要:对感染白斑综合征病毒(WSSV)的凡纳滨对虾(Litopenaeus vannamei)分别注射0.05和0.10 μg/μL 的vp28-siRNA,干扰效果实验表明,siRNA最佳浓度为0.10 μg/μL。凡纳滨对虾感染WSSV 24 h时注射0.10 μg/μL 的vp28-siRNA,检测免疫后不同时间点的干扰效果。结果表明:在注射vp28-siRNA 6 h后,实验组与对照组WSSV病毒拷贝数差异有统计学意义(P < 0.05);在48 h时实验组病毒拷贝数急剧下降,对照组则保持较高水平,可较好干扰WSSV病毒复制,干扰效果持续120 h,对凡纳滨对虾的保护率为40%。凡纳滨对虾用0.10 mg/mL肽聚糖(Peptidoglycan)免疫24 h后感染WSSV,检测6、12、24 h注射vp28-siRNA的保护率。结果显示:6 h注射组的保护率为80%,12 h注射组为63.33%,24 h注射组为56.67%。凡纳滨对虾在肽聚糖和vp28-siRNA作用后,可增加其对WSSV抗感染作用,降低死亡率,干扰时间越早,对对虾的保护率越高。
关键词:凡纳滨对虾;免疫增强剂;RNA干扰;肽聚糖;vp28-siRNA;白斑综合征病毒
Key word:Litopenaeus vannamei; immunopotentiating agent; RNA interference; peptidoglycan; vp28-siRNA; White Spot Syndrome Virus
对虾有成熟的非特异性免疫系统。肽聚糖(Peptidoglycan,PG)[1]、脂多糖(Lipopoly saccharide,LPS)[2]、葡聚糖(Glucan)及藻类多糖[3]等具有促进或诱发宿主防御反应,增强生物机体抗病能力的作用,称为对虾免疫增强剂,这些免疫增强剂研究为对虾养殖中病害防治新型药物开发开辟了新思路[4-5]。肽聚糖取自微生物细胞壁,因此细菌进入机体时被识别出来,激发起体内的免疫功能,是免疫增强剂的重要成员,可提高机体多种免疫因子活力,增强抗病力[6]。
白斑综合症病毒(White spot syndrome virus,WSSV)是引发亚洲地区对虾病毒性流行病主要病原[7],给对虾养殖业造成巨大损失[8-9]。目前,学界多采用添加中草药及制剂[10-13]、使用免疫增强剂[14-16]、注射抗体[17-18]或疫苗[19]等方法增强对虾免疫力,以防治WSSV。此外,细胞内的Dicer酶可将外源dsDNA剪成siRNA,与核酸酶合成沉默复合体及解旋双链siRNA,以siRNA为向导选择底物降解为与其同源的mRNA序列,这种现象称为RNA干扰(RNAi)。对虾体内不存在干扰素相关基因,不会诱发先天性免疫反应而降解dsRNA和siRNA,因此,可给对虾注射siRNA进行RNAi实验[20]。已有研究[21-22]表明,对虾注射WSSV的相应dsRNA[21]或siRNA[22]后,可减少体内病毒的复制。上述研究均为单方面增强机体的免疫能力或利用RNAi有效干扰WSSV复制以防治WSSV,笔者用肽聚糖注射免疫凡纳滨对虾(Litoprnaeus vannamei)后,用WSSV攻毒,再注射vp28-siRNA,研究肽聚糖和siRNA对对虾的免疫保护率,为凡纳滨对虾抗WSSV研究提供新的方法和思路。
1 材料与方法
1.1实验用虾及病毒原液
凡纳滨对虾(L.vannamei),体长(9.5 ± 0.3)cm,体质量(11.0 ± 0.6)g,取自湛江市东海岛东南庵里湛江腾飞实业有限公司对虾养殖场。经PCR检测,确认未携带白斑综合症病毒。对虾于1 m × 1 m × 0.8 m的水槽中暂养7 d,养殖条件:盐度24,水温28~32℃,每日按对虾体质量10%的剂量投喂配合饲料3次,连续充气,日换水量约1/3。
WSSV病毒粗提液由广东省水产经济动物病原生物学及流行病学重点实验室(下称本实验室)-80℃超低温保存。
1.2肽聚糖提取和溶液配制
参照谢警鸿[23]和刘春晓[24]方法提取溶藻弧菌(Vibrio alginolyticus)(本实验室保存)细胞壁的肽聚糖,用分析天平称量0.1 g的肽聚糖(纯度98.5%),溶入10 mL的BSS缓冲液(NaCl 18.0 g/L,KCl 0.7 g/L,NaHCO30.5 g/L,KH2PO40.54 g/L,调pH至7.2),用超声波溶解配制成0.1 mg/mL的肽聚糖溶液。
1.3siRNA选择与合成和荧光定量引物设计
siRNA来自WSSV主要囊膜蛋白vp28基因,李咏梅[25]等已在仓鼠肾(Baby hamster kidney,BHK)细胞中验证3条siRNA的有效性。选用其中一条siRNA和阴性对照siRNA(Negative control siRNA,nc-siRNA)。登陆NBCI搜索得WSSV vp28基因(GenBank登录号DQ681069)的全mRNA序列,引物W120和vp28用Premier 5软件设计,由生工生物工程(上海)股份有限公司合成。
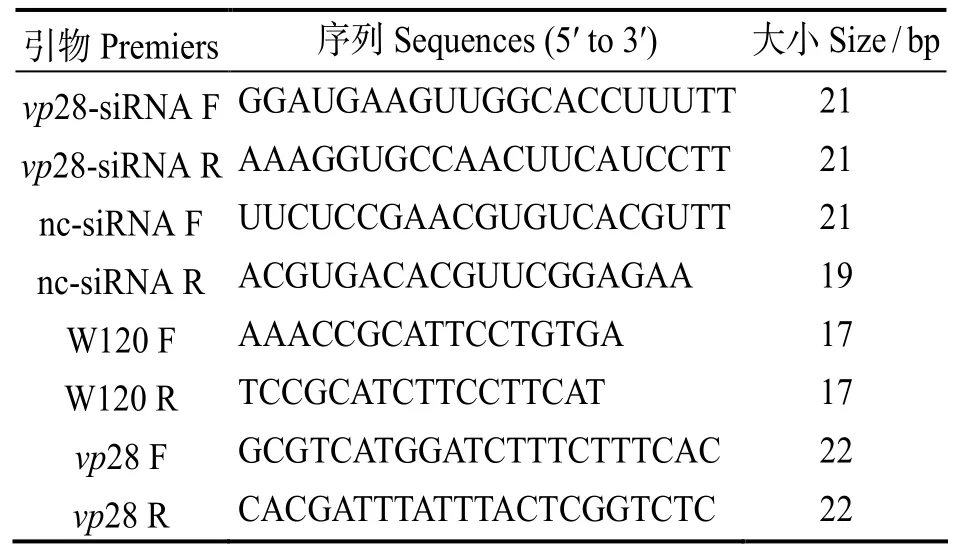
表1 siRNA和荧光定量引物Table 1 siRNA and quantitative real-time PCR primers
vp28-siRNA和nc-siRNA由上海吉玛制药技术有限公司合成。合成的vp28-siRNA用BSS缓冲液(DEPC水处理)配制成0.10和0.05 μg/μL溶液,nc-siRNA配制成0.05 μg/μL溶液。
1.4荧光定量PCR及标准曲线绘制
采用程晓燕等[26]的方法制备vp28重组质粒标准品,用核酸分析仪测定重组质粒的DNA 浓度,计算重组质粒的拷贝数,公式如下。
重组质粒的拷贝数=质粒质量浓度(μg/μL)× 10−6× 6.02 ×1023/重组质粒相对分子质量。
荧光定量PCR的反应体系:SYBR PremixEx Taq TM(2×)12.5 μL,模板1 μL,0.2 μmol/L引物2.0 μL。反应条件:94 ℃ 5 min;94℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR结束后,利用Rotor-Gene软件查看扩增曲线,计算Ct(Cyclethreshold)值,以及计算重组质粒不同稀释度(拷贝数)与Ct值的相关性,从而得到标准曲线。
1.5siRNA最佳浓度的确定
实验分4组,记为DZ、SR1、SR2、CZ组,每组对虾5尾,每尾分别肌肉注射100 μL稀释104倍的病毒粗提液。24 h时,SR2组注射100 μL的0.05 μg/μL vp28-siRNA,SR1组注射100 μL的0.10 μg/μL vp28-siRNA,DZ组仅注射100 μL的BSS缓冲液(阴性对照组),CZ组注射100 μL的nc-siRNA(阳性对照)。48 h时,分别取对虾的鳃组织提取DNA用于半定量PCR检测WSSV。反应体系(25 μL)含10×ExTaq Buffer 2.5 μL,2.5 mmol/L dNTP Mix 2.0 μL,10 μmol/L上、下游引物各1.0 μL,病毒粗提液1.0 μL,Ex Taq(5 U/μL)0.2 μL,ddH2O 17.3 μL。反应条件:95℃ 5 min;94℃ 30 s,54℃ 45 s,30循环;72℃ 1 min,72℃ 10 min。扩增结束后每组(5平行组)PCR产物合成一管,取其中的10 µL作10 mg/mL琼脂糖凝胶电泳。
1.6siRNA对凡纳滨对虾WSSV抗感染效果
设3个实验组,记为WS、SR、BS组,每组设置3个平行组,每个平行组对虾10尾。WS和SR实验组每尾各注射稀释104倍的病毒粗提液100 μL,BS组注射BSS缓冲液100 μL。24 h时,SR组注射100 μL vp28-siRNA(浓度为1.5节结果)。观察7 d,记录每天对虾死亡数,计算免疫保护率。
设实验组、对照组,每组设置3个平行组。每平行组对虾30尾,每尾各注射100 μL稀释104倍的病毒粗提液。24 h时,实验组每尾注射100 μL vp28-siRNA(浓度为1.5节的最佳浓度)。在注射后0、6、12、24、48、72、96、120 h时采集各组对虾鳃组织,每组每个时间点各取3尾,用荧光定量PCR检测WSSV变化情况。
1.7肽聚糖和vp28-siRNA 对凡纳滨对虾抗WSSV的影响
根据刘春晓[24]的结果,实验用肽聚糖质量浓度为0.1 mg/mL,所用病毒为稀释104倍的WSSV粗提液[14],vp28-siRNA浓度为1.5节的浓度结果。设5个实验组,分别记为PS、WS、PS6、PS12、PS24组,每组设置3个平行组,每平行组对虾30尾。各组处理如表2所示。
实验连续充气,日换水量约为1/3,定时吸出排泄物,及时取出死亡对虾。记录各组感染后 7 d的凡纳滨对虾死亡数。
1.8数据处理
所得数据采用SPSS20.0进行单因素方差分析和Duncan多重比较,用Excel作图。

表2 实验分组Table 2 The experiment designs the different groups
2 结 果
2.1绝对定量标准曲线绘制
用核酸分析仪测定vp28重组质粒的DNA 浓度为27.7 ng/μL,根据计算公式得到质粒中的目的基因拷贝数为3.93×109copies/μL,将其进行连续10倍稀释得到3.93×108、3.93×107、3.93×106、3.93×105、3.93×104、3.93×103和3.93×102copies/μL,进行荧光定量测定。结果见图1,其中R2=0.999 9,说明该方程线性相关性较佳,可用于计算病毒拷贝数。
2.2siRNA最佳浓度确定
图2可见,SR1条带亮度低于其他实验组,表明注射100 μL 0.10 μg/μL vp28-siRNA实验组病毒数量最少。用荧光定量PCR检测攻毒48 h时各组病毒的拷贝数见图3。图3表明,SR1组病毒拷贝数最少,与其他各组差异有统计学意义(P < 0.05)。表明注射0.10 μg/μL的vp28-siRNA干扰WSSV效果较好,可用于下一步实验。
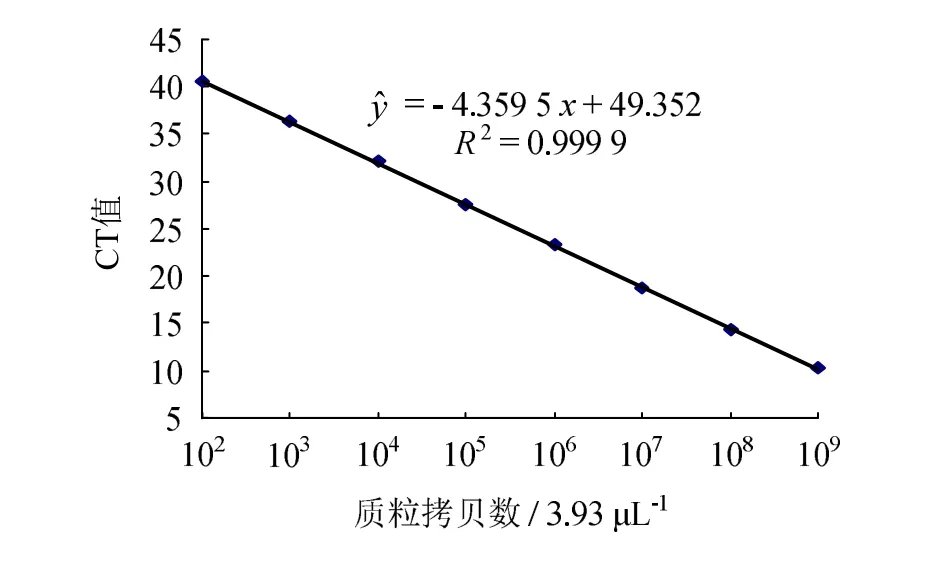
图1 WSSV基因荧光定量PCR标准曲线Fig.1 Standard curve of WSSV gene fluorogenic quantitative real-time PCR
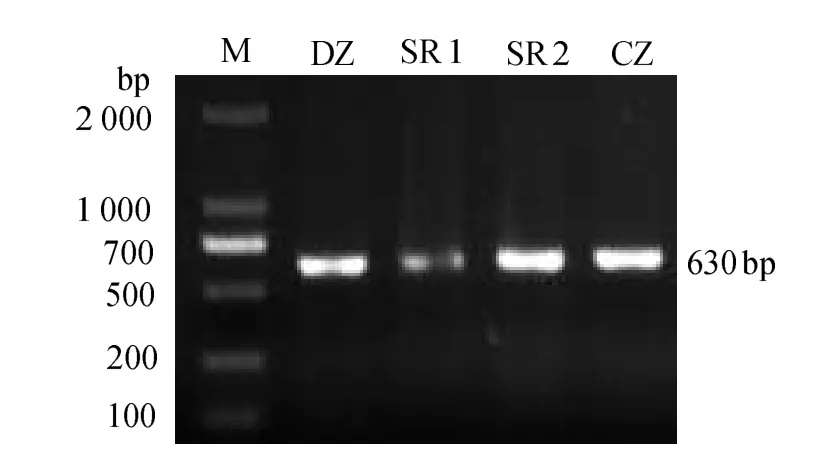
图2 WSSV半定量PCR鉴定结果Fig.2 Semi-quantitative PCR identification of WSSV
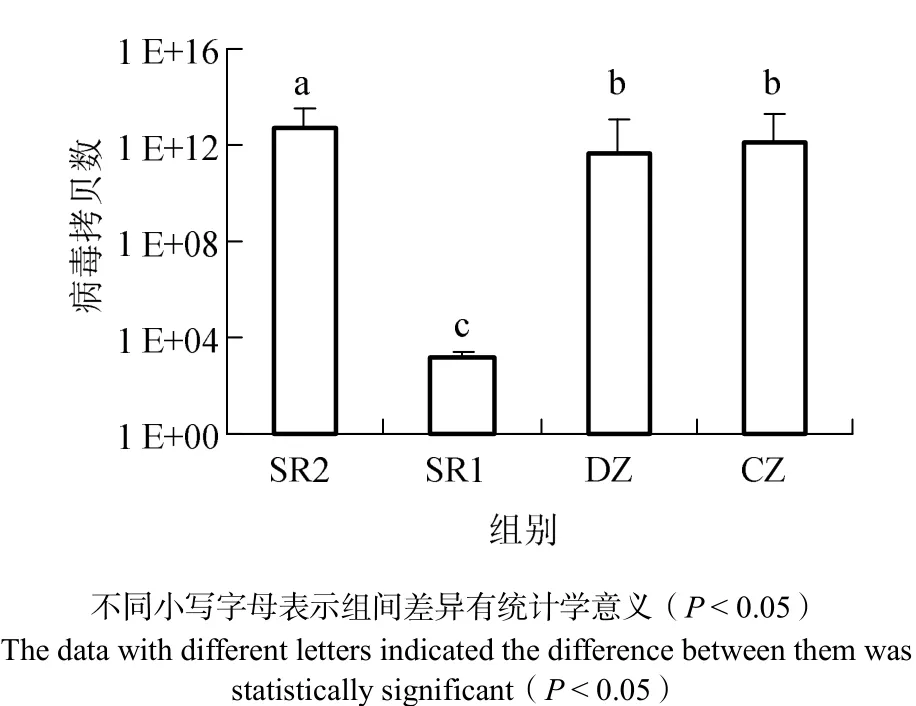
图3 攻毒48 h时凡纳滨对虾携带WSSV拷贝数Fig.3 Copy number of WSSV in Litopenaeus vannamei at 48 h after challenged with WSSV
2.3vp28-siRNA对凡纳滨对虾的抗WSSV存活率影响及WSSV携带情况
用质量浓度为0.10 μg/μL vp28-siRNA免疫感染WSSV 24 h的凡纳滨对虾,各组对虾存活率如表3所示。表3可见,对照组WS组7 d内死亡率达到100%;经vp28-siRNA免疫的SR组对虾死亡率为60%,保护率为40%。
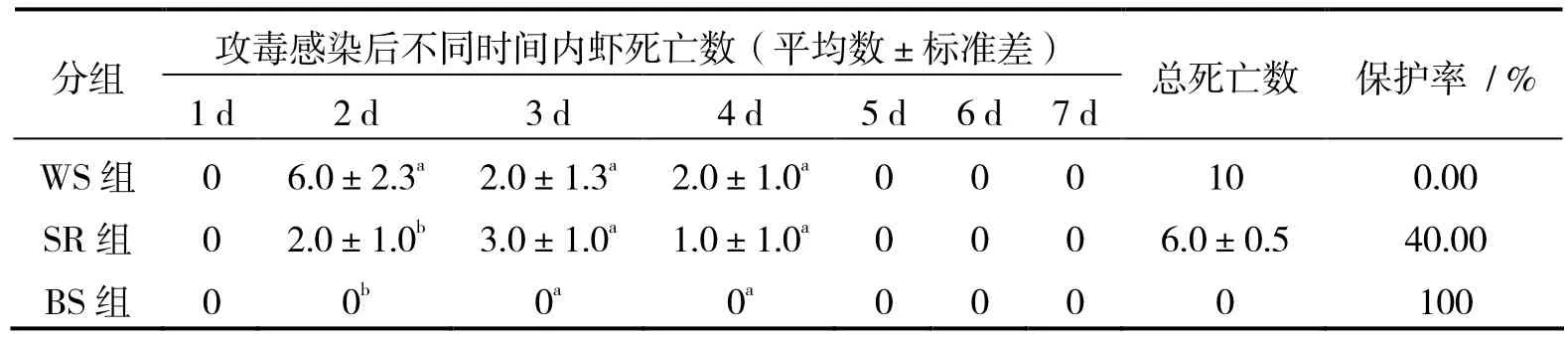
表3 vp28-siRNA对凡纳滨对虾的抗WSSV存活率的影响Table 3 Effects of vp28-siRNA on Litopenaeus vannamei infected WSSV
注射vp28-siRNA后各时间点病毒的DNA荧光定量PCR检测结果如图4所示。图4表明,在0 至24 h之间,病毒不断繁殖,其拷贝数快速倍增,但实验组低于对照组(P < 0.05);24 h后实验组病毒拷贝数急剧下降,48 h时, 实验组病毒拷贝数明显低于对照组,差异有统计学意义(P < 0.01),一直持续到120 h,而对照组则保持高水平的病毒拷贝数。

图4 vp28-siRNA对凡纳滨对虾携带WSSV拷贝数的影响Fig.4 Effects of vp28-siRNA on the WSSV copy number in Litopenaeus vannamei
2.4肽聚糖和vp28-siRNA对凡纳滨对虾感染WSSV存活率的影响
先用0.10 mg/mL肽聚糖对凡纳滨对虾免疫24 h,感染WSSV之后不同时间点注射vp28-siRNA,各组对虾存活率如表4。对照组和阴性对照组对虾的死亡率都为100%,PS6组的保护率为80%,PS12组的保护率为63.33%,PS24的保护率为56.67%。结果显示,注射vp28-siRNA时间点越后,凡纳滨对虾的保护率越低,仍有56.67%的保护率。
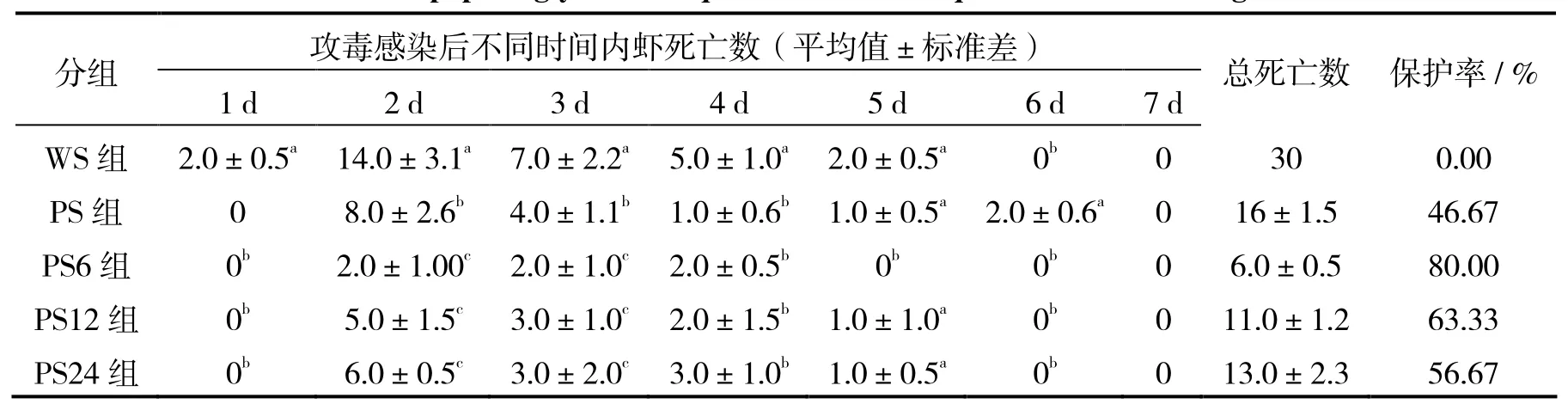
表4 肽聚糖和 vp28-siRNA对凡纳滨对虾的抗WSSV存活率的影响Table 4 Effects of peptidoglycan and vp28-siRNA on Litopenaeus vannamei against WSSV
3 讨 论
vp28是WSSV的一个高丰度的囊膜蛋白,在病毒初始感染对虾中起关键作用[27],抑制vp28的转录与翻译,对对虾WSSV的抗感染效果较好。李咏梅等[25]发现,siRNA在BHK细胞中对vp28基因的干扰效率维持在50%~70%。Xu等[28]把siRNA注射到体内后可成功抑制VP28在转录和翻译水平的表达,抑制病毒的复制,提高对虾对病毒的抵抗力。Zhu等[29]证明,把siRNA注射凡纳滨对虾体内也有同样效果,其免疫保护率约为40%。本研究表明,凡纳滨对虾注射vp28-siRNA后,其保护率为40%,与文献[29]结果一致,间接说明干扰WSSV病毒vp28可有效控制WSSV的感染。
本研究以WSSV囊膜蛋白vp28为模板设计实验用siRNA,确定vp28-siRNA质量浓度为0.10 μg/μL时干扰WSSV效果最佳。有研究证明,在凡纳对虾体内注射10 μg siRNA的干扰病毒效果最佳[30],与本研究相符。在对虾注射vp28-siRNA 48 h时(图4),实验组对虾体内病毒拷贝数与对照组相比急剧降低,差异有统计学意义(P < 0.01),说明干扰效果明显,效果可持续到120 h,这是RNAi信号扩增机制的作用结果,即在机体内以siRNA为引物,靶mRNA为模板,在RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,RdRP)作用下通过聚合酶链式反应生成新的长的dsRNA,新生dsRNA再进入下一个RNAi循环。有研究证明导入的双链RNA可诱导RNA干扰,其抑制效应可稳定存在5 d以上[31],与本实验干扰效果维持时间相符。在通过肽聚糖免疫后,再用siRNA注射到对虾体内,获得免疫保护率最高可达80%(表4),高于单注射肽聚糖(46.67%)和单注射siRNA(40%)的免疫保护率。说明一方面通过siRNA来干扰WSSV复制,导致WSSV不能大量繁殖;另一方面由于机体前期受肽聚糖免疫刺激后,免疫功能增强,把WSSV病毒颗粒快速消除,从而减少对虾在感染WSSV后死亡。但肽聚糖提取和siRNA制备费用昂贵,无法大量应用于对虾养殖,可为对虾抗病毒研究提供新的思路。
参考文献
[1]刘芳,杨跃寰.细菌细胞壁肽聚糖的研究[J].四川理工学院学报(自然科学版),2011,24(6):628-631.
[2]彭小云.脂多糖和枯草芽孢杆菌对草鱼免疫相关基因表达的影响[D].武汉:华中农业大学,2013.
[3]雷爱莹,江林源.蜈蚣藻多糖对凡纳滨对虾免疫相关基因表达的影响[J].南方农业学报,2014,45(4):682-686.
[4]陈国福,张春云,王光玉,等.A3_肽聚糖对凡纳对虾幼体生长及抗病毒感染力的影响[J].水产科学,2008,5(11):584-587.
[5]孟凡伦,马桂荣,孔健.乳链球菌SB900肽聚糖对中国对虾免疫功能的影响[J].山东大学学报(自然科学版):1999,34(1):90-95.
[6]王秀华,黄倢,宋晓玲.免疫增强剂——肽聚糖在对虾养殖中的应用[ J].海洋水产研究,2003,24(1):69-74.
[7]雷质文,黄倢,梁成珠,等.白斑综合症病毒的生物学活性[J].海洋科学,2002,26(3):26-31.
[8]ZHAN W B,WANG Y H,YU K K,et al.White spotsyndrome virus infection of cultured shrimp in China[J].J Aquat Anim Health,1998,10(4):40-410.
[9]MOMOYANA K,NAKANO H,KOUBE H.Mass mortalities of cultured Kuruma Shrimp,Penaeus japonicus,in Japan in 1993:epizootiological survey and infection trials[J].Fish Pathology,1994,29(2):135-139.
[10]国子娟.基于细胞培养筛选抗对虾白斑综合征病毒(WSSV)中草药及其实验效果评价[D].上海:上海海洋大学,2014.
[11]郭志勋,李卓佳,管淑玉.抗对虾白斑综合症病毒(WSSV)中草药的筛选及番石榴叶水提取物对WSSV致病性的影响[J].广东农业科学,2011,38(21):129-131.
[12]郝忱,万金娟,沈美芳,等.中草药添加剂对克氏原螯虾生长及免疫力的影响[J].江苏农业学报,2014,30(2):363-369.
[13]杨明.中草药制剂在凡纳滨对虾抗病性能中的应用研究[D].厦门:集美大学,2012.
[14]朱卫卫,邱德全,甘桢,等.溶藻弧菌肽聚糖对凡纳滨对虾白斑综合征病毒的抑制作用[J].广东海洋大学学报,2015,35(6):40-46.
[15]ITAMI T,ASANO M,TOKUSHIGE K,et al.Enhancement of disease resistance of kuruma shrimp,Penaeus japonicus after oral administ ration of peptidoglican derived from Bifidobacterium thermophilum [J].Aquaculture,1998,164(1/2/3/4):277-288.
[16]王秀华,黄倢,宋晓玲.免疫增强剂—肽聚糖在对虾养殖中的应用[J].海洋水产研究,2003,24(1):69-74.
[17]韦秀梅.抗对虾白斑症病毒(WSSV)囊膜蛋白VP28独特型单克隆抗体的研制与应用[D].山东:中国海洋大学,2010.
[18]施泓,阮灵伟.白斑综合症病毒囊膜蛋白VP28单链抗体的酵母表面展示及其抗病毒特性的初步研究[J].台湾海峡,2012,31(3):368-374.
[19]LI X A,LIU Q H,HOU L,et al.Effect of VP28 DNA vaccine on white spot syndrome virus in Litopenaeus vannamei[J].Aquaculture International,2010,18(6):1035-1044.
[20]ROBALINO J,BROWDY C L,PROIR S,et al.Induction of antiviral immunity by double-stranded RNA in a marine invertebrate[J].J Virol,2004,78(19):10442–10448.
[21]WESTENBERG M,HEINHUIS B,ZUIDEMA D,et al.siRNA injection induces sequence-independent protection in Penaeus monodon against white spot syndrome virus[J].Virus Res,2005,114(1/2):133–139.
[22]XU J Y,HAN F,ZHANG X.Silencing shrimp white spot syndrome virus(WSSV)genes by siRNA [J].Antiviral Res,2007,73(2):126–131.
[23]谢警鸿,邱德全,刘春晓,等.溶藻弧菌肽聚糖对凡纳滨对虾虾青素、免疫指标及保护率的影响[J].广东海洋大学学报,2013,33(1):50-55.
[24]刘春晓.溶藻弧菌肽聚糖对凡纳滨对虾常用免疫指标、脂肪酸含量及基因表达差异的影响[D].湛江:广东海洋大学,2014.
[25]李咏梅,黎铭,陈晓汉,等.RNA干扰南美白对虾白斑病毒vp28基因的体外研究[J].西南农业学报,2010,23(6):2083-2087.
[26]程晓燕,刘庆慧,黄倢,等.实时荧光定量PCR检测对虾白斑综合症病毒方法的建立[J].安徽农业科学,2010,38(26):14265-14267
[27]VAN HULTEN M C,WITTEVELDT J,SNIPPE M,et al.White spot syndrome virus envelope protein VP28 is involved in the systemic infection of shrimp[J].Virology,2001,285(2):228-2339.
[28]XU J Y,HAN F,ZHANG X B.Silencing shrimp white spot syndrome virus(WSSV)genes by siRNA[J].Antiviral Research,2007,73(2):126-131.
[29]ZHU F,ZHANG X B.The antiviral vp28-siRNA expressed in bacteria protects shrimp against white spot syndrome virus(WSSV)[J].Aquaculture,2011,319(3/4):311-314.
[30]黄添枝.RNA干扰在对虾抗病毒免疫中的作用[D].浙江:浙江大学,2013.
[31]TIU S H K,CHAN S M.The use of recombinant protein and RNA interference approaches to study the reproductive functions of a gonad-stimulating hormone from the shrimp Metapenaeus ensis[J].FEBS Journal,2007,274(17):4385-4395.
(责任编辑:刘庆颖)
Effects of Vibrio alginolyticus Peptidoglycn and vp28-siRNA on Litopenaeus vannamei Against White Spot Syndrome Virus
ZHU Wei-wei,QIU De-quan,GAN Zhen,LU Yi-shan,JIAN Ji-chang
(College of Fisheries,Guangdong Ocean University //Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals //Key Laboratory of Control for Disease of Aquatic Animals of Guangdong Higher Education Institutes,Zhanjiang 524025,China)
Abstract:Vp28-siRNA at the concentration of 0.05 and 0.10 μg/μL was injected into Litopenaeus vannamei suffered from White Spot Syndrome(WSS),respectively.The optimum concentration of vp28-siRNA was 0.10 μg/mL by interference effect experiment.L.vannamei was challenged with White Spot Syndrome Virus(WSSV),and was stimulated by vp28-siRNA at 24thday after infection.The effects of vp28-siRNA interference at different times were detected.The results showed that the experimental group had statistical differences from the control group(P < 0.05)at the 6th hour,and WSSV copy number had a rapid decline at 48th hour and the good interference replication of WSSV lasted until the 120th hour.The protection rate was 40%.L.vannamei immuned by peptidoglycan(0.1 μg/mL)was infected with WSSV.Then vp28-siRNA was injected at the differentbook=58,ebook=61times(6 h,12 h and 24 h)into the shrimps and the protection rate was measured.The results revealed that the protection rate of group 6 h,12 h and 24 h was 80%,63.33% and 56.67%,respectively.It is more effective to interfere with WSSV so that it can reduce shrimp mortality,after L.vannamei immuned with peptidoglycan and vp28-siRNA,and the earlier interference,the higher rate of protection.
中图分类号:S945.4+9
文献标志码:A
文章编号:1673-9159(2016)01-0057-06
通信作者:邱德全,男,教授,研究方向为水产经济动物免疫与病害控制。E-mail:qmsld@163.com
基金项目:广东省海洋渔业科技推广专项项目(A201100D03),广东省海洋经济创新发展区域示范专项项目(GD2012-A03-012),湛江市科技计划项目(2013A03021)
第一作者:朱卫卫(1986-),男,硕士研究生,研究方向为水产经济动物免疫与病害控制。E-mail:zhuweiwei320@163.com
收稿日期:2013-06-30
doi:10.3969/j.issn.1673-9159.2016.01.010
