西瓜糖含量相关性状的QTL分析
2016-04-06朱子成栾非时
程 瑶 刘 识 朱子成 栾非时
(东北农业大学园艺学院,农业部东北地区园艺作物生物学与种质创制重点实验室,黑龙江哈尔滨150030)
西瓜糖含量相关性状的QTL分析
程 瑶 刘 识 朱子成 栾非时*
(东北农业大学园艺学院,农业部东北地区园艺作物生物学与种质创制重点实验室,黑龙江哈尔滨150030)
摘 要:以高糖西瓜品系花园母本为母本、低糖西瓜品系LSW-177为父本配制杂交组合,构建含有125个单株的F2S7重组自交系群体(RILs),利用CAPS分子标记构建了1张包含245个CAPS标记、11个连锁群的遗传连锁图谱,该图谱覆盖基因组长度2 423.9cm,标记间的平均距离9.9cm。采用复合区间作图法对西瓜糖含量相关性状进行QTL分析,定位到与可溶性固形物相关的QTL 4个,表型贡献率分别为14.80%、11.50%、32.10%、8.60%;与果糖相关的QTL 3个,表型贡献率分别为8.80%、20.50%、9.50%;与蔗糖和葡萄糖相关的QTL各1个,表型贡献率分别为11.34%、24.10%。这9个QTL均表现为对糖含量的正加性效应,表明系高糖西瓜品系花园母本提供了对糖含量的贡献。
关键词:西瓜;CAPS;遗传连锁图谱;糖含量;QTL
程瑶,女,硕士研究生,专业方向:西瓜分子遗传育种,E-mail:chengyao504934423@163.com
西瓜(Citrullus lanatus)起源于非洲南部的干旱地区,是一种在世界范围内广泛种植的园艺作物(Hashizume et al.,2003)。西瓜糖含量是决定西瓜感官品质和商品价值的重要性状之一,西瓜果实中主要的可溶性糖是蔗糖、葡萄糖和果糖(张帆 等,2006)。农业部东北地区园艺作物生物学与种质创制重点实验室以高糖西瓜品系花园母本和低糖西瓜品系LSW-177为亲本材料,对西瓜果实可溶性糖含量的遗传规律和QTL定位分别进行了研究。栾非时等(2014)以6世代群体为材料研究了果糖、蔗糖和葡萄糖的遗传模型,结果表明,葡萄糖、果糖、蔗糖含量均为主基因+多基因的数量性状遗传模型。刘识等(2013)对F2群体的180个单株进行SSR标记,构建西瓜的遗传连锁图谱,对西瓜果实中心和边缘部分的3种可溶性糖以及总糖含量分别进行了QTL分析,由于所用标记较少,只检测到与中心和边缘总糖含量相关的QTL位点各1个,没有检测到与果糖、蔗糖、葡萄糖相关的QTL位点。国内外对于西瓜可溶性糖含量QTL定位的研究较少,Ren等(2014)利用整合的西瓜遗传连锁图谱对果实可溶性糖含量进行QTL分析,定位到5个与果糖相关的QTL,1个与葡萄糖相关的QTL,3个与蔗糖相关的QTL。
目前用于西瓜遗传连锁图谱构建和基因定位的分子标记主要有基于分子杂交的RFLP标记(Restriction Fragment Length Polymorphism)和基于PCR 扩增的 RAPD(Random Amplified Polymorphic DNA)、SSR(Simple Sequence Repeat)、AFLP(Amplified Fragment Length Polymorphism)、SRAP标记(Sequence Related Amplified Polymorphism)(Hashizume et al.,1996;易克 等,2003;Levi et al.,2006)。Levi 等(2006)指出,SSR和RAPD标记的多态性较低,AFLP多态性高但容易聚集在几个连锁群上,因此不能覆盖全基因组,且上述标记在染色体上的多态性是随机的。Levi等(2009)从100 条西瓜 EST(Expressed Sequenced Tag)单基因序列中开发出 40 对 SSR 引物,并对其可用性和多态性进行了验证和分析。随着高通量测序技术的发展,基因组测序为遗传标记的开发提供了新的思路和方法。Ren等(2012)基于97103和PI296341-FR 的基因组测序数据开发了大量的SSR、InDel(Insertion and Deletion)和SV(Structure Variation)标记。 SNP(Single Nucleotide Polymorphism)单核苷酸多态性指基因组DNA序列中由于单个核苷酸(A,T,C ,G)的替换而引起的多态性。1996年Lander第1次正式提出SNP为新一代分子标记,它具有共显性、稳定遗传、易于转化等优点(Esteras et al.,2012)。目前检测SNP常用的方法是DNA芯片技术,而利用全基因组测序结果挖掘SNP并将其转化为可开发的遗传标记的研究却鲜有报道。
本试验利用高通量测序技术对高糖西瓜品系花园母本和低糖西瓜品系LSW-177进行重测序,经过生物信息学分析,在基因组上寻找SNP位点,将其转化为CAPS标记,对重组自交系F2S7群体的125个单株进行标记,构建西瓜遗传连锁图谱。挖掘与可溶性固形物、果糖、蔗糖、葡萄糖相关的QTL位点,为西瓜糖含量的分子标记辅助选择育种提供理论依据。
1 材料与方法
1.1试验材料
母本材料是栽培西瓜品系花园母本,由东北农业大学园艺学院西甜瓜分子育种研究室提供,该品系可溶性固形物含量高(中心部位10.28%)、中熟(从授粉到瓜成熟35 d)。父本材料LSW-177来源于美国,由美国农业部农业研究署西南农业试验站Angela R.Davis博士提供,其特点是可溶性固形物含量低(中心部位8.59%)、中熟(从授粉到瓜成熟35 d)(Davis et al.,2008)。以花园母本和LSW-177配制杂交组合,获得F1,F1自交获得F2,其后代通过单粒传的形式连续自交获得由125个单株组成的 F2S7重组自交系群体(RILs)。
1.2田间试验
2014年4月将父母本、F1和F2S7125个单株种植于东北农业大学香坊农场的5号塑料大棚内,田间试验采用随机区组设计,亲本、F1及F2S7群体,每个株系每小区种植3株,3次重复,株距50cm,行距80cm。采用吊蔓栽培,双蔓整枝。自第2朵雌花开始授粉,为避免营养竞争,每株仅留1个瓜。授粉35 d后收获西瓜果实,果实纵切,用手持糖度计测量中心部位的可溶性固形物含量,可溶性固形物含量用Brix表示。称取中心部位的西瓜果肉5 g放于-80 ℃冰箱内备用。
1.3糖含量的测定
西瓜果肉可溶性糖含量的测定参照万学闪等(2009)的方法,略有改动。利用比色法,分别测量中心部位果糖、蔗糖和葡萄糖含量(张红 等,2009)。将5 g西瓜果肉用匀浆机破壁处理,加入10 mL 80%乙醇溶液,混匀后放于80 ℃水浴锅中浸提40 min,加入2 g活性炭脱色20 min,10 000 rpm离心30 min,吸取上清液,并将残渣重复上述操作,合并上清液,定容至25 mL待用。果糖和蔗糖含量采用蒽酮比色法测定,还原糖含量采用3,5-二硝基水杨酸比色法测定,用所得的还原糖数值减去果糖数值即为葡萄糖数值,设置3次重复,取平均值。试验过程中,吸光值的测定和标准曲线的绘制均用酶标仪完成。
1.4表型数据的统计分析
每个性状取其3次重复的平均值。使用Microsoft Excel 2003软件以及SPSS 19.0软件对试验数据进行统计与相关性分析。
1.5DNA的提取
出苗21 d后,取9株父母本、F1及RILs生长点部位的幼嫩真叶放入自封袋,标明株系号,采用改良的CTAB法提取基因组DNA(Murray & Thompson,1980)。
1.6CAPS标记的开发
本试验中用到的CAPS 标记是基于花园母本和LSW-177基因组重测序数据开发的,参考基因组数据以已经发布的西瓜基因组数据为准。用11种不同的限制性内切酶(EcoR Ⅰ,BsaH Ⅰ,Hind Ⅲ,Mbo Ⅱ,Pst I,Sca Ⅰ,BamH Ⅰ,Mlu Ⅰ,Asu Ⅱ,Dra Ⅰ 和Pvu Ⅰ)对序列进行酶切位点分析,在酶切位点上下游100~500 bp设计引物。每条染色体上平均设计40~70个CAPS引物,利用Primer Premier 6软件进行引物的设计。PCR体系参照盛云燕等(2006)的方法,扩增程序采用梯度PCR扩增:94 ℃预变性7 min;94 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,30个循环,每个循环降0.5℃;94 ℃变性20 s,45 ℃退火20 s,72 ℃延伸30 s;72 ℃终止延伸7 min。酶切体系为:1μL限制性内切酶缓冲液,0.5μL限制性内切酶(10 U·μL-1,THERMO),9μL超纯水,PCR扩增产物5μL,37 ℃水浴2 h。酶切产物用1%琼脂糖凝胶电泳检测。引物命名原则为WC+罗马数字+酶切位点所在染色体号+引物编号。
1.7遗传图谱的构建和QTL分析
利用 JoinMap 4.0软件对筛选出的分子标记进行分析并构建遗传图谱。 采用 Kosambi 函数计算图距,选择LOD值≥3.0,用Map命令构建连锁图谱。QTL分析使用Windows QTL Cartographer V 2.5软件。采用1 000 次重复置换测验,估算基因组范围内α= 0.05 水平上的 LOD阈值。以LOD值≥3.0为阈值。采用复合区间作图法(CIM),以 1.0cm步行速度在全基因组内进行扫描(Doerge & Churchill,1996)。QTL命名方式为性状英文缩写+连锁群号+ QTL 编号。使用MapChart 2.1软件绘制遗传连锁图谱,根据分子标记在染色体上的位置,依次将连锁群命名为LG1~LG11,对应染色体chr1~chr11。
2 结果与分析
2.1果实糖含量在亲本及RILs群体中的分布
西瓜果实糖含量在亲本和RILs群体中的表现列于表1,花园母本的可溶性固形物、果糖、蔗糖和葡萄糖含量均高于LSW-177。在RILs群体中,各性状均表现出明显的超亲分离,但总的趋势是介于两亲本之间,可溶性固形物、果糖、葡萄糖偏向于母本,蔗糖则明显偏向于父本。由图1可知,各性状在RILs群体中呈连续分布,峰度、偏度均小于1(表1),符合正态分布,属于数量性状,可以进行QTL分析。
2.2糖含量的相关性分析
由表2可知,可溶性固形物与果糖、蔗糖、葡萄糖均存在显著或极显著正相关,果糖与蔗糖和葡萄糖均存在极显著正相关,但蔗糖与葡萄糖存在极显著负相关。

图1 可溶性固形物、果糖、葡萄糖、蔗糖在RILs群体中的频率分布
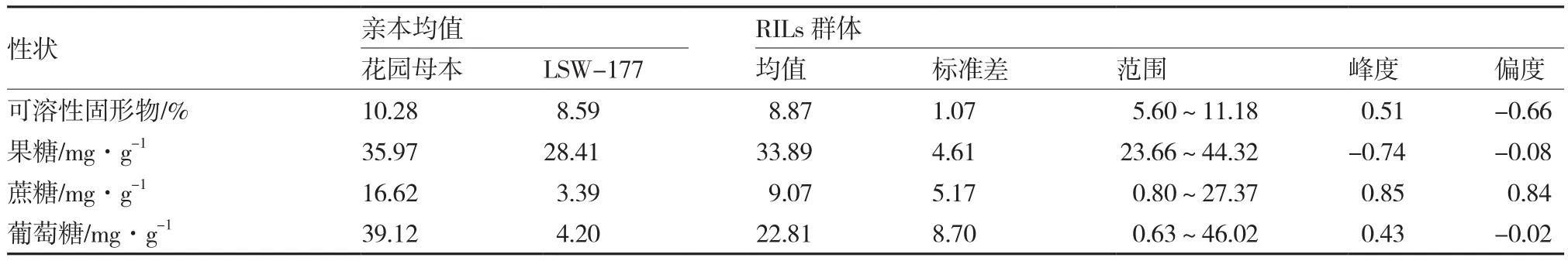
表1 西瓜果实糖含量在亲本及RILs群体中的分布

表2 可溶性固形物、果糖、蔗糖和葡萄糖的Pearson相关性分析
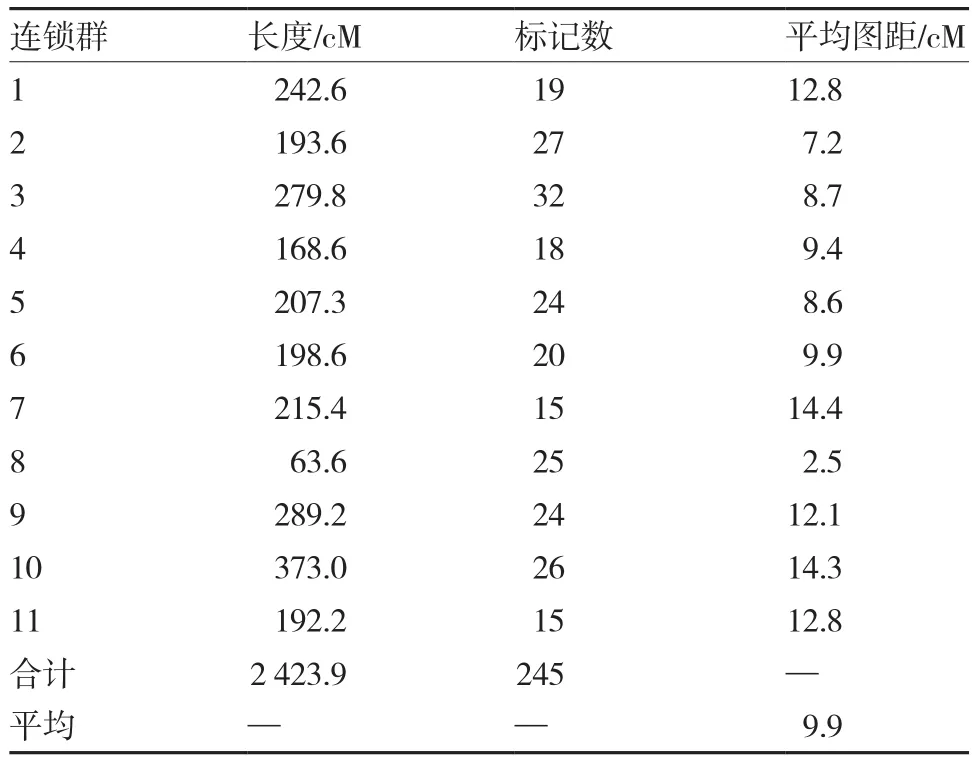
表3 CAPS标记在西瓜遗传图谱上的分布
2.3CAPS标记多态性和偏分离分析
共设计CAPS引物524对,筛选出在亲本间表现多态性的CAPS标记278个,多态率53.1%。在这278个标记中有58个标记表现出偏分离,占20.9%。其中有38个标记偏向于花园母本,占65.5%,20个标记偏向于父本,占34.5%。发生偏分离的标记有4个未归入任何连锁群,其他的54个标记分布在11个连锁群上,其中2号和11号连锁群居多,2号连锁群上有20个标记且全都偏向于母本,11号连锁群上有7个标记且全部偏向于父本。分布在1号连锁群上的偏分离标记3个,3号连锁群3个,4号连锁群3个,5号连锁群1个,6号连锁群4个,7号连锁群4个,8号连锁群2个,9号连锁群5个,10号连锁群2个。
2.4遗传连锁图谱构建
用278个表现多态性的CAPS标记对重组自交系的125个群体进行分析,LOD值≥3.0的图上标记有245个,分布在11个连锁群上,覆盖全基因组长度2 423.9cm,标记间的平均距离9.9cm,这11个连锁群长度范围在63.6~373.0cm之间,其中最小的连锁群是第8连锁群,最大的是第10连锁群,包含标记最多的是第3连锁群,含有32个标记(表3、图2)。
2.5糖含量QTL分析
利用Windows QTL Cartographer V 2.5复合区间作图法对重组自交系群体的果实糖含量进行QTL分析,共检测到与糖含量相关的QTL位点9个,结果如表4、图2所示。其中控制可溶性固形物的位点4个,据连锁群不同分别命名为BRX2-1、BRX2-2、BRX6-1 、BRX9-1;果糖含量的QTL3个,分别命名为Fru2-1、Fru6-1 、Fru7-1;蔗糖和葡萄糖的位点各1个,分别命名为Suc9-1、Glu6-1。这9个QTL对西瓜果实糖含量均表现为正的加性效应,表明系高糖西瓜品系花园母本对糖含量的贡献。
4个与可溶性固形物相关的QTL贡献率范围在8.60%~32.10%,累计贡献率为67.00%,其中BRX6-1贡献率为32.10%,大于15%,为主效QTL位点。BRX2-1、BRX9-1与相邻标记间的距离在3cm以内,BRX2-2与标记WCI02-28和WCI02-27的距离小于1cm,表明可溶性固形物与这2个标记紧密连锁。
与果糖相关的3个QTL分别定位在第2 、6、7连锁群上,累计贡献率38.80%,其中Fru6-1贡献率20.50%,为主效QTL位点。Fru2-1与标记WCI02-29、WCI02-28紧密连锁,Fru7-1与标记WCI07-26紧密连锁。
控制葡萄糖含量的位点Glu6-1分布在第6连锁群上,贡献率为 24.10%,LOD值6.3,为主效QTL位点。

图2 西瓜遗传连锁图谱及糖含量QTL位点左侧为遗传距离(cM),右侧为分子标记和QTL位点,BRX表示可溶性固形物,Fru表示果糖,Glu表示葡萄糖,Suc表示蔗糖。
与蔗糖相关的QTL定位在第9连锁群上,贡献率为 11.34%,与标记WCI09-36间的距离小于1cm,紧密连锁。
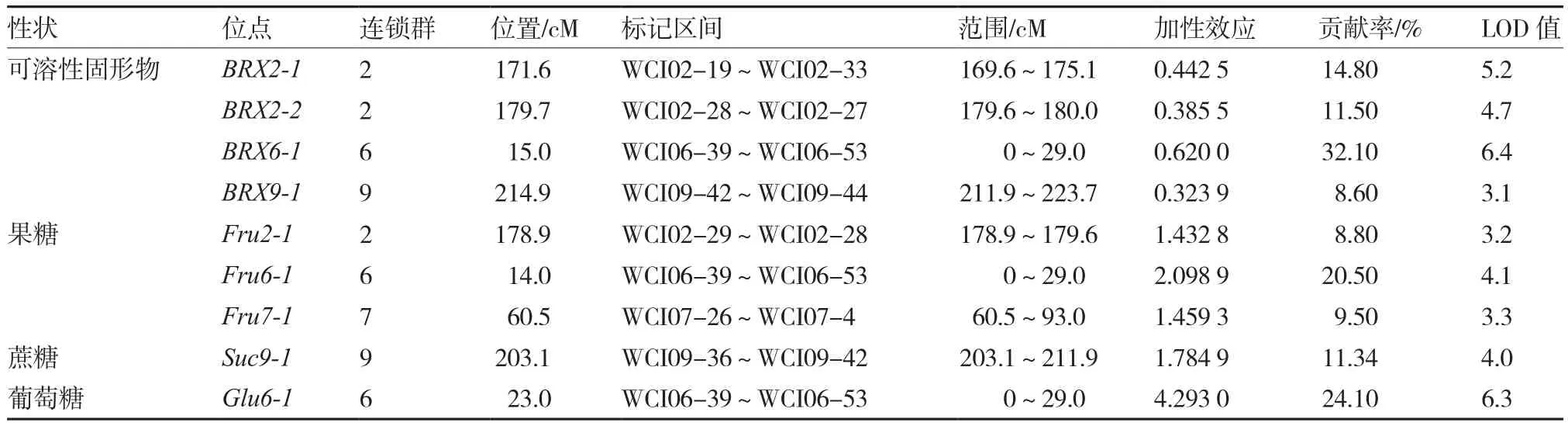
表4 西瓜果实糖含量QTL遗传效应分析
3 结论与讨论
3.1CAPS标记的开发和遗传图谱的构建
西瓜遗传距离狭窄,栽培品种间同工酶等生化标记和 RAPD 等分子标记的多态性十分有限(Zamir et al.,1984;Zhang & Rhodes,1993;Levi et al.,2001),西瓜全基因组测序的完成和高通量测序技术的发展为分子标记开发提供了新的思路与方法。本试验在西瓜基因组重测序基础上,发掘单个核苷酸突变位点,将其转化为CAPS标记,与SSR、AFLP、RAPD等标记相比,CAPS标记操作方便,结果稳定可靠,为共显性标记,重要的是引物与限制酶有多种组合,多态性高(王春明 等,2003)。
利用生物信息学软件对重测序的数据进行分析,共找到在亲本间有多态性的SNP位点352 483个,用11种不同的限制性内切酶分析,找到可以转化为CAPS标记的位点28 722个,如果增加限制性内切酶的种类和数量,可开发的CAPS标记的数量是巨大的。本试验共设计CAPS引物524对,筛选出在亲本间表现多态性的CAPS标记278个,多态率53.1%,而本实验室筛选的SSR标记多态性只有10.1%,这在刘识等(2013)的论文中已有报道。
重组自交系是将杂种后代经单粒传连续自交至完全纯合的一系列品系 ,由此构成的群体可以永久使用,该群体是构建遗传图谱和 QTL 定位的最佳材料(易克 等,2004)。本试验用RILs群体构建了1张以CAPS标记为主的遗传图谱,该图谱包含11个连锁群,覆盖全基因组长度2 423.9cm,标记间平均距离小于10cm,可以用作QTL分析。试验中采用的CAPS标记是在重测序的基础上开发的,标记在染色体上的位置是已知的,因此这11个连锁群可以和西瓜的11对染色体一一对应。图谱中最小的连锁群是第8连锁群,含有25个标记,长度只有63.6cm,Ren等(2014)在整合图谱时也发现第8连锁群最短,因此推断8号染色体可能是最小的染色体。由图2、表3中可以看出该图谱还不够密集,还需要进一步加密,为基因定位及分子标记辅助育种提供更多有价值的信息。
3.2标记的偏分离分析
偏分离是遗传作图研究中的一种普遍现象,是一种重要的进化动力,自交不亲和性和遗传搭车效应(hitchhiking)(即分子标记偏分离程度与影响等位基因频率的遗传因子连锁有关。在一些连锁群中存在着控制配子生活力和竞争力的座位,其结果是导致配子选择从而产生偏分离)是目前解释偏分离现象的两种观点(Xu et al.,1998)。一般而言,DH 群体和 RILs 群体偏分离的比率要高于F2群体。Levi 等(2006)在用一个测交群体〔Griffin14113(C.lanatus var.citrodie)×NHM(C.lanatus var.lanatus)〕×PI386015(C.colocynthis)构建的图谱中发现AFLP 标记与 RAPD、ISSR、SSR相比,表现出较高的偏分离比率。易克等(2004)在用重组自交系群体(PI296341×97103)构建图谱时,AFLP标记中有30%出现偏分离;28%的RAPD 和ISSR 标记表现出偏分离;而 SSR 标记的偏分离比率为 14.8%。本试验中278个CAPS标记的偏分离比率为20.9%,低于以上研究中AFLP、RAPD、ISSR的偏分离比率,高于SSR 标记的偏分离比率。虽然发生偏分离的标记在11个连锁群上均有分布,但2号连锁群上较多,27个标记中有20个标记发生了偏分离,发生偏分离的标记集中在标记WCI02-52和WCI02-38区域之间,且这些标记全都偏向于母本,推测该区域存在与糖含量相关的QTL位点。QTL分析结果证实了这一推测,在标记偏分离区域找到了3个与糖含量相关的QTL位点,且这3个位点均表现为母本基因型。
3.3果实糖含量的QTL 分析
国内外关于西瓜可溶性糖含量基因定位的报道很少,Ren等(2014)对已经发表的4个遗传连锁图谱进行整合时,除了对已经发表的与西瓜果实和种子相关的12个性状进行了重新定位,又加入了果实可溶性糖含量相关性状的QTL分析。定位到与可溶性固形物含量相关的位点4个,分别分布在2号(2个)、6号(1个)和8号(1个)连锁群上。本试验在2号连锁群上也定位到2个与可溶性固形物相关的QTL,在6号、9号连锁群上各定位到了1个,但并未在8号连锁群上定位到控制可溶性固形物含量的位点。Ren等(2014)定位到5个与果糖相关的QTL,分别位于2号(2个)、3号(1个)、6号(1个)、8号(1个)连锁群上,本试验定位到3个果糖的QTL,分别位于2、6、7号连锁群上,没有在3号和8号连锁群上找到位点。本试验只定位到了1个葡萄糖相关的QTL,位于6号连锁群上,结果与Ren等(2014)相同。Ren等(2014)定位到蔗糖相关的QTL 3个,分别分布在2号(2个)和5号(1个)连锁群上。本试验定位到1个蔗糖QTL,位于9号连锁群上。综合Ren等(2014)和本试验的研究结果可以推断,2号和6号连锁群上存在与糖含量相关的基因。
另外,在Ren等(2014)的试验和本试验中均发现QTL重合现象,在Ren等(2014)的研究中,2号连锁群上控制可溶性固形物的QTL与葡萄糖和蔗糖的QTL发生重合,6号连锁群上果糖与葡萄糖的QTL也存在同一定位,本试验中6号连锁群WCI06-39和WCI06-53标记之间可溶性固形物、果糖、葡萄糖之间存在同一定位。表明这4个性状之间确实存在极显著的相关关系。控制糖含量的许多 QTL 都在同一个连锁群上聚集,可能是基因连锁或多效基因的结果。果实糖含量是容易受环境因素影响的数量性状,本试验结果还需要进行多年多点的试验加以验证。
本试验利用花园母本×LSW-177杂交配制的含有125个单株的RILs群体,构建了1张CAPS遗传连锁图谱,该图谱包含245个CAPS标记,分布在11个连锁群上,覆盖基因组长度2 423.9cm,标记间的平均距离9.9cm,获得与果实糖含量相关的QTL位点9个,其中可溶性固形物相关的QTL 4个(BRX2-1、BRX2-2、BRX6-1 、BRX9-1),果糖3个(Fru2-1、Fru6-1 、Fru7-1)、蔗糖(Suc9-1)和葡萄糖(Glu6-1)各1个,这9个QTL对果实糖含量均表现为正的加性效应。
参考文献
刘识,王学征,栾非时,朱子成.2013.西瓜果实含糖量QTL分析.果树学报,30(1):75-80.
栾非时,王凤娇,高鹏,刘识,刘阳.2014.西瓜果实可溶性糖含量的遗传分析.东北农业大学学报,45(9):25-33.
盛云燕,栾非时,陈克农.2006.甜瓜SSR标记遗传多样性的研究.东北农业大学学报,37(2):165-170.
万学闪,刘文革,阎志红,赵胜杰,何楠,刘鹏.2009.无籽西瓜果实不同部位糖含量测定.中国瓜菜,28(5):10-14.
王春明,安井秀,吉村醇,苏昌潮,翟虎渠,万建民.2003.水稻叶蝉抗性基因回交转育和CAPS标记辅助选择.中国农业科学,36(3):237-241.
易克,徐向利,卢向阳,许勇,肖浪涛,王永健,康国斌.2003.利用 SSR和 ISSR 标记技术构建西瓜分子遗传图谱.湖南农业大学学报:自然科学版,29(4):333-347.
易克,许勇,卢向阳,肖浪涛,徐向利,宫国义,张海英.2004.西瓜重组自交系的AFLP分子图谱构建.园艺学报,31(1):53-58.
张帆,宫国义,王倩,何洪巨,许勇.2006.西瓜品质构成分析.果树学报,23(2):266-269.
张红,王怀松,贺超兴,张志斌,张显,伊鸿平,吴明珠.2009.甜瓜糖酸性状的遗传研究.园艺学报,36(7):989-996.
Davis A R,Perkins -Veazi P,Collins J,Levi A.2008.LSW-177 and LSW-194:Red-287 fleshed watermelon lines with low-total soluble solids.HortScience,43(2):538-539.
Doerge R W,Churchill G A.1996.Permutation tests for multiple loci affecting a quantitative character.Genetics,142(1):285-294.
Esteras C,Gomeez P,Monforte A,Blanca J,Vicente-Dolera N,Roig C,Nuez F,Pico B.2012.High-throughput SNP genotyping in Cucurbita pepo for map construction and quantitative trait loci mapping.BMC Genomics,13(1):80-101.
Hashizume T,Shimamoto I,Harushima Y,Yui M,Sato T,Imai T,Hirai M.1996.Construction of a linkage map for watermelon 〔Citrullus lanatus(Thunb.)Matsum & Nakai〕 using random amplified polymorphic DNA(RAPD).Euphytica,90:265-273.
Hashizume T,Shimamoto I,Hirai M.2003.Construction of a linkage map and QTL analysis of horticultural traits for watermelon 〔 Citrullus lanatus(Thunb.)Matsum & Nakai〕 using RAPD,RFLP and ISSR markers.Theoretical and Applied Genetics,106:779-785.
Levi A,Thomas C E,Wehner T C,Zhang X P.2001.Low genetic diversity indicates the need to broaden the genetic base of cultivated watermelon.HortScience,36:1096-1101.
Levi A,Thomas C,Trebitsh T,Salman A,King J,Karalius J,Newman M,Reddy O.2006.An extended linkage map for watermelon based on SRAP,AFLP,SSR,ISSR,and RAPD markers.Journal of the American Society for Horticultural Science,131:393-402.
Levil A,Wechter P,Davis A.2009.EST-PCR markers representing watermelon fruit genes are polymorphic among watermelon heirloom cultivars sharing a narrow genetic base.Plant Genetic Resources,7:16-32.
Murray M,Thompson W F.1980.Rapid isolation of high molecular weight plant DNA.Nucleic acids research,8:4321-4326.
Ren Y,Zhao H,Kou Q,Jiang J,Guo S,Zhang H,Hou W,Zou X,Sun H,Gong G,Levi A,Xu Y.2012.A high resolution genetic map anchoring scaffolds of the sequenced watermelon genome.PLoS one,7(1):e29453.
Ren Y,Gregor C,Zhang Y,Gong G,Zhang H,Guo S,Xu Y.2014.An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon(Citrullus lanatus).BMC Plant Biology,14(4):33-43.
Xu Y,Zhu L,Xiao J.1998.Chromosomal regions associated with segregation distortion of molecular markers in F2,backcross,doubled haploid,and recombinant inbred populations in rice(Oryza sativa L.).Molecular and General Genetics,253:535-545.
Zamir D,Navot N,Rudich J.1984.Enzyme polymorphism in Citrulllus and C.Colocythis in Israel and Sinai.Plant Systematics and Evolution,146:163-170.
Zhang X P,Rhodes B B.1993.RAPD molecular marker in watermelon.HortScience,28(5):583-597.
QTL Analysis for Sugar Content Related Traits in Watermelon
CHENG Yao,LIU Shi, ZHU Zi-cheng, LUAN Fei-shi*
〔Horticulture College, Northeast Agricultural University,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(Northeast region), Ministry of Agriculture, Harbin 150030,Heilongjiang,China〕
Abstract:A recombinant inbred lines(RILs)of 125 F2S7progenies were derived from the cross, a watermelon line ‘Huayuanmuben’ with high sugar content as female parent, and a watermelon line ‘LSW-177’ with low sugar content as male parent.A genetic linkage map was constructed by using cleavage amplified polymorphic sequence(CAPS)markers.The map contained 245 CAPS markers and grouped into 11 linkage groups,spanning a total length of 2 423.9cm, with an average gap of 9.9cm between each marker.A quantitative trait locus(QTL)analysis was conducted by using composite interval mapping method(CIM)to locate fruit sugar content locus.A total of 4 QTLs related to soluble solids content were identified, showing 14.80%, 11.50%,32.10% and 8.60% phenotypic variances, respectively.3 QTLs related to fruit fructose content were identified,showing 8.80%,20.50% and 9.50% phenotypic variances, respectively.One QTL related to fruit sucrose and 1 QTL related to glucose content were identified, showing 11.34% and 24.10% phenotypic variances, respectively.These 9 QTLs showed a positive additive effect for sugar content means cultivar ‘Huayuanmuben’ contributed the favorable alleles.
Key words:Watermelon;CAPS;Genetic linkage map;Sugar content;QTL
基金项目:农业部“948”计划项目(2014-S15),国家西甜瓜产业技术体系-分子育种岗位项目(CARS-26-02)
收稿日期:2015-02-06;接受日期:2015-04-07
*通讯作者(
Corresponding author):栾非时,女,教授,博士生导师,专业方向:西甜瓜分子遗传育种,E-mail:luanfeishi@sina.com
