秋葵降糖颗粒质量标准研究
2016-04-06何振洋胡冬华
何振洋 胡冬华
长春中医药大学,吉林 长春 130117
秋葵降糖颗粒质量标准研究
何振洋胡冬华
长春中医药大学,吉林长春130117
【摘要】目的:对秋葵降糖颗粒质量标准进行研究。方法:采用薄层色谱法对秋葵降糖颗粒进行定性鉴别,采用紫外可见分光光度法对秋葵降糖颗粒中总黄酮进行含量测定。结果:通过定性鉴别,秋葵总黄酮可以鉴别出来。秋葵总黄酮线性范围为8~48mg/L,平均回收率是98.57%,RSD为0.52% 。结论:该方法可行,重现性比较好,能有效地控制秋葵降糖颗粒的质量。
【关键词】秋葵降糖颗粒;秋葵总黄酮;质量标准
秋葵为锦葵科秋葵属植物AbelmoschusesculentusL.Moench[1],又名黄秋葵、羊角豆、咖啡黄葵、黄蜀葵,民间俗称“洋辣椒”。原产于非洲,20世纪初从印度传入中国,目前多见于中国南方。果荚常见绿色和红色两种,口感脆嫩,滑而不腻,有独特香味,种子可以榨油[2]。药用部位为黄葵的根、叶、花、果实或种子,其味淡,性寒,具有利咽、通淋、下乳、调经之功效。民间用于治疗糖尿病、咽喉肿痛、便涩淋症、养胃护肝、预防癌症。秋葵[3]中黄酮含量为2.8%,不仅具有防治糖尿病的功效,还具有抗氧化、防衰老的作用。另外,秋葵中含有丰富的维生素和矿物质,富含的锌和硒等微量元素对增强人体免疫抗癌能力有很大作用;黏多糖可以增强机体抵抗力,维持人体关节腔里关节膜和浆膜的光滑效果,削减脂类物质在动脉管壁上的堆积,而且可以避免肝脏和肾脏中结缔组织萎缩[3]。秋葵降糖颗粒是以秋葵茎、叶为药材基源,利用现代化中药制剂方法精制而成,实验依法对秋葵降糖颗粒的质量标准进行研究。
1仪器与材料
1.1仪器751GD紫外可见分光光度计(上海光学仪器公司);赛多利斯QUINTIX224-1CN电子天平(上海天普分析仪器有限公司)
1.2材料芦丁对照品(批号:101180-201401,中国药品生物制品检定所);秋葵对照药材(批号: SH298869,亳州市康美药材交易中心);秋葵降糖颗粒(批号:20140114、20140115、20140116、20140117、20140118、20140119、20140120、20140121、20140122、20140123);所用试剂均为分析纯。
2方法与结果
2.1总黄酮定性鉴别
2.1.1供试品溶液的制备秋葵降糖颗粒10g,加甲醇30ml,超声处理25min,过滤,将滤液挥去;加15ml水溶解烧杯中的残渣[4];加正丁醇充分振摇并提取3次,每次用量30ml,合并三次的正丁醇溶液,挥干溶剂后,在残渣中加入1.5ml甲醇,溶解后即得供试品溶液。
2.1.2对照品溶液的制备精密称取4g秋葵对照药材,研碎,加入30ml甲醇;搅拌后,对其进行25min的超声处理;过滤所得溶液并将滤液挥去[5];在残渣中加入15ml水,充分搅拌至溶解,加正丁醇充分振摇并提取3次,每次正丁醇用量为30ml,合并三次的正丁醇溶液,挥干溶剂,在残渣中加入1.5ml甲醇,溶解后即得对照品溶液。
2.1.3阴性对照溶液的制备在制剂过程中,采用的辅料是赤藓糖醇,利用上述同样的方法,将赤藓糖醇配制成实验所需的阴性对照溶液[6]。
2.1.4芦丁标准溶液的制备称取0.6g芦丁对照品,按照秋葵降糖颗粒供试品处理方法,制备得到芦丁标准对照溶液。
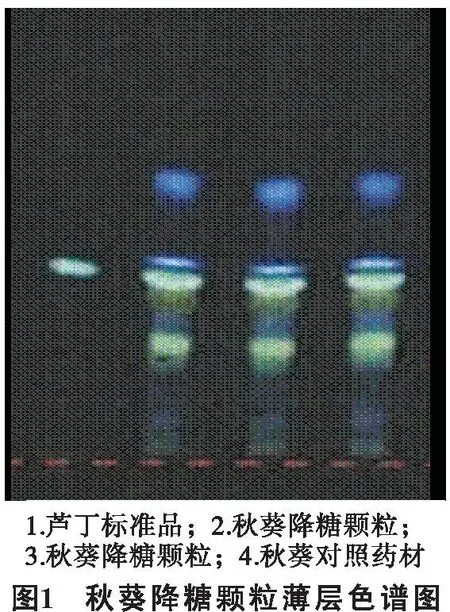
2.1.5薄层色谱将上述溶液点在同一薄层板上;将正丁醇,冰醋酸和水按照5∶1∶6的比例混溶,取上层溶液作为展开剂,在紫外光365nm下检视。结果见图1,说明了定性实验结果与理论分析一致。
2.2样品含量测定
2.2.1配制标准溶液105℃干燥芦丁标准品;精密称取2.5mg芦丁标准品,加入5ml甲醇溶解并转移至10ml量瓶中,超纯水稀释至刻度,充分振摇,即得0.25mg/ml标准溶液。
2.2.2配制供试品溶液精密称取1.25g秋葵降糖颗粒样品,加入25ml水,搅拌直到全部溶解;用聚酰胺柱进行分离总黄酮;用80ml水做洗脱液,洗脱至滤液无色;然后用乙醇100ml分三次洗脱;收集洗脱液,挥干溶剂;加入适量水,搅拌溶解剩余物后,转移至容量瓶中(100ml);继续加水稀释,至容量刻度线;从所得溶液中精密移取1ml,转移至容量瓶中(100ml)。用水稀释定容,即得供试品溶液。
2.2.3检测波长选定取1ml对照品溶液,甲醇为空白溶液,将二者分别放入751GD紫外可见分光光度计中,在410~710nm[7-9]范围内进行波长扫描范围,结果显示,最大吸收波长为510nm。
2.3方法学考察项
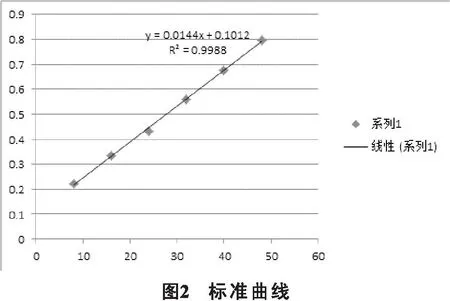
2.3.1线性关系的考察精密吸取0.33、0.66、0.99、1.32、1.65和1.98ml标准溶液(0.25mg/ml),转移至10ml的容量瓶中,加一定量超纯水使之均达到2.5ml; 然后精密移取5%亚硝酸钠溶液0.5ml加入到所得溶液里,充分振摇,静置8min;精取12%硝酸铝溶液0.5ml,加入,振摇均匀,同样静置8min;然后精取4.5ml 4.2%氢氧化钠溶液,用水稀释定容,摇匀;将所得溶液全部放置15min,浓度分别为8.25、16.50、24.75、33.00、41.25和49.50mg/L的标准溶液;各自移取标准溶液1.0ml进行吸光度检测[10-12];绘制标准曲线,Y轴是吸光度,X轴是浓度,绘制的标准曲线,得到线性回归方程:Y= 0.0144x+0.1012,R2=0.9988。结果表明:在8~48mg/L的浓度范围内,标准溶液浓度与吸光度呈线性关系。见表2、图2。
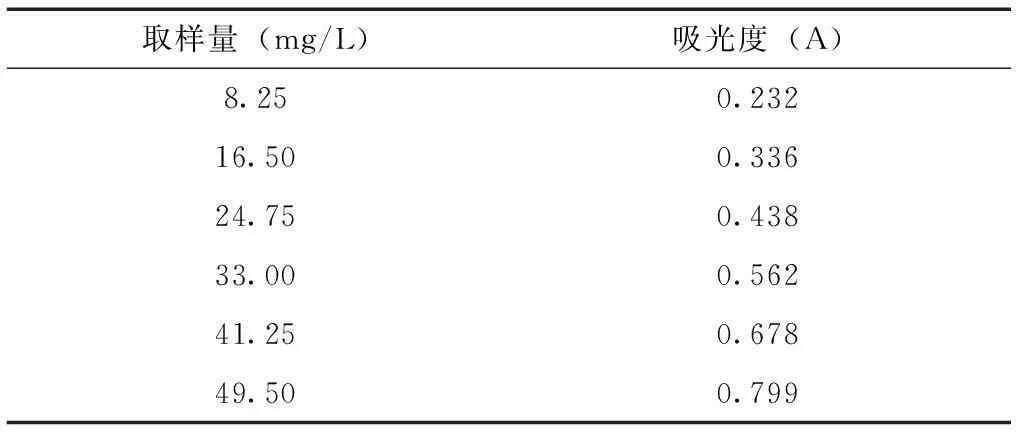
表2 线性关系考察
2.3.2稳定性试验对上述标准品溶液和供试品溶液各精密移取1ml[13-14],按照上述线性考察方法进行处理,依法在波长510nm处进行可见光检测,每25min对二者进行检测吸光度。
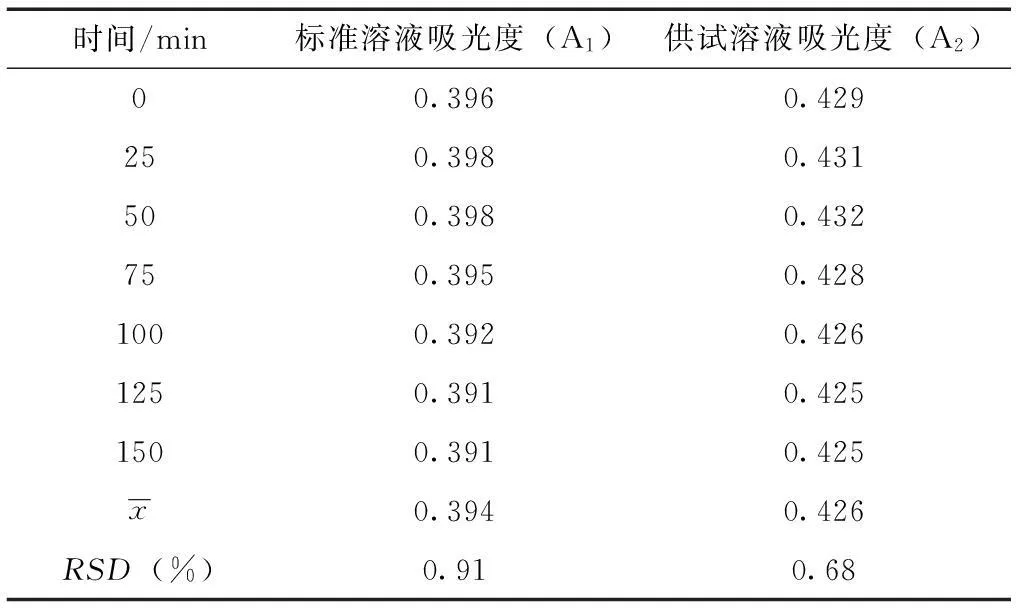
表3 稳定性试验结果
由表3可知,供试品溶液和对照品溶液在150min内的吸光度测定结果的RSD(%)分别为0.91%、0.68%。说明供试品溶液在150min内有良好的稳定性。
2.3.3精密度试验精密吸取标准溶液、样品溶液各1ml,同样的方法处理,在波长510nm处进行紫外-可见分光光度检测[15],分别检测6次,作好记录,进行精密度考察。
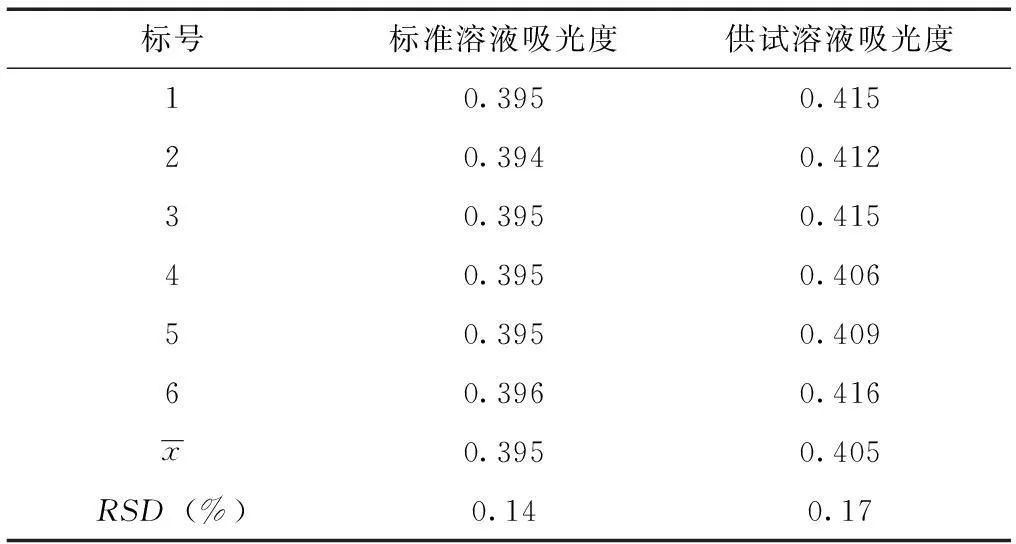
表4 精密度试验结果
由表4可知,经过连续6次精密测定对照品溶液和供试品溶液的吸光度值,二者检测结果的RSD(%)分别为0.14%和0.17%。说明该方法的精密度良好。
2.3.4重现性试验对同一批秋葵降糖颗粒样品,精密称取6份,定量为0.2500g,平行配制六份样品溶液,与上述标准溶液配制方法相同;显色后,在510nm处分别进行紫外-可见分光光度检测,记录下各自的吸光度值;同时计算样品中秋葵总黄酮的含量,从而进行重现性考察[16]。结果重现性试验的平均含量为60.17%,RSD(%)为0.85%,说明了该方法的重现性良好。见表5。
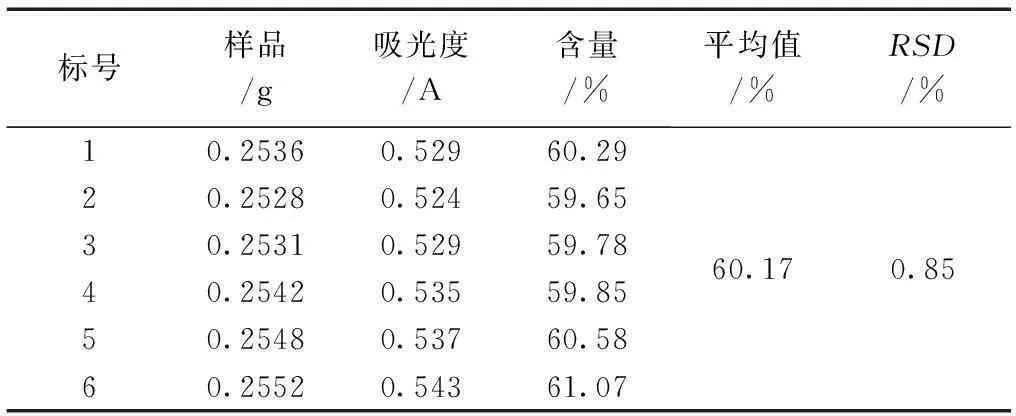
表5 重现性试验结果
2.3.5加样回收率试验取已知含量的供试品,精密称取6份,定量为0.6000g;随后分别精密加入相同的芦丁对照品,定量为361.0mg;依法对其进行显色,在510nm处分别检测其吸光度。结果加样回收率试验的平均回收率是98.54%,RSD为0.53%,说明该实验方法的准确性良好。见表6。
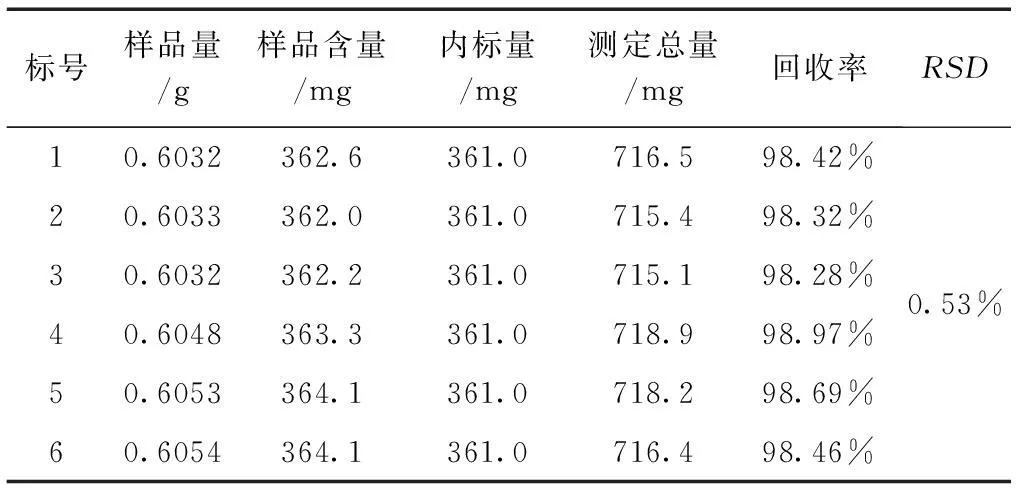
表6 回收率试验结果
2.4含量测定按照上述供试品溶液配制方法,将十批秋葵降糖颗粒样品配制成样品溶液,每批平行两份;在这同一批次的两份中,各自精取1ml,并且依法显色,测定吸光度,检测波长是510nm。结果见表1。
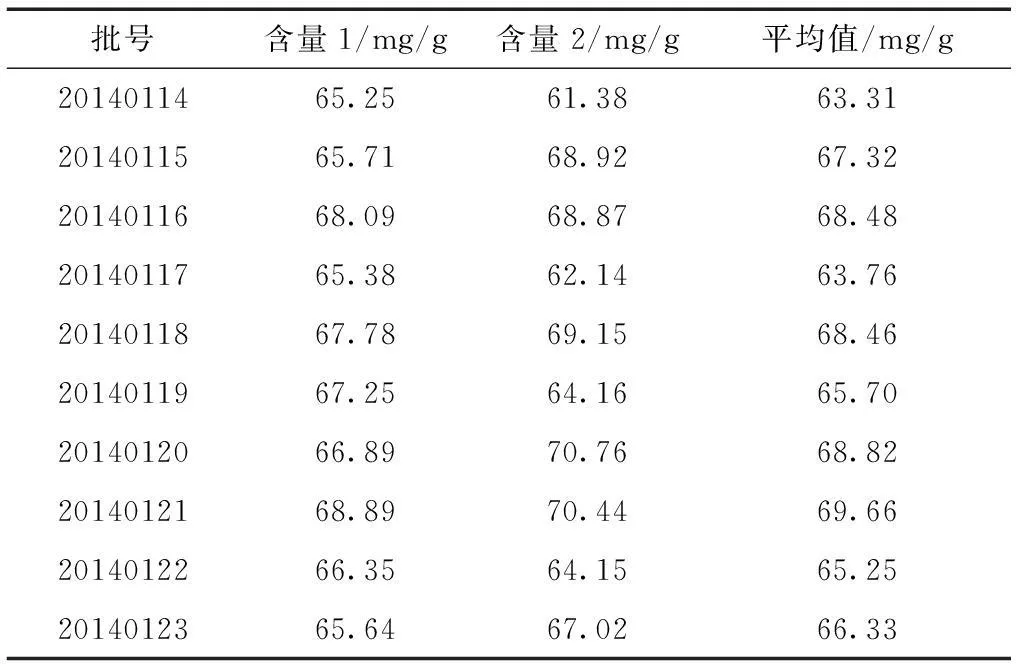
表1 样品含量测定
3讨论
3.1在定性鉴别过程中,对秋葵降糖颗粒采用的是超声提取法,对过滤所得溶液进行挥干,用超纯水溶解残渣,再次用正丁醇提取两次,合并提取液并挥干溶剂,加甲醇使所得残渣溶解,即得实验所需供试品溶液。经过系列实验表明:该方法不仅具有良好的定性鉴别结果,还具有很高的实验效率。
3.2含量测定过程中,分离纯化秋葵总黄酮是比较关键的一步,研究采用的是聚酰胺柱层析分离法。先用水洗脱,然后用乙醇洗脱,并对收集的洗脱液进行快速挥干。进一步的研究表明:该分离纯化方法能有效地分离出秋葵总黄酮。
3.3经过方法学考察,在8~48mg/L的浓度范围内,标准溶液浓度与吸光度呈线性关系。秋葵降糖颗粒中的总黄酮成分在150min内表现出良好的稳定性,并且,该实验方法的精密度、重现性和准确性良好,能有效地控制秋葵降糖颗粒的质量。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010.
[2]董彩文,梁少华. 黄秋葵的功能特性及综合开发利用[J].食品研究与开发,2007,28(5):180-182.
[3]单承莺,马世宏,张卫民. 保健蔬菜黄秋葵的应用价值与前景[J].中国野生植物资源,2012,31(2):68-71.
[4]张德权,台建祥,付勤. 生物类黄酮的研究及应用概况[J].食品与发酵工业,1999,25(6):52-57.
[5]宋秋华,张磊,梁飞.黄酮类化合物的提取工艺研究进展[J].山西化工,2007,27(4):24-27.
[6]方晴霞,金戈.黄秋葵中总黄酮含量的测定[J].医药导报,2004,23(9):675-676.
[7]李建华,陈珊. 黄秋葵水提液抗疲劳的药效学观察[J].中国运动医学杂志,2004,23(2):196-197.
[8]周兰香,黄阿根,谢凯舟. 化学分光光度与HPLC法测定荷叶总黄酮的研究[J].中草药,2002,33(1):35-37.
[9]吴燕春,谢金鲜. 黄秋葵的研究进展[J].中医药学刊,2005,23(10):1898-1899.
[10]黄泉秀. 比色法测定黄蜀葵花中黄酮类化合物的含量[J].中药材,1990,13(12):36-37.
[11]张思娟. 锦葵科植物化学成分研究概况[J].华西药学杂志,1992,7(2):104-105.
[12]吴琼诗. 芨藜全草中总黄酮的含量测定[J].广东药学院学报,1998,14(4):273-275.
[13]杨丽霞,姜良恩,王志程,等. 中草药黄酮类化合物防治糖尿病肾病的实验研究进展[J].中国实验方剂学杂志,2015,5(3):230-234.
[14]WU A M,JIANG Y J,H WANG P Y. Characterization of the okra mucilage by interaction with Gal,GalNAc and GlcNAc specific lectins[J].Biochimica et Biophysica Acta,1995,43(2):157-160.
[15 ]Savello PA,Martin FW,Hili J M. Nutritional Composition of Okra Seed Meal[J].Journal of Agricultural and Food Chemistry,2013(7):1163.
[16]Thanakosai W.,Phuwapraisirisan P. First identification of α-glucosidase inhibitors from okra (Abelmoschus esculentus) seeds[J]. Natural product communications. 2013,8(8):1085-1088.
Study on the Quality Standard for Okra Hypoglycemic Granules
HE ZhenyangHU Donghua
Changchun University Of Chinese Medicine,Changchun 130117,China
Abstract:Objective To study the quality standard for Okra hypoglycemic granules. Methods Okra hypoglycemic granules were identified by TLC and Okra total flavonoids were determined by UV-Vis spec-trophotometry. Results Okra total flavonoids were well identified through qualitative identification.The methodological study showed that content of total flavonoids of Okra hypoglycemic granule was higher. The linear relationship was in the range of 8~48mg/L,the average of the recovery was 98.57%,RSD(%) was 0.52%.Conclusion This method was available with a good reproducibility and it can control the quality of Okra hypoglycemic granules effectively.
Key words:Okra Hypoglycemic Granules;Okra Total Flavonoids;Quality Standard
(收稿日期:2015.12.25)
【中图分类号】R284.1
【文献标志码】A
【文章编号】1007-8517(2016)04-0031-03
