氯及其化合物知识在高考中的考查
2016-04-05湖北罗功举
湖北 罗功举
氯及其化合物知识在高考中的考查
湖北 罗功举
氯是考纲中定义的重要常见非金属元素,事实上,氯及其化合物知识确实也是历年高考命题的重要切入点,值得关注。下面以2015年高考题为例,将氯及化合物的常考方式归类分析如下,供复习参考。
一、考情分析
考纲要求:①了解氯单质及其重要化合物的主要性质及应用;②掌握Cl2的实验室制法;③了解氯单质及其重要化合物对环境质量的影响。
考情分析:从历年高考考查情况来看,主要考点包括以下几类:一是考查氯及其化合物的组成、结构、性质、用途等;二是融合基本概念和基本理论,考查知识的综合运用能力;三是从实验角度考查氯及其化合物的制备,考查微粒鉴别、化学实验基础知识和基本技能、实验设计等;四是联系实际,以现代生产、日常生活、科学技术等为背景,考查学科内知识的融合、渗透,检测综合应用水平。预测2017年高考中,氯及其化合物知识仍将是高考考查的重要物质,以其为载体可以元素化合物基础知识,可以综合考查基本概念和基本理论,或与生产、生活、科技、实验、计算等相联系,考查知识的综合应用能力。
二、知识体系
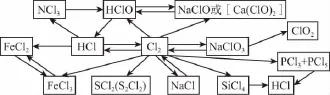
三、命题分析
(1)考查氯及化合物组成结构 一般的,这类问题主要涉及原子的组成微粒、物质的结构(如各原子的连接顺序、化学键情况等)分析,多以化学用语形式进行考查。
例1 (2015江苏)下列有关氯元素及其化合物的表示正确的是( )

D.氯乙烯分子的结构简式:H3C—CH2Cl
点评 用化学用语表示氯的某些化合物的结构时,有些经典的易错情形要引起注意,如书写次氯酸的结构式或电子式、氯化钙的电子式等,要通过理解或反复记忆来减少出错。
(2)考查氯及化合物的性质 这类问题多涉及氯及化合物的化学性质,如氧化性或还原性、与酸或碱反应、漂白性等,分析时要厘清物质的具体性质。
例2 (2015安徽)下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A.该溶液中,H+、NH、SO、Br-可以大量共存
B.该溶液中,Ag+、K+、NO、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1mol Cl2,转移电子约为6.02×1023个
分析:A项中,H+、ClO-、Cl-不能大量共存,错误;B项中,Ag+、Cl-不能大量共存,错误;C项中,NaClO水解,使该混合溶液呈碱性,故其离子方程式中不能出现H+,该反应过程为6Fe2++3ClO-+3H2O2Fe(OH)3↓+3Cl-+4Fe3+;D项中,发生反应:2H++ClO-+Cl-Cl2↑+H2O,每产生1mol Cl2,转移1mol电子,正确。答案为D。
点评 氯及化合物中,有些物质的性质具有多重性,如氯水、次氯酸盐等,分析具体问题时,要抓准考查对象与物质性质间的联系,以免张冠李戴。
(3)考查氯及化合物的有关反应式 常见问题包括化学反应方程式书写、氧化还原反应方程式分析、离子方程式书写或正误判断等,答题时,要注意细节要求。
例3 (2015北京)某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-Cl-+ClO-+H2O B.该消毒液的pH约为12:ClO-+H2OHClO+OHC.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-HClO+CH3COO-
分析:A项,Cl2和NaOH反应的化学方程式为Cl2+2NaOHNaCl+NaClO+H2O,正确;B项,饱和NaClO溶液的pH约为11,现混合溶液的pH约为12,说明含有一定量的NaOH使溶液碱性增强,错误;C项,消毒液与洁厕灵混用会发生氧化还原反应,方程式为NaClO+2HClNaCl+Cl2↑+H2O,正确;D项,醋酸的酸性强于HClO,根据强酸制弱酸的原理,该反应可以发生,正确。答案为B。
点评 氯是一种变价元素,氯及化合物的有关反应常常涉及氧化还原反应知识,分析问题时,要根据反应规律准确推断反应产物中氯元素的存在形式,再书写或判断。
(4)考查氯及化合物的转化关系 元素及化合物间的转化关系既是学习的重点,也常常是考查的重点。一要注意物质间的转化规律,二要把握转化条件,对信息问题更要重视此点。
例4 (2015广东)用O2将HCl转化为Cl2,可提高效益,减少污染。

(1)传统上该转化通过如上图所示的催化剂循环实现,其中,反应①为2HCl(g)+CuO(s)H2O(g)+CuCl2(s)
ΔH1,反应②生成1mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________________(反应热用ΔH1和ΔH2表示)。

(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线如图,则总反应的ΔH________(填“>”“=”或“<”)0;A、B两点的平衡常数K(A)与K(B)中较大的是________。
②在上述实验中若压缩体积使压强增大,画出相应αHCl-T曲线的示意图,并简要说明理由:_________________。
③下列措施中有利于提高αHCl-T的有_____________。
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程汇总n(Cl2)的数据如下:

_______t/mol __ __0 1.8 3.7 5.4 7.2 min 0 2.0 4.0 6.0 8.0n(Cl2)/10-3
计算2.0~6.0min以内HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出Cl2制备漂白粉的化学方程式:_____________________。
分析:本题以HCl转化为Cl2的反应问题为切入点,考查热化学方程式书写、反应速率计算、化学平衡问题、化学方程式书写等,综合性较强。
(1)根据图示可知反应②的热化学方程式为CuCl2(s)+1/2O2(gCuO(s)+Cl2(g) ΔH2,由盖斯定律,2①+2②,即得4HCl(g)+O2(g2Cl2(g)+2H2O(g) ΔH=2ΔH1+2ΔH2。
(2)①观察图象可知,随着温度的升高,总反应的HCl平衡转化率逐渐减小,说明该反应的正反应为放热反应,即ΔH<0。A点对应温度较低,平衡逆向移动程度较B点小,故平衡常数较大的是K(A)。
②此问考查压强和温度共同对化学平衡的影响。随着压强的增大,平衡向气体体积减小的方向移动,αHCl增大;而随着温度的升高,平衡向逆反应方向移动,αHCl减小。如图。

理由:增大压强,平衡向气体分子数减少的方向移动,即平衡正向移动,αHCl增大
③增加另一种反应物的浓度、减少生成物的浓度(如及时移出生成物)都可以提高反应物的转化率。答案:BD。
(3)根据题意可知:v(HCl)=Δn/Δt=(5.4×10-3mol-1.8×10-3mol)/4min=9.0×10-4mol·min-1。
(4)制备漂白粉是将氯气通入消石灰中制取的,反应方程式为2Ca(OH)2+2Cl2CaCl2+Ca(ClO)2+2H2O。
点评 分析元素及化合物间转化的综合性问题时,可将大题化小,分解为不同知识点类的问题,然后分别用对应知识来解答,最后整合。
(5)考查氯及化合物的有关实验 这类问题常常涉及物质的制备、微粒的鉴别、实验设计与探究、物质性质验证、实验基本操作、定量计算等,是综合性很强的必考题型。
例5(2015新课标Ⅱ)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
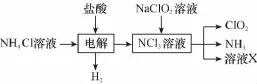
①电解时发生反应的化学方程式为______________________________________________________。
②溶液X中大量存在的阴离子有________。
③除去ClO2中的NH3可选用的试剂是_____________(填标号)。
a.水b.碱石灰
c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
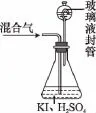
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;

①锥形瓶内ClO2与碘化钾反应的离子方程式为________________________。
②玻璃液封装置的作用是_______________。
③Ⅴ中加入的指示剂通常为___________,滴定至终点的现象是______________。
④测得混合气中ClO2的质量为__________g。
(4)O2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是________(填标号)。
a.明矾 b.碘化钾
c.盐酸 d.硫酸亚铁
分析:(1)反应中,氯酸钾中氯元素从+5价降低到+4价,得到1个电子,是氧化剂;亚硫酸钠中硫元素从+4价升高到+6价,失去2个电子,是还原剂,根据电子得失守恒可知该反应中氧化剂和还原剂的物质的量之比为2∶1。
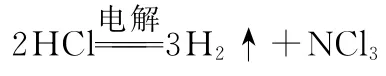
②反应中有氨气生成,所以存在OH-;根据氯元素守恒可知,溶液中还应该存在大量的Cl-。答案为OH-、Cl-。
③ClO2易溶于水,能与碱反应,所以除去ClO2中的NH3可选用的试剂是浓硫酸。答案为c。
(3)①ClO2具有强氧化性,则锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I-+8H+2Cl-+5I2+4H2O。
②由于二氧化氯是气体,容易挥发到空气中,所以玻璃液封装置的作用是吸收残余的二氧化氯气体(避免碘逸出)。
③由于碘遇淀粉显蓝色,则Ⅴ中加入的指示剂通常为淀粉溶液;滴定至终点的现象是溶液由蓝色变为无色,且半分钟内溶液颜色不再改变。
④根据方程式可知,2ClO2~5I2~10S2O,则测得混合气中ClO2的质量为0.1mol/L×0.02L×67.5g/mol÷5=0.027 00g。
(4)亚氯酸盐具有氧化性,因此,若要除去超标的亚氯酸盐,最适宜的是硫酸亚铁,因为氧化产物Fe3+能净水。
点评 处理实验问题时,一要把握实验原理(反应式、流程图、装置图),二要弄清实验目的,然后结合原理和目的来分析实验操作细节。
除上述一些类型的问题外,氯及其化合物的计算(如浓度计算、化学方程式计算等)、用途、涉及氯及其化合物的学科内综合问题(如氯碱工业、氧化还原反应)等也在近几年的高考中多次呈现。因此,复习中既要重视基础知识的梳理,也要研究热点题型,以提高学习水平和高考适应能力。
(作者单位:湖北省枝江一中)
