五维透视命题“宠儿”
——铁及其化合物
2016-04-05山东
山东 孙 晶
五维透视命题“宠儿”
——铁及其化合物
山东 孙 晶
一、把握一个整体框架

二、掌握Fe2+与Fe3+的鉴别
(1)直接观察颜色:
Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
(2)利用显色反应:
Fe2+的溶液+KSCN或NH4SCN溶液,溶液不呈红色;Fe3+的溶液+KSCN或NH4SCN溶液,溶液呈血红色。
有关离子方程式:
Fe3++SCN-[Fe(SCN)]2+
(3)利用铁化合物沉淀的颜色:
Fe2+的溶液+NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色;Fe3+的溶液+NaOH溶液,出现红褐色沉淀。
有关反应式:

(4)利用Fe3+的氧化性:
①Fe2+的溶液+Cu片,无明显现象;Fe3+的溶液+Cu片,铜被腐蚀,溶液变为蓝绿色。
有关离子方程式

②Fe2+的溶液+淀粉-KI试纸,试纸不变蓝;Fe3+的溶液+淀粉-KI试纸,试纸变蓝。
有关离子方程式:

(5)利用Fe2+的还原性:
①Fe2+的溶液+酸性KMnO4溶液,KMnO4溶液紫色褪去;Fe3+的溶液+酸性KMnO4溶液,KMnO4溶液紫色不褪。
②Fe2+的溶液+氯水,溶液变为棕黄色;Fe3+的溶液+氯水,无明显现象。
有关离子反应式:

注意:以上方法以KSCN溶液鉴别最常用。
三、明晰铁的三种氧化物

_________ ______FeO Fe2O3Fe3O4____________俗名—铁红______ ____磁性氧化铁__色态__ ____黑色粉末____ ___红棕色粉末黑色晶体水溶性_ ______难溶难溶难溶化合价_ _______+2+3+2、+3_____ FeO+CO △Fe2O3+3CO △Fe3O4+4CO △与CO、H2反应Fe+CO22Fe+3CO23Fe+4CO2FeO+H2 △Fe2O3+3H2 △Fe3O4+4H2 △Fe+H2O 2Fe+3H2O 3Fe+4H2O 4 4与稀硫酸反应FeO+H2SO 4 Fe3O4+4H2SO Fe2(SO4)3+3H2O Fe2O3+3H2SO FeSO4+H2O Fe2(SO4)3+FeSO4+4H2O
四、澄清铁及其化合物的四个易错点
1.Fe与O2、H2O(g)反应的产物都是Fe3O4而不是Fe2O3。Fe与Cl2反应时生成FeCl3,与S反应时生成FeS,说明Cl2的氧化能力大于S的。常温下,Fe、Al在冷的浓硫酸和浓硝酸中发生钝化,但加热后继续反应。Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3。
2.生成FeCl2除了用Fe和HCl的置换反应外,还可用化合反应:2FeCl3+Fe3FeCl2;生成Fe(OH)3除了用Fe3+与碱的复分解反应外,还可用化合反应:4Fe(OH)2+O2+2H2O4Fe(OH)3。
3.配制FeCl2溶液既要防氧化(加入Fe粉),又要抑制水解(加入盐酸);配制FeCl3溶液要加入浓盐酸抑制水解。
4.铁与稀硝酸反应产物分析:
铁与稀硝酸反应产物有两个特征反应:硝酸充分过量时为Fe+4HNO3(稀Fe(NO3)3+NO↑+2H2O(铁少量),此时n(Fe)∶n(HNO3)=1∶4;铁充分过量时为3Fe+4HNO3(稀)3Fe(NO3)2+2NO↑+4H2O,此时n(Fe)∶n(HNO3)=3∶8。很明显,当n(Fe)∶n(HNO3)≤1∶4时,只发生前一个反应,生成的盐只有Fe(NO3)3;当n(Fe)∶n(HNO3)≥3∶8时,只发生后一个反应,生成的盐只有Fe(NO3)2;当3∶8>n(Fe)∶n(HNO3)>1∶4时,可生成两种盐。
五、解读铁的五种经典题型
题型1 铁及其化合物的性质转化
【例1】A、B、C是中学化学中常见的三种元素的单质。A、B、C及其他物质反应的关系如下图示,其中B、D、E溶液呈酸性,又知常温下B为气态:

请回答:
(1)A、B、C三种单质分别是:A:_______,B:_______,C:_______。
(2)B与C反应生成E时的可能反应现象是_________。
(3)写出下列反应的离子方程式:
F+B→D_________________。
D+C→E+F_________________。
(4)E溶液显酸性的离子方程式:__________________。
【解析】由B的状态知B为非金属单质,B的溶液呈酸性,故B为氯气;D、E溶液为酸性,A、C可能是金属,A能从E中置换出C,A比C活泼;D与单质C反应生成两种生成含C的物质及含A的物质F,说明A具有变价,故A为铁、C为铜;D、E显酸性是因为金属离子发生水解反应。
【答案】(1)Fe Cl2Cu
(2)产生产生棕黄色的烟
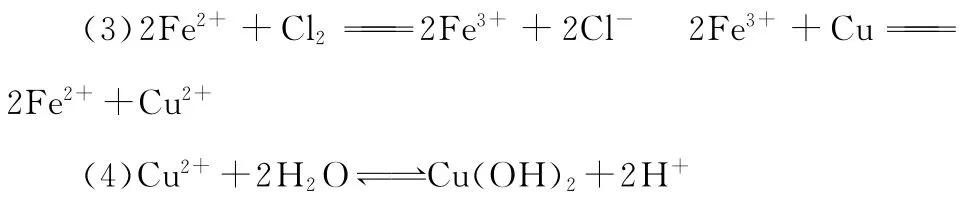
解法指南:本题表面看是推断题,但因题中没有任何特征性质的信息,解答中主要是利用物质间的转化关系进行分析,从结果上看,主要涉及了铁单质(铜单质)的性质,较具特征的反应是D(盐)+C(单质)→E(盐)+F(盐),符合此反应的主要是铁盐与单质铜的反应。
题型2 铁盐与亚铁盐的检验
【例2】为证明氢氧化铁胶体中存在氯化铁,某学习小组的几位同学分别提出了如下几种方案(方案中均是首先取一定量的胶体,放入适当的仪器中)。请对相应的方案做出评价,若不妥,请指出原因。
方案1:加KSCN显红色说明有FeCl3。
________________________________________________。
方案2:加AgNO3溶液形成白色沉淀证明有FeCl3。
__________________________________________________。
方案3:先将半透膜袋放在盛有蒸馏水的烧杯中,一段时间后取出烧杯中的水放入两支试管中,向一支中加入酸性AgNO3溶液,产生白色沉淀,向另一支中加入KSCN得到红色溶液,说明有FeCl3。
__________________________________________________。
方案4:先将半透膜袋放在流动的蒸馏水中,经过相当时间后从半透膜袋放内取出适量的液体放入两支试管中,向一支中加入酸性AgNO3溶液,产生白色沉淀,向另一支中加入KSCN得到红色溶液,说明有FeCl3。
__________________________________________________。
【解析】方案1不妥,一是因为该胶体本身是红褐色,二是可能导致胶体聚沉而影响检验结果。
方案2一是只能说明含有Cl-,二是可能导致胶体聚沉而影响检验结果。
方案3可行,因为通过渗析将胶体中的FeCl3转移到蒸馏水中。
方案4不妥,因为通过较长时间的渗析,胶体中可能存在的FeCl3已全部转入蒸馏水中。
【答案】见解析
解法指南:检验试剂直接加入到电解质中,会导致胶体聚沉;检验中应先用渗析法将相应的离子分离出来。
题型3 有关铁反应的计算
【例3】向含4mol HNO3的稀溶液中,逐渐加入Fe粉至过量(假设生成的气体只有一种),在此过程中n(Fe2+)随n(Fe)变化关系如图所示。下列有关说法正确的是( )

A.图中a=1、b=1.5
B.该过程中产生的气体是NO2
C.当加入Fe粉1.2mol时,溶液中n(Fe2+)=0.4mol
D.若向加入过量Fe粉充分反应后的滤液中加入稀盐酸后可继续溶解Cu
【解析】A项,稀硝酸与铁反应时,硝酸被还原为NO,因此向稀硝酸溶液中加入铁粉,依次发生反应为Fe+4HNO3Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe3Fe(NO3)2,结合题中硝酸的量可知a=1.5、b=1;B项,由反应方程式可知,该过程产生的气体为NO;C项,由反应方程式可知,当加入铁粉大于1mol时开始生成Fe2+,再结合2Fe(NO3)3+Fe3Fe(NO3)2可知,当加入1.2mol Fe时,0.4mol Fe3+转化为Fe2+,故溶液中n(Fe2+)=0.6mol;D项,滤液为Fe(NO3)2,向该溶液中加入HCl后,H+、NO、Fe2+发生氧化还原反应生成Fe3+,因此,加入盐酸后溶液可继续溶解铜。
【答案】D
解法指南:该题主要涉及稀硝酸与铁反应时,铁的用量的不同导致产物价态的差异;同时注意H+与NO-3的组合能够把Fe2+氧化成Fe3+。
题型4 考查铁的框图推断
【例4】A、B、C、D、E是中学化学中常见的几种单质,其中A、D是金属,B、C、E常温下是气体;甲、乙、丙、丁、戊为化合物,其中乙在常温下是无色无味的液体。它们之间有如下图所示的转化关系(有些产物已略去):

(1)写出下列反应的化学方程式:
A+乙:_________________,甲+D:_________________。
(2)D与烧碱反应的离子方程式是_________________。
(3)戊→丁的离子方程式是________________________。
【解析】从乙的状态与性质看,乙极可能是H2O,单质气体只有H2、O2、N2、Cl2、F2,B、C、E分别是谁需要结合框图进一步推断。从框图中特殊的反应条件“点燃”(一般有O2)、“高温”“电解”等信息,可推断置换反应“D+甲→A+丙”必为铝热反应。综合分析,不难推出:A为Fe,B为O2,C为H2,D为Al,E为Cl2,甲为Fe3O4,乙为H2O,丙为Al2O3,丁为FeCl3,戊为FeCl2。

解法指南:物质推断的关键在于找出突破口,特殊的现象、反应条件、状态、颜色均可成为解题的突破口。一般说来,无色无味的液体是水,点燃时有氧气(少数情况下也可以是Cl2)。
题型5 铁的实验设计
【例5】某化学研究性学习小组讨论Fe3+与SO之间发生怎样的反应,提出了如下几种可能:
可能一:发生氧化还原反应2Fe3++SO+H2O2Fe2++SO+2H+。
可能二:发生互促水解反应2Fe3++3SO+6H2O2Fe(OH)3(胶体)+3H2SO3。
可能三:以上两种同时发生。
为证明发生的是哪种反应,小组内的同学经讨论设计并实施了下列实验
实验Ⅰ 同学们选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是_____________________。
实验Ⅱ 取5mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液由黄色变为红棕色,无气泡及沉淀生成,继续滴加Na2SO3浓溶液至过量,溶液颜色加深,最终变成红褐色。这种红褐色液体是________,向红褐色液体中逐滴加入稀盐酸至过量,可观察到的现象是______ __________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。由上述实验得出的结论是_________________ _____________________________________________________。
实验Ⅲ 若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体。从形式上看,Na2CO3与Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与FeCl3溶液反应的现象差别很大,分析其可能的原因是①_____________________;②_____________________。
【解析】由于实验Ⅰ中只用了Na2SO3浓溶液、BaCl2稀溶液、稀盐酸三种试剂,而前两种能反应生成沉淀,盐酸又能溶解生成的沉淀,故这是用来检验Na2SO3是否变质或混有Na2SO4。实验Ⅱ中,因无沉淀及气体生成且溶液颜色由黄色变成红褐色,说明发生了双水解反应,得到了Fe(OH)3胶体,加入盐酸后胶体先聚沉后溶解同时导致SO2气体放出;加BaCl2有沉淀生成,说明溶液有SO被氧化为SO2-4。
【答案】实验Ⅰ:检验Na2SO3是否变质或混有Na2SO4,排除可能存在的SO的干扰
实验Ⅱ:Fe(OH)3胶体 先产生红褐色沉淀,后逐渐溶解得到黄色溶液并产生气泡 SO与Fe3+混合后同时发生互促水解反应与氧化还原反应
解法指南:实验问题涉及的知识往往是实验目的与原理、主要仪器及主要操作、实验现象及现象分析、结论或理论解释,其中实验目的与原理是核心,分析中必须首先抓住这一点。
知识回扣:
铁盐性质具有多样性:①铁盐具有较强的氧化性,能氧化“铁前”的金属单质、位于其后面的Cu及H2S、S2-、SO、SO2、I-等;②铁盐具有较强的水解性能,将饱和FeCl3溶液滴入到沸水中,则可得到红褐色的胶体:Fe3++3H2OFe(OH)3(胶体)+3H+;③当铁盐溶液与可溶性碳酸盐、可溶性酸式碳酸盐时,因发生互促水解反应而产生红褐色沉淀:2Fe3++3CO23-+3H2O2Fe(OH)3↓+3CO2↑;④铁盐遇可溶性碱溶液会产生红褐色沉淀:Fe3++3OH-Fe(OH)3↓;⑤遇KSCN或NH4SCN溶液则会由黄色变成红色;⑥遇苯酚溶液则会变成绿色溶液。
【查漏补缺训练】
1.要证明某溶液中不含Fe3+而可能含有Fe2+,进行以下实验操作时的最佳顺序为( )
①通入足量的Cl2
②加入足量的KMnO4溶液
③加入少量KSCN
A.①③B.③②
C.③①D.①②③
2.已知FeS2与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1∶8,则该反应的还原产物是( )
A.NO2B.NO
C.N2O D.NH4NO3
3.在如图所示元素Fe单质及其化合物变化中,下列说法正确的是( )

A.③反应的离子方程式为2Fe2++Cl22Fe3++2Cl-
B.钢铁腐蚀时,负极发生的反应:Fe-3e-Fe3+
C.以Fe为阳极,电解饱和NaCl溶液,阳极反应式:2Cl--2e-Cl2↑
D.FeCl2溶液中混有少量FeCl3,可以加入Cu除去FeCl3
【参考答案及解题提示】
1.C
2.B 提示:设参加反应的FeS2为1mol,HNO3为8mol,还原产物中N元素化合价为x,FeS2中Fe显+2价,S显-1价,反应后生成1mol Fe(NO3)3,由N元素守恒知做氧化剂的HNO3为8mol-3mol=5mol,即还原产物中N为5mol,由得失电子守恒知1+7×2=5×(5-x),解得x=2,所以还原产物是NO,B项正确。
3.A 提示:B项,钢铁腐蚀时,负极发生的电极反应是Fe-2e-Fe2+,错误;C项,以铁为阳极,电解NaCl溶液时,因铁为活性阳极,首先溶解,即阳极电极:Fe-2e-Fe2+,错误;D项,因铜和FeCl3溶液反应生成FeCl2,同时生成CuCl2杂质,错误。
(作者单位:山东省日照市莒县第四中学)
