物质结构和元素周期律的考查分类
2016-04-05湖北
湖北 宁 鹏
物质结构和元素周期律的考查分类
湖北 宁 鹏
纵观近几年全国各地高考试题,物质结构和元素周期律知识是Ⅰ卷的必考内容,部分高考试题的Ⅱ卷中还出现了推断题。除了考查学生对基本概念的辨析和理解外,通常还以元素推断为载体,重点考查学生对元素周期表、元素周期律以及元素化合物和化学反应原理的应用,试题的综合性很强,也有一定的深度和难度。本文结合考纲,分析高考真题,对物质结构和元素周期律的高考考点和考查形式进行分类例析,梳理教材知识,希望能在高考复习备考中帮助同学们拓展思维视角,更深刻地理解、掌握和应用物质结构和元素周期律知识,提高分析问题和解决问题的能力。
一、考查元素、核素和同位素等基本概念
【例1】(2014上海,1)“玉兔”号月球车用23984Pu作为热源材料,下列关于Pu的说法正确的是( )
【答案】D
【点评】考纲要求“了解元素、核素和同位素的含义”。本题源于教材中“核素”知识及其拓展,对元素、核素、同位素和同素异形体的概念进行考查,是教材知识的重组,难度较小。从命题角度上看,原子结构常以最新的科技成果、新闻事件为背景来考查以同位素为核心的概念辨析。复习时应重视对上述有关概念的理解和应用。
二、考查原子的构成及其微粒间的数量关系
【例2】(2015上海,1)中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于Lv的叙述错误的是( )
A.原子序数116
B.中子数177
C.核外电子数116
D.相对原子质量293
【答案】D
【点评】考纲要求“了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系”。本题源于教材中“原子核及原子符号”知识,对原子的构成及其微粒间的数量关系、质量数和相对原子质量的概念辨析进行考查,是教材知识的再现,难度较小。从命题角度上看,原子结构还常以原子符号X为切入点,考查元素原子符号的含义,核素中各微粒间的数量关系。解答这类题目的关键是:理解粒子符号Xb±的含义及各微粒间的数量关系。
三、考查原子核外电子排布
【例3】下列说法正确的是( )

B.(2015上海)原子核外电子排布可决定元素在周期表中的位置
C.(2014山东)核外电子排布相同的微粒化学性质也相同
【解析】A项,Cl-的最外层为8个电子,错误;B项,原子核外电子层数等于元素所在周期数,原子的各电子层容纳的电子数可决定元素所处的族的序数,故原子核外电子排布可决定元素在周期表中的位置,正确;C项,核外电子排布相同的微粒可以是原子或离子,例如:Ne、O2-两种微粒核外电子排布相同,但是它们的化学性质不同,错误;D项,3517Cl与3717Cl属于同位素,其核外电子排布相同,得电子能力相同,正确。
【答案】BD
【点评】考纲要求“了解原子核外电子排布”。本题源于教材“原子核外电子排布”知识,主要考查原子(或离子)的结构示意图、核外电子排布与周期表和元素性质的关系,是教材知识的拓展。从命题角度上看,此类题通常将核素符号、结构简式等化学用语与原子(或离子)的结构示意图、核外电子排布知识进行简单拼盘考查,难度较小。复习时应注意有关基础知识的积累和应用。
四、考查同周期、同主族元素性质的递变规律与原子结构的关系
【例4】(2014福建,23节选)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
【解析】同一主族元素的非金属性越强,其单质的氧化性越强,其氢化物的稳定性越强,与物质的熔点、氢化物水溶液的酸性无关,故选项bc正确。
【答案】bc
【点评】考纲要求“以第3周期、ⅠA族和ⅦA族为例,掌握同一周期、同一主族内元素性质递变规律与原子结构的关系;了解金属、非金属在元素周期表中的位置及其性质递变的规律”。本题源于教材中“元素的性质与原子结构”和“科学探究”的知识及其拓展,是考纲与教材知识综合考查的完美体现。从命题角度上看,此类题主要考查粒子半径大小比较、元素的金属性或非金属性强弱的判断及其应用,这也是高考考查的重点和高频考点,复习时一定要加强针对此考点的落实训练。
五、以元素推断为载体,综合考查元素周期表和元素周期律的应用
【试题特点】试题中提供某些推断元素的典型“题眼”,借助推断出的元素综合考查“物质结构和元素周期律”的应用,此类试题符合考纲中“考查学生接受、吸收、整合化学信息的能力,通过运用相关知识,分析问题和解决(解答)化学问题的能力”的要求,试题的综合性较强,一般为中等难度。
1.以元素电子层结构特点为“题眼”进行推断考查
【例5】(2015新课标Ⅰ,12)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
【解析】由于均为短周期主族元素,W的L层无电子,则W是H元素;X的L层有5个电子,则X是N元素,Y与Z的L层都是8个电子,则二者都是第三周期元素。根据最外层电子数之和为18可知,Y与Z的最外层电子数之和为12,Z的原子序数大于Y,所以Y是P,Z是Cl元素。结合元素周期律及元素性质判断各选项即可。
【答案】B
【点评】本题是以元素电子层结构特点为“题眼”的元素推断题,考查元素非金属性强弱的判断与应用、无机物结构与性质的判断。题中选项C的设置有一定的迷惑性,这就要求平时应养成细心审题的好习惯。解答此类题的关键是利用原子核外电子排布知识准确推断元素,再应用元素周期律进行判断解答。
2.以元素在周期表中的位置与原子序数的关系为“题眼”进行推断考查
【例6】(2015山东,8)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )

A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
【解析】设元素Y的原子序数为y,则由各元素在周期表中的相对位置可知,Z的原子序数为y+1,W的原子序数为y+10,则y+y+10=3(y+1),解得y=7,故X、Y、Z、W分别为Si、N、O、Cl元素。结合元素周期律及元素性质判断各选项即可。
【答案】C
【点评】考纲要求“了解元素周期表(长式)的结构(周期、族)及其应用”。元素周期表能够反映原子的位置和结构,是推断元素的突破口,高考考查中往往不是呈现完整的周期表,而是呈现某一片段,本题即是根据片段结构所提供的信息进行推断,考查学生应用元素周期表和元素周期律分析、解决问题的能力,难度中等。解答此类题的关键是:充分利用元素周期表的片段及位置与原子序数的关系推断元素。有些元素推断题,是以文字叙述来呈现信息的,解答时可根据文字信息先转化成周期表片段的形式,则能很直观地进行判断、分析、比较,得出正确答案。
3.以元素及其化合物的特性为“题眼”进行推断考查
【例7】(2015江苏,5)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
【解析】Y是非金属性最强的元素,则为F,以此为突破口,结合题中其他信息可以此推断出,X为O,Z为Al,W为Si。结合元素周期律及元素性质判断各选项即可。
【答案】A
【点评】考纲要求“掌握元素周期律的实质”。本题主要借助物质的特性考查元素的推断,进而考查“元素周期律”及元素性质知识。涉及元素非金属性强弱的比较、半径大小比较、气态氢化物稳定性比较等,难度不大。对于有特征性质的元素推断题,解答的关键是要善于归纳总结并熟记元素及其化合物特殊的性质,可先根据所给的特性确定元素,然后再结合其他条件,各个击破,推出结论。
4.以元素“位、构、性”三者间的关系为“题眼”进行推断考查
【例8】(2013山东,8)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )

A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
【解析】由题中提供的W的性质可推断出W为N元素,结合元素在周期表中的相对位置可知,X、Y、Z分别为O、S、Cl。之后,结合元素周期律及元素性质判断各选项即可。
【答案】A
【点评】元素在周期表中的位置反映了元素的原子结构和主要性质,元素的原子结构决定了元素在周期表中的位置和主要性质。本题是以元素在周期表中的位置和元素性质为“题眼”的元素推断题,是元素“位、构、性”三者关系的综合考查,全面考查学生对元素进行分析、推理的能力,以及运用元素周期律解决化学问题的能力。此类题也是高考考查的重点和高频考点,中等难度。在复习中一定要梳理好元素“位、构、性”三者的关系,稳打基础,系统整合元素推断的突破口。
六、考查电子式、化学键与物质类别的关系
【例9】下列说法正确的是( )
A.(2015新课标Ⅱ)60g丙醇中存在的共价键总数为10NA
C.(2014江苏)氧元素分别与镁、硅形成的化合物中化学键类型相同
【解析】A项,60g丙醇的物质的量是1mol,分子中存在的共价键总数为11NA,错误;B项,观察结构可知分子中含有碳碳双键,属于非极性键,错误;C项,MgO中含离子键,SiO2中含共价键,错误;D项,氯分子的电子式书写正确。
【答案】D
【点评】考纲中要求“了解化学键的定义,了解离子键、共价键的形成”。本高考题组源于教材中“化学键”知识,是教材知识的重组,考查知识点较多,难度不大。化学键试题的特点是概念性强,设问隐蔽,规范性程度要求较高,高考一般穿插在综合试题中进行拼盘考查。复习时要注意离子键和共价键、离子化合物和共价化合物的判断,化学键与分子间作用力的区别,了解氢键对物质的熔点、沸点和密度的影响,掌握常见微粒(如:N2、CO2、H2O2、Na2O2、OH-、NH等)的电子式的书写。
七、考查物质结构、元素周期律与元素化合物性质、化学反应原理的综合应用
【例10】(2015天津,7节选)随原子序数递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
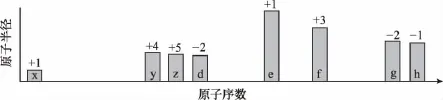
根据判断出的元素回答下列问题:
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:_____ ___________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是________。
②写出m点反应的离子方程式:_________________。
③若在R溶液中改加20mL 1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
【解析】根据图中八种短周期元素原子半径的相对大小、最高正价或最低负价的变化和元素周期律知识,推断出x、y、z、d、e、f、g、h分别为H、C、N、O、Na、Al、S、Cl元素。
(4)考查与化学反应原理的综合应用。1mol Na的单质在足量O2中燃烧,放出255.5kJ热量,则该反应的热化学方程式为2Na(s)+O2(g)Na2O2(s) ΔH=-511kJ·mol-1。
(5)考查与元素化合物性质相结合的综合应用。①R是NH4Al(SO4)2,因为NH3·H2O的碱性比Al(OH)3强,故Al3+的水解程度比NH大,且溶液显酸性,故离子浓度:c(SO)>c(NH)>c(Al3+)>c(H+)>c(OH-);②由图象知,向NH4Al(SO4)2溶液中滴加NaOH溶液,先生成沉淀:Al3++3OH-Al(OH)3↓,之后发生反应:NH+OH-NH3·H2O,最后是沉淀溶解:Al(OH)3+OH-AlO+2H2O,故m点反应的离子方程式为NH+OH-NH3·H2O;③NH4Al(SO4)2溶液中n(Al3+)=0.01mol,n(NH)=0.01mol,n(SO)=0.02mol,Ba(OH)2溶液中n(Ba2+)=0.024mol,n(OH-)=0.048mol,由Ba2++SOBaSO4↓知,生成n(BaSO4)=0.02mol。结合②中分析知:Al元素最终以AlO和Al(OH)3的形式存在,根据化学反应方程式可计算出生成0.002mol Al(OH)3,故反应中共生成沉淀为0.022mol。
【答案】(4)2Na(s)+O2(g)Na2O2(s)

【点评】本题以化学图象、元素的推断为载体,侧重知识“交叉融合”的考查,试题既涵盖元素周期表和周期律知识,又涉及“元素化合物”与“化学反应原理”内容。试题将溶液中离子浓度的大小比较、热化学方程式的书写、化学计算等高频考点有机结合起来,对逻辑思维能力要求较高,试题难度逐步加大,但区分度很好,有效考查学生应用所学知识分析、解决问题的能力。在复习时应注意教材中重点知识间的横、纵向联系,适当加强这类综合性试题的训练。
(作者单位:湖北省枣阳市第二中学)
