相关蛋白在携带载脂蛋白-J基因大鼠BMSCs中的表达及意义
2016-04-05刘学良郑晓梅
刘学良,周 冲,徐 斌,郑晓梅,刘 亮
(泸州医学院附属医院:1. 神经外科;2. 神经内科,四川泸州 646000)
相关蛋白在携带载脂蛋白-J基因大鼠BMSCs中的表达及意义
刘学良1,周 冲1,徐 斌1,郑晓梅2,刘 亮1
(泸州医学院附属医院:1. 神经外科;2. 神经内科,四川泸州 646000)
目的 检测重组质粒pEGFP-N1-apoJ在不同量、不同时间条件下转染大鼠骨髓间充质干细胞的瞬时转染效率,并测定载脂蛋白-J(ApoJ)在靶细胞中能否高表达。方法 贴壁培养细胞,并用脂质体LipofectaminTM2000分别介导0.8、1.2、1.6、2.0 μg重组质粒pEGFP-N1-apoJ转染,置荧光显微镜下观察转染结果,测定在24、48、72 h时间点的瞬时转染效率。蛋白免疫印迹法分别检测pEGFP-N1-apoJ质粒转染组、空pEGFP-N1质粒转染组、空白对照组ApoJ的表达情况。结果 不同的质粒量中1.6 μg pEGFP-N1-apoJ质粒与3.0 μL脂质体制备的复合物瞬时转染效率最高,分别作用24、48、72 h可达27.8%、34.3%、28.2%。蛋白免疫印迹法检测到pEGFP-N1-apoJ质粒组大量ApoJ表达,空质粒及空白对照组见微量ApoJ表达;并且pEGFP-N1-apoJ质粒组Apo-J的表达明显高于空载体及空白对照组(P<0.05)。结论 利用脂质体介导可将重组质粒pEGFP-N1-apoJ成功转染入大鼠骨髓间充质干细胞,ApoJ在大鼠骨髓间充质干细胞中得到大量表达。
载脂蛋白-J;重组质粒;骨髓间充质干细胞; 瞬时转染;蛋白免疫印迹法
载脂蛋白J(ApoJ或称clusterin, CLU)是从人血浆HDL中新分离出的一种酸性糖蛋白,分子量70 ku,由α及β亚基通过二硫键相连而成,广泛分布于人体各种组织,脑组织内主要是由星形胶质细胞产生。ApoJ除了负责运输脂质外,还参与精子成熟、膜再循环及神经元的保护等生理过程[1]。在损伤组织中,ApoJ基因表达升高,参与组织损伤的修复,可抑制补体介导的细胞毒作用,调控细胞的死亡和细胞膜的更新。相关研究显示ApoJ在多种神经系统疾病中均有高表达[2]。脑出血后ApoJ可能随着一系列病理损伤的进展,在脑出血病灶周围表达增加,以此来保护濒临凋亡的神经细胞。本实验将重组质粒pEGFP-N1-apoJ转染大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs),并检测ApoJ在靶细胞中能否高表达,为进一步研究高表达ApoJ基因的BMSCs移植治疗脑出血疾病奠定实验基础。
1 材料与方法
1.1 质粒和大鼠BMSCs
重组质粒pEGFP-N1-apoJ和空质粒pEGFP-N1由上海生博生物医药科技有限公司提供;大鼠BMSCs由泸州医学院附属医院医学实验中心赠送。
1.2 主要试剂
α-MEM培养基,胎牛血清(Gibson公司);脂质体LipofectaminTM2000(Nitrogen公司):高效RIPA组织/细胞裂解液,配有一支PMDF(solaria);兔抗鼠ApoJ抗体-Clustering Antibody(Proteintech公司);Anti-GAPDH(北京博奥森生物技术有限公司);二抗-羊抗兔IgG(bios);SDS-PAGE凝胶制备试剂盒(solaria);4*SDS-PAGE loading buffer(bidder);10~170 ku电泳蛋白彩色预染Marker(thermo);ECL发光液(Millipore)。
1.3 方法
1.3.1 细胞的复苏、传代及培养 从液氮中迅速取出BMSCs冻存管,于37 ℃水浴振荡使细胞在30~60 s内完全融化;用750 mL/L乙醇擦洗冻存管后,置于超净台中将BMSCs悬液移入离心管,加入10倍体积的α-MEM培养基,室温800 r/min离心5 min;去除上清液,采用全骨髓贴壁培养法[3]培养-完全培养基(α-MEM培养基加100 mL/L的胎牛血清、100 U/mol双抗)轻轻重悬细胞,接种于25 cm2培养瓶;37 ℃、50 mL/L CO2、饱和湿度条件下培养24 h后,换液继续培养。待BMSCs生长至70%~80%汇合度时,弃去培养基,用PBS冲洗2遍,加入2.5 g/L胰蛋白酶消化大约2 min,当细胞收缩变圆时,加入完全培养基终止消化,将BMSCs从瓶壁上轻轻吹打下来,收集细胞,离心后加入新鲜完全培养基重悬细胞,按1∶3进行传代培养。
1.3.2 脂质体介导不同DNA浓度的重组质粒pEGFP-N1-apoJ瞬时转染大鼠BMSCs 用胰蛋白酶将BMSCs从培养瓶上消化下来,以4~5×106接种于6孔板中,细胞融合达90%以上时即可进行转染,转染前1 d换液。转染前将6孔板中的细胞用无血清培养基冲洗细胞2遍,加入2 mL无血清培养基。取灭菌的1.5 mL Eppendorf管,EP管中用α-MEM培养基分别稀释0.8、1.2、1.6、2.0 μg pEGFP-N1-apoJ质粒至200 μL(全部标为①),温和混匀。另取相同数量的EP管,用α-MEM培养基分别稀释3.0 μL LipofectaminTM2000至200 μL(全部标为②),室温孵育5 min。将①号管中培养基分别与②号管中培养基混合,使总体积为400 μL,温和混合,复合物于室温孵育20 min。转染分为A1组、A2组、A3组、A4组(每组3孔),分别将含0.8、1.2、1.6、2.0 μg pEGFP-N1-apoJ质粒的400 μL转染复合物加入到相对应的孔中转染(并在6孔板上做好标记);转染后在37 ℃、50 mL/L CO2的培养箱中培养5~6 h,其后更换含有血清无双抗的全培养基继续培养。于24、48、72 h后荧光显微镜下观察其荧光表达情况,并测定转染后1、2、3 d的转染效率。
1.3.3 转染效率的测定 分别于细胞转染24、48、72 h后在荧光显微镜下观察各组细胞中绿色荧光蛋白的表达情况,在10个均匀分布的视野下用100倍镜观察,10个视野转染阳性细胞数之和/细胞总数之和=该孔细胞转染效率。
1.3.4 脂质体介导下质粒转染大鼠BMSCs 同1.3.2的方法准备好待转染的大鼠BMSCs。转染分为A、B、C三组(每组各2孔):A组为实验组, 转染质粒pEGFP-N1-apoJ(加入DNA的浓度与1.3.2中转染效率最高组相同);B组为对照组, 转染空质粒pEGFP-N1(所用空质粒pEGFP-N1 的量与A组所用质粒pEGFP-N1-apoJ的量相同);C组为空白对照组, 加入等量质脂体。其它步骤与1.3.2中均相同。在荧光显微镜下观察各组细胞中绿色荧光蛋白的表达。
1.3.5 单层贴壁细胞蛋白质的提取及Western blot检测ApoJ的表达 据1.3.4知:待提取蛋白的贴壁细胞分为A组(pEGFP-N1-apoJ质粒转染为实验组)、B组(用空pEGFP-N1质粒转染为对照组)、C组(空白对照组)。在转染72 h后,以细胞裂解液裂解细胞,裂解完后,用干净的刮棒快速的将细胞刮于孔壁的一侧,然后用枪将细胞碎片和裂解液移至1.5 mL离心管中(整个操作尽量在冰上进行)。然后于4 ℃下12 000 r/min离心5 min(提前开离心机预冷)。将离心后的上清液分装转移倒0.5 mL的离心管中做好相应标记,每管按照上清液:loading buffer=1∶3的体积比加入4*SDS-PAGE loading buffer,煮沸5 min。应用Western blot对ApoJ表达进行检测:制胶,上样,进行SDS-PAGE蛋白电泳,转膜,室温封闭2 h,加1∶1 000兔抗鼠ApoJ抗体4 ℃孵育过夜,加羊抗兔IgG二抗(1∶1 500)室温孵育2 h,暗室内曝光,显影、定影。内参为Gapdh。实验重复3次,计算机软件分析灰度值。
1.4 主要观察指标
①大鼠BMSCs的形态学观察;②脂质体介导下pEGFP-N1-apoJ质粒转染BMSCs的效率;③Western blot检测重组质粒pEGFP-N1-ape组、空pEGFP-N1质粒组及空白对照组中ApoJ表达情况。
1.5 统计学分析
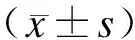
2 结 果
2.1 大鼠BMSCs的形态学观察
光学显微镜下观察,大鼠BMSCs未贴壁时为圆形单核细胞,折光性强;贴壁后形态发生改变,变为多角形和扁平形;细胞复苏后培养4~6 d可达90%融合,形态变为长梭形为主(图1A)。第3~4代后细胞形态趋于稳定相同,挤压成束状、漩涡状,细胞胞质丰富,核大,核仁也较明显(图1B)。
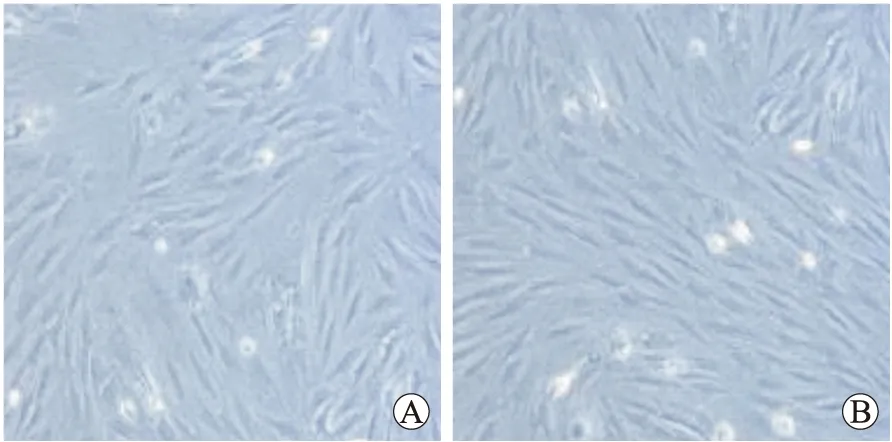
图1 大鼠BMSCs的形态学观察
Fig.1 Morphological observation of rats BMSCs (×50)
A:4~6 d的BMSCs;B:3~4代的BMSCs。
2.2 重组质粒转染后绿色荧光观察
分别在转染24、48、72 h时在荧光显微镜下观察各组细胞的荧光表达情况,可以看到各组细胞均有绿色荧光出现,但各组表达绿色荧光融合蛋白阳性细胞的数量存在明显差异。0.8、1.2、1.6 μg pGFP-N1-apoJ质粒分别与3.0 μL LipofectaminTM2000脂质体混合转染后,阳性细胞的数量逐渐增多,且1.6 μg pEGFP-N1-apoJ质粒转染后阳性细胞的转染效果最高。然而,当质粒的量增加到2.0 μg时,绿色荧光融合蛋白阳性细胞的数量并没有提高,反而降低(图2)。

图2 EGFP-N1-apoJ质粒转染后,绿色荧光融合蛋白在BMSCs中的表达
Fig.2 The expression of green fluorescent fusion protein in BMSCs after transfection of EGFP-N1-apoJ plasmid (×100)
A1、A2、A3、A4,分别是0.8、1.2、1.6、2.0 μg。A~F、M~R荧光显微镜观察转染的BMSCs细胞;G~L、S~X可见光下观察转染的BMSCs细胞;(A、G,D、J,M、S,P、V)、(B、H,E、K,N、T,Q、W)、(C、I,F、L,O、U,R、X)分别是转染24 h、48 h、72 h后的观察结果。
2.3 重组质粒转染后转染效率的测定结果
应用SPSS 19.0统计软件进行统计学处理,组间比较采用重复方差分析。结果显示,不同质粒浓度情况下转染效率有差异(P=0.001),不同时间点转染效率无明显差异(P=0.993),转染效率随着质粒浓度变化有变化趋势(P=0.041,表1)。采用3.0 μL LipofectaminTM2000脂质体与不同质量的质粒配制成复合物进行转染,随着质粒浓度的提高,转染效率增加;质粒的量达到1.6 μg时,在3个时间段获得最高的转染效率分别为27.8%、34.3%、28.2%,提高质粒DNA至2.0 μg却并没有提高转染效率(图3)。提示1.6 μg pEGFP-N1-apo质粒与3.0 μL脂质体配制转染复合物为转染的最适条件,可以获得较高的转染效率。
表1 4种不同处理方式在不同时间点转染效率的方差分析
Tab.1 Analysis of transfection efficiency by 4 different treatments at different time points

变异来源SSνMSFP处理0.07130.02446.4740.001个体时间误差0.00480.001时间0.00320.0023.9240.041时间X处理0.00164.500E-50.1130.993个体内误差0.006160.001

图3 不同pEGFP-N1-apoJ质粒量、不同时间点的转染效率
Fig.3 The transfection efficiency of pEGFP-N1-apoJ plasmid at different concentrations and time points
2.4 Western blot检测ApoJ的表达情况
使用Western blot法对转染72 h后的BMSCs表达的蛋白进行检测,结果显示,转染pEGFP-N1-apoJ质粒组在相对分子质量70 ku处可见大量ApoJ蛋白表达,空质粒及空白对照组见微量ApoJ蛋白表达(图4A)。阳性质粒转染BMSCs,ApoJ的表达明显高于空载体组和空白对照组(P<0.05,图4B)。
3 讨 论
BMSCs最早由PITTENGER等[4]于1999年从骨髓中分离培养出来,它具有多向分化潜能的成体干细胞[5],骨髓组织中含量最为丰富,在适宜的微环境里具有向成骨细胞、脂肪细胞、软骨细胞、心肌细胞、神经细胞等分化的能力[6-9]。鉴于BMSCs具有自我复制和多向分化潜能[10],且易获得、易培养、低免疫原性、能在宿主体内长期存活、易于外源基因转染和长期表达等优点,其在细胞治疗和基因治疗方面有良好的应用前景[11-12]。在神经系统疾病的应用中,BRASELTON[13]和MOSEY[14]两个研究小组分别采用不同的方法证实,体外扩增的BMSCs可通过血脑屏障经尾静脉注射、骨髓移植、脑部直接注射等途径进入脑内,广泛分布于全脑。这一研究为BMSCs移植治疗神经系统疾病提供了实验依据。

图4 转染72 h后各组ApoJ蛋白的表达情况
Fig.4 The expression of ApoJ protein in each group after transfection of 72 h
A:Western blot检测;B:统计学分析。1:pEGFP-N1-apoJ质粒转染组;2:空pEGFP-N1质粒转染组;3:空白对照组。
本实验通过脂质体介导pEGFP-N1-apoJ质粒对大鼠BMSCs进行转染,探索并优化转染相关条件[15-16]。在合适的质粒和脂质体比例下[17],脂质体可高效的介导外源性质粒基因转染BMSCs。本实验建立ApoJ基因修饰的BMSCs体系,经荧光显微镜下观察各组细胞中绿色荧光蛋白表达及Western检测,证实ApoJ在BMSCs中得以转录和翻译,说明携带外源性ApoJ基因的BMSCs构建成功。
基于上述原因,采用表达外源性ApoJ的BMSCs移植治疗脑出血,可以产生双重作用:首先,携ApoJ基因BMSCs可大量表达ApoJ,ApoJ可促进受损神经元和神经胶质细胞的功能恢复,并抑制炎症反应及神经细胞凋亡。再者,BMSCs能分化为神经元和神经胶质细胞,以补充脑出血后脑损伤丢失的细胞,在结构上修复和重建神经环路。本研究为进一步开展携ApoJ基因BMSCs移植治疗脑出血的实验提供一定的实验基础和理论依据,为后续进一步研究ApoJ的作用机制及为临床基因工程干细胞移植治疗脑出血提供一定的基础。
[1] WICHER G, FEX SVENNINGSEN A, VELSECCHI I, et al. Extracellular c luster inpromotes neuronal network complexityinvitro[J]. Neuroreport, 2008, 19(15):1487-1491.
[2] ELLIOTT DA, WEICKERT CS, GARNER B. Apolipoproteins in the brain: implications for neurological and psychiatric disorder[J]. Clin Lipidol, 2010, 51(4):555-573.
[3] 袁斌,马樱,闫铭,等. 大鼠骨髓间充质干细胞的改良培养方法及Hoechst体外标记研究[J]. 细胞与分子免疫学杂志, 2011, 27(1):61-63
[4] ANJOS-AFONSO F, SIAPATI EK, BONNET D.Invivocontribute of murine mesenchymal stem cells into multiple cell types under minimal damage conditions[J]. Cell Sci, 2004, 117(23):5655-5664.
[5] BIANCO P, ROBEY PG, SIMMONS PJ. Mesenchymal Stem Cells: Revisiting history, concepts, and assays[J]. Cell Stem Cell, 2008, 2(4):313-319.
[6] PINEY DG. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy[J]. Cell Cycle, 2007, 6(23):2884-2889.
[7] RIDDEN M, DICKER A, GOTHERSTROM C, et al. Functional characterization of human mesenchymal stem cell derived adiposities[J]. Brioche Biopsy’s Res Common. 2003, 311(2):391-397.
[8] YAN H, YU C. Repair of full-thickness cartilage defects with cells of different origin in a rabbit model[J]. Arthroscopy, 2007, 23(2):178-187.
[9] MUNOZ JR, STAUDINGER BR, ROBINSON AP, et al. Human stem/progenitor cells from bone marrow promotes neurogenesis of endogenous neural stem cells in the hippocampus of mice[J]. Proc Natal Accad Sic US A, 2005, 102(50):18171-18176.
[10] MIGUEL JJ, ERIC’S A, CONGEST P. Mesenchymal stem cells[J]. Exp Boil Med (Maywood), 2001, 226(6):507-520.
[11] DAWN B, BOLLIX R. Adult bone marrow-derived cells: regenerative potential, plasticity, and tissue commitment[J]. Basic Res Cardio, 2005, 100(6):494-503.
[12] MCFARLANE K, AGO X, LIU YB, et al. Bone marrow-derived mesenchymal stoma cells accelerate wound healing in the rat[J]. Wound Repair Regen, 2006, 14(4):471-478.
[13] BRASELTON TR, ROSIS FMV, KISMET GI, et al. From marrow to brain: expression of neuronal phenol types in adult mice[J]. Science, 2000, 290(5497):1775-1779.
[14] MESSAY E, CHANDRASIS KJ, HARTE G, et al. Turning blood into brain: cells bearing neuronal antigens generated in vive from bone marrow[J]. Science, 2000, 290(5497): 1779-1782.
[15] WILLIAMS DJ, PUHL HL, IKEDA SR. A simple, highly efficient method for heterologous expression in mammalian primary neurons using cationic lipid-mediated mRNA transfection[J]. Front Neurosci, 2010, 4:181.
[16] OBATA Y, CIOFANI G, RAFFA V, et al. Evaluation of cationic liposomes composed of an amino acid-based lipid for neuronal transfection[J]. Nanomedicine, 2010, 6:70-77.
[17] ZHANG S, ZHI D, HUANG L. Lipid-based vectors for siRNA delivery[J]. J Drug Target, 2012, 20(9):724-735.
(编辑 卓选鹏)
The expression of associated proteins in rat BMSCs with ApoJ gene
LIU Xue-liang1, ZHOU Chong1, XU Bin1, ZHENG Xiao-mei2, LIU Liang1
(1. Department of Neurosurgery; 2. Department of Neurology, the Affiliated Hospital of Luzhou Medical College, Luzhou 646000, China)
Objective To detect the transfection efficiency of recombinant plasmid pEGFP-N1-apoJ in rat bone marrow mesenchymal stem cells (BMSCs) at different DNA concentrations and time points and to detect the expression of apoJ in target cells. Methods We used bone marrow adherent culture method to culture rat BMSCs. LipofectaminTM2000 mediated respectively 0.8, 1.2, 1.6 and 2 μg of pEGFP-N1-apoJ recombinant plasmid to transfect BMSCs. The transfection results were observed under the fluorescence microscope. We determined the transient transfection efficiency at 24 h, 48 h and 72 h. Western blot was used to detect the expression of ApoJ in pEGFP-N1-apoJ plasmid transfection group, empty pEGFP-N1 plasmid transfection group and control group. Results In different DNA concentrations, when 1.6 μg of pEGFP-N1-apoJ plasmid was transfected with 3.0 μL of liposome in rat BMSCs, the transient transfection efficiency was the highest; it reached 27.8%, 34.3% and 28.2% at 24 h, 48 h and 72 h. Western blot results showed that pEGFP-N1-apoJ recombinant plasmid expressed large amounts of ApoJ; small amounts of protein expression of ApoJ was found in the empty plasmid and the control groups. The expression of ApoJ was higher in PEGFP-N1-apoJ group than in the empty carrier and the control groups (P<0.05). Conclusion Recombinant plasmid PEGFP-N1-apoJ can be transfected into rat BMSCs successfully via liposome. ApoJ is expressed in large amounts in rat BMSCs.
apolipoprotein-J; recombinant plasmid; bone marrow mesenchymal stem cell; transient transfection; Western blot
2015-04-23
2015-11-04
四川省教育厅重点项目课题(No.12ZA075);泸州市科技局课题(No.2011-I-S45) Supported by Key Projects of Sichuan Provincial Education Department (No.12ZA075) and Luzhou Science and Technology Bureau (No.2011-I-S45)
刘亮. E-mail: liust@163.com
Q782
A
10.7652/jdyxb201601012
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151210.1744.008.html(2015-12-10)
