围产期母体营养状态对子代下丘脑食欲调控网络胚胎编程的研究进展
2016-04-05闫剑群西安交通大学医学部基础医学院生理及病理生理系陕西西安710061
闫剑群,王 楠,吕 波,孙 波,罗 肖,孟 凯(西安交通大学医学部基础医学院生理及病理生理系,陕西西安 710061)
◇专家述评◇

围产期母体营养状态对子代下丘脑食欲调控网络胚胎编程的研究进展
闫剑群,王 楠,吕 波,孙 波,罗 肖,孟 凯
(西安交通大学医学部基础医学院生理及病理生理系,陕西西安 710061)
围产期的不良营养因素对子代相关组织的发育具有程控作用,可能引起能量代谢异常并导致代谢相关性疾病的发病。下丘脑是各种食欲调节信号的主要整合中枢,目前已发现多种食欲调节肽在下丘脑食欲调节网络中都扮演了重要的角色。研究表明,下丘脑的食欲调节网络在出生前就已建立,孕晚期及断奶前是食欲调控神经系统的分化发育的关键时期。食欲的调控是一个复杂的生理过程,多种递质、调质或肽类物质参与介导这一机制。其中,脂肪细胞释放的瘦素(leptin)是调控食欲和能量代谢的重要因子。Leptin在围产期母体肥胖程控子代肥胖及代谢异常中可能同样扮演着重要角色,下丘脑食欲调控神经网络的正常发育也一定程度地依赖于出生早期leptin水平的迅速升高。下丘脑的多个脑区,包括摄食调控中枢神经元均表达瘦素受体。研究围产期营养状态对子代下丘脑leptin神经调控网络发育的胚胎编程作用对揭示代谢性疾病发病的先天因素具有重要意义。
围产期;胚胎编程;下丘脑;瘦素;食欲调控
英国科学家Barker在1989年提出“巴克假说”,即“成人疾病的胚胎根源”假说,认为母体孕期营养不良将引起子代罹患多种疾病的几率增高,包括高血压、胰岛素抵抗、血脂异常以及多种心血管疾病。而越来越多的流行病学资料及动物研究表明,这种“胚胎编程”同样受到母体肥胖及糖尿病等的影响。由此认为出生体质量及成年期肥胖发生率呈“U”形的关系,即过低或过高的出生体质量均可引发肥胖发生率升高。这个概念指出围产期的不良营养因素对子代相关组织具有程控作用,可能引起能量代谢异常并导致代谢相关性疾病的发病。下丘脑是各种食欲调节信号的主要整合中枢,目前已发现多种食欲调节肽在下丘脑食欲调节网络中都扮演了重要的角色。研究表明,下丘脑的食欲调节网络在出生前就已建立,孕晚期及断奶前是食欲调控神经系统的分化发育的关键时期[1]。食欲的调控是一个复杂的生理过程,多种递质、调质或肽类物质参与介导这一机制。其中,脂肪细胞释放的瘦素(leptin)即是调控食欲和能量代谢的重要因子[2-3]。研究提示,leptin抑制禁食引起的食欲增强,减少摄食量,其作用可能是通过抑制下丘脑促进食欲的神经肽Y(neuropeptide-Y, NPY)、刺鼠相关蛋白(agouti-related protein, AgRP)的转录表达,并促进抑制食欲的调节肽,如阿片-促黑素细胞皮质素原(pro-opiomelanocortin, POMC)的转录和表达完成[4]。值得关注的是,leptin在围产期母体肥胖程控子代肥胖及代谢异常中可能同样扮演着重要角色[5],下丘脑食欲调控神经网络的正常发育也一定程度地依赖于出生早期leptin水平的迅速升高[6]。下丘脑的多个脑区,包括摄食调控中枢神经元均表达瘦素受体[7]。以下主要探讨围产期营养状态对子代下丘脑leptin神经调控网络发育的胚胎编程作用。
1 下丘脑调节能量平衡的通路
下丘脑在调节摄食及能量平衡中有十分重要的作用。下丘脑弓状核(arcuate nucleus, ARC)中的神经元在这个调节中尤为重要。ARC位于正中隆起(median eminence)的上方,并与室周器(circumventricular organs)毗邻,这个解剖位置使其可以接收并整合来自外周的激素信号,如leptin和胰岛素(insulin)。许多研究表明,ARC 与肥胖密切相关,并且含有许多leptin敏感神经元[8-11]。此外,近期的遗传学研究明确地提出了ARC神经元中leptin受体信号转导的重要性。在leptin缺失的小鼠中,恢复ARC神经元的leptin受体信号转导,可以通过减少摄食与脂肪组织来降低体质量增长[12-13]。这些资料表明,ARC是leptin中枢调节能量平衡的重要位点。ARC中包含两组重要的神经元:一组表达神经肽Y(neuropeptide Y, NPY)和刺鼠相关肽(agouti-related peptide, AgRP),主要转导促进食欲的信号;另一组表达阿黑皮素原(proopiomelanocortin, POMC)衍生肽,如α-促黑素细胞激素(α-melanocyte stimulating hormone, α-MSH),主要转导抑制食欲的信号。ARC中的这些神经元向下丘脑中其他控制摄食的关键部位发出神经纤维投射。这些部位包括室旁核(paraventricular nuclei, PVN),背内侧核(dorsomedial nuclei, DMN)及外侧下丘脑(lateral hypothalamus, LH)。
除了调节摄食及体质量,许多研究还表明,下丘脑是维持外周葡萄糖稳态的一个关键部位。向基底内侧下丘脑(medial basal hypothalamus, MBH)中注入胰岛素可通过增强肝脏胰岛素敏感性来降低肝糖原异生[14]。此外,在大鼠,MBH内胰岛素受体信号转导的下调可导致胰岛素抵抗[15-16]。所有的这些资料都表明,对于葡萄糖稳态的调节,下丘脑的胰岛素信号转导是非常重要的。近期的研究也表明,leptin对葡萄糖稳态的调节主要通过作用于下丘脑来实现。在leptin受体缺失的动物,恢复ARC内leptin受体功能,可以明显地改善葡萄糖稳态及胰岛素敏感性[12]。因此,下丘脑通过介导leptin及胰岛素的信号转导,在调节能量平衡及葡萄糖稳态中发挥重要的作用(图1)。
2 下丘脑的leptin信号转导
Douglas Colemen的研究提出了“来自脂肪组织的因子通过作用于下丘脑在调节体质量中发挥关键作用”的概念[18],然而这个因子被认定为leptin是由Friedman的研究小组完成的[19]。Leptin受体(obese receptor, Ob-R)的发现进一步促进了对leptin的研究;leptin在许多生理机制中发挥重要作用,如能量平衡,生殖及骨生成等[20]。Leptin将营养状态传递给下丘脑的调节中枢,在能量平衡的调节中起到重要作用[4,7]。无论是中枢还是外周注射leptin都可以降低摄食和体质量。在人类及啮齿类动物,由于leptin或leptin受体基因突变造成的leptin功能缺失都可以导致肥胖[21]。此外,在leptin缺失的小鼠中,给予leptin可以改善肥胖相关的代谢及内分泌缺陷[22]。

图1 下丘脑调节能量平衡的通路[17]
Fig.1 Regulating pathway of energy balance in hypothalamus[17]
Leptin受体是细胞因子受体家族中的一员。在六种leptin受体的亚型中,Ob-Rb在下丘脑中介导leptin的信号转导。Ob-Rb在下丘脑中大量表达,并且几乎所有的leptin敏感神经元都表达leptin受体[23]。在下丘脑中,Janus kinase 2(JAK2)-signal transducerand activator of transcription 3(STAT3)通路是leptin信号转导的主要通路[24](图2)。在下丘脑的几种STAT蛋白中,leptin只增加STAT3的磷酸化及STAT3的DNA结合力,尤其是在ARC、LH、下丘脑腹内侧核(ventromedial nucleus, VMN)和DMN。许多leptin敏感的神经元(包括NPY、POMC)都表达STAT3[25]。
细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3, SOCS3)可对leptin的JAK2-STAT3信号转导通路进行负反馈调控。尽管在哺乳动物的细胞系中,SOCS3的过表达可以降低JAK-STAT的信号转导;leptin能引起下丘脑中SOCS3的表达,并激活NPY及POMC神经元中的SOCS3[27];但下丘脑内SOCS3在leptin信号转导中的作用仍然是不清楚的。蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B, PTP1B)是另外一种调节leptin信号转导的蛋白,在下丘脑中与Ob-Rb表达在相同的部位[28];PTP1B敲除的小鼠对摄食引起的肥胖产生耐受,且对leptin更敏感,说明PTP1B在下丘脑的leptin信号转导中起重要作用[29]。SOCS3和PTP1B之间的相互作用在正常的leptin信号转导中可能扮演关键的作用。
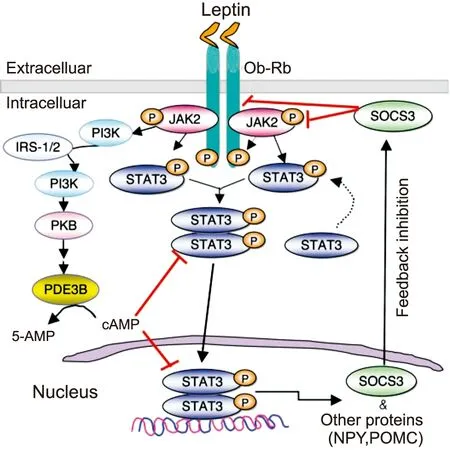
图2 下丘脑中leptin 胞内信号转导示意图[26]
Fig.2 Schematic diagram of intracellular signal transduction of leptin in hypothalamus[26]
3 下丘脑发育期leptin对代谢的调控
Leptin是一种由脂肪组织分泌的激素,通过作用于脑组织中不同的部位来影响摄食和能量平衡[30]。在ARC中,leptin作用于其长型受体Ob-Rb,激活JAK-STAT信号途径,引起STAT3的磷酸化。磷酸化的STAT3调节控制摄食和能量平衡的神经肽的表达,如NPY和POMC。在下丘脑发育的过程中,leptin也是一个非常关键的神经营养因子[31];在leptin 缺失的小鼠,从ARC发出的神经纤维投射出现异常。下丘脑从妊娠早期便开始快速发育并且一直持续到出生后。在啮齿类动物,下丘脑的神经形成发生在妊娠中期,而不同核团间的神经投射则发生在出生后早期[32]。在这些关键发育时期内的环境变化,如母鼠怀孕和哺乳期间的高脂饮食,可能扰乱下丘脑的发育并对子代的代谢产生长期作用。
Ob-Rb是介导leptin JAK2信号转导通路的受体。在胚胎期第10.5天,便可检测到小鼠脑中的leptin受体;但是,在胚胎期及出生后早期,Ob-Rb的mRNA 的表达都局限在第三脑室的室管膜细胞。给予出生后第4天的小鼠注射leptin可以引起第三脑室周围的细胞内产生强烈的SOCS3 mRNA表达;在出生后第7天之前,在ARC 及其他下丘脑核团中只有非常弱的Ob-Rb的表达及leptin引起的SOCS3的表达。不过,在出生后第10天,在下丘脑的许多部位,如ARC、VMN、DMN及LH,都有Ob-Rb mRNA的大量表达[33](图3);此外,给予出生后第10天的小鼠注射leptin可以引起这些下丘脑结构中STAT3的激活。在出生后小鼠的大脑皮质、海马以及丘脑背外侧核中,Ob-Rb mRNA的水平也短暂升高。但是,在leptin注射后,这些脑区并没有磷酸化STAT3的免疫反应,说明:①这些受体并不感受外周的leptin;②在leptin注射后激活其他的转导通路如分裂素激活的蛋白激酶(mitogen-activated protein kinase,MAPK)通路;③在这些脑区Ob-Rb mRNA并不翻译成蛋白。

图3 发育的脑组织中leptin 的作用位点[36]
Fig.3 The acting sites of leptin in the developing brain[36]
除了在成年期调节摄食及能量平衡,在出生后早期下丘脑发育过程中,leptin也调节摄食相关神经肽的表达。在出生后第10天的大鼠,给予leptin可增加ARC 中POMCmRNA的水平,但降低ARC中NPY mRNA的水平。此外,长期给予新生大鼠leptin可以降低VMN中所有亚型的leptin受体mRNA的表达,升高VMN中促肾上腺皮质激素释放激素(corticotropin-releasing factor, CRF)受体-2 mRNA的表达[34]。早在出生后第6天,leptin就可以引起ARC神经元中cFos的表达。然而,在新生小鼠,这些转录水平的变化与摄食的减少是不匹配的;给予正常小鼠或leptin敲除小鼠注射leptin直到断奶后才能影响摄食、耗氧量、体质量或脂肪含量[35]。因此,在出生后早期,尽管leptin可以调节下丘脑神经肽的表达,但并不调节摄食。断奶前leptin抑制食欲作用的下降可以让动物尽可能多的摄入食物,以保障生长及维持高代谢率。
4 围产期影响下丘脑发育及代谢的因素
在器官发育的敏感时期,有害的子宫内营养环境、出生后早期营养环境及激素水平都增加成年后代谢性疾病的易感性。从一般意义上来讲,相对于成年大脑,发育中的大脑对环境的变化更为敏感。越来越多的研究表明,围产期环境变化对摄食通路发育的调节是导致肥胖的可能因素[38](图4)。除了在成年动物中调节能量平衡,leptin也是下丘脑代谢通路发育过程中的重要营养因子。啮齿类动物在出生后两周内leptin水平升高,但此时leptin对体质量和摄食并没有影响。对于这个leptin高峰的来源,目前的信息是非常有限的,可能有一部分来自胎儿的脂肪组织。因为有研究发现,新生动物白色及棕色脂肪组织内升高的leptin mRNA表达与外周循环的leptin水平相一致。围产期的leptin也可能来自其他器官,如胃。此外,许多研究也表明,对于新生动物来讲,母乳对血浆leptin水平有非常重要的作用[39]。有趣的是,新生动物的leptin高峰与下丘脑的摄食通路发育相一致[40]。神经解剖学的实验也显示,在新生动物,leptin是下丘脑控制能量平衡通路发育的重要营养因子,对于摄食及体质量无明显影响;在leptin缺失的小鼠,向ARC注入顺行性示踪剂,结果显示ARC通路的形成被明显扰乱。在leptin缺失的新生小鼠,从ARC神经元到其他核团(如PVN、DMN、LH)的神经纤维投射密度明显下降(图5),并且在以后持续减少。在leptin受体缺失的动物模型,如Zucker大鼠,也能发现相似的破坏。Leptin缺失可以同时影响促进食欲(NPY/AgRP)和抑制食欲(POMC)的神经纤维投射,说明leptin对ARC内调节能量代谢的神经元的发育有广泛的影响。体外实验也显示,leptin可以直接作用于ARC神经元,从而引起轴突生长[41]。此外,leptin对轴突生长的作用主要局限在出生后的一段时期内;在出生后第4天到第12天给予leptin缺失的小鼠注射leptin可以使ARC到PVN的神经纤维投射恢复正常;相反,给予成熟动物注射leptin并不能改善这些纤维投射。这些资料表明,leptin神经发育的作用有一个关键的时期,局限在出生后数周内;在这段关键时期内leptin水平的变化可能引起长期的代谢影响。

图4 围产期代谢环境引起成年期肥胖的可能机制[37]
Fig.4 Possible mechanisms by which the perinatal metabolic environment may program adult obesity[37]
营养因素可以直接调节leptin的水平,所以营养环境的变化可以通过leptin来影响下丘脑发育。近期的研究发现,错误的leptin高峰出现时间可以对代谢产生长期影响。利用一种子宫内营养不足的小鼠模型,Yura发现出生前营养不良可导致leptin高峰提前出现,并对体质量调节及葡萄糖稳态产生有害影响[42];这个提前出现的leptin高峰也和减弱的leptin抑制食欲的作用相关。从出生后第2天到第13天,给予新生大鼠特异性的leptin拮抗剂,可以使leptin高峰降低,导致长期的leptin敏感性降低及对摄食引起肥胖的易感性增加。
综上所述,这些资料表明,对于下丘脑摄食通路的发育来讲,leptin是一个非常重要的营养因子。
5 母体围产期高脂饮食对子代大鼠leptin敏感性和肥胖发生的影响
我们近期的研究表明,在出生后第10天,不论是出生前的母体高脂饮食,还是出生后的母体高脂饮食,都降低雄性子代大鼠pSTAT3的激活;但只有出生前的母体高脂饮食降低雌性子代大鼠pSTAT3的激活。在出生后第21天,这个性别差异便消失,哺乳期间由高脂饮食母鼠抚养的雄性子代大鼠和雌性子代大鼠leptin的敏感性均降低。我们目前还不清楚为什么对leptin反应的性别差异会出现在出生后第10天,并且在出生后第21天消失。之前的研究显示,子代大鼠在成年期对母体高脂饮食的反应有性别差异。由此可以引发一个令人极为感兴趣的推论:雄性和雌性对代谢规划的差异起源于出生后的早期阶段,甚至在青春期之前,并且与发育期由受损的leptin信号转导引起的下丘脑发育缺陷有关。

图5 Leptin对下丘脑摄食通路发育的神经营养作用[37]
Fig.5 Neurotrophic action of leptin on hypothalamic feeding pathways[37]
许多研究发现,自愿转轮运动在多个脑部位增强leptin信号转导[43],并改变下丘脑调节能量平衡的神经肽的表达[44]。尽管在我们的实验中,运动并没有降低体质量,但我们发现,断奶3周后的运动改善母体高脂饮食子代大鼠的中枢leptin 敏感性及信号转导。我们之前的研究发现,怀孕或哺乳期间的母体高脂饮食在断奶前改变子代大鼠的leptin敏感性。在这个实验中,即使断奶后给予普通饮食,母体怀孕和哺乳期间的高脂饮食仍然降低成年子代大鼠的中枢leptin敏感性,这和FEREZOU-VIALA的研究结果一致。PATTERSON的结果显示,在DIO大鼠,3周的断奶后运动可以增加运动停止后4周leptin的厌食作用,但是在运动停止后10周,无论是之前运动的大鼠还是一直久坐的大鼠对leptin都没有反应[45]。我们的结果显示,在运动停止后7周,3周的断奶后运动可以增加母体高脂饮食子代大鼠的leptin的厌食作用。在这个实验中,增强的leptin的厌食作用与ARC中增强的leptin信号转导相一致。对于改变的中枢leptin敏感性及信号转导,一个可能的解释是调节能量平衡的中枢通路的变化。在我们的研究中,母体高脂饮食升高子代大鼠ARC中NPY的表达,但断奶后运动可以使其降低。KOZAK也发现母体高脂饮食的子代大鼠在成年期有较高的ARC中NPY的浓度[46];PATTERSON的研究发现,在DIO大鼠,断奶后运动对ARC中NPY的表达没有影响[47]。DMN 中NPY的表达与ARC中NPY的表达有相似的趋势,但无显著性差异。与之前的研究不同,我们发现运动大鼠降低ARC中POMC的表达。如果这个结果可以导致抑制食欲的α-MSH的释放减少,运动的大鼠便有增高的食欲,这和我们的实验结果一致——在运动的最后1周及运动后1周,与久坐组大鼠相比,运动组大鼠有较高的摄食量。我们今后的研究会探索刚刚结束运动时,ARC中POMC的表达是否有变化?ARC中leptin受体的表达在各组间无明显差异,但母体高脂饮食的子代大鼠有较低的VMN中leptin受体的表达,这可能是中枢leptin敏感性降低的一个原因。许多研究表明,PVN和VMN中的BDNF可能通过与MC4R相互作用,降低能量摄入并增加能量消耗[48]。我们并没有发现PVN中BDNF、VMN中BDNF及VMN中MC4R的改变。但是,运动组大鼠的PVN中的MC4R有升高的趋势,这可能导致运动组大鼠即使在运动后仍然有增强的能量代谢。研究表明,LH中的orexin和MCH参与能量平衡及奖赏相关的摄食调节[49]。我们的实验结果显示,母体高脂饮食及早期断奶后运动都可以降低LH中orexin及MCH的表达。目前,虽然我们不清楚这个现象的原因,不过,mRNA表达的变化不一定代表神经肽释放或受体功能的改变,此后的研究将会进一步探讨在蛋白水平的变化。
[1] GROVE KL, GRAYSON BE, GLAVAS MM, et al. Development of metabolic systems[J]. Physiol Behav, 2005,86(5):646-660.
[2] DJIANE J, ATTIG L. Role of leptin during perinatal metabolic programming and obesity [J]. J Physiol Pharmacol, 2008, 59 Suppl 1:55-63.
[3] HILL JW, ELMQUIST JK, ELIAS CF. Hypothalamic pathways linking energy balance and reproduction [J]. Am J Physiol Endocrinol Metab, 2008, 294(5):E827-832.
[4] SCHWARTZ MW, WOODS SC, PORTE D JR, et al. Central nervous system control of food intake [J]. Nature, 2000,404(6778):661-671.
[5] PICO C, JILKOVA ZM, KUS V, et al. Perinatal programming of body weight control by leptin: putative roles of AMP kinase and muscle thermogenesis[J]. Am J Clin Nutr, 2011, 94(6 Suppl): 1830S-1837S.
[6] AHIMA RS, PRABAKARAN D, FLIER JS. Postnatal leptin surge and regulation of circadian rhythm of leptin by feeding. Implications for energy homeostasis and neuroendocrine function[J]. J Clin Invest, 1998,101(5):1020-1027.
[7] FRIEDMAN JM, HALAAS JL. Leptin and the regulation of body weight in mammals[J]. Nature, 1998,395(6704):763-770.
[8] ELMQUIST JK, BJØRBAEK C, AHIMA RS, et al. Distributions of leptin receptor mRNA isoforms in the rat brain[J]. J Comp Neurol, 1998,395(4):535-547.
[9] COWLEY MA, SMART JL, RUBINSTEIN M, et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus[J]. Nature, 2001,411(6836):480-484.
[10] ELMQUIST JK, AHIMA RS, MARATOS-FLIER E, et al. Leptin activates neurons in ventrobasal hypothalamus and brainstem[J]. Endocrinology, 1997,138(2):839-842.
[11] ELIAS CF, SAPER CB, MARATOS-FLIER E, et al.Chemically defined projections linking the mediobasal hypothalamus and the lateral hypothalamic area[J]. J Comp Neurol, 1998,402(4):442-459.
[12] COPPARI R, ICHINOSE M, LEE CE, et al. The hypothalamic arcuate nucleus: a key site for mediating leptin’s effects on glucose homeostasis and locomotor activity[J]. Cell Metab, 2005,1(1):63-72.
[13] BALTHASAR N, COPPARI R, MCMINN J, et al. Leptin receptor signaling in POMC neurons is required for normal body weight homeostasis[J]. Neuron, 2004,42(6):983-991.
[14] OBICI S, ZHANG BB, KARKANIAS G, et al. Hypothalamic insulin signaling is required for inhibition of glucose production[J]. Nat Med, 2002,8(12):1376-1382.
[15] GELLING RW, MORTON GJ, MORRISON CD, et al. Insulin action in the brain contributes to glucose lowering during insulin treatment of diabetes [J]. Cell Metab, 2006,3(1):67-73.
[16] OBICI S, FENG Z, KARKANIAS G, et al. Decreasing hypothalamic insulin receptors causes hyperphagia and insulin resistance in rats [J]. Nat Neurosci, 2002,5(6):566-572.
[17] BOURET SG. Early life origins of obesity: role of hypothalamic programming[J]. J Pediatr Gastroenterol Nutr, 2009, 48 Suppl 1:S31-38.
[18] COLEMAN DL. Obese and diabetes: two mutant genes causing diabetes-obesity syndromes in mice[J]. Diabetologia, 1978, 14(3):141-148.
[19] ZHANG Y, PROENCA R, MAFFEI M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372(6505):425-432.
[20] TARTAGLIA LA, DEMBSKI M, WENG X, et al. Identification and expression cloning of a leptin receptor, OB-R[J]. Cell, 1995, 83(7):1263-1271.
[21] O’RAHILLY S, FAROOQI IS, YEO GS, et al. Minireview: human obesity-lessons from monogenic disorders[J]. Endocrinology, 2003,144(9):3757-3764.
[22] AHIMA RS, PRABAKARAN D, MANTZOROS C, et al. Role of leptin in the neuroendocrine response to fasting[J]. Nature, 1996,382(6588):250-252.
[23] MEISTER B. Control of food intake via leptin receptors in the hypothalamus[J]. Vitam Horm, 2000, 59:265-304.
[24] VAISSE C, HALAAS JL, HORVATH CM, et al. Leptin activation of Stat3 in the hypothalamus of wild-type and ob/ob mice but not db/db mice[J]. Nat Genet, 1996,14(1):95-97.
[25] MÜNZBERG H1, HUO L, NILLNI EA, et al. Role of signal transducer and activator of transcription 3 in regulation of hypothalamic proopiomelanocortin gene expression by leptin[J]. Endocrinology, 2003,144(5):2121-2131.
[26] SAHU A. Minireview: A hypothalamic role in energy balance with special emphasis on leptin[J]. Endocrinology, 2004,145(6):2613-2620.
[27] BASKIN DG, BREININGER JF, SCHWARTZ MW. SOCS-3 expression in leptin-sensitive neurons of the hypothalamus of fed and fasted rats[J]. Regul Pept, 2000,92(1-3):9-15.
[28] LAWRENCE CB, CELSI F, BRENNAND J, et al. Alternative role for prolactin-releasing peptide in the regulation of food intake[J]. Nat Neurosci, 2000,3(7):645-646.
[29] ELCHEBLY M, PAYETTE P, MICHALISZYN E, et al. Increased insulin sensitivity and obesity resistance in mice lacking the protein tyrosine phosphatase-1B gene[J]. Science, 1999,283(5407):1544-1548.
[30] ELMQUIST JK, AHIMA RS, ELIAS CF, et al. Leptin activates distinct projections from the dorsomedial and ventromedial hypothalamic nuclei [J]. Proc Natl Acad Sci USA, 1998,95(2):741-746.
[31] SIMERLY RB. Wired on hormones: endocrine regulation of hypothalamic development [J]. Curr Opin Neurobiol, 2005,15(1):81-85.
[32] BOURET SG. Development of hypothalamic neural networks controlling appetite [J]. Forum Nutr, 2010, 63:84-93.
[33] COTTRELL EC, CRIPPS RL, DUNCAN JS, et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat [J]. Am J Physiol Regul Integr Comp Physiol, 2009,296(3):R631-639.
[34] PROULX K, RICHARD D, WALKER CD. Leptin regulates appetite-related neuropeptides in the hypothalamus of developing rats without affecting food intake [J]. Endocrinology, 2002,143(12):4683-4692.
[35] MISTRY AM, SWICK A, ROMSOS DR. Leptin alters metabolic rates before acquisition of its anorectic effect in developing neonatal mice [J]. Am J Physiol, 1999,277(3 Pt 2):R742-747.
[36] CARON E, SACHOT C, PREVOT V, et al. Distribution of leptin-sensitive cells in the postnatal and adult mouse brain [J]. J Comp Neurol, 2010,518(4):459-476.
[37] BOURET SG. Role of early hormonal and nutritional experiences in shaping feeding behavior and hypothalamic development [J]. J Nutr, 2010,140(3):653-657.
[38] HORVATH TL, BRUNING JC. Developmental programming of the hypothalamus:a matter of fat [J]. Nat Med, 2006,12(1):52-53.
[39] MCFADIN EL, MORRISON CD, BUFF PR, et al. Leptin concentrations in periparturient ewes and their subsequent offspring [J]. J Anim Sci, 2002,80(3):738-743.
[40] BOURET SG, SIMERLY RB. Development of leptin-sensitive circuits [J]. J Neuroendocrinol, 2007,19(8):575-582.
[41] BOURET SG, DRAPER SJ, SIMERLY RB. Trophic action of leptin on hypothalamic neurons that regulate feeding [J]. Science, 2004,304(5667):108-110.
[42] ATTIG L, SOLOMON G, FEREZOU J, et al. Early postnatal leptin blockage leads to a long-term leptin resistance and susceptibility to diet-induced obesity in rats [J]. Int J Obes (Lond), 2008,32(7):1153-1160.
[43] SHAPIRO A, CHENG KY, GAO Y, et al. The act of voluntary wheel running reverses dietary hyperphagia and increases leptin signaling in ventral tegmental area of aged obese rats [J]. Gerontology, 2011, 57(4):335-342.
[44] BI S, SCOTT KA, HYUN J, et al. Running wheel activity prevents hyperphagia and obesity in Otsuka long-evans Tokushima Fatty rats: role of hypothalamic signaling [J]. Endocrinology, 2005,146(4):1676-1685.
[45] PATTERSON CM, BOURET SG, DUNN-MEYNELL AA, et al. Three weeks of postweaning exercise in DIO rats produces prolonged increases in central leptin sensitivity and signaling [J]. Am J Physiol Regul Integr Comp Physiol, 2009,296(3):R537-548.
[46] KOZAK R, BURLET A, BURLET C, et al. Dietary composition during fetal and neonatal life affects neuropeptide Y functioning in adult offspring [J]. Brain Res Dev Brain Res, 2000, 125(1-2):75-82.
[47] PATTERSON CM, DUNN-MEYNELL AA, LEVIN BE. Three weeks of early-onset exercise prolongs obesity resistance in DIO rats after exercise cessation[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294(2):R290-301.
[48] WANG C, GODAR RJ, BILLINGTON CJ, et al. Chronic administration of brain-derived neurotrophic factor in the hypothalamic paraventricular nucleus reverses obesity induced by high-fat diet [J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(5):R1320-1332.
[49] BANKS WA. Is obesity a disease of the blood-brain barrier? Physiological, pathological, and evolutionary considerations [J]. Curr Pharm Des, 2003, 9(10):801-809.
(编辑 胡爱玲)
The research progress of the fetal programming effects of maternal nutritional status on the hypothalamus appetite regulation network in offspring
YAN Jian-qun, WANG Nan, LÜ Bo, SUN Bo, LUO Xiao, MENG Kai
(Department of Physiology and Pathophysiology, School of Basic Medicine,Xi’an Jiaotong University, Xi’an 710061, China)
Perinatal adverse nutritional factors may program the development of related tissue in offspring, and cause energy metabolism disorders and lead to the pathogenesis of related metabolic diseases. The hypothalamus is the main integration center of various appetite regulating signals. A variety of peptides which play important role in the hypothalamus appetite regulation network have been found. Studies have shown that the hypothalamus appetite regulation network has been established before birth. Late pregnancy and weaning may be the key period for the differentiation of appetite regulation system. Appetite regulation is a complex physiological process, and a variety of neurotransmitters, neuromodulators or peptides are involved in mediating the mechanism. Among them, leptin, which is released by fat cells, is the important factor of the control appetite and energy metabolism. Leptin may also play an important role in the programming effects of perinatal maternal obesity on obesity and metabolic disorders in offspring. The normal development of the hypothalamus appetite regulation network must rely on early birth leptin surge. Multiple regions of the hypothalamus, including appetite regulating centers, express leptin receptors. The investigation on the effects of perinatal nutritional status on the development of hypothalamic leptin neural regulation network may help to clarify the congenital factors of metabolic diseases.
perinatal renod; fetal programming; hypothalamus; leptin; appetite regulation
1990~1996年先后在瑞典隆德大学和美国特拉华大学做博士后研究或任研究员;近年来主持或参与科学研究项目和教学研究项目30余项;主译专著1部,主编、副主编或参编国家级教材13本;培养硕士、博士20余人;发表研究论文百余篇;曾分享“全国科学大会奖”1项、省科技成果一等奖1项;主持陕西省国家级教学成果奖3项;现任中国生理学会常务理事,教育部基础医学专业类教学指导委员会副主委,国家自然科学基金委生命科学部、医学部评审专家。
2015-08-15
2015-09-20
闫剑群. E-mail: jqyan@mail.xjtu.edu.cn
R338.2
A
10.7652/jdyxb201601001
闫剑群,男,博士、教授(二级),现为西安交通大学医学部基础医学院“生理学” 国家重点学科带头人之一,“生理学”国家精品课程、“生理学”国家级教学团队负责人,享受国务院特殊津贴。主要研究领域:味觉生理学;摄食调控与代谢神经生物学;高等医学教育。
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1741.030.html(2015-12-09)
