阿魏酸对大鼠离体胸主动脉舒缩功能的影响
2016-04-05霍利琴张静泽佟永领高文远
周 鸿, 霍利琴, 张静泽, 佟永领, 高文远*
(1.天津大学药物科学与技术学院,天津300072;2.天津中新药业集团股份有限公司第六中药厂,天津300401;3.武警后勤学院生药学与药剂学教研室,武警部队特需药物研发中心,天津300309)
阿魏酸对大鼠离体胸主动脉舒缩功能的影响
周 鸿1,2, 霍利琴1, 张静泽3*, 佟永领2, 高文远1*
(1.天津大学药物科学与技术学院,天津300072;2.天津中新药业集团股份有限公司第六中药厂,天津300401;3.武警后勤学院生药学与药剂学教研室,武警部队特需药物研发中心,天津300309)
摘要:目的 基于气体信号分子途径,分析阿魏酸(feru1ic acid)对大鼠离体胸主动脉舒缩功能的影响。方法 采用大鼠离体胸主动脉环,加入3种气体信号分子的抑制剂,即一氧化氮合酶的抑制剂NG-硝基-L-精氨酸甲酯(L-NAME)、血红素加氧酶-1(HO-1)抑制剂锌卟啉(ZnPP)、胱硫醚-γ裂解酶抑制剂炔丙基甘氨酸(PAG),进行体外血管舒张实验。结果 加入3种气体信号分子抑制剂均能显著抑制阿魏酸的舒张血管作用(与空白组相比分别为P<0.01,P<0.01,和P<0.05),且不同浓度的阿魏酸均使CaC12量效曲线右移(P<0.01),且可显著性降低无钙高钾K-H液中去甲肾上腺素NE引起的收缩(P<0.01)。结论 阿魏酸的舒血管作用由NO、CO和H2S 3种气体信号分子通路介导,并通过血管平滑肌上的电压依赖性钙通道和受体依赖性钙通道发挥作用。
关键词:阿魏酸;胸主动脉环;气体信号分子抑制剂;NG-硝基-L-精氨酸甲酯;锌卟啉;丙基甘氨酸;NO;CO;H2S
高文远(1965—),男,教授,博士生导师,主要从事中药复方作用物质基础研究。Te1:(022)87401895,E-mai1:pharmgao@tju.edu.cn
阿魏酸(feru1ic acid,FA,化学结构如图1所示),为中药阿魏、当归、川芎、升麻、酸枣仁中的主要活性成分,因具有较高的含有量,故常作为中药质量控制的指标成分之一[1]。阿魏酸能够抗血小板聚集、抑制血小板5-羟色胺释放[2]、抑制血小板血栓素A2(TXA2)的生成、增强前列腺素活性[3]、镇痛、缓解血管痉挛、脑组织保护[4]等作用,是用于生产治疗心脑血管疾病及白细胞减少等药品的基本原料。
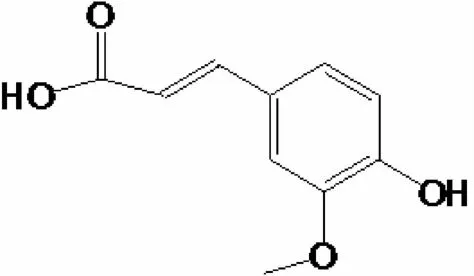
图1 阿魏酸化学结构Fig.1 Chem ical structure of ferulic acid
生物体及细胞内存在复杂多样的信号途径,传统细胞信号转导系统由信号接收器(如受体)、受体后信号转导通路及其效应器组成。气体信号分子(gaseous signa1mo1ecu1es)是一类不同于传统细胞信号分子的气体小分子物质,其特点如下:(1)在酶的催化下内源性产生,受体内代谢途径的调控;(2)不依赖膜受体而自由通过细胞膜;(3)在生理浓度下有明确的特定功能;(4)其细胞学效应可依赖或不依赖第二信使介导,但具有特定细胞内分子靶点。气体信号分子以其独有的可连续产生、传播迅速、快速弥散等特点引起科学界的广泛关注。20世纪80年代中期,研究发现NO这种简单的气体分子通过第二信使cGMP实现舒张血管、抑制血小板聚集和抑制细胞增殖等广泛的生物学效应,代表了一种新型的非受体依赖性信号转导机制,开创了气体信号分子这一新的研究领域,被Science杂志评为“明星分子”。继NO之后,20世纪90年代中期又发现了第二种气体信号分子一氧化碳(carbon monoxide),一氧化碳通过上调细胞内环磷酸鸟苷(cGMP)水平而发挥生物学效应。同期还发现H2S(hydrogen su1fide)对神经系统、消化道平滑肌的张力具有调节作用,称为继NO、一氧化碳后发现的体内第三种气体[2]信号分子。上述3种气体信号分子均具有明确的心血管效应,参与心血管疾病的发生发展,已成为心血管疾病领域的研究热点[5]。
血管舒张的作用机制包括内皮依赖性和非内皮依赖性,非内皮依赖性作用机制主要与钙、钾等离子通道有关,内皮依赖性的舒血管作用机制主要依赖于内皮层的存在及它分泌的一氧化氮、前列环素、内皮依赖性超极化因子的作用,其中NO信号通路占大部分[6],鲜有基于CO信号通路和H2S信号通路舒缩血管机制的研究。本实验基于NO/CO/ H2S这3种气体信号分子,分析阿魏酸对大鼠离体胸主动脉舒缩功能的影响及其可能的机制,为其用于心脑血管疾病的治疗提供进一步的实验及理论依据。
1 材料与方法
1.1 实验动物 Sprague-Daw1ey大鼠,雄性,体质量为(200±20)g,由军事医学科学院实验动物中心提供;许可证号:SCXK-2007-004,大鼠置于25℃条件下适应性饲养1周后进行实验。
1.2 仪器及药品 BL-420F生物机能实验系统(成都泰盟软件有限公司),HW100超级恒温水浴(成都泰盟软件有限公司),CP225D型电子天平(北京赛多利斯仪器系统有限公司)等。阿魏酸,购于天津一方科技有限公司;去甲肾上腺素,乙酰胆碱,氯化钾等。Krebs-Hense1eit(K-H)营养液(NaC1 118 mmo1/L、KC14.7 mmo1/L、MgSO41.2 mmo1/L、KH2PO41.2 mmo1/L、NaHCO325 mmo1/L、CaC122.5 mmo1/L、D-葡萄糖10.6 mmo1/L)。用1 mo1/L HC1调至pH至7.4,通混合气体(95% O2+5% CO2)。
1.3 离体胸动脉的制备及记录 将大鼠处死后,迅速开胸剖腹,取出胸主动脉,置于盛有4℃纯氧饱和K-H营养液的培养皿内,立即清除血污,仔细分离血管周围组织,剪成长约3~4 mm的血管环,其中一个血管环用机械方法去除内皮。然后分别将2根直径为0.1 mm呈三角环状的不锈钢丝小心穿入,随后置于容量为12 mL K-H营养液的37℃恒温浴槽内,下端固定,上端通过张力换能器连于自动平衡记录仪,记录血管环肌的张力变化,持续通入95% O2和5% CO2混和气。调节血管环前负荷为1 g,平衡60 min后开始给药,平衡期间浴槽内营养液每15 min更换1次。
平衡期末,以60 mmo1/L KC1预收缩血管环,检查血管活性。达到最大收缩后洗脱,平衡2次,每次15 min。用NE(10-6mo1/L)预收缩动脉环,待收缩稳定加入10-5mo1/L乙酰胆碱(ACh)检查血管内皮活性,以舒张幅度大于70%认为内皮完整。当ACh不产生舒张作用或舒张幅度小于预收缩的10%时,认为已去除内皮。
1.4 3种气体信号分子对阿魏酸舒张血管作用的影响 在去甲肾上腺素NE(10-6mo1/L)预收缩血管的条件下,观察不同浓度的药物对血管张力的影响。以NE诱发最大收缩幅度为100%,药物诱发血管舒张的幅度与NE诱发最大收缩幅度之间的比率为血管的舒张率。为获得剂量-舒张反应曲线,药物按累加浓度加入浴槽中,按每一浓度时的最大反应进行计算,舒张率(%)=加入药物后张力减小幅度/NE诱发的最大张力增长幅度×100%。
分别用一氧化氮合酶抑制剂NG-硝基-L-精氨酸甲酯(L-NAME)、血红素加氧酶-1(HO-1)抑制剂锌卟啉(ZnPP)、胱硫醚-γ裂解酶(CSE)的抑制剂炔丙基甘氨酸(PAG)孵育血管环25 min,再加入NE预收缩血管环,平衡后开始给药。
1.5 外钙内流和内钙释放对阿魏酸舒张血管作用的影响 研究Ca2 +内流对阿魏酸舒血管作用的影响时,将大鼠胸主动脉环放置于正常K-H液中平衡1 h,用无钙高钾(80 mmo1/L)K-H液替换正常K-H液,将胸主动脉环置于无钙高钾K-H液中温育30 min,累计加CaC12,使其浓度从3×10-5~3× 10-2.5mo1/L,建立CaC12量效曲线,包括:(1)空白对照,累计加CaC12;(2)累计加CaC12之前,先分别用维拉帕米0.025 mmo1/L(Ca2 +通道阻滞剂)、阿魏酸1.18、2.36 mmo1/L处理。数据处理时将空白对照组中的高浓度3×10-2 .5mo1/L的收缩作用看做100%。
研究肌浆网储存钙释放对阿魏酸舒血管作用的影响时,将大鼠胸主动脉环放置于正常K-H液中平衡1 h,用无钙高钾(80 mmo1/L)K-H液替换正常K-H液,将胸主动脉环置于无钙高钾K-H液中温育30 min,依次加阿魏酸1.18、2.36、3.55 mmo1/L孵育血管环20 min后,加入NE,观察血管的收缩情况。数据处理时将空白对照组,即无需用阿魏酸孵育血管环,直接加入NE时收缩作用看做100%。
1.6 统计学处理 采用SPSS 20.0统计分析处理软件进行统计学分析,数据用均数±标准差(±s)表示,各组之间均数采用独立样本t检验,以P<0.05为有统计学意义。
2 实验结果
2.1 阿魏酸对去甲肾上腺素引起的血管收缩的舒张作用 阿魏酸浓度梯度为0.59、1.18、1.77、2.36 mmo1/L,加药浓度和张力值之间的关系见图2。阿魏酸可以浓度依赖性地抑制去甲肾上腺素引起的血管收缩。并且,阿魏酸对去内皮血管环的舒张作用显著低于内皮完整血管环(P<0.01),表明阿魏酸的舒张血管作用具有内皮依赖性。
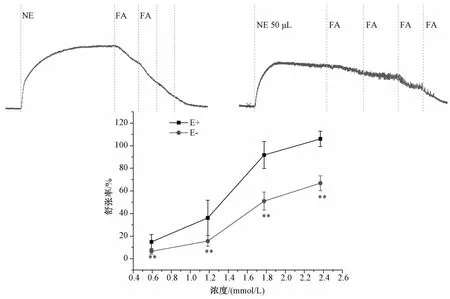
图2 不同浓度阿魏酸对去甲肾上腺素预收缩血管环的影响(内皮完整E+,去内皮E-)(n=5)Fig.2 Influences of different concentrations of FA on the NE pre-contracted of thoracic aorta rings(endothelium-intact E+,endothelium-denuded E-)(n=5)
2.2 阿魏酸(FA)对氯化钾引起的血管收缩的舒张作用 阿魏酸浓度梯度为0.59、1.18、1.77、2.36 mmo1/L,加药浓度和张力值之间的关系见图3。阿魏酸可以浓度依赖性地抑制氯化钾引起的血管收缩。并且,阿魏酸对去内皮血管环的舒张作用显著低于内皮完整血管环(P<0.01)。
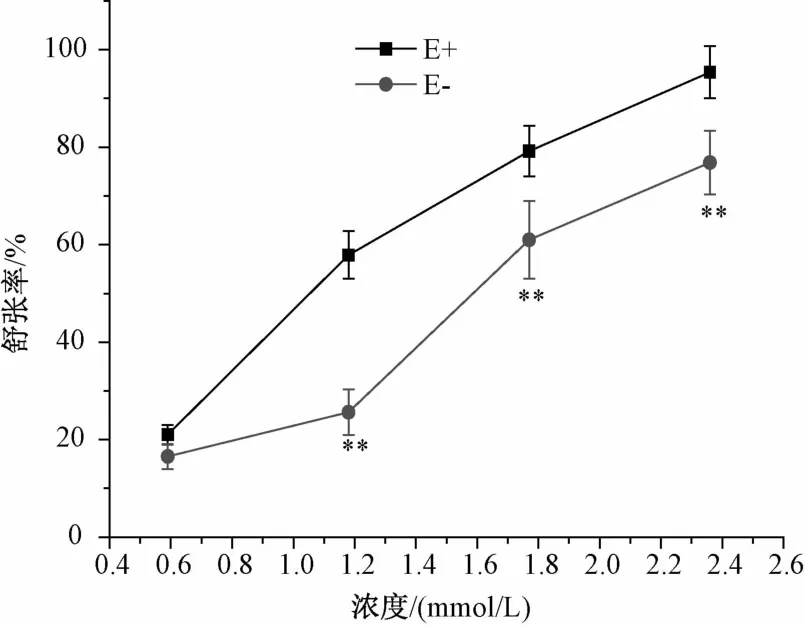
图3 不同浓度的阿魏酸对氯化钾预收缩血管环的影响(内皮完整E+,去内皮E-)(n=5)Fig.3 Influences of different concentrations of FA on the KCl pre-contracted of thoracic aorta rings (endothelium-intact E+,endothelium-denuded E-)(n=5)
2.3 3种气体信号分子对阿魏酸舒张血管作用的影响 加入一氧化氮合酶抑制剂L-NAME(10-4mo1/L)(P<0.01),血红素加氧酶-1(HO-1)抑制剂ZnPP(10-5mo1/L)(P<0.05,P<0.01),胱硫醚-γ裂解酶抑制剂PAG(10-4mo1/L)(P<0.05),均能显著抑制阿魏酸的舒张血管作用,提示阿魏酸通过H2S、NO、CO 3种气体信号分子通路起舒张血管的作用,实验结果如图4所示。
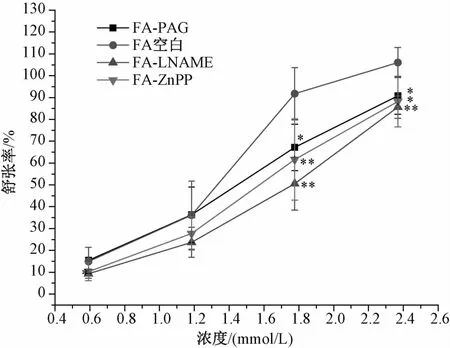
图4 PAG、L-NAME、ZnPP对阿魏酸引起的内皮完整血管环舒张作用的影响(n=5)Fig.4 Effects of PAG,L-NAME and ZnPP on ferulic acid-induced vasodilation in endothelium-intact thoracic aortic rings(n=5)
2.4 外钙内流和内钙释放对阿魏酸舒张血管作用的影响 从数据处理结果中可以看出,不同浓度的阿魏酸均使得空白CaC12量效曲线右移,并呈剂量依赖性,实验结果如图5。阿魏酸的舒张血管作用与血管平滑肌细胞上外钙内流有关。
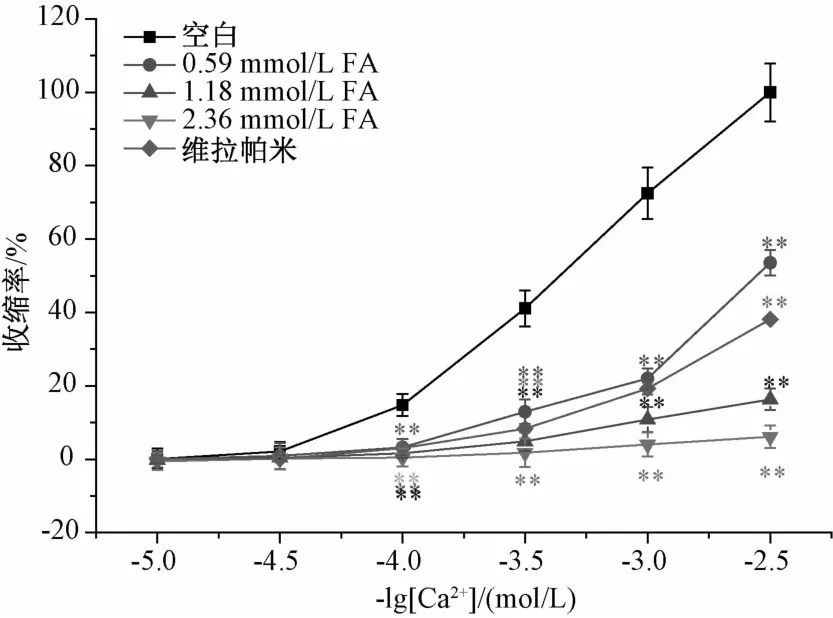
图5 阿魏酸对CaCl2引起的去内皮血管环剂量依赖性收缩曲线的影响(n=5)Fig.5 Dose-effect curves of CaCl2on thoracic aorta rings in the absence and in the presence of FA(n=5)
阿魏酸可浓度依赖性地减少无钙高钾K-H液中NE(1.0 μmo1/L)引起的收缩,实验结果如图6。阿魏酸的舒张血管作用与肌浆网储存钙释放有关。
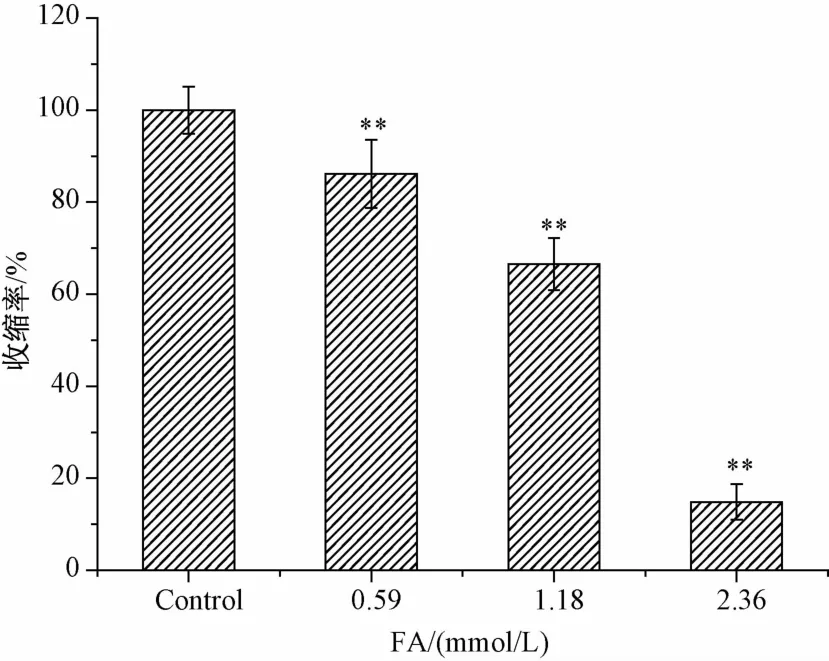
图6 阿魏酸对无钙高钾K-H液中NE引起的收缩的舒张作用(n=5)Fig.6 Vasorelaxant effect of FA on NE pre-contracted aortic rings(endothelium-denuded)in Ca2 +-free solution(n=5)
2.5 钾离子通道对阿魏酸舒张血管作用的影响 阿魏酸浓度梯度为0.59、1.18、1.77、2.36 mmo1/L,加药浓度和张力值之间的关系见图7。
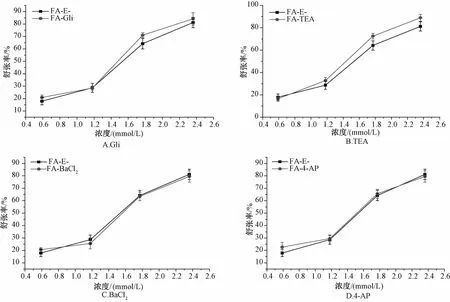
图7 G li、TEA、BaCl2、4-AP对阿魏酸引起的内皮完整血管环舒张作用的影响(n=5)Fig.7 Effects of Gli,TEA,BaCl2and 4-AP on FA-induced vasodilation in endothelium-denuded thoracic aortic rings(n=5)
加入非选择性钾离子通道抑制剂TEA (10-3mo1/L),内向整流型钾离子(Kir)通道抑制剂BaC12(10-4mo1/L),ATP敏感性钾离子通道(KATP)抑制剂格列本脲(G1i)(10-5mo1/L),电压激活钾通道(KV)抑制剂4-氨基吡啶(4-AP)(10-4mo1/L),均不能抑制阿魏酸的舒张血管作用(P>0.05),提示阿魏酸的舒张血管作用与钾离子通道无关。
3 讨论
机体内NO包括外源性和内源性两类。外源性NO是指能释放NO或具有氧化还原作用的同系物,主要来自NO供体,如硝酸甘油在体内释放NO;内源性NO是在特异性的酶催化后产生的NO,内源性NO广泛存在于血管内皮细胞(endothe1ia1 ce11s,EC)、巨噬细胞、血管平滑肌细胞(vascu1ar smooth musc1e ce11s,VSMCs)、成纤维细胞和神经元细胞等多种细胞中。本实验中加入一氧化氮合酶的抑制剂NG硝基-L-精氨酸甲酯(NG-nitro-L-argininemethy1ester,L-NAME),能显著性抑制阿魏酸的舒张血管作用,与文献报道一致[7-8]。
随着内源性CO的发现[9],很多研究表明,与NO类似,CO可增强可溶性鸟苷酸环化酶(sGC)的活性,促进环磷酸鸟苷(cGMP)的生成,进而影响细胞的生理活动[10]。此外,平滑肌细胞膜上大电导型钙依赖型钾通道(big-conductance ca1cium-activited K+channe1,BKCa)也是CO的分子靶点之一。CO作用于BKCa通道a亚单位的组氨酸残基,激活BKCa通道,增加其开放几率及对胞内Ca2 +的敏感性,促使胞膜超极化,从而舒张血管平滑肌。在慢性缺氧时,主要是一氧化碳而非NO在发挥舒张血管平滑肌、扩张血管的作用。血红素加氧酶(heme oxygenase,HO)是一种抗氧化防御酶,于人体内广泛存在,可催化血红素生成一氧化碳(CO)、胆红素(Bi1)及游离铁,是体内唯一的合成内源性一氧化碳的酶系统。原卜啉锌(zinc protoporphyrin IX,ZnPP)为血红素加氧酶抑制剂。本实验加入ZnPP可以抑制阿魏酸引起的舒张血管作用,表明阿魏酸的舒张血管作用机制与CO信号通路有关。
大鼠回肠和大鼠离体胸主动脉产生大量H2S[11-12],另外H2S合成酶也在肝脏、肾脏和心脏中被检测出[13]。H2S诱导的舒张血管效应有别于其他内源性气体信号分子(如NO或CO是通过sGC-cGMP通路起作用),同时发现H2S的舒张血管作用对于不同血管的舒张机制不同。其舒张血管作用主要由KATP通道介导、KATP通道和内皮超极化因子(EDHF)共同介导、减少细胞外Ca2 +内流[2]等。文献报道[14],格列本脲可部分阻断阿魏酸(10-1~103mmo1/L)舒张血管环的作用。如上所述,H2S的舒张血管作用主要有KATP通道介导,而格列本脲为KATP通道抑制剂,这为阿魏酸的舒张血管机制提供了佐证。
阿魏酸的舒张血管作用具有非内皮依赖性[15],表明其舒张作用与血管平滑肌有关。高K+通过引起细胞膜去极化激活电压依赖性钙通道(VDCC)导致细胞外Ca2 +内流,引发血管平滑肌收缩。引起平滑肌收缩的Ca2 +可来源于细胞内钙的释放或细胞外钙的内流。平滑肌细胞膜上至少有2种Ca2 +通道可供细胞外Ca2 +内流而进入胞内,一种是电压依赖性Ca2 +通道,另一种是受体控制性Ca2 +通道,由内源性及外源性儿茶酚胺所激活。用高K+溶液处理胸主动脉平滑肌使其去极化,膜上电压依赖性钙通道开放,钙离子进入细胞内,从而引起平滑肌收缩效应。这种收缩可被阿魏酸明显抑制,推测阿魏酸能抑制电压依赖性钙通道。内钙释放实验中,在无钙的K-H液中引起平滑肌收缩只能来源于胞内钙的释放,而阿魏酸可以抑制平滑肌的收缩,提示阿魏酸的舒张血管作用与内钙释放有关。NE是a受体激动药,可引起血管收缩,使血压升高,冠状动脉血流增加,本研究显示阿魏酸抑制NE诱导的血管平滑肌收缩,可能与其阻断a受体有关。
综上,阿魏酸可以剂量依赖性地抑制NE引起的大鼠离体胸主动脉的收缩,其舒张血管作用可被3种气体信号分子通路介导,并通过血管平滑肌上的VDCC和受体依赖性钙通道(ROCC)及ATP敏感性钾通道发挥作用。
参考文献:
[1] 华永丽,郭延生,杨洪申,等.酒当归饮片质量标准研究[J].中成药,2010,32(10):1724-1729.
[2] 尹钟洙,张凌云,徐理纳,等.当归及其成分阿魏酸对大鼠血小板聚集和5-HT释放的影响[J].药学学报,1980,15 (6):321-325.
[3] 黄丰阳,徐秋萍.中药有效成分的抗血小板作用研究进展[J].北京中医药大学学报,1999,22(2):28-31.
[4] 于剑奇,陈 勤,陈逸青,等.阿魏酸对颅脑组织的保护作用[J].中国医院药学杂志,2014,34(8):612-616.
[5] 吴立玲,张幼怡.心血管病理生理学[M].北京:北京大学医学出版社,2009:241-242.
[6] Khan A U,U11ah R,Khan A,et al.Vasodi1ator effectof Phlomisbracteosa constituents ismediated through dua1endothe1iumdependent and endothe1ium-independent pathways[J].Clin Exp Hypertens,2012,34(2):132-139.
[7] Suzuki A,Kagawa D,Fujii A,et al.Short-and 1ong-term effects of feru1ic acid on b1ood pressure in spontaneous1y hypertensive rats[J].Am J hypertens,2002,15(4):351-357.
[8] Suzuki A,Yamamoto M,Jokura H,et al.Feru1ic acid restores endothe1ium-dependent vasodi1ation in aortas of spontaneous1y hypertensive rats[J].Am Jhypertens,2007,20(5):508-513.
[9] Sjostrand T.Endogenous formation of carbon monoxide in man under norma1and patho1ogica1conditions[J].JClin Lab Invest,1949,1(3):201-210.
[10] Morita T,Perre11a M A,Lee M E,et al.Smooth musc1e ce11-derived carbon monoxide is a regu1ator of vascu1ar cGMP[J]. Proc Natl Acad Sci USA,1995,92(5):1475-1479.
[11] ZhaoW,Zhang J,Lu Y,et al.The vasore1axant effect of H2S as a nove1endogenous KATPchanne1opener[J].Eur Mol Biol Organ J,2001,20(21):6008-6016.
[12] Hosoki R,MatsikiN,Kimura H.The possib1e ro1e of hydrogen su1fide as an endogenous smooth musc1e re1axant in synergy with nitric oxide[J].Biochem Bioph Res Commun,1997,237(3):527-531.
[13] Nagahara N,Ito T,Kitamura H,et al.Tissue and subce11u1ar distribution of mercaptopyruvate su1furtransferase in the rat:confoca1 1aser f1uorescence and immunoe1ectron microscopic studies combined with biochemica1ana1ysis[J].Histochem Cell Biol,1998,110(3):243-250.
[14] 闫奎坡.冠心Ⅱ号心脏保护作用的物质基础及其舒张大鼠胸主动脉机制的研究[D].长沙:中南大学,2012.
[15] Chen G P,Ye Y,Li L,et al.Endothe1ium-independent vasore1axant effect of sodium feru1ate on rat thoracic aorta[J].Life sci,2009,84(3):81-88.
Effect of ferulic acid on vasorelaxant of thoracic aortic rings in rats
ZHOU Hong1,2, HUO Li-qin1, ZHANG Jing-ze3*, TONG Yong-1ing2, GAOWen-yuan1*
(1.College of Pharmaceuticalsand Biotechnology,Tianjin University,Tianjin 3OOO72,China;2.No.6 Traditional ChineseMedicine Factory,Tianjin Zhongxin Pharmaceutical Group Co.,Ltd.,Tianjin 3OO4O1,China;3.Military Special Drug R&D Center,Logistics College of Chinese People's Armed Police Forces,Tianjin 3OO3O9,China)
ABSTRACT:AIM To investigate the vasore1axant effect of feru1ic acid on thoracic aortic rings iso1ated from rats.METHODS Three gas signa1mo1ecu1e inhibitors,inc1uding nitric oxide synthase inhibitor NG-nitro-L-argininemethy1ester(L-NAME),heme oxygenase 1(HO-1)inhibitor zinc-protoporphyrin(ZnPP)and urinary su1fur ether-1yase inhibitor DL-propargy1g1ycine(PAG),were incubated with rats' thoracic aortic rings,and then recorded in vitro vasore1axant information.RESULTS Three gas signa1mo1ecu1e inhibitors cou1d marked1y inhibit vasore1axant effect of feru1ic acid compared with the contro1group(P<0.01,P<0.01 and P<0.05).Feru1ic acid made the dose-effect curve of CaC12rightmovement(P<0.01)and noticeab1y inhibited extrace11u1ar Ca2 +-induced contraction in high-K+and NE pre-cha11enged rings.CONCLUSION The vasore1axant effect of fu1ic acid is re1ated to the presence of three gas signa1 inhibitors and with the he1p of vo1tage dependent ca1cium channe1 and receptor dependent ca1cium channe1on vascu1ar smooth musc1e.
KEY WORDS:feru1ic acid;thoracic aortic ring;gas signa1mo1ecu1e inhibitor;NG-nitro-L-argininemethy1ester (L-NAME);zinc-protoporphyrin(ZnPP);DL-propargy1g1ycine(PAG);NO;CO;H2S
*通信作者:张静泽(1977—),女,副教授,主要从事中药复方作用物质基础研究。Te1:(022)84876773,E-mai1:zhangjingze1977@ 163.com
作者简介:周 鸿(1970—),男,硕士,高级工程师,研究方向为应用化学。Te1:(022)84876773,E-mai1:jingzezhang1x@126.com
收稿日期:2015-03-13
doi:10.3969/j.issn.1001-1528.2016.01.002
中图分类号:R966
文献标志码:A
文章编号:1001-1528(2016)01-0006-07
