盐旱交叉胁迫对大豆萌发期保护酶的影响
2016-03-30山西大同大学生命科学学院综合分析与测试中心山西大同037009
, , , (山西大同大学 .生命科学学院; .综合分析与测试中心, 山西 大同 037009)
盐旱交叉胁迫对大豆萌发期保护酶的影响
张永芳a,王润梅a,赵丽华b,刘丽萍a
(山西大同大学 a.生命科学学院; b.综合分析与测试中心, 山西 大同 037009)
为了研究盐旱交叉胁迫对大豆萌发期保护酶活性的影响,以中黄25号大豆为试验材料,采用水培法培养并对其进行盐旱交叉胁迫处理,测定胁迫下过氧化氢酶(CAT)和过氧化物酶(POD)的活性变化。结果表明:盐旱交叉胁迫下,随着胁迫程度的加剧,CAT活性整体呈下降趋势,其中180 mmol/L NaCl和25%~30% PEG-6000交叉胁迫处理时,CAT活性明显高于其它处理组;在同一盐分浓度和不同浓度PEG-6000交叉胁迫下, PEG-6000浓度梯度为20%,25%和30%时,随着PEG-6000浓度的增加,POD活性基本都呈下降趋势;但在同一PEG-6000浓度和不同盐浓度的交叉胁迫下,随着NaCl浓度的增加,POD活性却逐渐升高。以上结果表明,在150 mmol/L NaCl盐、20% PEG-6000旱胁迫下,大豆可通过调节其保护酶活性以适应逆境,增强抗盐、抗旱能力。
大豆; 盐旱交叉胁迫; 保护酶
大豆是优质蛋白和食用油脂的重要来源,在我国长江流域,黄河流域,江南以及东北三省,西南等地区多有种植,然而近几年来,其产量却呈下降趋势,原因是随着环境条件的变化,植物往往同时或相继经受多种环境胁迫[1],特别是盐胁迫和干旱胁迫,导致不能满足大豆各生育期需水量,使得根系欠发达,吸水困难[2]。因此,如何有效利用这些盐旱土壤,提高大豆产量成为目前农业研究的主要课题之一。
聚乙二醇(PEG)作为一种高分子渗透剂,亲水性较强[3],不能穿越植物细胞壁进入细胞质而引起质壁分离,因此可人工模拟干旱胁迫;氯化钠作为高浓度物质也可使细胞渗透失水而发生质壁分离、膜透性增加,膜内大量离子外渗[4-8],膜外大量Na+进入细胞内膜,细胞内膜两边离子失去平衡。
目前,关于盐或干旱单一耐性对大豆影响的研究较多。陈庆华研究了干旱胁迫对大豆苗期叶片保护酶活性等的影响,结果表明:随着干旱胁迫的加强,过氧化物酶(POD)和过氧化氢酶(CAT)等的活性表现为先升后降的趋势,轻度胁迫下质膜透性和丙二醛含量增幅较小,重度胁迫时增幅明显增大[9]。李建英等研究指出,干旱胁迫后化控种衣剂能提高大豆幼苗叶片POD和SOD的活性,提高抗旱性[10];高亚梅等研究了不同大豆品种在干旱胁迫下各相关酶系的变化,结果表明:干旱胁迫下大豆根中SOD,POD,CAT活性增加显著,从而得出SOD、POD、CAT都是大豆保护酶系统的重要组成部分的结论[11];许东河等研究了盐胁迫对大豆生理指标的影响,表明膜脂质过氧化是大豆盐伤害的重要原因[12]。但是针对盐和干旱交叉胁迫对大豆影响的研究却鲜有报道。
本研究拟以中黄25号大豆为实验材料,研究其萌发期在盐旱交叉胁迫下生理指标变化,探寻最有利于大豆生长的盐浓度和PEG浓度,为更好地利用盐碱土,提高大豆产量奠定理论基础。
1 材料与方法
1.1 材料及仪器
1.1.1 材 料
试验材料为中黄25号大豆种子。
1.1.2 仪 器
恒温培养箱、SP-754型紫外分光光度计(上海博迅实业有限公司)、ST 16 R型台式高速冷冻离心机(赛默飞世尔科技有限公司)、BS 223 S型精密电子分析天平(赛多利斯科学仪器有限公司)。
1.2 种子处理及试验设计
选用籽粒大小均匀、饱满的中黄25号大豆种子,用清水将其冲洗干净,然后经0.1% HgCl2溶液消毒8~9 min后,用蒸馏水冲洗3~4次,最后用温水(25 ℃)将其避光浸泡72 h左右进行催芽,待其胚芽长到1.5 cm左右时,全部放置到铺有3层滤纸、喷以Hoagland营养液(以刚浸湿滤纸为宜)的干净培养皿中,各培养皿放置6粒大豆种子,以进行相应的胁迫处理。本次试验采用随机区组试验设计,包括1个对照, 9个盐旱交叉胁迫处理,其中,3个盐分胁迫处理梯度为S 1(120 mmol/L),S 2(150 mmol/L)和S 3(180 mmol/L)NaCl溶液,每个处理3次重复。以PEG-6000人工模拟干旱胁迫。3个干旱胁迫梯度为轻度胁迫T 1(PEG-6000浓度为20%),中度胁迫T 2(PEG-6000浓度为25%),重度胁迫T 3(PEG-6000浓度为30%)。
1.3 试验方法及处理
盐旱胁迫各处理中,每个培养皿每次加3 mL NaCl溶液和3 mL PEG-6000溶液。
1.4 测定指标及方法
1.4.1 测定指标
胁迫处理10 d后选取发芽势好的大豆种子,先用蒸馏水冲洗一下,以清除豆子表面残留的NaCl溶液和PEG-6000溶液,然后称取0.5~1.0 g测定其保护酶活性,每个处理随机取样。采用紫外吸收法测定CAT的活性,用愈创木酚法测定POD的活性。每个处理以1 min内A240降低0.1为1个CAT酶活性单位;以470 nm波长下,每分钟OD增加0.01定义为1个POD酶活性单位。
1.4.2 测定方法
CAT活性测定:测定方法参照文献[13]。
POD活性测定:将称取好的大豆种子1.0 g剪碎置于已在冰中预冷的研钵中,加少量石英砂和少量磷酸缓冲液(pH=7.0),冰浴研磨匀浆后转移至50 mL容量瓶中定容,摇匀。取5 mL于离心管,同样在4 ℃、15 200 r/min下冷冻离心20 min,上清液即为POD酶液。取10 mL具塞试管3支(3次重复),各加入酶液1 mL,0.1%愈创木酚1.0 mL,磷酸缓冲液(pH=7.0)1.0 mL,摇匀,加入0.18% H2O21.0 mL后,于25 ℃下准确反应10 min,最后分别加5%偏磷酸0.2 mL终止反应。用蒸馏水调零,于分光光度计上测定3支试管的A470,每30 s读数1次,共测6次。
1.4.3 CAT和POD酶活性计算公式
CAT活性[U/(g·min)]=ΔA240×Vt/0.1×Vs×t×FW
式中,ΔA240为反应时间内吸光度的变化值(降低);Vt为酶提取液总体积(5 mL);Vs为测定时取酶液的体积(0.1 mL);t为测定时的总时间(3 min);FW为样品鲜重(0.5 g)。
POD活性[U/(g·min)]=ΔA470×Vt/FW×Vs×t
式中,ΔA470为反应时间内吸光度的变化值(升高);Vt为酶提取液总体积(5 mL);Vs为测定时取酶液的体积(1.0 mL);t为测定时的总时间(3 min);FW为样品鲜重(1.0 g)。
1.5 数据处理
采用Excel和SPSS软件对数据进行分析。
2 结果与分析
2.1 盐旱交叉胁迫下中黄25号发芽种子中CAT活性变化
由图1可知,在不同盐浓度处理下,随着盐浓度的增加,CAT活性整体基本上呈下降趋势。在同一NaCl浓度和不同PEG-6000浓度胁迫下,随着干旱胁迫程度的增加,CAT活性也基本呈下降趋势,但在180 mmol/L NaCl和25% PEG-6000交叉胁迫下,CAT活性却明显高于另外2个处理组,这说明较高盐分与干旱交叉胁迫能刺激CAT活性升高,迅速清除过多的自由基,从而防止对膜上以及膜内不饱和脂肪酸的过氧化作用。
图2表明,在不同浓度PEG处理下,在轻度干旱(20% PEG-6000)胁迫下,随着盐分胁迫浓度的增加,CAT活性呈先上升后下降的趋势。在中度干旱胁迫下,随着盐分浓度的增加CAT活性大致呈上升趋势,同时可以明显看出,中等浓度150 mmol/L NaCl 胁迫下相对于120 mmol/L NaCl胁迫下的CAT活性略有下降,不显著(p=0.843gt;0.05),但在180 mmol/L NaCl胁迫下CAT 活性远远高于前两者,CAT活性在此时达到最大值。可能是它在较高盐分和干旱的交叉胁迫下活性大增,清除自由基的能力增强,从而避免因自由基积累引发的膜脂过氧化作用对细胞造成的伤害,因而对高强度的逆境有一定的适应能力。在重度干旱和不同盐分交叉胁迫下,CAT活性相对于轻度和中度干旱胁迫下的都低,这可能是由于胁迫程度加剧,其抗氧化能力降低,自由基大量积累,膜脂发生过氧化作用,细胞膜遭到破坏,但在这同一重度干旱胁迫水平下,180 mmol/L NaCl胁迫时,CAT活性比前两者都高。其中,高盐胁迫与中等盐胁迫下CAT活性达到显著差异(p=0.019lt;0.05)。这说明在细胞已遭受严重伤害的情况下,CAT还能继续维持一定时间的稳定性,甚至通过升高活性来尽可能降低自由基对细胞的伤害。这同样再次说明了中黄25号大豆耐盐力高的品质优势是使其高产的原因之一。
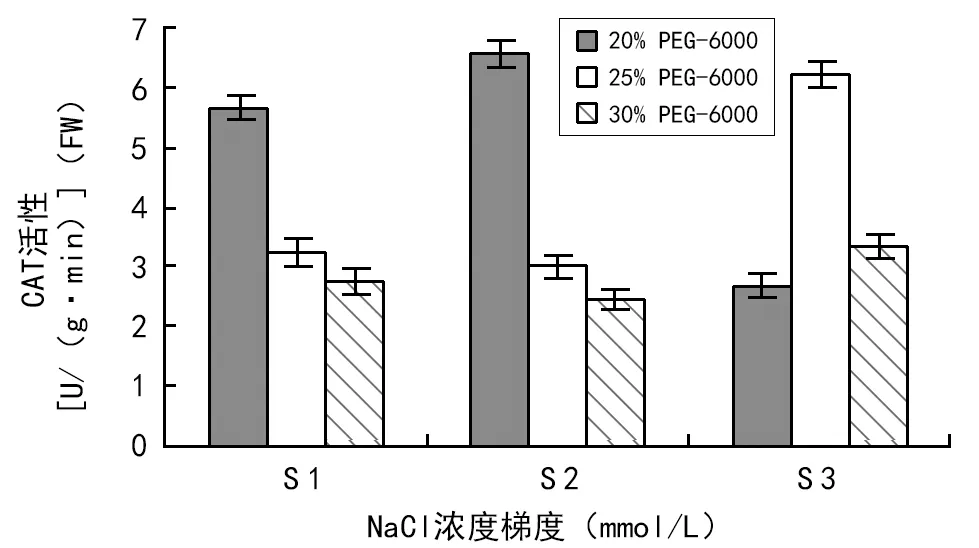
图1 盐旱交叉胁迫下CAT活性变化

图2 盐旱交叉胁迫下CAT活性变化
通过单因素方差分析,在不同的交叉胁迫下进行多重比较,各个处理组之间CAT活性变化不显著(p=0.348gt;0.05),说明不同盐旱交叉胁迫对CAT的活性影响不是很大,可能CAT不是中黄25号大豆起主要作用的保护酶。
2.2 盐旱交叉胁迫下中黄25号发芽种子中POD活性变化
由图3可知,在同一NaCl浓度和不同浓度的PEG-6000交叉胁迫下,随着PEG-6000溶液浓度的增加,POD活性基本都呈下降趋势。但在120 mmol/L NaCl和不同浓度的PEG-6000交叉胁迫下,POD活性先升高后降低,但在轻度干旱(20% PEG-6000)和中度干旱(25% PEG-6000)胁迫下的活性变化达极显著(p=0.001lt;0.01),这可能是由于中黄25号大豆具有一定的抗旱性,它能迅速提高POD的活性来清除氧自由基,免除了细胞发生过氧化,因此,此时的逆境对种子影响不大,种子受水分胁迫较小,产生的氧自由基等不多。
由图4可知,在同一浓度的PEG-6000和不同浓度的NaCl交叉胁迫下,随着胁迫程度的加剧,POD活性整体在逐渐下降。而在各同一干旱胁迫水平,即PEG-6000浓度梯度为20%,25%和30%下,随着NaCl胁迫浓度的增加,POD活性基本呈上升趋势。在轻度干旱(20% PEG-6000)胁迫处理水平,随着盐分胁迫处理浓度的增加,150 mmol/L和180 mmol/L NaCl胁迫下POD活性都升高,在浓度为180 mmol/L NaCl胁迫下达到最大值;在中度干旱胁迫处理水平POD活性变化和上述情况一样, 这表明中黄25号大豆在一定的较高盐和干旱交叉胁迫范围内,能通过迅速提高POD活性,清除自由基,免除了氧自由基对细胞质膜的破坏作用,维持细胞内的稳态和生命代谢的正常运行,表现出一定的适应能力;在重度干旱胁迫处理水平,POD活性相较于中度干旱胁迫下明显降低,可能双重胁迫下,自由基大量产生并积累,胞质膜发生过氧化作用而遭到破坏,同时也可从图中得知,随着NaCl胁迫浓度的增加,POD活性基本也呈上升趋势,在180 mmol/L NaCl胁迫下达到最大值。上述结果表明,中黄25号大豆具有一定的抗盐和抗旱能力,虽然随着二者交叉胁迫程度的增加,POD活性整体下降,但在各个干旱胁迫浓度梯度下,POD活性随着盐浓度的增加活性都保持相对较高水平,尤其是在180 mmol/L NaCl胁迫下较150 mmol/L NaCl胁迫下保持较高水平,呈现一定的稳定性,这可能与中黄25号为高产大豆品种有关。
用单因素方差分析,在不同的交叉胁迫下,通过多重比较,各个处理组整体之间POD活性变化不显著(p=0.175gt;0.05)。但是,在低盐与重度干旱交叉胁迫处理组下POD活性和高盐与轻度干旱交叉胁迫处理组下POD活性有显著差异(p=0.029lt;0.05);在中等盐胁迫处理水平下,轻度干旱和重度干旱胁迫下的POD活性达到显著差异(p=0.027lt;0.05);同样,在高盐胁迫处理水平下,轻度干旱和重度干旱胁迫下的POD活性也达到显著差异(p=0.05)。此外,在中等盐与重度干旱胁迫处理组下POD活性有显著差异(p=0.013lt;0.05)。以上结果说明,POD是中黄25号大豆保护系统中主要的保护酶之一。
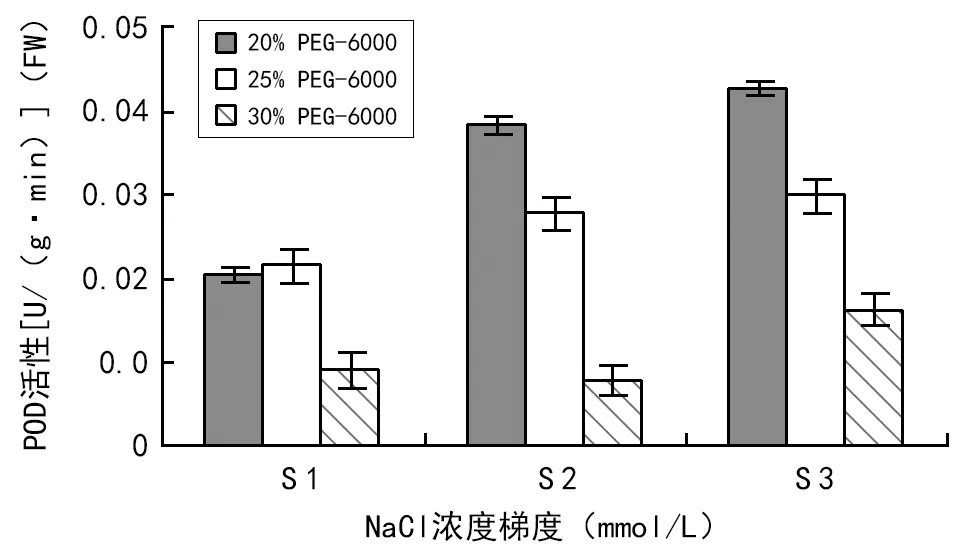
图3 盐旱交叉胁迫下POD活性变化
3 讨论与结论
自由基伤害学说认为,植物细胞中存在着能清除活性氧自由基的保护酶系,如CAT、POD等,它们的协调作用能有效清除羟自由基、H2O2等自由基,防御膜脂过氧化,使细胞免受其伤害[14]。根据这个学说,通过在实验室内人工模拟或实地研究在现实存在的各种逆境下,不同植物体内的保护酶,如SOD、CAT、POD活性的变化,以此来作为植物抗逆性强弱的一种指标,同时也可以作为鉴定特定品种特性的依据。
本研究以高产大豆品种中黄25号进行了不同的盐旱交叉胁迫处理,结果表明:中黄25号大豆具有较强的抗盐与抗旱性,且抗盐能力更高,它的CAT和POD活性在高盐和各种水平的干旱交叉胁迫下仍能保持相对较高的活性和稳定性,甚至有活性升高的表现。其中CAT活性和POD活性在20% PEG-6000和150 mmol/L NaCl交叉胁迫处理下都处于较高水平,同时最有益于大豆的生长。而保护酶起着关键作用,可清除自由基,防止自由基对膜上和膜内的不饱和脂肪酸的氧化,保护膜的完整性使种子免受伤害。由于实验条件的限制,本实验仅仅对发芽期大豆的2个保护酶的活性变化进行了研究,其他大豆苗期在盐旱交叉胁迫下保护酶活性变化有待进一步探讨。
[1]杨鹏辉,李贵全,郭丽,等.干旱胁迫对不同抗旱大豆品种花荚期质膜透性的影响[J],干旱地区农业研究,2003,21(3):127-129.
[2]王海珍,梁宗锁,郝文芳.白刺花适应土壤干旱的生理学机制[J].干旱地区农业研究,2005,23(1):106-110.
[3]Atress SM,Foeke LC.Embryogeny of gymnosperms:advances in synthetic seed technology of conifers[J].Plant cell,Tissue and Organ Culture,1993,35(1):1-3.
[4]ZHU JK.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Bio,2002,53:247-273.
[5]MAHY,GUOR,LIHA,et al.Study on salinity tolerance of tomatoes during seed germination under different salt stress conditions[J].Agricultural Scienceamp; Technology,2008,9(4):4-7.
[6]秦红艳,沈育杰,李昌禹,等.不同葡萄品种膜脂过氧化和保护酶活性对盐胁迫的响应[J].北方园艺,2010(20):4-9.
[7]孙国荣,关畅,阎秀峰,等.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-38.
[8]王善广,张华云,郭郢,等.生物膜与果树抗寒性[J].天津农业科学,2000,6(1):37-40.
[9]陈庆华.干旱胁迫对大豆幼苗叶片保护酶活性和膜脂过氧化作用的影响[J].安徽农业科学,2009,37(14):6 396-6 398.
[10]李建英,田中艳,周长军,等.干旱胁迫下化控种衣剂对大豆幼苗生长发育及保护酶活性的影响[J].大豆科学,2010,29(4):611-614.
[11]高亚梅,韩毅强,杜吉到,等.干旱胁迫对大豆酶活性的影响[J].黑龙江八一农垦大学学报,2007,19(4):13-16.
[12]许东河,李冬艳,陈于和.盐胁迫对大豆膜透性丙二醛含量及过氧化物酶活性的影响[J].华北农学报,1993,8(S 1):78-82.
[13]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:214-218.
[14]Fridovich I.Biological effects of the superoxide radical[J].Archives Biochemistry and Biophysics.1986,247(1):1-11.
Effects of Salt and Drought Intercross Stresses on Activity of Protective Enzymes in Germination Stage of Soybean
ZHANGYongfanga,WANGRunmeia,ZHAOLihuab,LIULipinga
2016-06-30
山西大同大学校级科研项目(编号:2015 Q 15)。
张永芳(1982—),女,山西朔州人;讲师,硕士,研究方向:植物生理及分子生物学;E-mail:107987188@qq.com。
10.16590/j.cnki.1001-4705.2016.11.096
S 565.1
A
1001-4705(2016)11-0096-04
