胸腺神经内分泌肿瘤手术治疗及预后因素
2016-03-30陈野野刘洪生李单青秦应之
陈野野,刘洪生,李单青,黄 诚,李 力,秦应之
中国医学科学院 北京协和医学院 北京协和医院胸外科,北京100730
胸腺神经内分泌肿瘤手术治疗及预后因素
陈野野,刘洪生,李单青,黄 诚,李 力,秦应之
中国医学科学院 北京协和医学院 北京协和医院胸外科,北京100730
目的 探讨胸腺神经内分泌肿瘤 (neuroendocrine tumors of the thymus,NETT)的临床特点、手术为主的综合治疗经验及相关预后因素。方法 2004年12月至2013年12月在北京协和医院诊治并经手术病理证实为NETT的患者26例,其中男性18例,女性8例,回顾性分析其临床表现、影像学资料、手术为主的综合治疗方案、围术期并发症及随访情况。结果 26例患者就诊时中位年龄为46岁 (13~75岁),中位病程为3.5个月 (1~84个月)。起病隐匿,临床症状不特异,7例合并库欣综合征,1例合并多发性内分泌腺瘤病1型。胸部增强CT可见胸腺区占位。所有患者均接受开胸手术切除治疗,22例肿瘤大体完整切除。无围术期死亡病例,出现并发症3例。16例患者术后行辅助治疗。术后病理类型为高分化的神经内分泌癌20例 (典型类癌8例,不典型类癌12例),低分化的神经内分泌癌6例 (小细胞神经内分泌癌5例,大细胞神经内分泌癌1例)。Masaoka-Koga分期为Ⅰ期4例,Ⅱ期3例,Ⅲ期12例,Ⅳ期7例。长期随访结果示中位生存期为51.0个月,3年、5年生存率为71.0%和44.6%。多因素分析结果示肿瘤分化程度 (P=0.039)及分期 (P= 0.012)是影响预后的因素。结论 NETT是一种罕见的侵袭性极强的恶性病变,临床表现不特异,早期诊断及治疗存在很大难度,早期行增强CT有助于发现病变及评估手术可行性。肿瘤分化程度及分期可能是影响预后的主要因素。
神经内分泌肿瘤;胸腺;手术治疗;预后
Med J PUMCH,2016,7(3):190-194
胸腺神经内分泌肿瘤 (neuroendocrine tumors of the thymus,NETT)是一类极为罕见的恶性肿瘤。自1972年被首次报道,至今全球仅报道数百例[1-3]。NETT既往多被称为胸腺类癌 (thymic carcinoid),2004年正式命名为NETT并将其病理分型更新为高分化的神经内分泌癌,包括典型类癌 (typical carcinoid)和不典型类癌 (atypical carcinoid),以及低分化的神经内分泌癌,包括小细胞和大细胞神经内分泌癌[4]。NETT临床表现较为复杂,可为散发病例,也可合并多发性内分泌腺瘤病1型 (multiple endocrine neoplasia type 1,MEN-1)[5],另外文献报道约有10%~30%的病例可分泌促肾上腺皮质激素 (adrenocorticotropic hormone,ACTH),从而导致库欣综合征 (Cushing's syndrome)[6-7]。由于其为罕见疾病,且临床表现较为复杂,涉及多学科,目前尚缺乏诊治经验及临床治疗指南。文献报道手术完整切除是目前最佳治疗方案。本文回顾性分析北京协和医院自2004年后近10年间在新病理分型指导下经手术切除治疗且病理明确诊断的26例NETT资料,旨在总结以手术为主的综合治疗疗效,并分析其潜在的预后因素。
资料和方法
一般资料
2004年12月至2013年12月在北京协和医院诊治、术前评估为可切除病灶并经手术病理证实为NETT的患者共26例,其中男性18例,女性8例 (2.25∶1),中位年龄46岁 (13~75岁)。本组患者占同期因胸腺肿瘤在本院胸外科行手术切除治疗患者的4.2% (26/612)。所有患者均行胸部增强CT进行术前诊断及手术可行性评估。
治疗方法
对患者采取以手术为主辅以放化疗的综合治疗。手术方式根据肿瘤的部位、大小、是否侵及上腔静脉系统 (双侧无名静脉、上腔静脉主干)等具体情况不同而采用正中开胸或侧开胸,无胸腔镜切除病例。术中切除肿瘤及胸腺、纵隔脂肪组织及肿大淋巴结,肿瘤侵犯的部分脏器组织如纵隔胸膜、血管、心包、肺组织等予以一并切除,以期达到完整切除,必要时需要行无名静脉或上腔静脉人工血管重建术。肿瘤分期参考Masaoka-Koga分期标准[8]。术后根据情况行辅助治疗并于门诊随诊。
统计学处理
应用SPSS 19.0软件进行数据分析,符合正态分布的计量资料采用均数±标准差表示,非正态分布采用中位数表示。应用Kaplan-Meier生存曲线及Log-rank单因素检验分析生存时间及预后相关因素。生存期计算为自手术日期到患者死亡或末次随诊日期。选择年龄 (中位年龄为界)、性别、肿瘤大小 (最大径线中位值为界)、分化程度 (高分化与低分化)、是否合并库欣综合征、Masaok-Koga分期 (Ⅰ、Ⅱ、Ⅲ期为一组,Ⅳ期为一组)以及术后是否接受辅助治疗等变量因素,应用Log-rank检验进行单因素分析其对生存期是否存在影响,并将单因素分析中P<0.25的变量代入Cox回归模型行多因素分析。以P<0.05为差异有统计学意义。
结果
临床症状及影像学表现
26例患者中位病程为3.5个月 (1~84个月)。3例 (11.5%)患者无任何症状,常规体格检查发现。7例 (26.9%)因库欣综合征就诊查出胸腺占位,1例 (3.8%)因MEN-1行进一步检查发现胸腺病变,2例 (7.7%)因神经系统症状检出胸腺肿瘤,无并发重症肌无力的患者。13例患者有局部症状主诉,包括胸痛6例 (23.1%),胸闷气短4例 (15.4%),咳嗽2例 (7.7%),咽部异物感1例 (3.8%)。胸部增强CT发现病变位于胸腺区,有的表现为边界清楚的类圆形结节 (图1A),也有为分叶状肿物,边界不清、膨胀生长或侵袭性生长 (图1B),病变可见增强。胸部增强CT可初步评估是否为侵袭性并判断手术可行性。
手术方法及术中情况
手术采用正中开胸切口18例,侧开胸切口6例,因肿瘤巨大采用正中开胸+侧开胸切口2例。22例(84.6%)肿瘤大体完整切除,4例可见残留。肿瘤中位最大径为5.5 cm(2.5~18.0 cm)。术中除切除肿瘤组织外,合并肺组织切除11例,心包部分切除9例,单侧膈神经切除2例,上腔静脉侧壁切除修补1例,上腔静脉或无名静脉切除人工血管置换3例 (表1)。无围术期死亡病例,术后并发症3例,1例为Ⅱ型呼吸衰竭,呼吸机支持治疗2周后好转;1例为右侧无名静脉血栓形成,抗凝治疗后好转;1例为伤口感染。
术后辅助治疗
术后接受单纯放疗5例,单纯化疗2例,放化疗结合治疗9例,未行辅助治疗10例。

图1 可发现胸腺病变并评估手术可行性的增强CT图像A.胸腺区椭圆形结节 (箭头),边界尚光整。术中探查病变有包膜,未侵犯纵隔胸膜。术后病理为典型类癌,Masaoka-KogaⅡ期;B.胸腺区分叶、不规则肿物 (箭头),不均匀增强,边界不清晰,左侧胸膜、心包及左侧无名静脉受累。术中探查病变外侵,切除受累胸膜、心包、左侧无名静脉并行左无名-右心房人工血管搭桥术。术后病理为不典型类癌,Masaoka-KogaⅢ期

表1 26例胸腺神经内分泌肿瘤的手术方式、切除范围、分期及病理情况
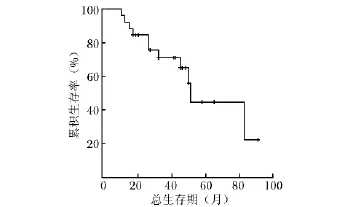
图2 胸腺神经内分泌肿瘤患者Kaplan-Meier生存曲线示中位生存期为51.0个月(95%CI:48.5~53.5)
病理结果及分期
病理类型为高分化的神经内分泌癌20例 (典型类癌8例,不典型类癌12例),低分化的神经内分泌癌6例 (小细胞神经内分泌癌5例,大细胞神经内分泌癌1例)。Masaoka-Koga分期为Ⅰ期4例,Ⅱ期3例,Ⅲ期12例,Ⅳ期7例 (表1)。
生存期及预后因素
随访结果显示NETT患者总中位生存期为51.0个月 (95%CI:48.5~53.5)(图2)。3年和5年生存率分别为71.0%及44.6%。11例患者死亡,其中1例术后15个月时死于化疗毒副作用,1例术后50个月时死于心脏疾病,另9例死于肿瘤进展。Log-rank单因素分析结果显示,对NETT患者预后有显著影响的因素为分期(Ⅰ~Ⅲ期比Ⅳ期,P=0.009);其他因素包括性别(P= 0.690)、年龄 (P=0.307)、肿瘤大小 (P=0.147)、分化程度 (P=0.228)、是否完整切除(P=0.174)、是否合并库欣综合征 (P=0.076)以及术后是否行辅助治疗 (P=0.477)均对生存期无显著影响。将单因素分析中肿瘤大小、分期、分化程度、是否完整切除、是否合并库欣综合征及术后是否行辅助治疗几个因素 (P<0.25)代入Cox模型行多因素分析,发现分化程度高的NETT及Ⅰ~Ⅲ期NETT的生存期有显著优势 (P=0.039,P=0.012)(表2)。
讨论
胸腺肿瘤是前上纵隔最常见肿瘤,占所有肿瘤病变的0.2%~1.5%,为少见病,而NETT在胸腺肿瘤中仅占2%~5%,属罕见疾病[9],美国报道其年发病率约为5.25/10万[1,3]。NETT为较新的病种,1972年才被首次报道,由于病例数稀少,且常合并副肿瘤综合征(文献报道20%~40%)如异位ACTH综合征、MEN-1等,涉及多学科诊疗,临床经验总结及指南匮乏,诊疗难度很大,预后较差[7,10]。首次报道至今约40年,文献多为病例报告或小规模病例总结,国内外单中心报道最大病例数也仅为28例,多中心最大样本量报道来自美国流行病监督及最终结果资料库 (Surveillance,Epidemiology,and End Results,SEER),共160例患者,男∶女为2.63∶1(116/44),中位年龄57岁,中位生存期64个月[1,3,7,10-11]。因2004年重新制定了病理分型标准,本研究回顾性选取2004年12月后按新标准分型诊治的病例。男女性别比2.25∶1,中位年龄46岁,占同期胸腺肿瘤比例4.2%,其中合并异位ACTH综合征7例 (26.9%),合并MEN-1 1例 (3.8%),中位生存期51.0个月。与既往文献报道数据基本相符。
NETT除具罕见性外,其特点还有呈侵袭性生长,文献报道胸腺来源的神经内分泌肿瘤较其他部位来源的神经内分泌肿瘤侵袭性更强,更容易出现外侵及转移[12-13]。NETT临床症状隐匿,多为非特异性表现,局部症状多为胸部闷痛、气短、咳嗽等,亦或初始发病时表现为副肿瘤综合征如库欣综合征、MEN-1等,导致临床医师常难以考虑到胸腺疾病而进行胸部CT检查,有时在例行检查中应用普通胸部X线片,但纵隔其他脏器如心脏大血管以及中轴骨性结构的重叠导致早期病变难以在X线片上辨识,因此此类疾病早期发现较为困难,容易漏诊、误诊,也是此类疾病仅有部分患者能够接受手术切除的原因。本组高达73.1% (19例)的患者肿瘤侵犯到纵隔胸膜或纵隔以外脏器,说明此类肿瘤具有极强的外侵性。胸部增强CT对胸腺疾病的诊断较为重要,可较为清楚地显示肿瘤形态及与周围脏器的关系,并评估手术可切除性,因此当患者临床存在库欣综合征或怀疑存在胸腺病变时应及早进行胸部增强CT检查。但胸部增强CT并不能确定肿瘤的良恶性,NETT的CT表现与胸腺瘤常难以鉴别,其最终诊断依赖病理。
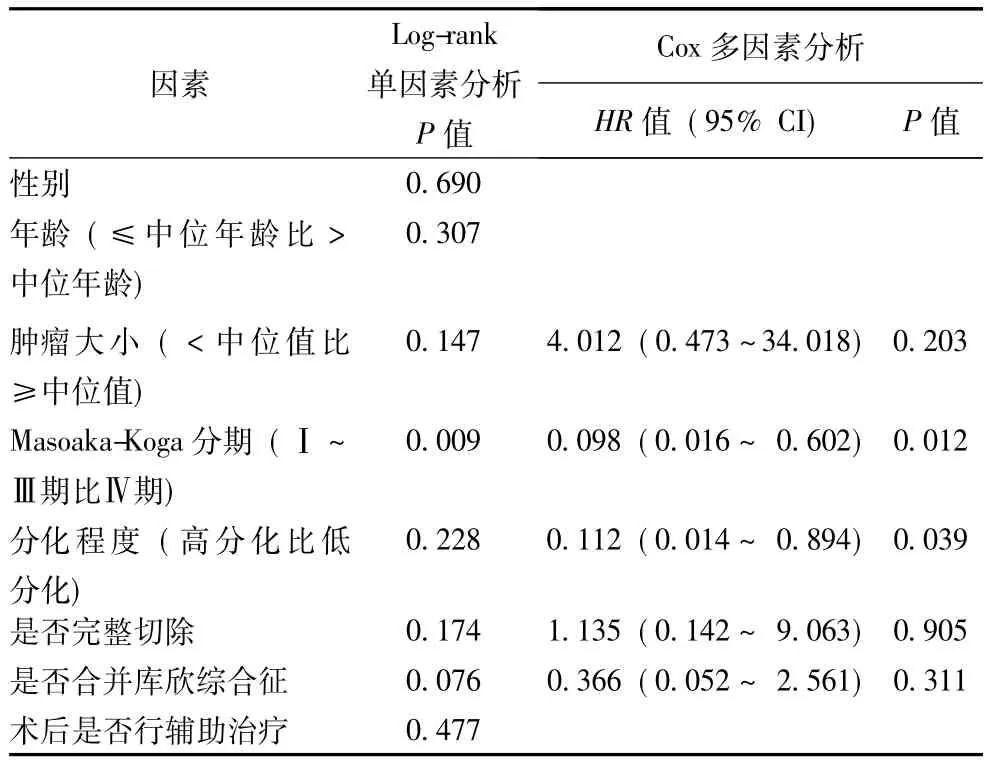
表2 胸腺神经内分泌肿瘤预后因素的Log-rank单因素分析和Cox多因素分析结果
手术仍然是目前治疗NETT的最佳方案,甚至有学者提出其为唯一有效的治疗方法,手术切除患者生存期明显优于非手术患者[1,3,10]。文献报道在病理明确诊断的患者中,接受手术的患者比例约68.1% ~78.0%,而手术大体切净率约80% ~100%[3,7,10]。本组患者大体切净率达到84.6%,术中为了达到整体切除,常常会连同受累胸膜、肺组织、心包、大血管(主要为无名静脉及上腔静脉)、膈神经等一并切除。
由于NETT外侵率高,术后常需要辅助治疗。但目前文献报道对于NETT而言,多数化疗药物有效性均较差[14-15],也有文献报道部分有远处转移已无法手术切除的病例对替莫唑胺及铂类药物有一定反应[3,16],但还需更多病例数据证实。另外,放疗对于NETT的敏感性也存在争议,部分文献报道放疗可以减少NETT患者术后复发率,但对远期生存无改善作用[1,7]。放化疗疗效的不确定性以及肿瘤自身极强的外侵性决定目前治疗效果不令人满意。
NETT总体治疗效果欠佳,文献报道其3年、5年和10年生存率分别为50%~66%、33%~53%和0~10%[1,11,17-18],也有个别中心报道5年、10年生存率可达到约80%及60%[7]。本组患者3年及5年生存率分别为71.0%及44.6%,因研究年限因素,暂无10年生存率数据。在相关预后因素的分析中,不同研究结果存在较大差异。美国SEER数据库的研究认为肿瘤大小(5 cm为界)、外侵程度以及肿瘤的恶性程度是影响预后的主要因素,而放化疗对预后似乎没有显著影响,但这组数据同时包含手术与未手术患者[1]。而在以手术治疗为主的病例总结中,Cardillo等[7]认为肿瘤小于7 cm以及Ki-67指数小于10%为改善预后的因素,而肿瘤的高恶性程度 (大细胞肿瘤)、分期为Ⅳ期、存在副肿瘤综合征以及术后放疗等为预后的不良因素。
在本研究中,笔者经多因素分析发现高分化与低分化的NETT相比生存期有显著差异,肿瘤的分化程度应为影响预后的因素之一;另外应用Masaoka-Koga分期Ⅰ~Ⅲ期为一组,Ⅳ期为一组时,其生存期存在显著差异。分析认为,本组患者中,Ⅳ期主要为纵隔淋巴结出现转移,考虑淋巴结转移与预后可能有一定关系,但目前在胸腺肿瘤手术中,淋巴结切除范围一直处于争论的热点,还没有统一的范围界定及分组,在26例患者中只有15例病理中有可评估淋巴结,因此淋巴结转移是否一定与预后相关还不得而知。而其他因素如肿瘤大小、是否合并副肿瘤综合征以及术后是否进行辅助治疗等因素对预后无显著影响。对于NETT的分期系统争议较大,至今还没有被广泛接受的分期系统。目前仍以经Koga修订后的Masaoka-Koga分期系统为主[8]。在本组病例中,Ⅰ期及Ⅱ期患者分别为4例 (15.4%)及3例(11.5%),Ⅲ期及Ⅳ期患者分别为12例 (46.2%)及7例 (26.9%),Ⅲ、Ⅳ期患者比例超过70%的情况也说明此类病变具有极强的侵袭性,并在一定程度上反映了诊治的疑难程度,也可能是本组患者3年、5年生存率偏低的原因之一。
综上,NETT为一种罕见的恶性病变,外侵性极强,临床症状不特异,难以早期发现,胸部增强CT是发现此类病变并评估手术可行性的重要方法。早期手术切除是目前NETT治疗的关键,肿瘤分化程度以及分期可能是影响预后的因素。放化疗等辅助治疗的作用尚不确定,有待进一步研究。
[1]Gaur P,Leary C,Yao JC.Thymic neuroendocrine tumors:a SEER database analysis of 160 patients[J].Ann Surg,2010,251:1117-1121.
[2]Rosai J,Higa E,Davie J.Mediastinal endocrine neoplasm in patients with multiple endocrine adenomatosis.A previously unrecognized association[J]. Cancer, 1972, 29: 1075-1083.
[3]Crona J,Bj rklund P,Welin S,et al.Treatment,prognostic markers and survival in thymic neuroendocrine tumours.A study from a single tertiary referral centre[J].Lung Cancer,2013,79:289-293.
[4]Travis WD,Brambilla E,Müller-Hermelink HK,et al.Pathology and Genetics of Tumours of the Lung,Pleura,Thymus and Heart(WHO Classification of Tumours)[M].Lyon,France:IARC Press,2004:145-247.
[5]Goudet P,Murat A,Cardot-Bauters C,et al.Thymic neuroendocrine tumors in multiple endocrine neoplasia type 1:a comparative study on 21 cases among a series of 761 MEN1 from the GTE(Groupe des Tumeurs Endocrines)[J].World J Surg,2009,33:1197-1207.
[6]Ruffini E,Oliaro A,Novero D,et al.Neuroendocrine tumors of the thymus[J].Thorac Surg Clin,2011,21:13-23.
[7]Cardillo G,Rea F,Lucchi M,et al.Primary neuroendocrine tumors of the thymus:a multicenter experience of 35 patients[J].Ann Thorac Surg,2012,94:241-246.
[8]Detterbeck FC,Nicholson AG,Kondo K,et al.The Masaoka-Koga stage classification for thymic malignancies:clarification and definition of terms[J].J Thorac Oncol,2011,6:1710-1716.
[9]Yao JC,Hassan M,Phan A,et al.One hundred years after“carcinoid”:epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008,26:3063-3072.
[10]Cardillo G,Treggiari S,Paul MA,et al.Primary neuroendocrine tumours of the thymus:a clinicopathologic and prognostic study in 19 patients[J].Eur J Cardiothorac Surg,2010,37:814-818.
[11]Tiffet O,Paul MA,Ladas G,et al.A clinicopathologic study of 12 neuroendocrine tumors arising in the thymus[J].Chest,2003,124:141-146.
[12]Modlin IM,Lye KD,Kidd M.A 5-decade analysis of 13,715 carcinoid tumors[J].Cancer,2003,97:934-959.
[13]Oberg K,Jelic S.Neuroendocrine bronchial and thymic tumors:ESMO clinical recommendation for diagnosis,treatment and follow-up[J].Ann Oncol,2009,20:147-149.
[14]Oberg K.Chemotherapy and biotherapy in the treatment of neuroendocrine tumours[J].Ann Oncol,2001,12:111-114.
[15]Oberg K,Hellman P,Ferolla P,et al.Neuroendocrine bronchial and thymic tumors:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2012,23:120-123.
[16]Ekeblad S,Sundin A,Janson ET,et al.Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors[J].Clin Cancer Res,2007,13: 2986-2991.
[17]Moran CA,Suster S.Neuroendocrine carcinomas(carcinoid tumor)of the thymus.A clinicopathologic analysis of 80 cases[J].Am J Clin Pathol,2000,114:100-110.
[18]Fukai I,Masaoka A,Fujii Y,et al.Thymic neuroendocrine tumor(thymic carcinoid):a clinicopathologic study in 15 patients[J].Ann Thorac Surg,1999,67:208-211.
Neuroendocrine Tumors of the Thymus:Outcomes after Surgical Resection and Prognostic Factors
CHEN Ye-ye,LIU Hong-sheng,LI Shan-qing,HUANG Cheng,LI Li,QIN Ying-zhi
Department of Thoracic Surgery,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
LIU Hong-sheng Tel:010-69154038,E-mail:liuhsh@pumch.cn
Objective To discuss the clinical manifestations,surgery-based therapy of neuroendocrine tumors of the thymus(NETT)and the potential prognostic factors.Methods We selected 26 consecutive cases diagnosed,treated,and confirmed as NETT by postoperative pathology between December 2004 and December 2013 in Peking Union Medical College Hospital,including 18 males and 8 females.Their clinical manifestations,imaging findings,surgery-based therapy,perioperative complications,and follow-up were retrospectively analyzed.Results The median age of the 26 cases was 46(13-75)years and the median duration of disease was 3.5(1-84)months.Early detection of NETT was difficult due to occult onset and nonspecific clinical manifestations.Seven cases were complicated with Cushing's syndrome and 1 case with multiple endocrine neoplasia type 1.Thoracic contrast-enhanced computed tomography showed mass in the region of thymus.All the cases received thoracotomy and 22 cases got macroscopically radical resection,with 3 cases developing complications and no perioperative death.Sixteen cases received adjuvant therapy after the surgery.Pathologically,there were 20 well differentiated cases(8 typical carcinoids and 12 atypical carcinoids),and 6 poorly differentiated cases(5small cell and 1 large cell neuroendocrine tumors).There were 4 Masaoka-Koga stageⅠ cases,3 stageⅡ cases,12 stageⅢcases,and 7 stageⅣ cases.After long-term follow-up,the median survival was 51.0 months,and 3-and 5-year survival rates were 71.0%and 44.6%,respectively.Multivariate analysis showed that degree of tumor differentiation(P=0.039)and staging(P=0.012)had impact on prognosis.Conclusions NETT is a rare malignancy with tremendous aggressiveness.Early confirmed diagnosis and therapy is still a big challenge due to nonspecific clinical manifestations.Thoracic contrast-enhanced CT could help detect the tumor and evaluate the possibility of surgery.Stage and differentiation of the tumor might be major prognostic factors.
neuroendocrine tumors;thymus;surgery;prognosis
刘洪生 电话:010-69154038,E-mail:liuhsh@pumch.cn
R736.3
A
1674-9081(2016)03-0190-05
10.3969/j.issn.1674-9081.2016.03.006
2015-08-29)
