金属-酶协同催化动态动力学拆分反应研究进展
2016-03-29蒋成君吕力琼黄俊
蒋成君,吕力琼,黄俊
(浙江科技学院生物与化学工程学院,浙江 杭州 310023)
金属-酶协同催化动态动力学拆分反应研究进展
蒋成君,吕力琼,黄俊
(浙江科技学院生物与化学工程学院,浙江 杭州 310023)
摘要:金属催化和酶催化在很长时间被认为是两个不同的领域,动态动力学拆分反应是金属-酶协同催化的成功应用。如何有效地协同金属催化的消旋化与酶催化的动力学拆分是其中的关键问题。本文对金属-酶协同催化动态动力学拆分醇和胺类化合物进行了综述,重点介绍了动态动力学拆分中常用的金属催化剂,各种金属与酶的协同,并对其前景进行了展望,指出提高酶在反应体系中的稳定性是未来的发展方向。
关键词:生物催化;动力学;化学反应;手性
近年来,金属催化剂在药物合成领域得到了广泛的应用,这些金属催化剂有时需要高温、高压等苛刻的反应条件,且对环境造成污染。酶催化具有反应条件温和、高选择性等优点,越来越广泛地应用于手性药物的合成。这两种催化过程非常高效和经济,但是它们的协同使用尚不多见。主要有3个原因:第一,联合这两种催化过程最近才被关注;第二,金属催化剂和酶催化剂在很长时间被认为是两个不同的领域,有机化学家难以发现有效的酶催化,生物化学家难以了解金属催化体系;第三,一般认为酶的活性会被金属抑制。然而,金属-酶协同的催化反应具有巨大的潜力。动态动力学拆分反应(DKR)是金属-酶协同的催化反应的一个重要应用[1]。在DKR中,金属催化的底物消旋化与酶催化剂的动力学拆分有机地结合(图1)。本文对近几年金属-酶协同动态动力学拆分醇和胺类化合物进行综述。
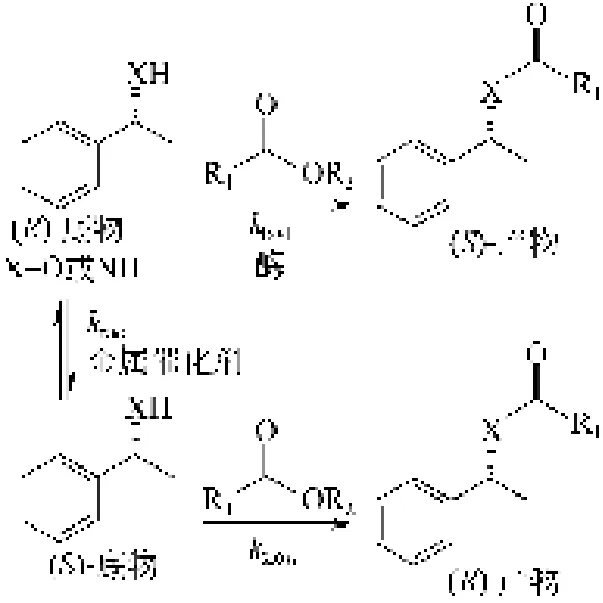
图1 金属-酶协同催化动态动力学拆分反应
1 动态动力学拆分中常用的金属催化剂
常用的金属催化剂如图2所示。这些金属主要是ⅧB族的元素Pd、Ru、Rh、Ni、Co、Ir,ⅤB的 V和ⅢA的铝。
2 金属-酶协同催化动态动力学拆分醇类化合物
2.1 Pd配合物与酶的协同催化
1996年,WILLIAMS等[2]报道了PdCl2(MeCN)2与荧光假单胞菌脂肪酶动态动力学拆分烯丙基酯衍生物(图3),19天后获得醇的产率为81%,ee值为 96%。在这一反应中,底物通过钯(Ⅱ)催化消旋化,脂肪酶水解生产单一构型的醇。虽然反应时间长达19天,但是这一开创性的研究证实了过渡金属催化和酶结合进行DKR的可能性。
2.2 Rh配合物与酶的协同催化
在随后的研究中,WDINH等[3]报道了仲醇的DKR(图4),通过氢转移机理来实行底物的消旋化。Rh2(OAc)4协同脂肪酶进行拆分,(R)-1-苯乙醇的收率为60%,ee值为98%。然而这种方法有几个缺点,总的收率低和必须添加邻菲咯啉和苯乙酮作为有效消旋试剂。尽管这种特殊的DKR系统有缺点,但是这项研究仍是重要的,因为它证实了醇可以通过金属催化的氢转移实现消旋化。这项工作为后续催化剂的设计提供了灵感的源泉,不同的过渡金属催化剂不断开发,通过氢转移反应实现了底物的消旋化。

图2 动态动力学拆分中常用的金属催化剂

图3 PdCl2(MeCN)2与荧光假单胞菌脂肪酶协同的DKR体系

图4 Rh2(OAc)4与荧光假单胞菌脂肪酶协同的DKR体系
2.3 Ru配合物与酶的协同催化
紧接着WILLIMAS的开创性工作,BÄCKVALL 等[4]首次提出了仲醇的DKR体系(图5),其中南极假丝酵母脂肪酶B(CALB)固定在丙烯酸树脂(商品名称Novozyme-435)和Shvo的二钌配合物1,这两种催化剂对脂肪族和芳香族的醇都兼容,并且产物的ee值也较高,根据KAZLAUSKAS规则[5]显示出S型选择性。但是这一体系的缺点是Shvo配合物要求70℃的温度来有效地分裂成两个单体物种1a和1b(图2),其机制是氧化还原使底物消旋化[6]。由于Shvo配合物需要热活化,Shvo配合物1只能结合耐热的脂肪酶使用,这限制了可用于DKR的酶的种类,如对热敏感的丝氨酸蛋白酶就不能使用。Shvo配合物的另一个缺点是它必须与活化的芳基酯(对氯苯乙酸酯)一起使用,当以简单的烯基乙酸酯为酰基供体时,会干扰外消旋,导致形成大量酮副产物。尽管有这些限制,但是配合物1已经成功地结合了一些酶来进行β-叠氮醇、安息香、β-环醇、杂芳基乙醇、羟基烷烃磷酸盐、γ-羟基酰胺、羟基酸酯、羟基醛、β-羟基烷基砜、β-腈醇等的DKR。此外,配合物1已经被用作 β-取代伯醇DKR的消旋催化剂,通过中间醛的烯醇化发生消旋化。

图5 Shvo双钌配合物和Novozyme-435催化的仲醇DKR
由于Shvo的二钌配合物只有在温度大于70℃时才有活性。随后的研究致力于发现更高活性的催化剂,可以在温和的反应条件下有效的消旋醇,在DKR中可以更大范围地使用各种酶。PARK等[7]报道了配合物2-(η5-茚基)RuCl(PPh3)2在室温下可消旋底物,并且生成微量的酮副产物。然而,配合物2有一些缺点,它需要KOH来激发催化活性,KOH可以使酶失活。后来发现配合物2也可以用O2和Et3N来激活,有效的消旋需要60℃的反应温度。配合物2成功地和洋葱假单胞菌脂肪酶结合对简单的仲醇进行DKR(图6)[8]。

图6 (η5-茚基)RuCl(PPh3)2和洋葱假单胞菌脂肪酶仲醇DKR
酶和以钌为活性中心的配合物的耦合,拓展了DKR领域的后期研究,开发了钌配合物作为外消旋催化剂[9],通过氢转移反应实现底物的消旋化。KIM 等[10]制备出了氨基环戊二烯钌配合物3,并证实它在室温下能有效地催化仲醇外消旋化。和配合物1不同,使用配合物3时,可用叔丁醇钾活化替代热活化,与KOH相比,配合物3在大多DKR体系中显示出更高的兼容性。
配合物3成功地与Novozym-435配对,在室温下高产率和高ee值地合成多种脂肪族和苄基(R)-乙酸酯(图7)。配合物3的一个优点是可以用乙酸异丙烯酯代替活性酯(对氯苯乙酸酯)作为酰基供体。然而,需要长达7天的反应时间。这与分步消旋和KR反应有鲜明对比,它们一般在几小时内完成。DKR和分步反应效率上的显著差异表明配合物3和CALB不完全兼容,导致催化剂部分失活。
因为它在室温下良好的消旋活性,所以配合物3可以协同更敏感的蛋白酶枯草杆菌DKR仲醇,得到S构型产物。KIM等[11]已在最近的研究中表明配合物3可以与表面活性剂-洋葱假单胞菌脂肪酶协同在室温下进行烯丙基醇DKR。

图7 配合物3和Novozym-435仲醇DKR
配合物3发现后不久,BÄCKVALL等[12]制备出了相关的环戊二烯钌配合物4。它被证实为一种高效的催化剂,即使催化剂用量低至0.5%(摩尔分数)[13]也能在10min内完全消旋光学纯的1-苯乙醇。无论在结构和活化方法上,这种消旋催化剂显示出许多与配合物3的相似之处;但是配合物3改善了其与酶的兼容性。配合物4和Novozym-435的结合提供了仲醇快速的DKR方法;如1-苯乙醇在3h内高产率转化为ee值大于99%的乙酸酯[14]。配合物4为新一代DKR和动态不对称转换(DYKAT)的发展铺平了道路。DKR中利用配合物4这一方法已被广泛地应用到功能仲醇中,消旋得到高产率和高ee值的产物,包括脂肪醇、烯丙基醇、氯醇、二元醇、高烯丙基醇、N-杂环1,2-氨基醇。
配合物4对于氯乙醇[38]、烯丙基醇的消旋速度显著减慢,它要求在DKR中不断增加反应温度。对于这些底物,有必要进一步研究更高效的消旋配合物与敏感蛋白酶结合进行DKR。VERHO等[15]报道了匹配配合物和底物的电子性质来实现更高效的氯乙醇外消旋的方法。在研究中发现配合物4的高度电子缺失相似物配合物5对氯乙醇消旋反应比配合物4快10~30倍。
近年来,合成了一些基于环戊二烯钌为核心的酶-兼容消旋配合物相似物。特别是KIM等[16]、HAN 等[17]开发出了钌为活性中心的消旋催化剂-配合物5,配合物5可以在空气中进行醇的DKR,稳定性和适用范围更广。配合物5的另一个优点是它可以连接到聚苯乙烯上,形成非均相的聚合物接枝配合物6。配合物6可回收,在1-苯乙醇DKR重复使用3次,仍可获得95%的收率、99%的ee值。在随后的研究中,配合物6被用在光学纯药物(-)-卡巴拉汀关键中间体的合成。
KIM等[18]报道了配合物4的相似物配合物7,其在空气中稳定,在室温下可由Ag2O激活并和Novozym-435协同用于一小部分脂肪族和苄醇的DKR体系中。最近,LEE等[19]报道了配合物8,它包含了一个酰基取代的环戊二烯基配体。这种配合物可更广范围地应用于光学纯仲醇的DKR体系。配合物8和洋葱假单胞菌脂肪酶可在16~25℃下DKR α-芳基丙炔基醇、苄基醇、γ-氯醇和TMS-炔醇。LEINO等[20-21]报道了五苄基环戊二烯基钌配合物9,它显示出与配合物4相同的活性和功能范围。配合物9的优点是苄基取代配体可以由简单和廉价的原料环戊二烯和苄醇大规模简单的合成。与配合物1和3~8的合成相比较,配合物9需要更昂贵的前体四苯基环戊二烯酮。NOLAN等[22]开发了另一种有效的外消旋配合物。阳离子钌茚基配合物10,可由K2CO3有效激活,它和Novozyme-435成功结合用于多种仲醇的DKR,此配合物在室温下获得高产率和ee值。AGRAWAL等[23]表明钌配合物可由易得的配合物[Ru(p-异丙基)Cl2]2和配体1,4-双(二苯基膦)-丁烷原位反应形成,配合物可结合从施氏假单胞菌形成的TL脂肪酶在室温下对α-羟基酮进行有效DKR。这些底物的DKR提供了各种功能分子直接获取路径,如光学纯的氨基醇和二醇衍生物。
基于钌的消旋配合物在仲醇的DKR中也可以应用。例如,HAAK等[24]开发了在含有甲苯和50mmHEPES缓冲液的两相体系中利用阳离子不变的配合物11和双突变环氧化物水解酶(Hhec)从相应的氯乙醇一步合成光学纯化合物的方法。与配合物3~9相比,配合物11可由叔丁醇钾活化,在室温下有效地DKR。配合物11对苄醇比较表现出明显高的消旋活性和选择性。
2.4 Ir与酶的协同催化
MARR等[25]报道了铱催化的消旋化。这种DKR利用一系列“钢琴凳”型铱NHC配合物与CALB结合,见图8。

图8 铱配合物11和环氧化物水解酶合成光学纯的环氧化物
2.5 V与酶的协同催化
在过去的十年,大量钒催化醇的DKR得到了发展。AKAI等[26-27]发现含氧钒(Ⅴ)配合物[VO(OSiPh3)3)]在温和的反应条件下能通过羟基的1,3-转移消旋二烯丙基醇(图9)。因此,这种配合物被发现能与几种酯兼容,如洋葱假单胞菌脂肪酶、Novozyme-435、荧光假单胞菌的脂肪酶,它适用于线性和环状烯丙基醇DKR,有良好的产率和ee值。EGI等[28]也制备出了非均相的含氧钒(Ⅴ)配合物相似物,它被固定在聚合物和介孔硅胶上。固载的含氧钒(Ⅴ)配合物证实可以循环6次以上而不失活性,而且它能够消旋芳香和丙炔醇。这种配合物增加缺少烯丙醇的底物消旋能力,它可以通过碳正离子中间体脱水机理进行。WUYTS等[29]报道了钒配合物催化的其他仲醇DKR。在这个系统中,VOSO4结合Novozyme-435实现一些苄基醇在80℃下的DKR。

图9 [VO(OSiPh3)3)]和Novozyme-435协同
2.6 其他类型
上述金属价格昂贵,近年来发展了一些低成本的金属催化体系。BERKESSEL等[30]设计了AlMe3/binol/CALB系统,用于室温下脂肪族和苄醇的DKR。酸和沸石也可作为消旋催化剂与酶一起进行仲醇DKR。但是酸和沸石只能通过脱水机理来消旋醇,这限制了要形成稳定碳正离子底物。此外,由于副产物的大量形成,这些酸和沸石催化时的收率比预期产量低。
与二级醇形成鲜明对比的是叔醇实现DKR。虽然有一些酶可以拆分叔醇,但是它已被证实很难配合DKR过程来原位消旋。因为叔醇季碳缺少氢取代,所以不可能通过氢转移机理消旋底物。因此,叔醇消旋的催化剂仅限于那些通过脱水机制形成碳正离子的催化剂(如路易斯酸或钒催化剂)。碳正离子中间体的形成比相应的仲醇更容易,这将有利于叔醇的外消旋化。叔醇的DKR被认为是不对称合成领域内一个重要的里程碑,在天然产物和药物合成中有很大的应用。
3 金属-酶协同催化动态动力学拆分胺类化合物
3.1 Pd与酶的协同催化
光学纯的胺类可以通过酶的动力学拆分获得。然而,由于缺乏有效的胺消旋催化剂,胺类的DKR大大减少。胺类消旋困难的主要原因是它们可以作为很强的配位体,这可能会抑制催化剂甚至导致催化剂完全失活。因此,需要高温来打破这种平衡并促进消旋反应,但是升高温度会限制可使用酶的种类。另外一个与胺消旋相关的挑战是生成的亚胺中间体是高度活性的,可发生一些副反应,从而减少了产品产量,增加了分离的难度。例如,亚胺在水存在下易于水解生成相应的酮。亚胺中间体也可受到另一胺分子的亲核攻击生成缩胺醛,可进一步降低为仲胺副产物。人们已经发现这些副反应通常是由于高温引起。因此,高效、温和的消旋胺尤为重要。
1996年REETZ等[31]第一次报道了胺的DKR,Pd/C催化外消旋化完成1-苯乙胺的拆分。不幸的是,DKR反应在三乙胺存在下进行,温度50~55℃,使用乙酸乙酯作为酰基供体,发现过程缓慢,8天只得到了60%的转化率。
受到REETZ等[31]开创性发现的鼓舞,几个研究小组继续研究基于钯的非均相催化剂,应用于胺的DKR。JACOBS等[32-33]研究了作为载体的碱土是怎样影响固定化钯粒子的外消旋化活动。在这些载体中,钯/硫酸钡具有最高的活性和选择性。DKR 在70℃和0.01MPa 氢气压力下进行,反应可以用乙酸乙酯或者乙酸异丙酯作为酰基供体。在这些反应条件下,一系列的苄基伯胺转化成相应的(R)-酰胺,在24~72h内有高产率、高ee值。ANDRADE等[34]也证实了这些催化剂对含硒的苄基伯胺的DKR也适用。然而,这个DKR体系明显的缺点是它只限于苄基胺,脂肪族伯胺反应太过缓慢,唯一可适用的脂肪族胺是1-甲基-3-苯丙胺。脂肪族的胺明显比苄型的底物消旋慢,相应的DKR要求不断升高温度并延长反应时间,来获得满意的结果。
在随后的研究中,PARVULESCU等[35]证实Pd/BaSO4和Pd/CaCO3对伯胺的消旋活性和选择性可以用微波辐射替代传统的加热方法。造成这种现象的原因是金属活性中心能够有效地吸收微波,从而产生所谓的“热点”,可以达到超过周围反应介质的温度,利用微波辐射导致更快的DKR。

图10 Pd/AlO(OH) 和Novozyme-435.对脂肪族和苄基伯胺的DKR
KIM等[36-37]将Pd固定在AlO(OH)上作为消旋催化剂与Novozyme-435协同催化(图10)。这个催化体系在伯胺的DKR中有效。然而,这种催化系统对于脂肪族底物DKR要求更严苛的反应条件(12%Pd,100℃,1大气压H2)。有趣的是,无论是纳米钯催化剂还是酶,在1-甲基-3-苯丙胺的DKR中可以循环8次,没有观察到转化率或ee值的损失。在随后的研究中,CHOI等[38]扩展了这种方法的适用范围,使α-氨基酰胺也包括在内。此外,BÄCKVALL等[39]将Pd/AlO(OH)和CALA-MCF结合用于β-氨基酯的DKR。
徐刚等[40]制备了一种基于钯固定在双氢氧化物阴离子支持层上的非均相消旋催化剂,并证实了它可以与Novozyme-435协同在55℃下用于苄基伯胺的DKR。不幸的是,它有几个缺点,如催化剂用量多、底物浓度稀和需要用4-氯苯基戊酸酯作为酰基供体。最近SHAKERI等[41]也开发了一种基于钯的非均相消旋催化剂,1.5~3.0nm的钯纳米粒子固定在MCF(AmP-MCF)上。这种钯纳米催化剂(Pd0-AmP-MCF)在1-苯乙胺的消旋中显示出高活性,而且与酶有良好的兼容性。这种(Pd0-AmP-MCF)催化剂与Novozyme-435协同对一系列伯胺DKR,生成相应(R)-酰胺有高的产率和良好的ee值(图11)。更进一步,通过增加催化剂中钯的量(摩尔分数从1.25%到5.0%),在50℃下可能促进有效的消旋,这允许催化剂在1-苯乙胺的DKR中与敏感的脂肪酶Amano Lipase PS-C1(洋葱假单胞菌脂肪酶固定在陶制小珠子上)结合。值得注意的是,这是Amano Lipase PS-C1第一次成功地用在胺的DKR上。在这个反应中,钯纳米粒子的使用量减少,反应时间缩短,底物浓度提高。Pd0-AmP-MCF还表现出高稳定性和低流失率,在1-苯乙胺的DKR中可循环4次,催化性能没有明显的降低。和其他钯基催化剂类似,这个DKR系统对于脂肪族胺类并不适用。

图11 Pd0-AmP-MCF 和 Novozyme-435/Amano Lipase PS-C1结合对伯胺的DKR
李灿等[42]也研究伯胺的DKR系统,他们用一种稍微不同的Pd0-AmP-MCF催化剂,这种催化剂浸渍在碳酸钾中,钯负载量比BÄCKVALL等[39]所用的低,得到了几种胺有效DKR。但是,这很难与SHAKERI等[41]的体系相比较,因为他们增加了酶的用量,降低了底物浓度。
BÄCKVALL等[39]用来固定Pd纳米颗粒的材料MCF也被用来固定CALA。BÄCKVALL探索了同时固定钯纳米粒子和酶的可能性。首先制备载有中等负载钯的Pd0-AmP-MCF催化剂,为酶留下大量的自由氨基,用戊二醛连接CALB。通过共固定化设计,可得到类似于金属酶双功能催化剂,可用于外消旋作用和KR。在1大气压氢气、70℃下,使用甲氧基乙酸乙酯作为酰基供体,进行1-苯乙胺的DKR来评价这种双功能催化剂。在这些条件下反应16h,以99%的产率得到99%的ee值的(R)-酰胺。有趣的是,发现双功能催化剂的性能要比Pd(0)-AmP-MCF 和 CALB-MCF两个催化剂单独使用时好,显然两个催化剂的高接近性提高了DKR的反应速率。这种双功能催化剂可以循环利用,但是从第三个循环开始,活性会慢慢下降,因为亲水硅胶表面会引起部分酶变性。
3.2 Ru与酶的协同催化
PAMIES等[44]证实Shvo二聚体1可以在110℃下对伯胺进行有效的消旋,但是消旋需要高温,而酶拆分需要在较低的温度下进行。因此,消旋和拆分必须分步进行。然而,这个问题后来改用甲氧基取代的shvo类似物配合物12来解决,在90℃下能有效地消旋。配合物12和Novozyme-435一起使用,一些脂肪族和苄基的伯胺一锅法DKR可以达到高收率和ee值(图12)。

图12 配合物12和Novozyme-435伯胺DKR
这使1-苯乙胺的DKR能大规模地进行,只需加入少量催化剂(1.25%,摩尔分数),就能获得高收率和98%的ee值的手性1-苯乙胺。
当配合物12为DKR的催化剂时,乙酸异丙酯就可作为酰基供体,这种酰基供体因为其较低的价格和高可用性被视为理想选择,但是断开酰胺键需要强酸和高温,这可能对含敏感功能基团的底物不利。为了解决这个问题,BÄCKVALL等[45]改进了脂肪族和苄基伯胺的DKR过程,采用配合物12和CALB协同,碳酸二苄酯作为酰基供体。此时的产物在温和的反应条件下,通过Pd催化氢解,接上的苄氧羰基可以很容易地去除。SHAKERI等[46]也证实了配合物12可与相关的固定在硅质单细胞泡沫(MCF)上的南极假丝酵母脂肪酶A(CALA)合用来进行β-氨基酯的DKR。
3.3 Raney镍/Raney钴与酶的协同催化
JACOBS等[47]报道了Raney 镍和 Raney 钴催化剂也可与Novozyme-435结合进行伯胺的DKR,这些DKR反应进行缓慢,甚至在70~80℃下要反应2~5天,转化率和ee值普遍较低。跟踪整个反应中起始原料的ee值,发现动力学拆分反应的速率限制步骤是动力学拆分反应。而在通常情况下伯胺的动力拆分在高温下应该是比较快的。
4 结论与展望
从动态动力学拆分的概念产生到现在,该法已经得到了广泛关注,并有少量应用于工业生产中。这一进步的关键是几种消旋催化剂的成功设计,特别是基于钌的消旋催化剂,它可以在温和的反应条件下消旋醇,因此可以使用越来越多的与之兼容的酶。
动态动力学拆分的底物类型最终是由酶来确定的。因此酶的选择非常重要,到目前为止,因为脂肪酶具有高活性和选择性,已成为DKR首选的酶。此外,脂肪酶有许多实用的优点,包括价廉易得、高热稳定性和对有机反应介质的高耐受性。然而正如前面提到的,天然的脂肪酶在仲醇的拆分中更易偏向选择R型,不能直接得到S型的产物,这限制了仲醇DKR的应用,筛选S型选择性的酶就显得十分重要,可以直接通过DKR获得S型产物。丝氨酸蛋白酶对醇的动力学拆分中表现出S选择性,但是可承受的温度比较低。
醇和胺的动态动力学拆分反应研究进程中,改进酶的研究将会起到重要的作用,根据现有的分子生物技术,生物化学家已经有了提高和扩展天然酶组合的方法。尤其是通过基因库的筛选和选择获得新的改进酶突变体,提高酶热稳定性。
参 考 文 献
[1] VERHO O,BÄCKVALL J E. Chemoenzymatic dynamic kinetic resolution:a powerful tool for the preparation of enantiomerically pure alcohols and amines[J]. Journal of the American Chemical Society,2015,137(12):3996-4009.
[2] ALLEN J V,WILLIAMS J M. Dynamic kinetic resolution with enzyme and palladium combinations[J]. Tetrahedron Letters,1996,37:1859-1862.
[3] DINH P M,HOWARTH J A,HUDNOTT A R,et al. Catalytic racemisation of alcohols:applications to enzymatic resolution reactions[J]. Tetrahedron Letters,1996,37:7623-7626.
[4] LARSSON A L E,PERSSON B A,BÄCKVALL J E. Enzymatic resolution of alcohols coupled with ruthenium-catalyzed racemization of the substrate alcohol[J]. Angewandte Chemie International Edition,1997,36:1211-1212.
[5] KAZLAUSKAS R J,WEISSFLOCH A N E,RAPPAPORT A T,et al. A rule to predict which enantiomer of a secondary alcohol reacts faster in reactions catalyzed by cholesterol esterase,lipase from pseudomonas cepacia,and lipase from Candida rugose[J]. Journal of Organic Chemistry,1991,56:2656-2665.
[6] CONLEY B L,PENNINGTON-BOGGIO M K,BOZ E,et al. Discovery applications,and catalytic mechanisms of Shvo’s catalyst[J]. Chemical Reviews,2010,110:2294-2312.
[7] KOH J H,JEONG H M,PARK J. Efficient catalytic racemization of secondary alcohols[J]. Tetrahedron Letters,1998,39:5545-5548.
[8] KOH J H,JUNG H M,KIM M J,et al. Enzymatic resolution of secondary alcohols coupled with ruthenium-catalyzed racemization without hydrogen mediator[J].Tetrahedron Letters,1999,40:6281-6284.
[9] AKAI S,TANIMOTO K,KITA Y. Lipase-catalyzed domino dynamic kinetic resolution of racemic 3-vinylcyclohex-2-en-1-ols/Intramolecular diels-alder reaction:one-pot synthesis of optically active polysubstituted decalin[J]. Angewandte Chemie International Edition,2004,43:1407-1410.
[10] CHOI J H,KIM Y H,NAM S H,et al. Aminocyclopentadienyl ruthenium chloride:catalytic racemization and dynamic kinetic resolution of alcohols at ambient temperature[J]. Angewandte Chemie International Edition,2002,41:2373-2376.
[11] KIM H,CHOI Y K,LEE J,et al. Ionic-surfactant-coated burkholderia cepacia lipase as a highly active and enantioselective catalyst for the dynamic kinetic resolution of secondary alcohols[J]. Angewandte Chemie International Edition,2011,50:10944-10948.
[12] WARNER M,BACKVALL J E. Mechanistic aspects on cyclopentadienylruthenium complexes in catalytic racemization of alcohols[J]. Accounts of Chemical Research,2013,46:2545-2555.
[13] CSJERNYIK G,BOGAR K,BACKVALL J E. New efficient ruthenium catalysts for racemization of alcohols at room temperature[J]. Tetrahedron Letters,2004,45:6799-6802.
[14] MARTIN-MATUTE B,EDIN M,BOGAR K,et al. Highly compatible metal and enzyme catalysts for efficient dynamic kinetic resolution of alcohols at ambient temperature[J]. Angewandte Chemie International Edition,2004,43:6535-6539.
[15] VERHO O,JOHNSTON E V,KARLSSON E,et al. Tuning of the electronic properties of a cyclopentadienylruthenium catalyst to match racemization of electron-rich and Electron deficient alcohols[J].Chemistry—A European Journal,2011,17:11216-11222.
[16] KIM N,KO S B,KWON M S,et al. Air-stable racemization catalyst for dynamic kinetic resolution of secondary alcohols at room temperature[J]. Organic Letters,2005,7:4523-4526.
[17] HAN K,KIM C,PARK J,et al. Chemoenzymatic synthesis of rivastigmine via dynamic kinetic resolution as a key step[J]. Journal of Organic Chemistry,2010,75:3105-3108.
[18] KO S B,BABURAJ B,KIM M J,et al. Air-stable racemization catalysts for the dynamic kinetic resolution of secondary alcohols[J]. Journal of Organic Chemistry,2007,72:6860-6864.
[19] LEE J H,KIM N,KIM M J,et al. Substituent effect on catalytic activities of [{η5-Ar4C4COC (O) Ar} Ru (CO) 2Cl] in racemization and DKR of secondary alcohols[J]. ChemCatChem,2011,3:354-359.
[20] PAIVO M,MAVRYNSKY D,LEINO R,et al. Dynamic kinetic resolution of a wide range of secondary alcohols:cooperation of dicarbonylchlorido(pentabenzylcyclopentadienyl) ruthenium and CAL-B[J]. European Journal of Organic Chemistry,2011,8:1452-1457.
[21] MAVRYNSKY D,PAIVIO M,LUNDELL K,et al. Dicarbonylchloro (pentabenzylcyclopentadienyl) ruthenium as racemization catalyst in the dynamic kinetic resolution of secondary alcohols[J]. European Journal of Organic Chemistry,2009,9:1317-1320.
[22] FERNANDEZ J A,MANZINI S,NOLAN S P. A cationic ruthenium complex for the dynamic kinetic resolution of secondary alcohols[J]. Chemistry—A European Journal,2014,20:13132-13135.
[23] AGRAWAL S,MARTINEZ-CASTRO E,MARCOS R,et al. Readily available ruthenium complex for efficient dynamic kinetic resolution of aromatic hydroxy ketones[J]. Organic Letters,2014,16:2256-2259.
[24] HAAK R M,BERTHIOL F,JERPHAGNON T,et al. Dynamic kinetic resolution of racemic haloalcohols:direct access to enantioenriched epoxides[J]. Journal of the American Chemical Society,2008,130:13508-13509.
[25] MARR A C,POLLOCK C L,SAUNDERS G C. Base-free dynamic kinetic resolution of secondary alcohols using “piano-stool”complexes of N-heterocyclic carbenes[J]. Organometallics,2007,26:3283-3285.
[26] AKAI S,TANIMOTO K,KANAO Y,et al. A dynamic kinetic resolution of allyl alcohols by the combined use of lipases and [VO(OSiPh3)3][J]. Angewandte Chemie International Edition,2006,45:2592-2595.
[27] AKAI S,HANADA R,FUJIWARA N,et al. One-pot synthesis of optically active allyl esters via Lipase-Vanadium combo catalysis[J]. Organic Letters,2010,12:4900-4903.
[28] EGI M,SUGIYAMA K,SANETO M,et al. Mesoporoussilica-immobilized Oxovanadium cocatalyst for the Lipase-catalyzed dynamic kinetic resolution of racemic alcohols[J].Angewandte Chemie International Edition,2013,52:3654-3658.
[29] WUYTS S,WAHLEN J,JACOBS P A,et al. Heterogeneous vanadium catalysts for racemization and chemoenzymatic dynamic kinetic resolution of benzylic alcohols[J]. Green Chemistry,2007,9:1104-1108.
[30] BERKESSEL A,SEBASTIAN-IBARZ M L,MULLER T N. Lipase/Aluminium-katalysierte dynamische kinetische racematspaltung von sekundären Alkoholen[J]. Angewandte Chemie International Edition,2006,45:6567-6570.
[31] REETZ M T,SCHIMOSSEK K. Lipase-catalyzed dynamic kinetic resolution of chiral amines:use of palladium as the racemization catalyst[J]. Chimia,1996,50:668-669.
[32] PARVULESCU A,DE VOS D,JACOBS P. Efficient dynamic kinetic resolution of secondary amines with Pd on alkaline earth salts and a lipase[J]. Chemical Communications,2005,42:5307-5309.
[33] PARVULESCU A,DE VOS D,JACOBS P. Palladium catalysts on alkaline-earth supports for racemization and dynamic kinetic resolution of benzylic amines[J]. Chemistry-A European Journal,2007,13:2034-2043.
[34] ANDRADE L H,SILVA A V,PEDROZO E C. First dynamic kinetic resolution of selenium-containing chiral amines catalyzed by palladium (Pd/BaSO4) and Candida antartica lipase (CAL-B)[J]. Tetrahedron Letters,2009,50:4331-4334.
[35] PARVULESCU A,VAN DER EYCKEN E,JACOBS P A,et al. Microwave-promoted racemization and dynamic kinetic resolution of chiral amines over Pd on alkaline earth supports and lipases[J]. Journal of Catalysis,2008,255:206-212.
[36] KIM Y,PARK J,KIM M J. Fast racemization and dynamic kinetic resolution of primary benzyl amines[J]. Tetrahedron Letters,2010,51:5581-5584.
[37] KIM M J,KIM W H,HAN K,et al. Dynamic kinetic resolution of primary amines with a recyclable Pd nanocatalyst for racemization[J]. Organic Letters,2007,9:1157-1159.
[38] CHOI Y K,KIM Y,HAN K,et al. Synthesis of optically active amino acid derivatives via dynamic kinetic resolution[J]. Journal of Organic Chemistry,2009,74:9543-9545.
[39] ENGSTROM K,SHAKERI M,BÄCKVALL J E. Dynamic kinetic resolution of β-amino esters by a heterogeneous system of a Palladium nanocatalyst and Candida antarctica Lipase A[J]. European Journal of Organic Chemistry,2011,10:1827-1830.
[40] XU G,DAI X,FU S,et al. Efficient dynamic kinetic resolution of arylamines with Pd/layered double-hydroxide-dodecyl sulfate anion for racemization[J]. Tetrahedron Letters,2014,55:397-402.
[41] SHAKERI M,TAI C W,GOTHELID E,et al. Small Pd nanoparticles supported in large pores of mesocellular foam:an excellent catalyst for racemization of amines[J]. Chemistry-A European Journal,2011,17:13269-13273.
[42] JIN Q R,JIA G Q,ZHANG Y M,et al. Modification of supported Pd catalysts by alkalic salts in the selective racemization and dynamic kinetic resolution of primary amines[J]. Catalysis Science & Technology,2014,4:464-471.
[43] SHAKERI M,ENGSTROM K,SANDSTROM A G,et al. Highly enantioselective resolution of β-Amino esters by Candida antarctica Lipase A immobilized in mesocellular foam:application to dynamic kinetic resolution[J]. ChemCatChem,2010,2:534-538.
[44] PAMIES O,ELL A H,SAMEC J S M,et al. An efficient and mild ruthenium-catalyzed racemization of amines:application to the synthesis of enantiomerically pure amines[J]. Tetrahedron Letters,2002,43:4699-4702.
[45] HOBEN C E,KANUPP L,BÄCKVALL J E. Practical chemoenzymatic dynamic kinetic resolution of primary amines via transfer of a readily removable benzyloxycarbonyl group[J]. Tetrahedron Letters,2008,49:977-979.
[46] SHAKERI M,ENGSTROM K,SANDSTROM A G,et al. Highly enantioselective resolution of β-amino esters by candida antarctica lipase A immobilized in mesocellular foam:application to dynamic kinetic resolution[J]. ChemCatChem,2010,2:534-538.
[47] PARVULESCU A N,JACOBS P A,DE VOS D E. Heterogeneous raney nickel and cobalt catalysts for racemization and dynamic kinetic resolution of amines[J]. Advanced Synthesis & Catalysis,2008,350:113-121.
综述与专论
Recent progress in dynamic kinetic resolution by metal catalysis cooperate with enzymes
JIANG Chengjun,LÜ Liqiong,HUANG Jun
(School of Biological and Chemical Engineering,Zhejiang University of Science & Technology,Hangzhou 310023,Zhejiang,China)
Abstract:Enzyme and metal catalysis used to be considered as unconnected just like “two sides of a medal”. Chemoenzymatic dynamic kinetic resolution is an important application of metal complexes in cooperative catalysis with enzymes. The key point is how to cooperate racemization by metal and to conduct kinetic resolution by enzymes effectively. Racemization of a substrate with a metal complexes combined with a stereoselective transformation of the substrate catalyzed by an enzyme by kinetic resolutions dynamic was reviewed. The metal catalysts used in dynamic kinetic resolution and the coordination of various metals and enzymes were mainly introduced. In the final part of the perspective,improving the stability of enzyme in the reaction system is thought to be the future research direction.
Key words:biocatalysis; kinetics; chemical reaction; chirality
基金项目:中国博士后科学基金(2014M551745)及浙江省自然科学基金(LY15B060008)项目。
收稿日期:2015-06-29;修改稿日期:2015-09-25。
DOI:10.16085/j.issn.1000-6613.2016.03.024
中图分类号:TQ 463
文献标志码:A
文章编号:1000–6613(2016)03–0807–08
第一作者及联系人:蒋成君(1981—),男,博士,高级工程师。E-mail jcj312@ 163.com。
