聚乙烯吡咯烷酮对甲烷水合物形成热力学条件的影响*
2016-03-28唐翠萍戴兴学梁德青
唐翠萍,戴兴学,梁德青
(中国科学院广州能源研究所,中国科学院天然气水合物重点实验室,广州 510640)
聚乙烯吡咯烷酮对甲烷水合物形成热力学条件的影响*
唐翠萍,戴兴学,梁德青†
(中国科学院广州能源研究所,中国科学院天然气水合物重点实验室,广州 510640)
摘 要:低剂量抑制剂对天然气水合物形成条件的影响对组合抑制剂的开发和选用具有重要意义。本文采用定容压力搜索法,在282.6 K ~ 290.3 K范围内测定了纯水和含低剂量抑制剂聚乙烯吡咯烷酮水溶液的甲烷水合物形成相平衡条件。测量结果显示浓度为0.5wt%、5wt%和15wt%的聚乙烯吡咯烷酮对水合物形成条件有促进作用,但促进作用不大,分析认为高分子的加入降低了溶液的活度,但是增加了溶液对甲烷的溶解度,而活度降低和甲烷溶解度增加对甲烷水合物形成相平衡条件影响相反。
关键词:低剂量抑制剂;水合物;形成;相平衡
0 引 言
天然气水合物,又称笼形水合物,是由一种或数种气体或易挥发的液体和水相互作用所形成的包络状晶体,主体分子即水分子以氢键相互结合形成的笼形空隙将客体分子包络在其中形成非化学计量的化合物,客体分子和水分子之间通过范德华力相互作用[1]。自从20世纪30年代在前苏联的天然气管道中首次发现了天然气水合物之后[2],随着石油工业的快速发展,天然气水合物对油气工业造成的影响越来越大,深海油气开采、恶劣条件下的油气输送等都会有水合物形成和堵塞的风险,因此水合物防治的研究在全世界全面展开。
一般管道内的水合物问题,可以通过以下几种方法抑制水合物的形成:(1)除水,使得体系没有形成大量水合物所需的水,但是有些时候在一些地方除水是很困难的,比如在井头和钻井平台之间除水可能是不可行的;(2)保温,保持高温使系统维持在无水合物的区域,但是此方法在很多情况下是不经济的;(3)降压,系统压力可以降低到水合物形成压力以下,但是这样就降低了密度从而降低了管道输送的效率;(4)添加抑制剂,阻止水合物生成最常用的方法是添加抑制剂,抑制剂分为热力学抑制剂和低剂量抑制剂。
热力学抑制剂通过改变水溶液或水合物相的化学势,使得水合物的分解曲线移向较低温度或较高压力,从而达到抑制水合物形成的目的[3-5]。热力学抑制剂的特点是使用浓度高,加入量大,而且相应的运输、储存、泵送、注入及回收成本较高。低剂量抑制剂(LDHI)通常是通过抑制水合物成核,或者干扰水合物核的生长或聚结,防止水合物晶粒进一步长大。LDHI包括动力学抑制剂和阻聚剂,由于加入量很少(浓度一般小于1wt%),成本较低,经济可行[6-8]。但是低剂量抑制剂抑制时间有限[9],且使用过冷度一般不高于8.3℃[10],所以实际操作过程中,需要将低剂量抑制剂和其他化合物或者不同类型抑制剂联合使用。LEE等[11-12]实验指出含某正庚烷体系聚环氧乙烷能加强动力学抑制剂的抑制效果,聚环氧乙烷能增强木薯淀粉的抑制作用。HEIDARYAN等[13]研究了甲醇和聚乙烯甲醚作为低剂量组合抑制剂的效果。
当低剂量抑制剂和其他化合物或者热力学抑制剂联合作用到含有其他物质的体系中,比如钻井液体系,由于二者作用机制不同,不得不考虑抑制剂对整个体系热力学或者动力学条件的影响,以便在选用抑制剂时可以预测或评估它们对体系的影响。热力学抑制剂对体系形成动力学和热力学影响在油田研究较多,而低剂量抑制剂由于使用时间不长,主要是其动力学效果研究,以评价其抑制能力,低剂量抑制剂通常认为改变水合物形成的动力学过程,但是低剂量抑制剂的添加能否改变体系形成水合物的热力学条件,这对与热力学抑制剂联合使用、或者钻井液中水合物抑制剂的选择至关重要。王燕鸿等[14]采用分子动力学模拟手段研究过聚乙烯唑啉对甲烷水合物分解影响的动力学过程,但是没有研究热力学影响。本文研究低剂量抑制剂聚乙烯吡咯烷酮(PVP)在不同浓度下对甲烷水合物分解的热力学条件的影响,以指导实际使用中低剂量抑制剂及抑制剂浓度的选择。
1 实验部分
1.1 实验装置
图1为本实验所用装置,主要包括高压反应釜、磁力搅拌系统、恒温水浴(酒精)、手动增压系统和数据采集系统等。装置的核心为高压反应釜,由不锈钢材料制成,设计耐压强度为40 MPa,最大工作压力为32 MPa,内径40 mm,容积为100 ml,工作温度范围为 –30℃ ~ 80℃。磁力搅拌系统可以对反应釜内溶液进行搅拌,从而促进水合物的生成和分解。恒温水浴为宁波天恒仪器厂生产的THD-2015型低温恒温槽,恒温槽温度控制范围为 –20℃~100℃,控温精度为±0.1℃。实验时,整个高压反应釜浸没于恒温水浴槽中。反应釜内温度变化由Pt100热电阻温度计测定,测温精度为±0.1℃,热电阻温度计由北京威斯特中航机电技术有限公司制造,压力由北京威斯特中航机电技术有限公司生产的CYB-30S隔爆型压力变送器测定,该压力变送器的量程为 –0.1 MPa~25 MPa,精度为 ±0.1%FS。所有的温度、压力读数记录都是由Agilent公司Agilent 34970A型数据采集系统采集存储。

图1 气体水合物相平衡条件测定装置示意图Fig. 1 Schematic diagram of the experimental apparatus1 气瓶;2 手动增压泵;3 活塞容器;4 压力表;5 压力传感器;6 磁力搅拌系统;7 温度传感器;8 真空泵;9 高压反应釜;10 制冷与加热单元;11 恒温槽;12 计算机;13 数据采集仪;14 真空表。
1.2 实验材料
实验所有的实验气体为甲烷,纯度99.99vol%,由佛山市华特气体有限公司生产,生成水合物的水为实验室自制二次蒸馏水,所用添加剂PVP为(C6H9NO)n,由美国国际特品有限公司(ISP)提供。
1.3 实验过程
实验所测水合物相平衡点采用定容压力搜索法。首先对体系进行抽真空,蒸馏水清洗反应釜三次,反应溶液润洗一次,用实验气体吹扫反应釜后,吸入反应溶液60 ml。抽真空后注入实验气体至预定压力。开启恒温水浴,开通磁力搅拌系统,逐步降温,观察温度和压力的变化,压力会随着温度按照一定的斜率降低,当有水合物生成时,会出现压力突降,当在某个温度下压力降低足够多时,逐步升高体系温度进行水合物的分解,当接近水合物完全分解点时,每次以0.1 K逐步升温,且恒温至少4小时以上,至釜内温度、压力达到平衡,以确保反应釜内水合物完全分解,直到温度恢复到初始实验时的温度,结束实验。在PT图上压温线出现明显的拐点认为是水合物分解点,即水合物相平衡点。
2 结果与讨论
为了验证本文实验装置和实验方法的准确性,而且气体纯水相平衡实验是水合物抑制剂体系实验的基础,获得了纯水体系中气体水合物的相平衡曲线,才能将抑制剂对水合物相平衡的影响进行对比,因此首先对纯水体系中甲烷水合物相平衡条件进行了实验研究,实验数据列于表1。实验结果与VERMA[15]、NAKAMURA[16]以及MOHAMMADI[17]的实验数据进行了对比,如图2。

表1 甲烷+水体系相平衡实验结果Table 1 Experimental data for methane hydrate equilibrium conditions in pure water
由图2可以看出纯水体系在283.3 K ~ 290.3 K温度范围内水合物分解数据实验结果与VERMA、 NAKAMUR以及MOHAMMADI的研究结果吻合得很好,表明本实验所采用的装置与实验方法是可靠的,可以进行后面添加低剂量抑制剂的研究。
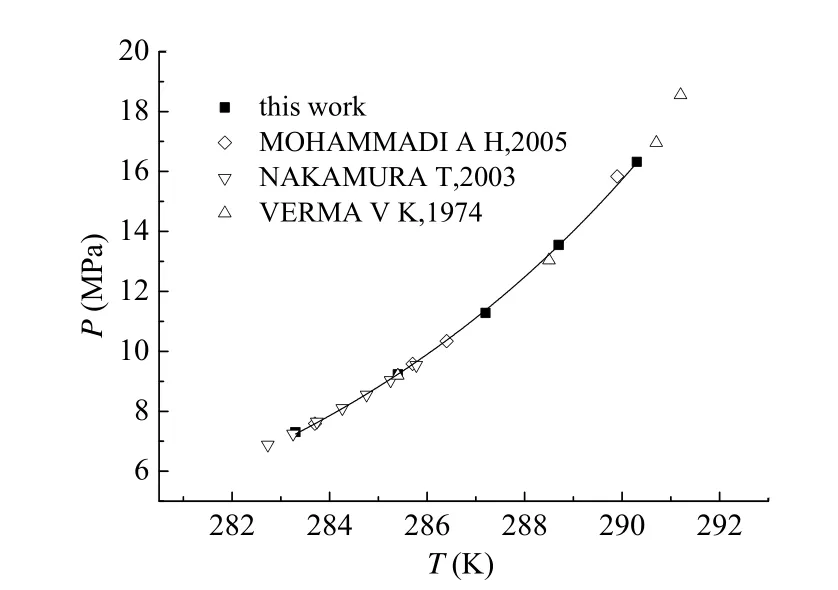
图2 纯水中的甲烷水合物相平衡数据Fig. 2 Comparison of methane hydrate equilibrium conditions in pure water
以该实验数据作为基准,在此基础上研究添加抑制剂对P-T曲线的影响。对本实验条件下的甲烷水合物相平衡数据进行拟合,可以得到压力对温度的拟合公式:
式中:P为压力,MPa;T为温度,K。
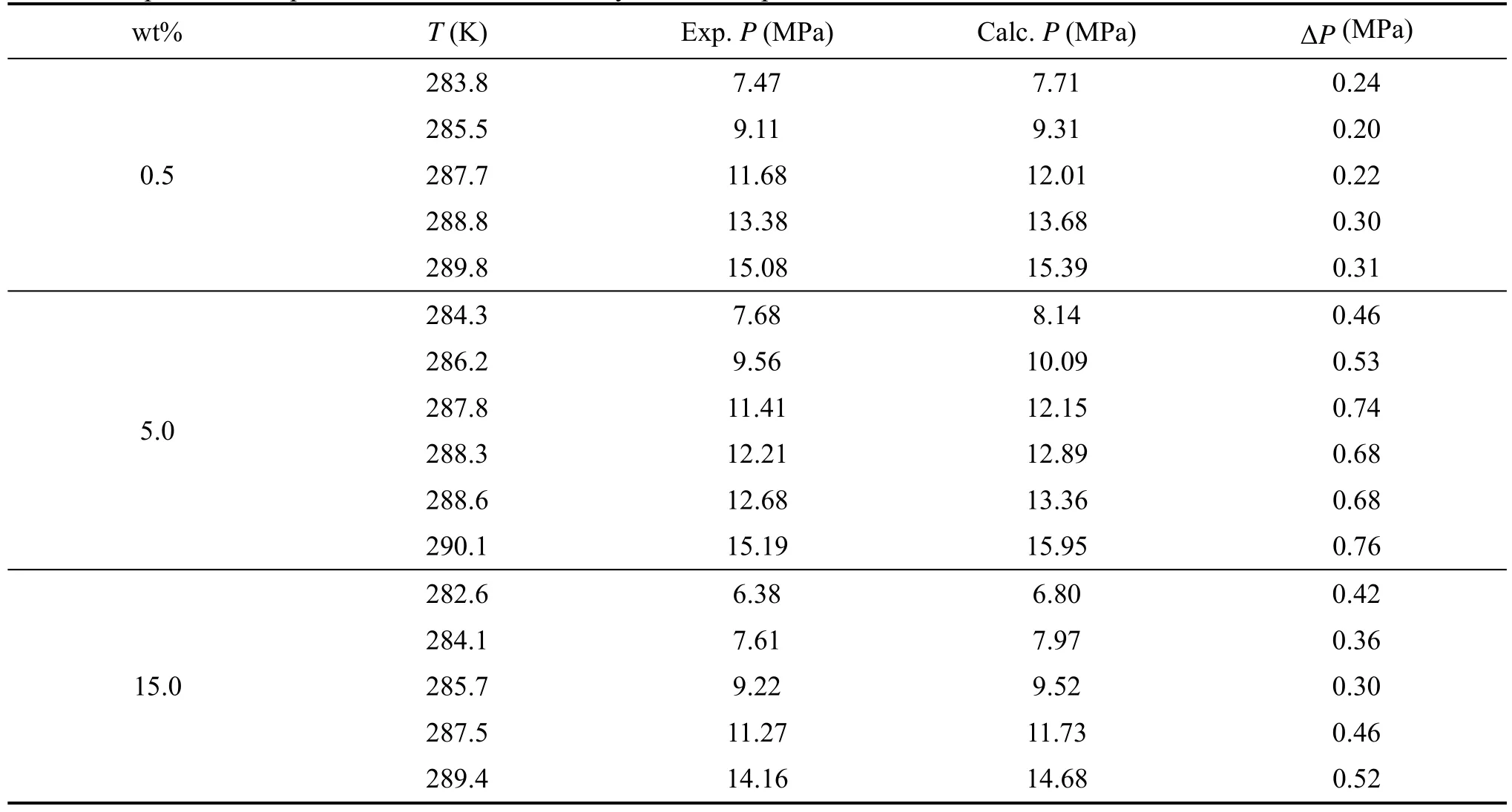
表2 添加PVP对甲烷水合物相平衡的影响Table 2 Experimental equilibrium data for methane hydrate in the presence of PVP
在甲烷与纯水体系研究的基础上,对添加不同浓度的动力学抑制剂聚乙烯吡咯烷酮进行了研究。含有不同浓度的聚乙烯吡咯烷酮溶液形成甲烷水合物相平衡实验结果列于表2。表2中的计算数据(Calc)为采用公式(1)计算所得。
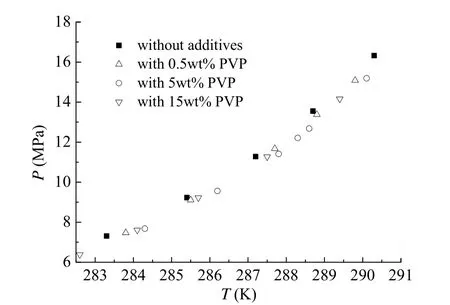
图3 甲烷+PVP+水体系水合物水合物分解P-T图Fig. 3 Experimental equilibrium data of methane hydrate in the presence of PVP
图3显示了不同浓度PVP对甲烷相平衡的影响。从图中可以看出,添加PVP后,甲烷水合物形成的P-T线向高温方向移动,也就是说添加PVP后,在相同压力下,水合物形成温度升高,即从热力学上来说促进了甲烷水合物的形成。在282.6 K ~ 290.1 K范围内,对甲烷 + PVP + 水体系做了三个浓度的水合物形成相平衡条件研究,PVP反应溶液质量浓度分别为0.5wt%、5.0wt%、15.0wt%。由图3可以看出,不同浓度的Inhbiex157对甲烷体系形成水合物的相平衡条件,都具有一定的促进作用,但是浓度导致的促进能力差别很小。特别是当浓度高达15.0wt%时,对相平衡条件的改变程度仍然很小。在溶液状态下,水合物的形成相平衡条件与气体组成和溶液盐度或者活度有关,天然气水合物的形成压力会随溶液活度的降低而升高[18],也就是说,溶液活度的降低会导致水合物更难生成,相平衡曲线会左移。根据高分子溶液对活度系数的影响来看,高分子溶液浓度的增加会导致活动系数降低[19],活度系数降低,溶液活度降低。本实验过程中反应气体均为甲烷,而添加不同浓度的PVP对溶液活度改变程度不一样,浓度越高,溶液活度越低,那么水合物的形成温度压力曲线应该向左移动,更难形成水合物。但是实验过程中对甲烷相平衡曲线的影响是向右的,即从热力学上来说,是促进水合物形成的,且高分子浓度对这种促进能力影响不大。那么,可以认为,高分子的引进,改变了甲烷在水中的溶解度,使得甲烷溶解度增大,甲烷溶解度随着PVP浓度的增加而增加,溶解度增大带来的水合物形成温度升高的影响和抑制剂分子对溶液活度减低的影响二者互相牵制和反作用,从而导致了PVP对甲烷水合物相平衡微弱的促进作用,且浓度对促进能力影响不大。
表2和图4显示了不同浓度的PVP对甲烷水合物相平衡条件的影响情况。表2中计算值为采用拟合公式(1),在不同温度下计算得到的相平衡压力;实验值是表2中各浓度对应的甲烷水合物相平衡温度压力实测值;ΔP为计算值与实验值之差。表2中ΔP为正值,说明实验所测不同浓度的动力学抑制剂PVP对甲烷水合物的形成条件均为促进作用。从图4可以看出,三种不同浓度PVP对甲烷水合物形成条件影响都不大,但是影响程度分别为0.5wt%大于15wt%,15wt%大于5wt%。即有可能PVP对甲烷水合物浓度的影响不是简单的随浓度的升高而升高,而是有一个先升高后降低的过程,不过由于这个影响程度差别很小,针对15wt%和5wt%浓度,偏差之差最大为0.46,其次为0.4,在实验误差范围内,不能完全支持此结论。
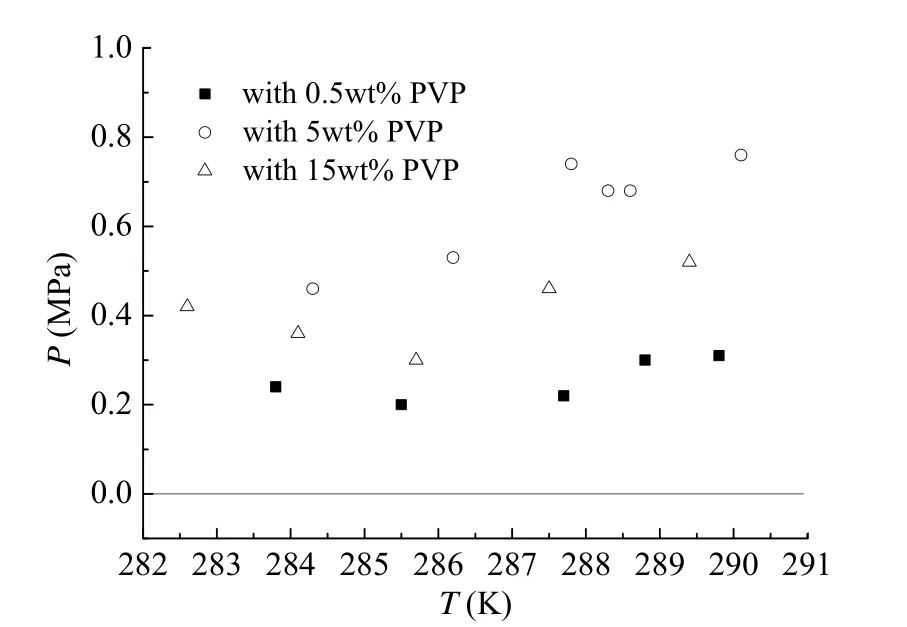
图4 PVP对甲烷水合物形成温度和压力的影响Fig. 4 Influence of PVP with different concentrations on methane hydrate equilibrium data
3 结 论
本文采用定容压力搜索法,测定并分析了不同浓度的低剂量抑制剂聚乙烯吡咯烷酮对甲烷水合物形成相平衡条件的影响。测定了282.6 K ~ 290.3 K 和6.38 MPa ~ 16.32 MPa范围内纯水和不同浓度PVP溶液中甲烷水合物的相平衡条件。空白实验中甲烷在纯水体系里相平衡数据与此温度范围内的文献数据吻合,证明了本实验装置和实验数据的可靠性。0.5wt%、5wt%和15wt%三种浓度PVP对甲烷水合物形成条件有促进作用,但促进作用不大,分析认为高分子的加入降低了溶液的活度,但是增加了溶液对甲烷的溶解度,活度的降低和甲烷溶解度的增加对水合物形成相平衡条件的影响是相反的,二者共同作用导致PVP浓度的大幅增加而相平衡条件改变很小。
参考文献
[1] SLOAN E D. Clathrate hydrate of nature gases[M]. 2nd ed. New York: Marcel Dekker Inc, 1998: 27-49.
[2] HAMMERSCHMIDT E G. Formation of gas hydrates in natural gas transmission Lines[J]. Industrial & engineering chemistry, 1934, 26(8): 851-855. DOI: 10.1021/ie50296a010.
[3] DHOLABHAI P D, ENGLEZOS P, KALOGERAKIS N, et al. Equilibrium conditions for methane hydrate formation in aqueous mixed electrolyte solutions[J]. The Canadian journal of chemical engineering, 1991, 69(3): 800-805. DOI: 10.1002/cjce.5450690324.
[4] MAEKAWA T. Equilibrium conditions for clathrate hydrates formed from methane and aqueous propanol solutions[J]. Fluid phase equilibria, 2008, 267(1): 1-5. DOI: 10.1016/j.fluid.2008.02.006.
[5] MOHAMMADI A H, KRAOUTI I, RICHON D. Methane hydrate phase equilibrium in the presence of NaBr, KBr, CaBr2, K2CO3, and MgCl2aqueous solutions: Experimental measurements and predictions of dissociation conditions[J]. The journal of chemical thermodynamics, 2009, 41(6): 779-782. 10.1016/j.jct. 2009.01.004.
[6] KELLAND M A. History of the development of low dosage hydrate inhibitors[J]. Energy & fuel, 2006, 20(3): 825-847. DOI: 10.1021/ef050427x.
[7] KELLAND M A, REYES F T, TROVIK K W. Tris(dialkylamino)cyclopropenium chlorides: Tetrahydrofuran hydrate crystal growth inhibition and synergism with polyvinylcaprolactam as gas hydrate kinetic inhibitor[J]. Chemical engineering science, 2013, 93: 423-428. DOI: 10.1016/j.ces.2013.02.033.
[8] DARABOINA N, PACHITSAS S, VON SOLMS N. Experimental validation of kinetic inhibitor strength on natural gas hydrate nucleation[J]. Fuel, 2015, 139: 554-560. DOI: 10.1016/j.fuel.2014.09.013.
[9] CLARK L W, ANDERSON J. Development of effective combined kinetic hydrate inhibitor/corrosion inhibitor (KHI/CI) products[C]//Proceedings of the Fifth International Conference on Gas Hydrates, June 12-16, 2005. Trondheim, Norway, 2005: 1249-1257.
[10] VON JOSHI S, GRASSO G A, LAFOND P G, et al. Experimental flowloop investigations of gas hydrate formation in high water cut systems[J]. Chemical engineering science, 2013, 97: 198-209. DOI: 10.1016/ j.ces.2013.04.019.
[11] LEE J D, ENGLEZOS P. Enhancement of the performance of gas hydrate kinetic inhibitors with polyethylene oxide[J]. Chemical engineering science, 2005, 60(19): 5323-5330. DOI: 10.1016/j.ces.2005.05.023.
[12] LEE J D, WU H J, ENGLEZOS P. Cationic starches as gas hydrate kinetic inhibitors[J]. Chemical engineering science, 2007, 62(23): 6548-6555. DOI: 10.1016/j.ces. 2007.07.041.
[13] HEIDARYAN E, SALARABADI A, MOGHADASI J, et al. A new high performance gas hydrate inhibitor[J]. Journal of natural gas chemistry, 2010, 19(3): 323-326. DOI: 10.1016/S1003-9953(09)60060-8.
[14] 王燕鸿, 陈玉娟, 包玲, 等. 聚乙烯唑啉作用下甲烷水合物分解的分子动力学模拟[J]. 物理化学学报, 2012, 28(7): 1683-1690. DOI: 10.3866/PKU.WHXB201204113.
[15] VERMA V K. Gas hydrates from liquid hydrocarbonwater systems[D]. Michigan: University of Michigan, 1974.
[16] NAKAMURA T, MAKINO T, SUGAHARA T, et al. Stability boundaries of gas hydrates helped by methane--structure-H hydrates of methylcyclohexane and cis-1,2-dimethylcyclohexane[J]. Chemical engineering science, 2003, 58(2): 269-273. DOI: 10.1016/S0009-2509(02)00518-3.
[17] MOHAMMADI A H, ANDERSON R, TOHIDI B. Carbon monoxide clathrate hydrates: Equilibrium data and thermodynamic modeling[J]. AIChE journal, 2005, 51(10): 2825-2833. DOI: 10.1002/aic.10526.
[18] 刘伟, 金翔龙, 初凤友, 等. 海底天然气水合物相平衡的影响因素[J]. 海洋地质前沿, 2011, 27(5): 16-23.
[19] 景孔华, 康惠宝, 王利生. 改进PSRK模型预测高分子溶液的活度系数[J]. 计算机与应用化学, 2005, 22(11): 1001-1004. DOI: 10.3969/j.issn.1001-4160.2005.11.012.
唐翠萍(1977-),女,博士,副研究员,主要进行天然气水合物抑制研究。
梁徳青(1970-),男,博士,研究员,博士生导师,主要从事天然气水合物研究。
Equilibrium Conditions for Methane Hydrate in the Presence of Polyvinylpyrrolidone Aqueous Solutions
TANG Cui-Ping, DAI Xing-Xue, LIANG De-Qing
(Key Laboratory of Natural Gas Hydrate, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China)
Abstract:Influence of low dosage hydrate inhibitors on gas hydrate formation condition is important for development and chooses of combined hydrate inhibitors. By using polyvinylpyrrolidone aqueous solutions, experimental data on the equilibrium conditions for methane hydrate with different concentrations within the temperature range from 282.6 K to 290.3 K were reported in this work. Measurements were made using an isochoric pressure-search method. The results show polyvinylpyrrolidone with the concentration from 0.5wt% to 15wt% has a little promoting effect on methane hydrate formation equilibrium conditions, and it is thought that addition of the polymer of polyvinylpyrrolidone can decrease the solution activity, but can increase the solubility of methane in this polymer solution.
Key words:low dosage hydrate inhibitor; gas hydrates; formation; equilibrium condition
作者简介:
通信作者:†梁德青,E-mail:liangdq@ms.giec.ac.cn
基金项目:国家自然科学基金(41406103)
* 收稿日期:2015-09-29
修订日期:2015-12-15
文章编号:2095-560X(2016)01-0028-05
中图分类号:TK01+9
文献标志码:A
doi:10.3969/j.issn.2095-560X.2016.01.005
