寒湿环境对佐剂关节炎模型大鼠炎症反应的影响*
2016-03-27任香怡魏江平巨少华徐世军
陈 欢,任香怡,魏江平,巨少华,胡 勇,徐世军△
(1.成都中医药大学,成都 611137;2.四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137)
【实验研究】
寒湿环境对佐剂关节炎模型大鼠炎症反应的影响*
陈 欢1,2,任香怡1,2,魏江平1,2,巨少华1,2,胡 勇1,2,徐世军1,2△
(1.成都中医药大学,成都 611137;2.四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137)
目的:考察寒湿环境对佐剂性关节炎模型大鼠炎症反应的影响及乌头汤的干预回调作用,综合揭示“风寒湿三气杂至合而为痹”的科学内涵。方法:采用佐剂性关节炎模型复合寒湿环境制备寒痹动物模型,从造模第6天开始每隔4 d测定大鼠足容积并计算足肿胀率,第16天开始给予乌头汤干预治疗30 d,第45天观察踝关节病理形态学及检测大鼠血清白介素-6(IL-6)、类风湿因子(RF)、抗-环瓜氨酸多肽抗体(anti-CCP)的含量水平。结果 给予大鼠寒湿环境刺激后,寒湿对照组与模型对照组比较,足肿胀率、病理损伤程度以及血清因子IL-6、RF、anti-CCP均无统计学意义,但均呈上升趋势;乌头汤治疗后与寒湿对照组比较,大鼠足肿胀率31 d后显著下降,大鼠踝关节损伤明显改善,血清因子IL-6、RF、anti-CCP水平明显降低。结论:寒湿环境通过加重完全弗氏佐剂性关节炎大鼠关节炎症反应,促进RA疾病的发展,且乌头汤具有较好的回调干预作用。
寒湿环境;佐剂性关节炎模型;乌头汤
类风湿关节炎(rheumatoid arthritis,RA)属于痹症范畴。中医认为RA发病是因于本虚,“风寒湿三气杂至”或“风寒湿气中其俞”成痹,指出环境因子在RA发病中具有极其重要的地位。西医认为RA是一种以慢性关节滑膜炎为特征的自身免疫性疾病,环境和遗传因素都是其发病的关键因素。双胞胎人群样本研究表明,环境因素对RA发展比遗传因素更为重要[1]。当外界温度下降或湿气加重均会导致由炎症引发的关节疼痛等不适感[2-3],此外环境因素可通过改变基因的表观遗传修饰参与RA的免疫应答[4]。目前由于中医证的模型缺乏,疾病模型在RA研究和药物评价中得到广泛应用,其中佐剂性关节炎模型(Adjuvant arthritis model,AA)因为与人类 RA病理改变相近应用更广。研究表明,环境因素对佐剂性关节炎模型自身抗体表达和关节损坏程度有明显影响[5]。但目前尚无环境因素对该模型炎症因子影响的研究报道,也未见采用“以方测证”思路的经方干预评价的研究报道。
1 材料与方法
1.1 动物和药物
SPF级雄性 SD大鼠,体质量140~160 g,由成都达硕实验动物有限公司提供(动物合格证号SCXK(川)2013-24)。
依照上海中医学院1982年版《中医方剂与临床手册》乌头汤的组成和用量为川乌15 g、黄芪15 g、麻黄9 g、白芍9 g、甘草9 g,并按2010版《中华人民共和国药典》加工炮制后组方,常规方法制备成100%标准汤剂;醋酸地塞米松片,浙江仙琚制药股份有限公司(批号120245)。
1.2 实验仪器和试剂
足趾容积测量仪(成都泰盟科技有限公司); 3001全自动酶标仪(Thermo Scientific);转轮式切片机(德国徕卡-2016);TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BMJ-Ⅲ型包埋机(常州郊区中威电子仪器厂);数码三目摄像显微镜,BA400Digital(麦克奥迪实业集团有限公司);图像分析软件Motic Images Advanced。
完全弗氏佐剂(CFA)购于 sigma公司(批号SLBB1397);anti-CCP-ELISA检测试剂盒、RF-ELISA检测试剂盒、IL-6-ELISA检测试剂盒,武汉华美生物科技有限公司提供(批号 O04033624、O31033614、O31033612)。
2 方法
2.1 分组与造模
将40只雄性 SD大鼠按随机数字表法分为5组,即空白对照组、模型对照组(CFA)、寒湿对照组(CFA+寒湿)、地塞米松组(CFA+地塞米松)和乌头汤组(CFA+寒湿+乌头汤)各8只[6]。
造模方法参照如下[5],除空白对照组注射0.1 ml生理盐水外,其余大鼠右后足底均注射 0.1 mlCFA。寒湿对照组与乌头汤组2组大鼠造模后每天置于2~8℃、相对湿度70% ~80%的环境下6 h。
2.2 给药
造模后第16天开始,给药组大鼠分别按60 kg成人等效剂量给予灌胃乌头汤(7.98 g/kg)、地塞米松(5 mg/kg),其余各组大鼠均给予等量蒸馏水,药体积为20 ml/kg,每日1次,连续30 d。
2.3 足肿胀率测定
表1显示,造模前测定各大鼠的右后足容积2次,取平均值作为正常足容积;造模后第6天开始,每隔4 d测定大鼠的足容积2次取平均值,同时记录大鼠体质量直至45 d。计算并比较各组的足肿胀率[E(%)=(Vt-Vn)/m,Vt为造模后足容积,Vn为造模前正常足容积,m为大鼠测量足容积当天体质量]。
2.4 踝关节组织病理学检测
图1表2显示,末次给药后取大鼠右后踝关节,以10%甲醛溶液固定,石蜡包埋、切片,苏木素-伊红(HE)染色,光学显微镜观察组织病理变化,并采用以下标准进行病理形态学评分:炎性细胞浸润评分:0:无;1:稀疏、散在;2:较密集;3:大量。滑膜组织增生评分:0:无;1:单层;2:2层;3:3层。纤维组织增生评分:0:无;1:少量增生;2:中等;3:大量。巨噬细胞增生评分:0:无;1:稀疏;2:较密集;3:大量。
2.5 检测血清因子
表3显示,实验第45天末次给药后,各组大鼠股动脉取血,制备血清。按照ELISA法说明书步骤检测血清中IL-6、RF、anti-CCP含量水平。
表1 各组大鼠足肿胀率变化(±s)

表1 各组大鼠足肿胀率变化(±s)
注:与模型对照组比较:*P<0.05;与寒湿对照组比较:#P<0.05
组别 鼠数 给药剂量/g·kg-11 d /ml·g-16 d /ml·g-111 d /ml·g-116 d /ml·g-121 d /ml·g-126 d /ml·g-131 d /ml·g-136 d /ml·g-141 d /ml·g-145 d /ml·g-1空 白 组 8 — 0.005±0.00 0.08±0.03* 0.11±0.03* 0.19±0.02 0.18±0.04* 0.14±0.03* 0.14±0.05* 0.16±0.03* 0.15±0.03* 0.16±0.03*模 型 对 照 组 8 — 0,005±0.00 0.43±0.09 0.56±0.14 0.58±0.14 0.56±0.18 0.53±0.18 0.59±0.19 0.52±0.16 0.53±0.16 0.55±0.14寒 湿 对 照 组 8 — 0.005±0.000.52±0.11 0.59±0.17 0.61±0.11 0.67±0.18 0.64±0.17 0.61±0.19 0.54±0.12 0.56±0.14 0.59±0.15地 塞 米 松 组 8 5 mg 0.005±0.000.47±0.07 0.48±0.07 0.46±0.08 0.40±0.07 0.38±0.09* 0.34±0.10* 0.29±0.05* 0.26±0.08* 0.22±0.07*乌 头 汤 组 8 7.98 0.006±0.000.41±0.09 0.59±0.11 0.60±0.12 0.59±0.08 0.49±0.09 0.44±0.14# 0.35±0.09# 0.31±0.13# 0.38±0.13#
表2 各组大鼠踝关节病理学评分结果(±s)

表2 各组大鼠踝关节病理学评分结果(±s)
注:与模型对照组比较:*P<0.05;与寒湿对照组比较:#P<0.05
组别 鼠数 给药剂量/g·kg-1炎性细胞浸润 纤维组织增生 滑膜组织增生 巨噬细胞增生空白对照组 8 — 0* 0* 0* 0*模 型对照组 8 — 15 18 17 16寒 湿对照组 8 — 18 20 21 18地 塞 米 松 组 8 5 mg 10* 13* 10* 9*乌 头 汤 组 8 7.98 11# 12# 11# 10#
3 统计学方法
采用SPSS 17.0统计软件进行统计分析,以均数±标准差(±s)表示,各组数据呈正态分布,不符合正态分布时采用非参数检验,P<0.05为差异有统计学意义。
4 结果
4.1 各组大鼠足肿胀率的变化
表1显示,与模型对照组比较,寒湿对照组大鼠足肿胀率从第6天开始逐渐增加,第21天达到峰值,第36天出现上升趋势至实验结束;乌头汤干预治疗以后,与寒湿对照组比较,给药后大鼠足肿胀率从第21天开始呈下降趋势,从第31天开始均呈显著下降(P<0.05)。
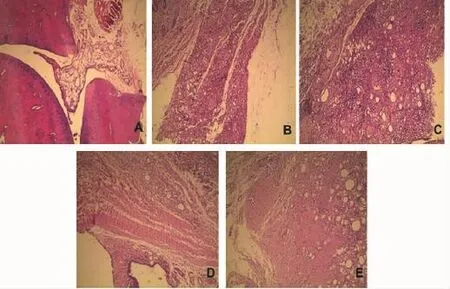
图1 各组大鼠踝关节病理学HE染色结果(HE ×100)
表3 各组大鼠血清中IL-6、RF、anti-CCP含量变化比较(±s)

表3 各组大鼠血清中IL-6、RF、anti-CCP含量变化比较(±s)
注:与模型对照组比较:*P<0.05;与寒湿对照组比较:#P<0.05
组别 鼠数 给药剂量/g·kg-1 IL-6/pg·ml-1 RF/mIU·ml-1 anti-CCP/IU·ml-1空 白 对 照 组 8 — 38.966± 7.448* 83.163±32.228* 23.252±14.247*模 型 对 照 组 8 — 289.128±12.543 240.954±62.029 125.623±24.354寒 湿 对 照 组 8 — 298.376±15.181 264.340±64.874 126.248±30.577地 塞 米 松 组 8 5 mg 145.721±47.556* 144.725±36.267* 36.544±26.093*乌 头 汤 组 8 7.98 176.238±31.055# 176.023±44.423# 42.041±29.188#
4.2 各组大鼠踝关节病理学变化
4.2.1 HE染色结果 图1显示,正常大鼠踝关节滑膜细胞单层排列整齐,无血管增生,无纤维化,无乳头状增生,未见炎细胞浸润。模型对照组可见关节滑膜增生明显,毛细血管增多扩张充血以及炎细胞浸润;寒湿对照组可见滑膜细胞增生活跃,滑膜组织中纤维组织增生,毛细血管增生及充血严重,可见大量炎性细胞浸润及纤维母细胞浸润。乌头汤组滑膜肿胀、充血程度及滑膜细胞增生,较寒湿对照组减轻,未见明显炎细胞浸润及血管增生、纤维化不明显。
4.2.2 病理评分 表2显示,寒湿对照组的炎性细胞浸润、滑膜组织增生、纤维组织增生、巨噬细胞增生均高于模型对照组,但差异无统计学意义(P>0.05)。经乌头汤治疗以后,乌头汤组的炎性细胞浸润、滑膜组织增生、纤维组织增生、巨噬细胞增生较寒湿对照组均明显下降(P<0.05)。
4.3 各组大鼠血清中IL-6、RF、anti-CCP含量的变化
表3显示,寒湿对照组与模型对照组比较,血清中IL-6、RF、anti-CCP水平均有上升趋势,但差异无统计学意义(P>0.05);乌头汤组与寒湿对照组比较,血清中IL-6、RF、anti-CCP水平均明显降低(P< 0.05)。
5 讨论
大量证据表明,RA的发展进程与环境因素诱发个体遗传危险因素有关。RA危险因素临床对照研究表明,居住环境、气候变化等环境因素是引发RA的第三重要危险因素[7]。RA遗传易感宿主暴露于环境危险因素下,触发伴随自身抗体产生的自身免疫反应的发生,推动机体免疫失调,最终发展成炎症性关节炎[8]。而对 RA全组基因相关研究证实,RA发病机制与遗传因素和环境因素在人类白细胞抗原(HLA)DRB1等位基因和其他风险等位基因上的相互作用有关,在基因水平上论证了环境因素与RA的关系[9-10]。在RA发病阶段中,环境因素刺激机体产生免疫反应,在此过程中发现有大量与炎症反应相关的自身抗体和细胞因子[11-13]。自身抗体RF和Anti-CCP积聚于关节滑膜上,导致关节产生大量炎症细胞因子,引发 RA全身炎症反应[14]。实验证明,RA患者自身抗体水平升高常伴随炎症因子水平的升高,如IL-1、TNF-α、IL-6等,而IL-是重要的促炎因子,在炎症发展中起重要的作用[15-17]。以病的模型研究证实,表征的更多是药物的共性特征,而对药物的个性特征体现不明显。本实验依据“以方测证”的思路,经与方证相应的经典名方乌头汤干预治疗后,研究环境因素对RA形成及发展的影响。本研究结果显示,足肿胀率不同测定点寒湿对照组均较模型对照组升高,第21天达到峰值,提示寒湿环境加重了佐剂性关节炎模型大鼠足肿胀程度。病理结果与足肿胀率结果吻合,均显示寒湿环境加重了佐剂性关节炎模型大鼠踝关节损伤程度,推动了 RA疾病的发展。寒湿对照组大鼠血清中RF、anti-CCP、IL-6的表达水平均较模型对照组升高,与足肿胀率、病理结果一致,提示寒湿环境可能通过上调血清中IL-6、RF、anti-CCP三者水平,扩大佐剂性关节炎的炎症反应,加重RA的疾病程度。乌头汤干预治疗后,大鼠足肿胀程度得到明显减轻,踝关节病理状态得到较好改善,血清中IL-6、RF、anti-CCP的分泌水平发生不同程度下调,说明乌头汤对由寒湿环境刺激后加重的炎症反应有显著的回调作用。从以上结果得出结论,寒湿环境因素可能通过上调自身抗体以及炎症因子水平加重完全弗氏佐剂性关节炎大鼠的炎症反应,而乌头汤下调炎症因子水平,回调由寒湿环境引起的炎症反应。本实验只在细胞因子水平上对寒湿环境是否影响RA进行了探讨,缺乏从基因分子层面研究寒湿环境对RA影响的探究,两者结果是否一致还有待进一步的研究。
[1]Svendsen A J,Holm N V,Kyvik K,et al.Relative importance of genetic effects in rheumatoid arthritis:historical cohort study of Danish nationwide twin population Commentary:Do genes or environment influence development of rheumatoid arthritis?[J].Bmj,2002,324(7332):264.
[2]Strusberg I,Mendelberg R C,Serra H A,et al.Influence of weather conditions on rheumatic pain[J].The Journal of rheumatology,2002,29(2):335-338.
[3]Sato J,Aoyama M,Yamazaki M,et al.Artificially produced meteorological changes aggravate pain in adjuvant-induced arthritic rats[J].Neuroscience letters,2004,354(1):46-49.
[4]Costenbader K H,Gay S,Alarcón-Riquelme M E,et al.Genes,epigenetic regulation and environmental factors:which is the most relevant in developing autoimmune diseases? [J].Autoimmunity reviews,2012,11(8):604-609.
[5]申洪波,白云静,胡荫奇.环境因素对痹证大鼠自身抗体表达的影响[J].中国中医基础医学杂志,2010(9):832-834.
[6]徐世军,代渊,李磊,等.基于“方证相关”理论的治“痹”经方调控 T细胞亚群比较研究[J].中国中药杂志,2010 (15):2030-2032.
[7]倪红燕.类风湿关节炎危险因素的临床对照研究[J].现代中西医结合杂志,2011,20(25):3160-3161.
[8]Karlson E W,Deane K.Environmental and gene-environment interactions and risk of rheumatoid arthritis[J].Rheumatic Disease Clinics of North America,2012,38(2):405-426.
[9]Karlson E W,Chibnik L B,Kraft P,et al.Cumulative association of 22 genetic variants with seropositive rheumatoid arthritis risk[J].Annals of the rheumatic diseases,2010,69 (6):1077-1085.
[10]Mahdi H,Fisher B A,Källberg H,et al.Specific interaction between genotype,smoking and autoimmunity to citrullinated αenolase in the etiology of rheumatoid arthritis[J].Nature genetics,2009,41(12):1319-1324.
[11]Deane K D,O’Donnell C I,Hueber W,et al.The number of elevated cytokines and chemokines in preclinical seropositive rheumatoid arthritis predicts time to diagnosis in an age‐dependent manner[J].Arthritis& Rheumatism,2010,62 (11):3161-3172.
[12]Kokkonen H,Mullazehi M,Berglin E,et al.Antibodies of IgG,IgA and IgM isotypes against cyclic citrullinated peptide precede the development of rheumatoid arthritis[J].Arthritis Res Ther,2011,13(1):R13.
[13]Kokkonen H,S derstr m I,Rockl v J,et al.Up‐regulation of cytokines and chemokines predates the onset of rheumatoid arthritis[J].Arthritis&Rheumatism,2010,62(2):383-391.
[14]巨少华,胡勇,任香怡,等.环瓜氨酸肽辅助完全弗氏佐剂致关节炎大鼠的模型研究[J].中药药理与临床,2014,4: 043.
[15]丁立珉,孙万邦.细胞因子在类风湿关节炎发病机制中作用的研究进展[J].中国当代医药,2012,19(7):12-14.
[16]李沛,王大为,刘晓东.肿瘤坏死因子-α及其受体与类风湿关节炎[J].中国药科大学学报,2011,42(3):276-283.
[17]刘喜德,蔡龙,李召东,等.抗环瓜氨酸肽抗体与类风湿关节炎的相关性研究[J].中华风湿病学杂志,2007,11(6): 361-365.
Effects of Cold Environment on the Inflammatory Reaction of Adjuvant Arthritis in Rats
CHEN Huan1,2,REN Xing-yi1,2,WEI Jiang-ping1,2,JU Shao-hua1,2,HU Yong1,2,XU Shi-jun1,2△
(1.Chengdu University of Traditional Chinese Medicine,Chengdu 611137,China; 2.Key Laboratory of Systematic Research and Exploitation of TCM Resources in Sichuan Province,Chengdu 611137,China)
Objective:To observe the influence of cold-damp environment on inflammation of AA rats and evaluate the therapeutic effect of Wutou decoction.Methods:Establish the cold-arthralgia-syndrome rat model caused by complete Freund’s adjuvant combined with cold and dampness environment.Rats’paw volumes were measured every five days from the first modeling day.Sprague-Dawley rats of Wutou decoction group were treated with Wutou decoction(4.9 g·kg-1) continued 30 days after modeling 15 days.Histopathological examination was done for ankle joint and serum was analyzed for Interleukin-6(IL-6),Rheumatoid factor(RF)and Anti-cyclic citrullinated peptide antibodies(anti-CCP)by ELISA kits at 45th day after injecting.Results After the stimulation of cold-dampness environment,compared with the model group,the paw swelling,injury of ankle joint and the level of IL-6,RF and anti-CCP of the cold-dampness group had an increasing tendency.But these results about all showed no statistical significance.With Wutou decoction therapy,the paw swelling significantly decreased after the 31 d,the injury of the ankle joint tissues was obviously recovered and IL-6,RF and anti-CCP revealed an increased tendency compared with the cold-damp group.Conclusion:The cold-dampness environment can aggravate inflammation of AA rats’model and contribute to pathology development of rheumatoid arthritis.Wutou decoction can impede inflammation induced by cold-dampness environment.
Cold-dampness environment;Complete Freund’s adjuvant arthritis;Wutou decoction
R593.22
:B
:1006-3250(2016)03-0328-04
2015-01-12
国家自然科学基金面上项目(81273900);中药药理四川省青年科技创新研究团队(2014TD0007);四川省科技创新苗子工程培育项目(2014-089)
陈 欢(1989-),女,重庆人,在读硕士,从事中药抗炎与免疫药理学研究。
△通讯作者:徐世军,男,甘肃人,教授,从事中药神经与精神药理学、中药效应的信号转导机制和中药抗病毒、抗炎与免疫药理学研究,Tel:028-61800231,E-mail:docxu@126.com。
