多囊卵巢综合征孕妇胎盘类固醇的研究
2016-03-26郭江虹南华大学附属第一医院妇产科湖南衡阳421001
郭江虹(南华大学附属第一医院妇产科,湖南衡阳421001)
多囊卵巢综合征孕妇胎盘类固醇的研究
郭江虹
(南华大学附属第一医院妇产科,湖南衡阳421001)
摘要:目的评估多囊卵巢综合征(PCOS)孕妇胎盘类固醇硫酸酯酶(STS)、3β-羟基类固醇脱氢酶1型(3β-HSD-1)和P450芳香化酶(P450arom)活性。方法研究对象为足月分娩的20例PCOS孕妇和30例健康对照孕妇。分娩后采集胎盘组织和脐带血样本。孕34周时采集母体血液样本。评估胎盘组织中STS、3β-HSD-1和P450arom活性。测定血液样本内孕酮、硫酸脱氢异雄酮(DHEAS)、脱氢表雄酮(DHEA)、雄烯二酮、睾酮、雌酮、雌二醇和总雌三醇含量。结果与健康对照组孕妇比较,PCOS孕妇胎盘组织中3β-HSD-1含量较高,而P450arom活性较低。此外,PCOS孕妇雄烯二酮和睾酮浓度比对照组孕妇高(P=0.016和0.025)。相较于对照组女性新生儿,PCOS组女性新生儿脐带血内雄烯二酮较低,而雌三醇浓度较高(P=0.038和0.031)。结论PCOS孕妇胎盘组织内参与类固醇合成的两个重要酶活性发生改变,3β-HSD-1升高,而P450降低,该变化可引起怀孕期间雄激素分泌增加。
关键词:多囊卵巢综合征;胎盘;3β-羟基类固醇脱氢酶;P450芳香化酶
多囊卵巢综合征(Polycysticovarysyndrome,PCOS)是常见内分泌代谢紊乱症,影响约5%~10%的育龄期妇女,其主要特点是排卵/月经不规则、多囊性卵巢和高雄激素血症[1]。PCOS影响患者生育能力,PCOS妊娠并发症和不良后果发生率较高[2]。此外,PCOS妇女妊娠期间表现出雄激素浓度显著增加[3-4]。有趣的是,还有研究发现先兆子痫和妊娠期糖尿病妇女中雄激素水平也升高[5-6]。
怀孕期间,胎盘是产生类固醇的重要器官,但是目前尚未见胎盘类固醇生成对PCOS妇女雄激素水平影响的研究。人胎盘吸收的雄激素主要是来自胎儿和母体肾上腺的C19雄激素,其主要成分为硫酸脱氢异雄酮(dehydroepiandrosterone,DHEAS)。胎盘组织中硫酸基团经类固醇硫酸酯酶(steroid sulfatase,STS)裂解,未结合的甾族化合物经活化3β-羟基类固醇脱氢酶1型(3β-hydroxysteroid dehydrogenase type 1,3β-HSD-1)转变成雄烯二酮,随后又被17β-羟基类固醇脱氢酶转化为睾酮[7]。此外,胎儿肾上腺DHEAS也可以经16α-羟基化作用形成合成雌三醇的雄激素前体16α-羟基-脱氢表雄酮-硫酸酯(16α-OH-DHEAS)。因此,PCOS妇女胎盘中STS、3β-HSD-1和/或P450芳香化酶(P450 aromatase,P450arom)活性变化可导致产妇或胎儿血液循环中雄激素浓度增加。
本研究主要评估PCOS妇女在妊娠期间胎盘STS、3β-HSD-1和P450芳香化酶的活性,并通过测定母体血和脐带血中的类固醇浓度来探讨酶活性变化的临床意义。
1 资料与方法
1.1研究对象
采用病例对照研究设计,20例PCOS孕妇为研究组,对照组为30例月经正常、无高雄激素血症的孕妇。所有PCOS孕妇2014年1月-2014年12月就诊于南华大学妇产科。主要临床表现为闭经、月经稀发、月经量少、不孕、多毛、肥胖等;实验室检查,基础体温测定呈单相,血、血清睾酮浓度>0.6 ng/ml和/或游离雄激素指数(free androgen index,FAI)>5.0,雄(甾)烯二酮浓度>3.0 ng/ml以及超声下可见独特的卵巢形态。排除标准:高泌乳素血症、雄激素分泌瘤、库欣综合征和迟发性21-羟化酶缺乏症、甲状腺疾病患者及接受克罗米芬或外源性促性腺激素等诱发排卵类药物治疗的PCOS患者。所有患者接受生活方式评估,大部分PCOS患者服用500~2 000 mg二甲双胍,PCOS患者妊娠测试阳性即停止服用二甲双胍。对照组孕妇社会经济水平、年龄等与PCOS组患者匹配。对照组妇女具有28~32 d的规律月经周期史,无多毛症和高雄激素血症的其他表征,无溢乳及甲状腺功能异常。所有孕妇都是健康的,未接受任何药物治疗。
1.2标本采集
1.2.1血液样本所有受试者孕34周时采集血液样本,脐带血样品为分娩时脐动脉-静脉混合脐带血样本。血液样本立即离心,血清置入-80℃冰箱冷冻保存,待进一步分析。
1.2.2胎盘组织顺产或剖宫产后立即收集足月妊娠(孕37~40周)胎盘。使用无菌解剖刀在每个胎盘脐带插入位置(约5 cm)横切,将绒毛膜表面至基板部分分成3个水平段并分别编码为:S1,靠近绒毛膜层;S2,绒毛膜层和基底膜层间区域;S3,靠近基底膜层。
1.3标本检测
1.3.1酶学检测STS活性检测:酶溶液(100 mg蛋白质)与40 mmol/L预冷DHEAS和[1,2,6,7-3H] DHEAS(20 nmol)混合,37℃孵育30 min,加入2.0 ml甲苯终止酶反应,涡旋混匀1min,600×g离心5 min,分离DHEAS(水相)与脱氢表雄酮(dehydroepiandrosterone,DHEA)(有机相)。收集甲苯层,并利用液体闪烁计数器(美国Packard仪器有限公司)进行测定。胎盘3β-HSD活性检测:将100 mg蛋白、200 mmol磷酸钠缓冲液(pH=8.9)、100 mmol/L DHEA和40 ml甲醇混合,得到温育混合物1 ml。加入4.0 mmol/L的1-萘乙酰胺(1-naphthyl acetamide,NAD)后,检测340 nm处光密度(optical density,OD)值,通过在OD 340与空白(无NAD)对照组比较,测得酶活性。芳香化酶活性检测:来自于微粒体部分的100 mg蛋白与50 nmol [1β-3H]-雄甾-4-烯-3、17-二酮(比活性23.5 Ci/mmol)、0.5 ml磷酸盐缓冲液(pH=7.4)和1.2 mmol/L还原型辅酶Ⅱ混合。将反应混合物在37℃恒温水浴中振荡30 min。用1 ml的20%三氯乙酸终止反应,12000×g离心10min。将上清液与4.0ml氯仿混合,涡旋混合3min,600×g离心10min。取水相500 ml与0.5 ml的5%木炭悬浮液混合,孵育30 min后,12000×g离心15min,液体闪烁计数器计数上清液。
1.3.2类固醇检测测定母血和脐带血血清中的孕酮、DHEAS、DHEA、雄烯二酮、睾酮、雌酮、雌二醇和雌三醇。所有检测在同一批次的PCOS组和对照组间进行。孕酮和雌三醇总量用酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)测定。DHEAS、DHEA、雄烯二酮、睾酮、雌酮和雌二醇由放射免疫法测定。检测敏感性分别为0.3ng/ml、2.0ng/ml、1.0mg/dl、0.1 ng/ml、0.1 ng/ml、0.1 ng/ml、5.0 pg/ml和8.0 pg/ml,批内和批间变异系数分别为孕酮4.0%和7.0%、雌三醇4.8%和8.8%、脱氢表雄酮5.1%和11.0%、脱氢表雄酮3.8%和8.6%、雄烯二酮5.0%和5.0%、睾酮4.2% 和5.2%、雌酮4.3%和6.0%以及雌二醇4.0%和4.2%。
1.4统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)或中位数(四分位间距)表示,正态分布用Kolmogorov-Smirnov检验评估。分类数据用χ2或Fisher精确检验进行分析,当数据呈正态分布时组间比较用t检验或用Mann-Whitney检验,P<0.05为差异有统计学意义。
2 结果
2.1临床特征
两组孕妇间年龄、初始体重、初始体重指数和身高等参数比较,差异无统计学意义。但是PCOS孕妇在妊娠末期体重较对照组孕妇更重(P=0.020),怀孕期间体重增加组间比较差异无统计学意义。3例PCOS孕妇合并妊娠糖尿病。剖腹产率组间比较差异无统计学意义(对照组:60.0%,PCOS组:70%)。对照组47%和PCOS组60%为初产妇。见表1。
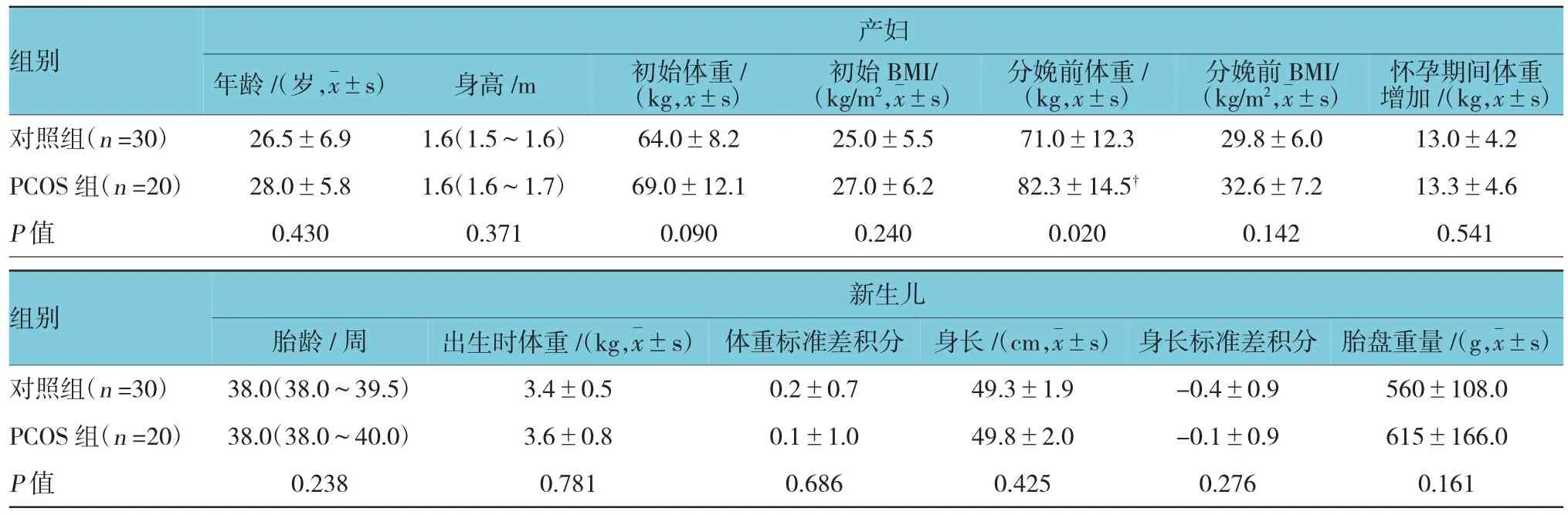
表1 两组产妇和新生儿一般特征
两组新生儿在胎龄、体重、身长、体重标准差积分(weight standard deviation scores,SDS)和身长标准差积分比较,差异无统计学意义。此外,两组胎盘重量、女胎比例比较,差异无统计学意义(60%和50%,P=0.112)。
2.2酶活性
对照组和PCOS组胎盘组织3个位置的STS活性比较,差异无统计学意义。PCOS组孕妇在S1、S2 和S3处表现出较高的3β-HSD-1活性[S1:(40.0± 4.3)vs(56.0±4.4)u/(min·mg蛋白),P=0.014;S2:(63.0±5.2)vs(83.0±6.8)u/(min·mg蛋白),P=0.020;S3:(42.0±6.4)vs(63.0±6.2)u/(min·mg蛋白),P= 0.049]。此外,PCOS组在S2处的3β-HSD-1活性高于S1和S3处(P=0.002和0.030)。另一方面,PCOS组胎盘组织3个位置的P450芳香酶活性较对照组低[S1:(1.25±0.12)vs(0.92±0.06)pmol/(min·mg蛋白),P=0.036;S2:(1.18±0.09)vs(0.88±0.08)pmol/(min·mg蛋白),P=0.042;S3:(1.35±0.14)vs(0.81± 0.21)pmol/(min·mg蛋白),P=0.025]。胎盘组织3个位置P450芳香酶活性,无论是对照组还是PCOS组内比较,差异无统计学意义。见附图和表2。
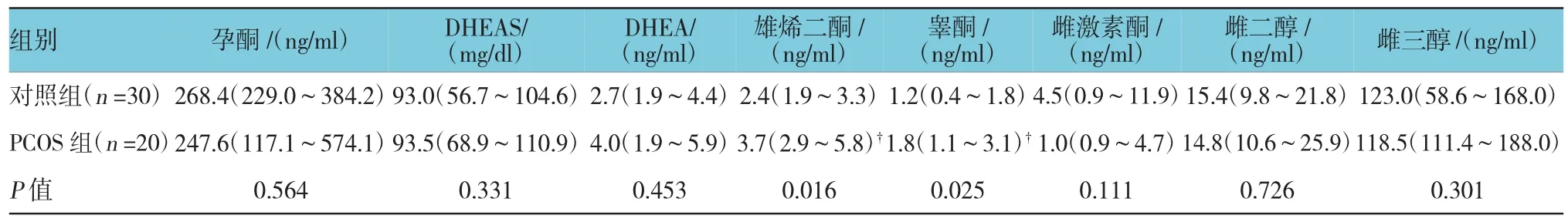
表2 PCOS组和对照组孕妇孕34周时血清性激素含量比较
2.3类固醇浓度
PCOS组孕妇孕34周时血清中雄烯二酮和睾酮浓度明显高于对照组(见表2)。PCOS组新生儿脐带血中雄烯二酮低于对照组新生儿,而雌三醇浓度高于对照组。此外,PCOS组新生儿脐带血雌激素酮浓度通常低于对照组新生儿(P=0.061)。男性新生儿中,PCOS组雄烯二酮水平有较对照组低的倾向,但差异无统计学意义(P=0.054)(见表3)。
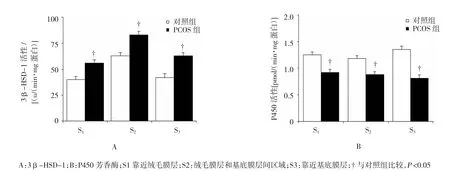
附图 对照组和PCOS组胎盘组织不同部位3β-HSD-1和P450芳香酶活性比较
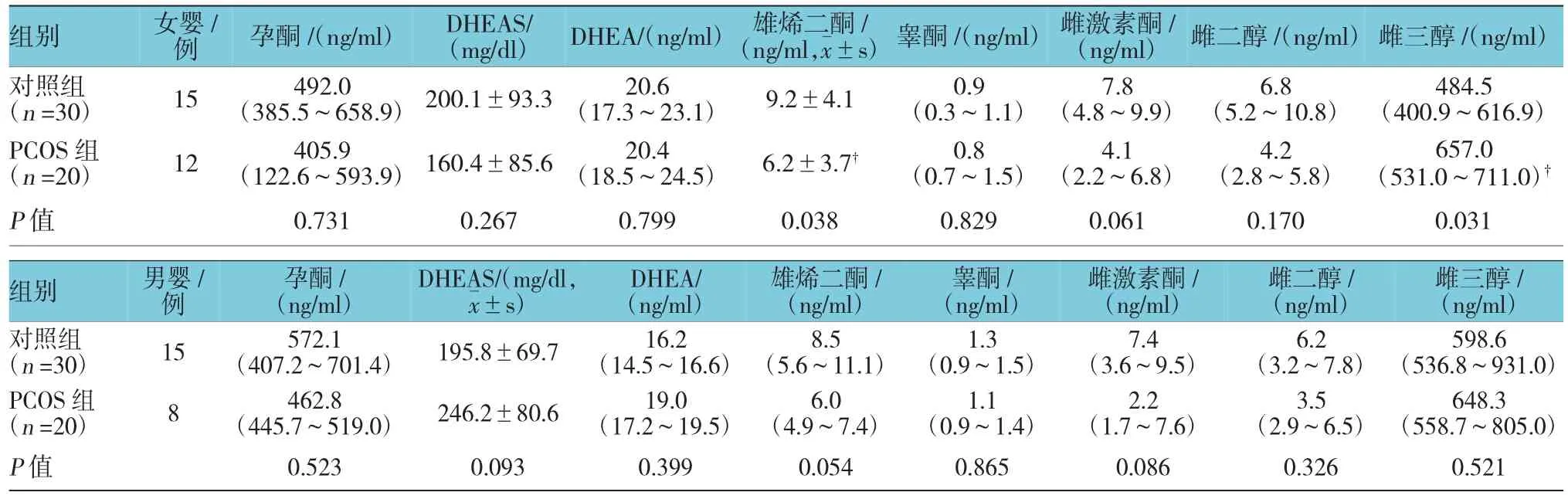
表3 PCOS组和对照组新生儿脐带血性激素含量比较
3 讨论
本研究提高对多囊卵巢综合征妇女怀孕的认识,并为胎盘类固醇能够改变PCOS女性妊娠期间内分泌水平的观点提供新的实验依据。
本研究发现,PCOS患者孕34周时血清雄激素浓度升高,与以往研究结果一致[3-4]。由于3β-HSD-1能够催化5-3β-羟基类向4-3-17-酮甾类转化[7],胎盘组织里3β-HSD-1活性增加可能导致PCOS患者合成更多的雄性激素,雄性激素经芳香化酶P450迅速芳香化,产生雌激素,因此笔者推测,胎盘组织里P450活性降低可引起雄激素底物积累,本研究中母体血液雄激素含量偏高可能是由于胎盘类固醇异常引起。
目前,关于胎盘组织里3β-HSD-1和P450芳香化酶活性调控机制的研究较少。通常PCOS妇女早期到晚期妊娠阶段胰岛素抵抗程度和胰岛素水平较高,而胰岛素和胰岛素样生长因子能够抑制人类滋养细胞中P450芳香化酶活性,并激活3β-HSD-1[8]。妊娠糖尿病和先兆子痫等情况下,孕妇胰岛素抵抗加剧,并伴有高胰岛素血症,将引起胎盘芳香化酶活性降低。因此,PCOS女性妊娠期间代谢异常是胎盘3β-HSD-1和P450芳香化酶活性变化的可能原因。
PCOS女性胎盘组织中3β-HSD-1和芳香化酶P450活性对胎儿的影响呈不确定性,胎盘中芳香酶将雄激素转化为雌激素的能力较强,以至于<1%的酶活性都能通过母体雄激素增加防止胎儿男性化[9]。尽管本研究未在女婴中观察到男性化迹象,但是,不能排除PCOS患者胎盘酶活性异常可对卵巢或代谢功能产生影响,因为PCOS女性分娩的女儿幼年时有卵泡质量和胰岛素抵抗变化。Barry等[10]发现,多囊卵巢综合征孕妇的女性新生儿脐静脉内睾酮浓度较高,提示雄激素可能部分来自胎盘。本研究未发现PCOS组和对照组胎儿睾酮浓度差异,可能是因为本研究检测标本是混合脐带血。Anderson等[11]发现PCOS患者的女性新生儿混合脐血内雄烯二酮和血清雌二醇浓度较低,而本研究也发现女性多囊卵巢综合征孕妇的新生儿脐血内雄烯二酮减少,雌三醇水平增加。雌三醇是16a-OH-雄烯二酮芳香化的产物,而胎盘中雄激素16α-羟基化可能的主要部位是肝脏,并与CYP3A7酶活性有关[12]。PCOS组新生儿脐带血雌三醇含量增加可能有2个原因:①与新生儿肾上腺产生的DHEAS 16α-羟基化增加有关;②胎盘合成的雄烯二酮在胎儿体内被肝脏或肾上腺代谢为16α-OH-雄烯二酮,随后由胎盘组织芳香化为雌三醇。雌三醇是胎儿肾上腺活性和胎儿健康的有效标志物。孕中期母体血清雌三醇含量低与唐氏综合征、18三体综合征、类固醇硫酸酯酶缺乏征等代谢性疾病和胎儿死亡有关[13-15]。目前,尚未发现脐带血中雌三醇含量升高与不良妊娠结局有关。
总之,本研究表明,PCOS女性胎盘组织能够促进雄激素产生,而大部分雄激素又能被母体血液循环清除。PCOS组女性新生儿脐血雄烯二酮水平下降,雌三醇水平提高,提示PCOS组胎儿类固醇代谢发生改变。
参考文献:
[1]王颖,侯丽辉,孟小钰,等.多囊卵巢综合征卵巢多囊形态的诊断及进展[J].医学研究杂志, 2014, 43(8): 178-180.
[2]卢永军,阮祥燕,田玄玄,等.多囊卵巢综合征综合治疗对妊娠结局的影响[J].首都医科大学学报, 2014, 35(4): 428-432.
[3]刘萍,刘洋,李彩萍.多囊卵巢综合征患者子宫内膜性激素受体表达与早期流产的关系[J].当代医学, 2013, 19(14): 29-30.
[4] Falbo A, Rocca M, Russo T, et al.Changes in androgens and insulin sensitivity indexes throughout pregnancy in women with polycystic ovary syndrome (PCOS): relationships with adverse outcomes[J].J Ovarian Res, 2010, 3(9): 23-29.
[5]崔毓桂,邵丽,千日成,等.雄激素与女性生殖[J].国际生殖健康/计划生育杂志, 2014, 33(5): 329-333.
[6]张颖,金亦,杨建波,等.基于新诊断标准妊娠期糖尿病妊娠结局分析[J].中国实用妇科与产科杂志, 2012, 28(11): 848-850.
[7]汤彪,黄引平,姚锋祥,等.重度子痫前期孕妇脂氧素A4及11β羟基类固醇脱氢酶2的表达及意义[J].现代妇产科进展, 2012, 21(10): 785-788.
[8] Sir-Petermann T, Echiburu' B, Maliqueo M, et al.Serum adiponectin and lipid concentrations in pregnant women with polycystic ovary syndrome[J].Human Reproduction, 2007, 22(9): 1830-1836.
[9] Meek CL, Bravis V, Don A, et al.Polycystic ovary syndrome and the differential diagnosis of hyperandrogenism[J].The Obstetrician and Gynaecologist, 2013, 15(3): 171-176.
[10] Barry JA, Kay AR, Navaratnarajah R, et al.Umbilical vein testosterone in female infants born to mothers with polycystic ovary syndrome is elevated to male levels[J].Journal of Obstetrics and Gynaecology, 2010, 30(6): 444-446.
[11] Anderson H, Fogel N, Grebe SK, et al.Infants of women with polycystic ovary syndrome have lower cord blood androstenedione and estradiol levels[J].Journal of Clinical Endocrinology and Metabolism, 2010, 95(11): 2180-2186.
[12] Ince I, Knibbe CA, Danhof M, et al.Developmental changes in the expression and function of cytochrome P450 3A isoforms: evidence from in vitro and in vivo investigations [J].Clinical Pharmacokinetics, 2013, 52(5): 333-345.
[13] Craig WY, Palomaki G, Roberson M, et al.Further insights into implications of undetectable or very low unconjugated estriol in maternal serum during the second trimester[J].Prenatal Diagnosis, 2011, 31(8): 616-618.
[14]张金珍,谢丹萍,蒋素莹,等.妊娠中期检测母体血清三联标志物筛查胎儿发育异常的临床应用[J].中外医学研究, 2014, 12(3): 71-72.
[15]卢秀敏,张蕊,刘羽,等.黑龙江地区15549例孕中期母体血清产前筛查及结果分析[J].哈尔滨医科大学学报,2014,48(5):413-415.
(申海菊编辑)
Placental steroidogenesis in pregnant women with polycystic ovary syndrome
Jiang-hong Guo
(Department of Gynaecology and Obstetrics, the First Affiliated Hospital, University of South China, Hengyang, Hunan 421001, China)
Abstract:Objective To evaluate the activity of steroid sulfatase (STS), 3β-hydroxysteroid dehydrogenase type 1 (3β-HSD-1) and P450 aromatase (P450arom) in placenta of pregnant women with polycystic ovarian syndrome (PCOS).Methods Twenty pregnant women with PCOS and 30 control pregnant women who delivered at term were studied.Samples of placental tissue and cord blood were obtained after delivery.A maternal blood sample was obtained during the 34th week of gestation.In placental tissue, the activity of STS, 3β-HSD-1 and P450arom was evaluated.The content of progesterone, dehydroepiandrosterone sulfate (DHEAS), dehydroepiandrosterone(DHEA), androstenedione, testosterone, estrone, estradiol and total estriol was determined in the blood samples.Results In placental tissue from women with PCOS, higher 3β-HSD-1 and lower P450 aromatase activity was observed compared to the control women.Moreover, women with PCOS showed higher androstenedione and testosterone concentrations compared to normal pregnant women (P = 0.016 and 0.025, respectively).In cord blood, the female newborns of the women with PCOS exhibited lower androstenedione and higher estriol concentrations compared to the daughters of the control women (P= 0.038 and 0.031).Conclusions Placental tissue from women with PCOS shows changes in the activity of two important enzymes for steroid synthesis, i.e.higher 3β-HSD-1 and lower P450, which could increase androgen production during pregnancy.
Keywords:polycystic ovary syndrome; placenta; 3β-hydroxysteroid dehydrogenase; P450 aromatase
收稿日期:2015-09-25
文章编号:1005-8982(2016)01-0094-05
中图分类号:R711.75
文献标识码:B
