硬皮病动物模型建模药物最适浓度探讨*
2016-03-26陆晓凤罗婧莹桂林医学院附属医院皮肤科广西桂林541000
陆晓凤,罗婧莹(桂林医学院附属医院皮肤科,广西桂林541000)
硬皮病动物模型建模药物最适浓度探讨*
陆晓凤,罗婧莹
(桂林医学院附属医院皮肤科,广西桂林541000)
摘要:目的探讨用博来霉素(BLM)制作硬皮病动物模型的最适浓度。方法将24只BALB/C小鼠随机平均分为3个实验组和1个对照组,各实验组小鼠分别皮下注射200、700和1 000μg/ml浓度的BLM,对照组小鼠皮下注射等量的磷酸盐缓冲液(PBS),注射4周后处死小鼠,取注射部位皮肤行苏木精-伊红染色法(HE)染色、Masson染色、真皮羟脯氨酸含量检测及真皮厚度检测。结果700和1 000μg/ml浓度的BLM成功建模,但1 000μg/ml的浓度可导致小鼠皮肤浅表溃疡。结论硬皮病动物模型成功与否与BLM药物浓度高低关系密切,700μg/ml博莱霉素浓度具有较好的建模效果,且不会出现皮肤溃疡的副作用。
关键词:硬皮病;博来霉素;动物模型;最适浓度
硬皮病(Scleroderma)是以局限性或弥漫性皮肤及内脏结缔组织纤维化、硬化及萎缩为特点的结缔组织疾病,疾病发展到晚期病情常较重,危及患者生命[1]。目前硬皮病发病机制仍不清楚,围绕其展开相关研究显得尤为重要。由于直接以硬皮病患者为研究对象有较多的局限性,所以建立稳定的硬皮病动物模型是硬皮病基础研究的前提条件。目前国内外常以博来霉素(Bleomycin,BLM)皮下注射的方法建模,但关于建模的最适浓度尚无统一认识[2-4]。本实验采用不同浓度的博来霉素皮下注射于小鼠背部,4周后切取小鼠注射部位皮肤进行相关指标检测,探讨最适宜硬皮病建模的博来霉素浓度。
1 材料与方法
1.1实验动物
24只BALB/c小鼠,购于桂林医学院动物实验中心,SPF清洁级,为6周龄雌性小鼠,体重18~22g,饲养于桂林医学院动物实验中心SPF清洁级动物饲养室。
1.2主要试剂、仪器及耗材
博莱霉素购自北京索来宝生物科技有限公司,生产批号415A027,磷酸盐缓冲溶液(phosphate buffer saline,PBS)、Masson染色全套试剂来自于桂林医学院附属医院病理科,羟脯氨酸试剂盒购自南京建成公司,生产批号20151205,紫外分光光度计。
1.3实验方法
1.3.1实验分组将24只BALB/c小鼠随机分为4组,分别标记为A、B、C、D组,每组6只。用小动物剃毛器剃去小鼠背部皮肤,范围为≥3 cm×3 cm的圆形区域。博来霉素用PBS稀释,分别配制成200、700和1 000μg/ml浓度。A组小鼠为对照组,皮下注射PBS 100μl/d;B组小鼠皮下注射200μg/ml博来霉素100μl/d;C组小鼠皮下注射700μg/ml博来霉素100μl/d;D组小鼠皮下注射1 000μg/ml博来霉素100μl/d。每只小鼠皮下注射时,分别以12、3、6和9点钟方向进针,实行多点注射,注射器针头与小鼠皮肤表面角呈10度,每点注射25μl,1次/d,连续注射4周。
1.3.2实验方法完成4周注射后的次日,颈椎脱臼法处死小鼠,取小鼠注射部位皮肤2块。其中一块用福尔马林溶液浸泡,石蜡包埋,行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色、Masson染色,并测真皮厚度;另一块置于-80℃冰箱冷冻存于管中,用于测量皮肤中羟脯氨酸的含量。
1.4统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1肉眼观察各小鼠注射部位皮肤的变化
连续注射博来霉素4周后,肉眼可以观察到,A组小鼠注射部位皮肤呈粉红色,触感柔软,弹性好,无异常隆起、凹陷,无溃疡,无出血点;B组小鼠注射部位皮肤肉眼观及触感与A组小鼠无明显差异;C组小鼠注射部位皮肤明显增厚,硬化,弹性差,粗糙,无溃疡,无出血点;D组小鼠注射部位皮肤不仅有增厚、硬化、变粗糙、弹性差等表现,还出现明显的浅表溃疡。见图1。

图1 小鼠皮肤肉眼观
2.2注射部位皮肤组织HE染色
连续注射博来霉素4周后,取注射部位的皮肤行HE染色,镜下可见A组小鼠注射部位皮肤表皮层、真皮层、脂肪层、肌肉层与正常小鼠皮肤病理组织结构相同,未发生变化;B组小鼠真皮层略增厚,胶原纤维稍变粗,脂肪层未见明显变化;C、D组小鼠注射部位皮肤真皮层明显增厚,胶原纤维明显增多、增粗,排列变紧密,且皮下脂肪层明显变薄,甚至消失。见图2。
Masson染色是用于显示组织中纤维的染色方法之一,可使胶原纤维被亮绿染成绿色,使肌纤维被丽春红染成红色。取小鼠注射部位皮肤行Masson染色,可见C、D组小鼠皮肤真皮层中,被染成绿色的胶原纤维明显增多(见图3)。将该组织切片拍成图片,用免疫组织化学法定量分析系统进行分析。每只小鼠切片随机取5个视野采集图像,以亮绿色为阳性,计算阳性率,再用SPSS 18.0统计软件分别算出D各组阳性率的均数±标准差(±s),然后将A组分别与B、C、D 3组作独立样本t检验,计算t值、P值。结果显示,C、D组Masson染色阳性率高于A组,差异有统计学意义(P<0.05)。见表1。

图2 小鼠皮肤HE染色(HE×20)
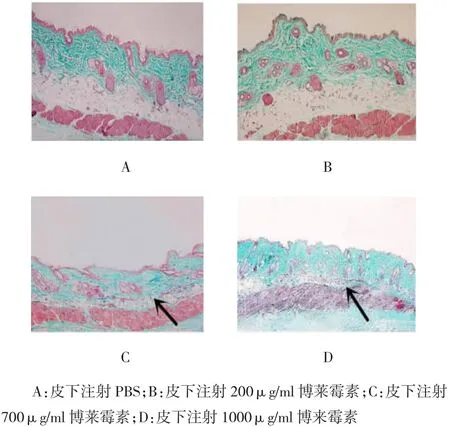
图3 小鼠皮肤Masson染色(Masson×20)
2.3注射部位皮肤的真皮厚度
连续注射博来霉素4周后,肉眼可见注射部位皮肤厚度发生不同变化,采用彩色病理图像分析系统对小鼠真皮的厚度进行测量,所得数据并用SPSS 18.0统计软件算出各组的均值±标准差(±s)。将A组分别与B、C、D组进行独立样本t检验,可见C、D组小鼠皮肤增厚,真皮层厚度明显增加。见表2。
2.4注射部位皮肤的胶原含量
羟脯氨酸在胶原蛋白中占13.4%,在弹性蛋白中含量极少,其他蛋白中不含羟脯氨酸,因此小鼠皮肤中羟脯氨酸的含量可以间接地反映所测部位胶原蛋白的含量,进而推断该部位纤维化的程度。按羟脯氨酸试剂盒说明书进行操作,测量并计算出各组小鼠注射部位皮肤羟脯氨酸的含量,并且重复上述步骤3次,记录3次所测数值,所得数据用均数±标准差(±s)表示,并分别将A组与B、C、D 3组进行比较,用SPSS 18.0统计软件进行独立样本t检验,结果显示,C、D组小鼠注射部位皮肤的羟脯氨酸含量明显增加。见表3。
博来霉素浓度过低,建模效果不好,而浓度过高,虽然可以使小鼠注射部位皮肤出现典型硬皮病样改变,但同时也会导致小鼠皮肤出现溃疡,不利于后续研究。
表1 各组小鼠注射部位皮肤Masson染色阳性率(%±s)

表1 各组小鼠注射部位皮肤Masson染色阳性率(%±s)
注:1)与A组比较,t=1.295,P=0.224;2)与A组比较t=31.339,P=0.000
组别 例数 阳性率A组 6 29.4±1.3 B组 6 30.3±1.01)C组 6 68.3±2.82)D组 6 81.6±2.42)
表2 各组小鼠注射部位真皮厚度比较(μm,±s)
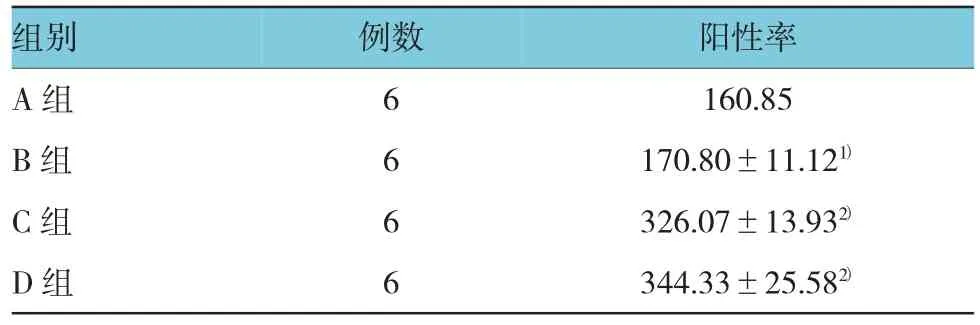
表2 各组小鼠注射部位真皮厚度比较(μm,±s)
注:1)与A组比较,t=1.963,P=0.780;2)与A组比较,P=0.000 (tC=27.030,tD=17.174)
组别 例数 阳性率A组 6 160.85 B组 6 170.80±11.121)C组 6 326.07±13.932)D组 6 344.33±25.582)
表3 各组小鼠注射部位羟脯氨酸含量比较(μg/mg,±s)

表3 各组小鼠注射部位羟脯氨酸含量比较(μg/mg,±s)
注:1)与A组比较,t =0.941,P=0.385;2)与A组比较,P=0.000 (tC=10.544,tD=18.157)
组别 例数 羟脯氨酸含量A组 6 4.17±0.47 B组 6 4.36±0.131)C组 6 7.90±0.732)D组 6 7.95±0.192)
3 讨论
硬皮病是皮肤科相关疾病中,临床处理较为棘手的一种常见病,由于其病因和发病机制不明确,所以尚无有效的治疗措施,针对其展开研究显得尤为重要。良好的动物模型是研究硬皮病的基础,关于硬皮病动物模型的建造,前人做过很多研究,包括用UCD鸡[5]或者紧皮鼠等[6],但由于建模成本较高、动物来源困难等多方面原因,未被推广运用。后来,Toshiyuki等[7]发现,博来霉素诱导的硬皮病小鼠模型与临床硬皮病患者的组织病理改变极为相似。但关于建模浓度的问题,文献报道尚未达成共识,这给后来研究硬皮病,且以该方法建立动物模型的研究人员造成很大的困惑。本实验研究显示,200μg/ml博来霉素建立的动物模型无典型硬皮病样改变;700μg/ml博来霉素建立的硬皮病动物模型,肉眼见小鼠皮肤明显变硬,HE染色可见真皮层胶原纤维明显增多,真皮层明显增厚,皮肤羟脯氨酸含量明显增加,脂肪层变薄,甚至消失,与Juniantito[8]、Avouac 等[9]提到的硬皮病动物模型的组织病理变化相符。虽然1 000μg/ml博来霉素也能造出该模型,但小鼠浅表皮肤出现溃疡,且溃疡逐日加重,显然不利于以硬皮病小鼠为载体的后续研究。查阅国内文献发现,第四军医大学杨蓉娅教授、北京协和医院王千秋教授、上海交通大学郑捷教授等分别给予BALB/c小鼠300、500和600μg/ml BLM皮下注射,连续注射28d,成功建立硬皮病动物模型[10-12]。本研究分析发现3者的建模浓度为200~1 000μg/ml,与本研究结果不谋而合。同时提示,硬皮病动物模型的最适造模浓度并非单一浓度,而是一个适宜的浓度范围,通过上述实验,笔者可初步确定该范围在200~1 000μg/ml,后续笔者将补充实验,继续精确、缩小该范围。
参考文献:
[1] Young A, Khanna D.Systemic sclerosis: a systematic review on therapeutic management from2011 to 2014 [J].Curr Opin Rheumatol, 2015, 27(3): 241-248.
[2] Koca SS, Ozgen M, Sarikava M, et al.Ghrelin prevents the development of dermal fibrosis in bleomycin-induced scleroderma[J].Clin Exp Dermatal, 2014, 39(2): 176-181.
[3] Maurer B, Distler A, Suliman YA, et al.Vascular endothelial growth factor aggravates fibrosis and vasculopathy in experimental models of systemic sclerosis[J].Ann Rheum Dis, 2014, 73(10): 1880-1887.
[4] Demir T, Turkbeyler I, Kaplan DS, et al.Effectiveness of palosuran in bleomycin-induced experimental scleroderma[J].Inflammation, 2013, 36(1): 75-79.
[5] Ek WE, Sahlqvist AS, Croo KS, et al.Mapping QLT affecting a systemic sclerosis-like disorder in a cross between UCD-200 and red jungle foul chicken [J].Dev Comp Immunol, 2012, 38 (2): 352-359.
[6] Gerber EE, Gallo EM, Fontana SC, et al.Integrin-modulating therapy prevents fibrosis and autoimmunity in mouse models of scleroderma[J].Nature, 2013, 503(7474): 126-130.
[7] Toshiyuki Y, Kiyoshi N.Animal model of sclerotic skin.V: increased expression of alpha-smooth muscle actin in fibroblastic cells in bleomycin-induced scleroderma[J].Clin Immunol, 2002, 102(1): 77-83.
[8] Juniantito V, Izawa T, Yuasa T, et al.Immunophenotypical characterization of macrophages in rat bleomycin-induced scleroderma[J].Vet Pathol, 2013, 50(1): 76-85.
[9] Avouac J, Furnrohr BG, Tomcik M, et al.Inactivation of the transcription factor STAT-4 prevents inflammation-driven fibrosis in animal models of systemic sclerosis[J].Arthritis Rheum, 2011, 63(3): 800-809.
[10]李海涛,杨蓉娅,朱晓丹,等.UVA1对硬皮病小鼠模型影响的实验观察[J].中国麻风皮肤病学杂志, 2008, 24(1): 20-22.
[11]刘彤云,王千秋,崔盘根,等.MMP-9和TMP-1在硬皮病模型鼠皮肤硬化过程中的作用[J].中国麻风皮肤病学杂志, 2008, 24(7): 508-510.
[12]曹华,郑捷.局部注射博来霉素建立硬皮病小鼠模型的实验研究[J].中国皮肤性病学杂志, 2007, 21(8): 469-473.
(申海菊编辑)
Optimal drug concentration for scleroderma mouse model*
Xiao-feng Lu, Jing-ying Luo
(Department of Dermatology, the Affiliated Hospital of Guilin Medical University, Guilin, Guangxi 541000, China)
Abstract:Objective To analyze the optimal concentration of Bleomycin for scleroderma mouse model.Methods Twenty-four BALB/c mice were divided into 4 groups including 3 experimental groups and 1 control group.The mice of the experimental groups were injected with 200, 700 and 1,000 μg/ml Bleomycin respectively and those in the control group were injected with PBS.The staining for HE and Masson, and detection for dermis hydroxyproline content and dermis thickness were executed after the extraction of injective-site skin about 4 weeks later.Results Scleroderma mouse model was successfully established at the 700 and 1,000 μg/ml concentration of Bleomycin, but the skin ulcer of injective site occured in the experimental group of 1,000 μg/ml concentration.Conclusions There is a close relationship between establishment of scleroderma mouse model and drug concentration.The 700 μg/ml concentration of Bleomeycin has a good molding effect, which does not have the side effect like skin ulcer.
Keywords:scleroderma; Bleomycin; animal model; optimal concentration
通信作者]罗婧莹,E-mail:luojingying2005@aliyun.com;Tel:0773-2823796
*基金项目:国家自然科学基金(No:81460473);广西自然科学基金(No:2012NSFAA053133)[
收稿日期:2015-08-12
文章编号:1005-8982(2016)01-0001-04
中图分类号:R593.25
文献标识码:A
