长牡蛎中国群体和日本群体杂交子代的杂种优势分析❋
2016-03-24孔令锋于瑞海
余 勇, 李 琪, 于 红, 孔令锋, 于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
长牡蛎中国群体和日本群体杂交子代的杂种优势分析❋
余勇, 李琪❋❋, 于红, 孔令锋, 于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
摘要:为研究长牡蛎不同种群杂交的杂种优势,本研究选择长牡蛎中国群体(C)连续选育5代和日本群体(J)连续选育6代的个体作为亲本,进行完全双列杂交,比较分析了幼虫期、稚贝期和养成期3个阶段各实验组的生长与存活情况。研究表明:在幼虫期,杂交组的生长与存活性状表现出微弱的杂种优势,自交组JJ(J♀×J♂)和反交组JC(J♀×C♂)生长优势明显,而自交组CC(C♀×C♂)和正交组CJ(C♀×J♂)存活率较高,表明幼虫期存在显著的母性效应,正交组CJ存活率最高,杂种优势率为4.67%~40.30%。在稚贝期及养成期,杂交组各生长性状(壳高、壳长、壳宽和总重)表现出显著的杂种优势,总重的杂种优势率最高,为13.61%~21.71%,其中正交组CJ各生长性状的杂种优势率均表现为正值。从整个生长阶段来看,正交组CJ在幼虫期存活率最高,在稚贝期和养成期各生长性状均具有杂种优势,表明正交组CJ是最适的杂交组合,具有很大的生产潜力。
关键词:长牡蛎; 双列杂交; 杂种优势
YU Yong, LI Qi, YU Hong, et al. Heterosis of hybrid between Chinese and Japanese populations of the Pacific Oyster (Crassostreagigas)[J].Periodical of Ocean University of China, 2016,46(2): 35-41.
长牡蛎(Crassostreagigas)俗称太平洋牡蛎,自然分布于东亚海区,具有生长速度快、产量高、适应环境能力强等特点,自1840年代长牡蛎被引进到许多国家进行养殖,是世界上重要的经济贝类[1]。中国是长牡蛎养殖大国,牡蛎养殖在中国海水养殖业中占有十分重要的地位,2012年中国牡蛎养殖产量395万t,占世界牡蛎产量80%、全国贝类产量32.7%、全国海水养殖产量24%,主要养殖产区为山东、江苏、辽宁等沿海地区[2]。随着牡蛎养殖产业的快速发展,长牡蛎的产量得以大幅度提高,但却出现人工育苗困难、死亡率升高、个体小、形态不规则等种质衰退的现象,因此培育产量高、品质好的长牡蛎优良品种成为养殖业的可持续发展的重要因素。
杂种优势是指两个遗传背景不同的亲本杂交产生的杂种F1在生长、存活、抗逆性等方面比亲本的一方或双亲优越的现象[3]。因杂种优势的存在,杂交育种成为动植物遗传改良的重要手段,该技术广泛应用于包括水产动物在内的动植物种质改良中[4-6]。目前,水产动物中,贝类亚种间、不同地理群体间及家系间杂交研究比较多:汪德耀等[7]对厦门的密鳞牡蛎(OstreadenselamellosaLischke)、僧帽牡蛎(OstreacucullataBorn)和福建南部的野生长牡蛎种间杂交,发现杂交苗具有一定的生长优势;胡志国等[8]研究中国南方九孔鲍(Haliotisdiversicolorsupertexta)2个不同地理群体的杂交子代的生长优势,结果表明增加野生群体在交配亲本中的数量可有效提高九孔鲍生长性能;国外学者Hedgecock等[9-10]建立长牡蛎不同近交系,利用不同近交系间的杂交探讨了基因的上位性在杂种优势形成中重要作用。
孔令锋等[11]研究了中国和日本长牡蛎第1代选育群体间杂交后代的生长和存活情况,发现杂交后代壳高、壳长和存活率的杂种优势均较为明显。理论上,随着群体选育代数增加,不同群体间的基因频率差异越大,这样的种群杂交后代可能产生更大的杂种优势[12]。本文为了探索种内不同地理群体长牡蛎经过连续选育后,选育群体间的杂交子代在生长以及存活性状上能否保持稳定的杂种优势,利用中国长牡蛎第5代选育群体和日本长牡蛎第6代选育群体的一龄贝作为亲本进行完全双列杂交,比较各实验组幼体和成体阶段生长与存活情况,分析杂种优势,筛选最优杂交组合,旨在为杂交育种提供理论和实践依据。
1材料与方法
1.1 材料
长牡蛎中国群体和日本群体分别为2012年建立的中国乳山选育群体F5代和日本宫城选育群体F6代,实验于2013年6月在山东省莱州市海益苗业有限公司苗种培育基地进行,亲本均为一龄贝。
1.2 实验设计
利用长牡蛎中国群体与日本群体进行4个组合的杂交与自交试验。杂交实验组:长牡蛎中国群体♀×长牡蛎日本群体♂(C♀×J♂,CJ),长牡蛎日本群体♀×长牡蛎中国群体♂(J♀×C♂,JC);自交实验组:长牡蛎中国群体♀×长牡蛎中国群体♂(C♀×C♂,CC),长牡蛎日本群体♀×长牡蛎日本群体♂(J♀×J♂,JJ)。
1.3 苗种培育与养成
1.3.1 人工授精与孵化采用解剖法,从2个群体中分别挑选出性腺发育良好的雌、雄个体各10个作为亲本。将各群体的10个雌性亲本的卵子均匀混合,用24℃的海水促熟约30min,之后将10个雄性个体的精子充分混匀,按照实验设计进行人工授精。受精卵在100L的聚乙烯桶中孵化,稳定地充气以提供充足的氧气,水温控制在23~24℃,孵化密度为30~50个/mL。实验中所需的器材均进行彻底消毒与清洗,防止污染。
1.3.2 幼虫培育受精卵经过大约22h的孵化后发育到D形幼虫,用300目筛绢选优。幼虫培育参照于瑞海等[13]的方法进行饵料的投喂、逐级筛选培养、密度控制以及附着基的投放。幼虫培育阶段,水温控制在24℃左右,持续充气。每天早、晚各换水1次,换水量为1/3~1/2,每周清底1次。每天观察幼虫摄食情况及水中残饵量并调整饵料投喂量。各实验组投饵、换水、充气等操作一致,所用实验器材每次使用后在淡水中浸泡5min并清洗干净,以防各组之间出现污染。
1.3.3 稚贝培育及养成21d后,各实验组幼虫开始出现眼点,当30%左右的幼虫出现眼点时,开始投放扇贝附着基。足量的幼虫附着好后,先在沉淀池暂养一段时间,为适应自然水区环境提供缓冲时间,同时避过自然海区野生牡蛎产卵期,防止污染。时机合适时,在威海市刘公岛海区进行笼式浮筏悬挂养殖。各组密度保持一致,并处于同一水深,11月后转移至乳山海区养殖。养成期间,每月定期清理笼子上的附着物,并观察生长情况,调整养殖密度。
1.4 数据测量
幼虫期存活率=测量当天幼虫密度/第1天幼虫密度×100%。
幼虫期,在受精后1、5、9、13、17天取样,每组30个个体,用卢戈氏液固定。在100×的显微镜下,用目微尺测量样本的壳高和壳长。取样当天测量各组密度,并且调整至同一密度水平。稚贝和养成期,在受精后90、150、210、270天,每组取样30个,用游标卡尺(精度0.02mm)测量壳高、壳长和壳宽,并用电子天平秤(精度0.1g)称量体重。
1.5 数据分析
计算杂交子代各性状的杂种优势率(Heterosis,H),公式为:
H=(F1-P)/P×100%。
式中:F1为杂交子代性状的平均值;P为两自交组子代性状的平均值[14]。
2结果与分析
2.1 幼虫期生长及存活率的比较分析
本研究4个实验组幼虫期的生长及存活情况见表1。对于壳高性状,自交组CC和JJ间大多存在显著差异(P<0.05),杂交组间(CJ和JC)差异不显著(P>0.05)。具有相同母本的实验组间(CC和CJ,JC和JJ)无显著差异(P>0.05),相同父本的实验组间(CC和JC,CJ和JJ)则差异显著(P<0.05)。对于壳长性状,JC和JJ在不同的生长阶段(5日龄除外)差异不显著(P>0.05),而9日龄后,JC和JJ的生长明显快于CC和CJ。总体而言,4个实验组在幼虫期壳高和壳长具有相同的生长趋势,即JJ>JC>CJ>CC。在存活率方面,CC、CJ和JC 3组之间无显著差异(P>0.05),CJ组存活率最高,而JJ组存活率最低,总体趋势:CJ>CC>JC>JJ。
壳高性状、壳长性状、存活率性状的变异系数分别为0.04~0.18、0.02~0.19和0.06~0.27。其中存活率的变异系数最大,说明此性状有较大的改良潜力;壳高及壳长的变异系数变化不大,说明这些性状的遗传性能比较稳定。
2.2 幼虫期生长和存活性状杂种优势率
幼虫阶段,杂交子代生长及存活性状的杂种优势率见表2。杂交组的壳高和壳长在9~17日龄时具有生长优势,杂种优势率分别为1.03%~3.52%和1.21%~3.86%;而杂交组的存活率在整个幼虫阶段都表现出优势,杂种优势率为0.80%~14.77%。相对于自交组,CJ组存活率具有显著优势,杂种优势率为4.67%~40.30%;而JC组壳高、壳长分别在5和9日龄后具有明显的杂种优势率,分别为1.61%~6.14%和1.98%~8.74%。
2.3 稚贝期和养成期生长性状的比较分析
稚贝及养成期,4个实验组的壳高、壳长、壳宽及总重性状的观测值见表3。对于壳高和壳长性状,90日龄时,4个实验组表现为CC>CJ>JC>JJ;90日龄后,CJ表型观测值最大,270日龄时各实验组表现为CJ>JJ>CC≈JC。对于壳宽性状,210日龄时,4个实验组间不存在显著差异(P>0.05);270日龄时,CJ最大且与其他3组均存在显著差异(P<0.05)。对于总重性状,正交组CJ最大,270日龄时与其他3组存在显著差异(P<0.05)。各性状的变异系数为0.12~0.59,总重变异系数最大(0.29~0.59),说明此性状在稚贝及养成期改良潜力大。
2.4 稚贝期和养成期生长性状的杂种优势率
2个杂交组在稚贝及养成期生长性状的杂种优势率见表4。150日龄后,杂交子代在稚贝期和养成期的生长优势明显,壳高、壳长、壳宽和总重杂种优势率的范围分别为4.46%~11.56%、4.74%~8.30%、-4.71%~6.19%和13.61%~21.71%。其中正交组CJ的生长优势突出,总重的杂种优势率最大,范围为38.10%~40.17%,而反交组JC的4个性状并没表现出杂种优势,可见正、反交组间差异较大,这对杂交子代总体的杂种优势影响较大。
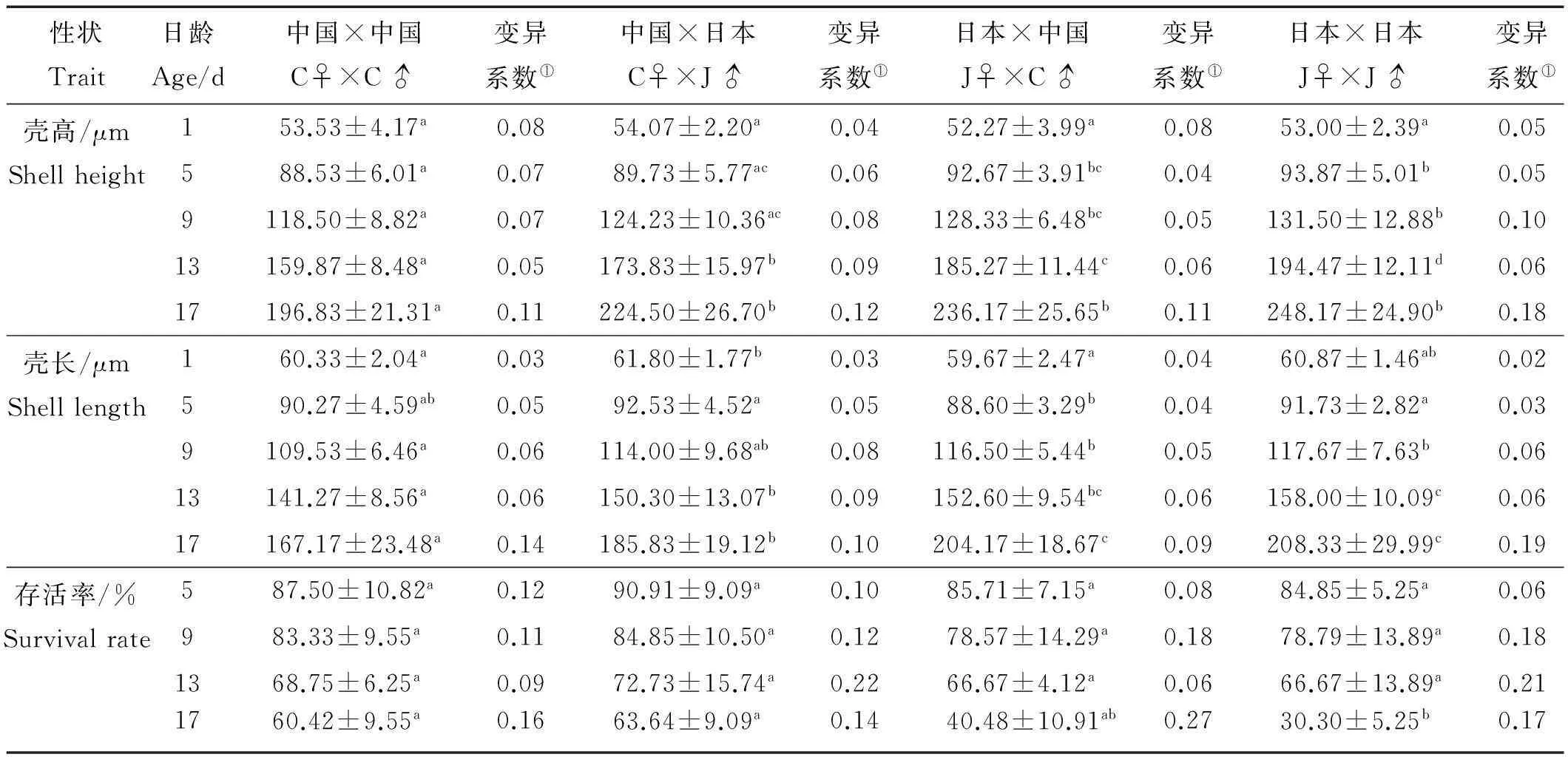
表1 长牡蛎杂交群体幼虫期生长和存活性状
注:变异系数=标准差/平均值;同一行各组均值上标注不同小写字母为差异显著(P<0.05)。Coefficient of variation=standard deviation/mean. The values within the same line with different lowercase letters are significantly different at the levels of 0.05.
①Coefficient of variation
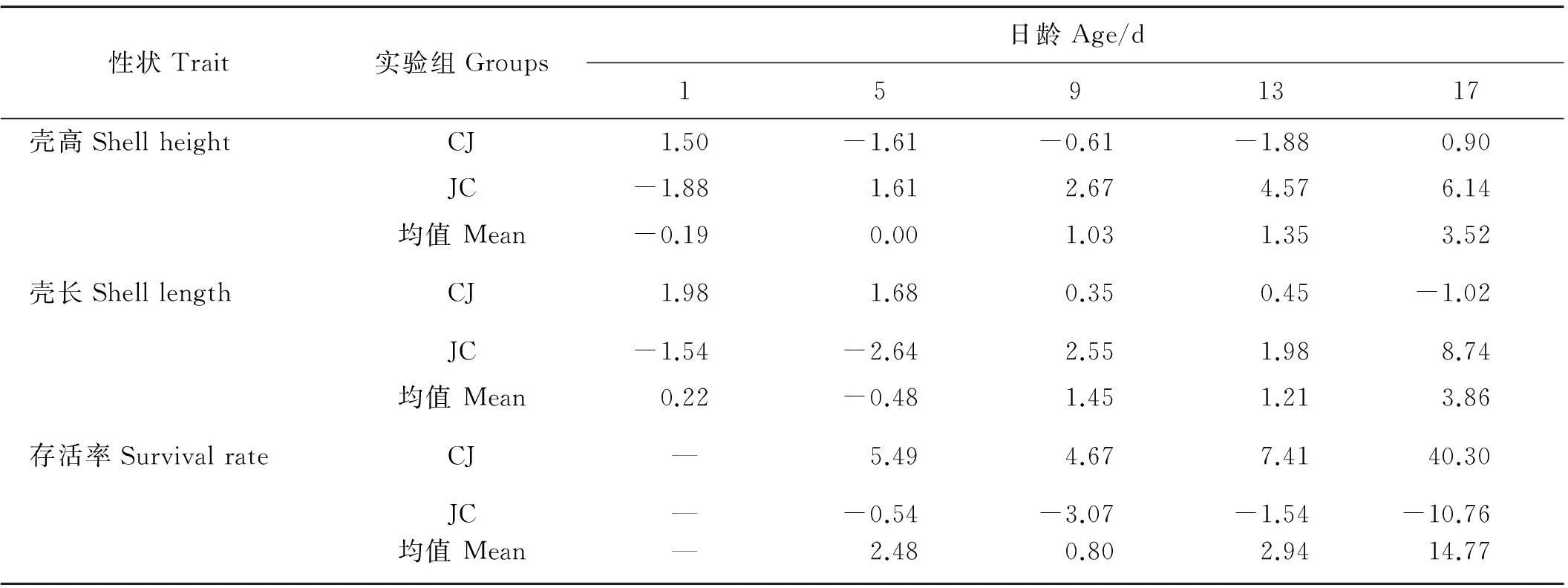
表2 幼虫期各杂交组生长和存活的杂种优势率

表3 稚贝期和养成期各实验组生长性状
注:变异系数=标准差/平均值;同一行各组合均值上标注不同小写字母为差异显著(P<0.05)。Coefficient of variation =standard deviation/mean. The values within the same line with different lowercase letters are significantly different at the levels of 0.05.
①Coefficient of variation
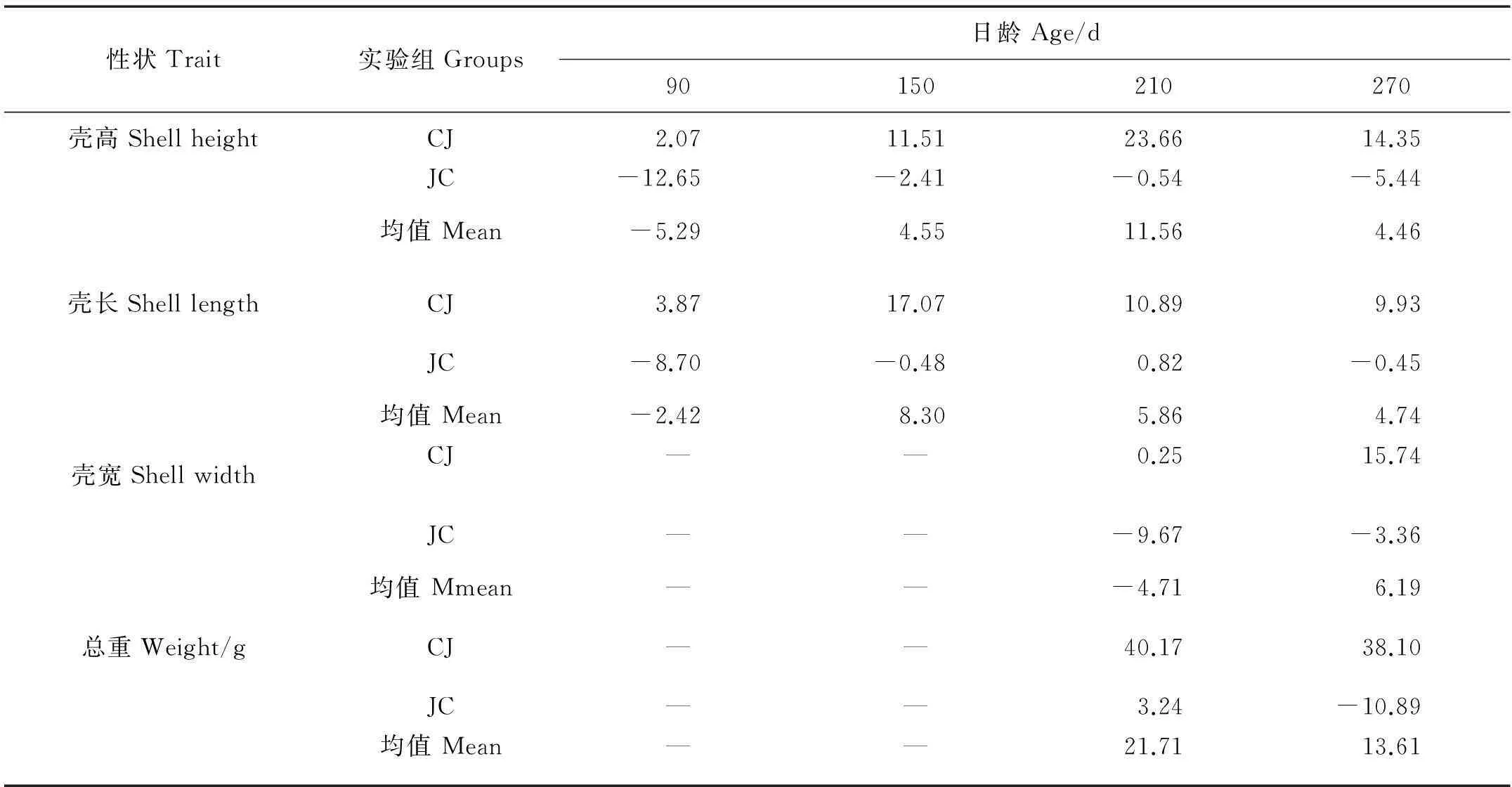
表4 稚贝期和养成期各杂交组生长和存活的杂种优势率
3讨论
3.1 母性效应对杂交的影响
母性效应主要包括细胞质遗传、母体营养(通过卵或者产前产后的食物供给)、模仿行为、通过母体与同胞间的互相作用[15],对杂交个体的早期生长与存活性状的影响尤为突出[16]。国外学者在研究海湾扇贝(Argopectenirradiansirradians)群体间[17]、牡蛎种间[18]以及群体间[19-20]杂交时发现,幼虫期杂交后代的生长和存活均存在显著的母性效应,并且随着个体生长而消失。本研究发现各实验组在幼虫期壳高、壳长大小总体表现为JJ>JC>CJ>CC,存活率表现为CJ>CC>JC>JJ,母性效应表现明显。
软体动物中,以脂质的形式储存的能量对幼虫早期的生长发育具有重要影响[21]。Newkirk等[22]研究美洲牡蛎(Crassotreavirginica)时发现母性效应的产生可能是因为亲本在产卵前所处的水区环境不同而导致营养积累不一样。而本研究采用的中、日群体在同一海区养成,并同一时间转移至室内暂养,人工投喂相同的饵料促熟,产前水体环境一致。国外学者[23]发现遗传或者母性环境适应上的差异将导致不同群体中雌性个体的卵粒大小以及质量不一致,这可能是本研究中生长发育早期母性效应产生的原因。本研究选用的日本群体的选育代数多于中国群体,理论上认为选育代数较多则优良基因型的纯合度更高,生长更具优势,储存能量可能更丰富,因此以日本群体为母本的实验组在幼虫期生长优势明显;然而,在存活率方面,以中国群体为母本的子代优于日本群体为母本的子代,究其原因可能在于实验在中国水域环境中进行,虽然日本群体已经选育到了第6代,但长期积累的地理环境适应性差异无法短时间内消除。
3.2 杂种优势
杂种优势即杂交子代在生长、存活、抗性等方面优于双亲平均表现的现象。本研究中,杂种优势在幼虫期、稚贝及养成期都存在,并且存活性状比生长性状的杂种优势更显著。这一结论与海湾扇贝不同群体杂交实验结果一致[24]。幼虫期,由于母性效应的存在,生长性状在9日龄后开始显现杂种优势,而且壳高的杂种优势随着日龄的增加逐渐增大;存活性状的杂种优势率在13日龄后明显大于生长性状的杂种优势率。虽然母性效应对幼虫期有重要影响,但并未完全掩盖杂种优势,这可能是因为经过连续多代的选育,两亲本群体的基因频率差异变大。但在幼虫期,反交组JC表现出明显的杂种优势;稚贝及养成期,正交组CJ在生长上具有显著的杂种优势,而JC总体上没有表现出杂种优势。JC和CJ分别在幼虫期和稚贝及养成期表现出杂种优势的现象在孔令锋等[11]的研究中也存在,这种现象是环境和遗传因素共同作用的结果。因此在生产实践中除了选择亲本群体外,挑选合适的父母本组合才能充分利用杂种优势。综上所述,长牡蛎中国群体和日本群体的杂交子代表现出明显的生长与存活优势,尤其是正交组CJ在幼虫期存活优势显著,在稚贝及养成期生长优势明显,均强于最好的自交组。因此中国群体为母本(C♀)和日本群体(J♂)为父本的杂交组合具有更高的应用价值。这与宋盛亮等[25]的研究结果基本一致,表明以中国和日本的选育群体为核心群体,随着中、日群体选育代数增加,C♀×J♂的杂交组合能稳定地提高长牡蛎的生长性能,这为进一步开展杂交育种奠定了基础。
参考文献:
[1]MiossecL,LeDeuffRM,GoulletquerP.Alienspeciesalert: Crassostrea gigas (Pacificoyster) [J].ICESCooperativeResearchReport, 2009, 299: 1-42.
[2]农业部渔业局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2013: 28-29.
Ministry of Agriculture, Fisheries Bureau. China Fishery Statistical Yearbook [M] . Beijing: China Agriculture Press, 2013: 28-29.
[3]张国范, 刘晓, 阙华勇, 等. 贝类杂交及杂种优势理论和技术研究进展[J]. 海洋科学, 2004, 28(7): 54-60.
Zhang Guofan, Liu Xiao, Que Huayong, et al. The theory and application of hybridization and heterosis in marine mollusks [J]. Marine Sciences, 2004, 28(7): 54-60.
[4]Shurtliff Q R. Mammalian hybrid zones: a review [J]. Mammal Review, 2013, 43(1): 1-21.
[5]Bueno C S, Lafarge T. Higher crop performance of rice hybrids than of elite inbreds in the tropics: 1. Hybrids accumulate more biomass during each phenological phase [J]. Field Crops Research, 2009, 112(2): 229-237.
[6]朱华平, 卢迈新, 黄樟翰, 等. 鱼类遗传改良研究综述[J]. 中国水产科学, 2010, 17(1): 168-181.
Zhu Huaping, Lu Maixin, Huang Zhanghan, et al. Genetic improvement in fish: A review [J]. Journal of Fishery Sciences of China, 2010, 17(1): 168-181.
[7]汪德耀, 刘汉英. 牡蛎人工杂交初步研究[J]. 动物学报, 1959, 11(3): 283-295.
WANG Deyao, LIU Hanying. Preliminary studies on artificial hybridization of oyster [J]. Current Zoology, 1959, 11(3): 283-295.
[8]胡志国, 刘建勇, 包秀凤, 等. 九孔鲍双列杂交家系子代的杂种优势与配合力分析[J]. 南方水产科学, 2014, 10(1): 43-49.
Hu Zhiguo, Liu Jianyong, Bao Xiufeng, et al. Combining ability and heterosis of hybridization between cultured and wild stocks ofHaliotisdiversicolorsupertexta[J]. South China Fisheries Science, 2014, 10(1): 43-49.
[9]Hedgecock D, Davis J P. Heterosis for yield and crossbreeding of the Pacific oysterCrassostreagigas[J]. Aquaculture, 2007, 272(S1): 1-14.
[10]Hedgecock D, McGoldrick D J, Bayne B L. Hybrid vigor in Pacific oysters: an experimental approach using crosses among inbred lines [J]. Aquaculture, 1995, 137: 285-298.
[11]孔令锋, 滕爽爽, 李琪. 长牡蛎中国群体与日本群体杂交子一代的生长和存活比较[J]. 海洋科学, 2013, 37(8): 78-84.
Kong Lingfeng, Teng Shuangshuang, Li Qi. Growth and survival of the first generation of hybrid between Chinese and Japanese populations of Pacific oysterCrassostreagigas[J]. Marine Sciences, 2013, 37(8): 78-84.
[12]Sheridan A K. Genetic improvement of oyster production—a critique [J]. Aquaculture, 1997, 153: 165-179.
[13]于瑞海, 李琪, 王昭萍, 等. 我国北方太平洋牡蛎育苗及养殖现状[J]. 科学养鱼, 2008(6): 3-5.
Yu Ruihai, Li Qi, Wang Zhaoping, et al. The current situation of culture of Pacific oyster (Crassostreagigas) in north of China [J]. Scientific Fish Farming, 2008(6): 3-5.
[14]常亚青, 刘小林, 相建海, 等. 栉孔扇贝中国种群与日本种群杂交一代的早期生长发育[J]. 水产学报, 2002, 26(5): 385-390.
Chang Yaqing, Liu Xiaolin, Xiang Jianhai, et al. The juvenile growth and survival of hybrid between Chinese population and Japanese population ofChlamysfarreri[J]. Journal of Fisheries of China, 2002, 26(5): 385-390.
[15]Mather K, Jinks J L. Biometrical Genetics [M]. New York: Cornell University Press, 1971: 382.
[16]Falconer D S. Introduction to Quantitative Genetics [M]. 2th edition, London: Longman, 1981: 232.
[17]Cruz P, Ibarra M. Larval growth and survival of two catarina scallop (Argopectencircularis, Sowerby, 1835) populations and their reciprocal crosses [J]. Journal of Experimental Marine Biology and Ecology, 1997, 212(1): 95-110.
[18]Soletchnick P, Huvet A, Le Moine O, et al. A comparative field of growth, survival and reproduction ofCrassostreagigas,C.angulataand their hybrids [J]. Aquatic Living Resources, 2002, 15(4): 243-250.
[19]Hedgecock D. Hybrid vigoris pervasive in crosses among inbred lines of Pacific oysters [J]. Journal of Shellfish Research, 1996, 15(2): 511-517.
[20]Mallet A L, Halev L E. General and specific combining abilities of larval and juvenile growth and viability estimated from natural oyster populations [J]. Marine Biology, 1984, 81(1): 53-59.
[21]Cragg S M, Crisp D J. The Biology of Scallop Larvae [M]. Amsterdam: Elsevier, 1991: 75-132.
[22]Newkirk G F, Waugh D L, Haley L E, et al. Genetics of larval tolerance to reduced salinities in two populations of oysters,Crassostreavirginica[J]. Journal of the Fisheries Board of Canada, 1977, 34(3): 384-387.
[23]Solemdal P. Maternal effects-a link between the past and the future [J]. Journal of Sea Research, 1997, 37(3-4): 213-227.
[24]Zhang H B, Liu X, Zhang G F, et al. Growth and survival of reciprocal between two bay scallop,ArgopectenirradiansconcentricusSay andA.irradiansirradiansLamarck [J]. Aquaculture, 2007, 272(S1): 88-93.
[25]宋盛亮. 长牡蛎不同选育群体间杂交效应及其与环境互作分析[D]. 青岛: 中国海洋大学, 2011.
Song Shengliang. The analysis of effect of crossbreeding among different selected strains and genotype × environment interactions in the Pacific oysterCrassostreagigas[D]. Qingdao: Ocean University of China, 2011.
责任编辑朱宝象
Heterosis of Hybrid Between Chinese and Japanese Populations of the Pacific Oyster (Crassostreagigas)
YU Yong, LI Qi, YU Hong, KONG Ling-Feng, YU Rui-Hai
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:The Pacific oyster, Crassostrea gigas, which originated from Asia and was introduced to many countries, has had the highest production of any aquatic species for the past several years. Selection and cross-breeding programs for genetic improvement in C. gigas have initiated in several countries. In order to promote the development of cross-breeding, a complete diallel cross between Chinese and Japanese populations of the Pacific oyster (Crassostrea gigas) was carried out. With the increase in breeding algebra of the population, gene frequency differences between groups may be larger, hybrids may have a greater heterosis. In the study, Chinese population (C) was mass selected for five generations while Japanese population (J) was done so for six generation. Growth and survival performances were compared among hybrid and pure populations in different growth stages. Heterosis of growth traits was analyzed. The results indicated that the growth and survival of the two reciprocal crosses showed weak heterosis in larval stage. The pure bred group (JJ) and hybrid cross JC showed significant growth advantage, but pure bred group (CC) and the cross (CJ) lived well, indicating that there were significant maternal effects. Japanese population has been breeding more years, thus it may provide better growth vigor. But Chinese population has better adaptability in Chinese water, so it may provide better viability. In larval stage, the CJ cross had the highest survival rate with the heterosis ranging from 4.67% to 40.30%. In spat and adult stages, growth of the two reciprocal crosses showed heterosis comparable with the pure bred groups. Among the four traits (shell height, shell length, shell width and body weight), 2body weight had the highest heterosis, which varied between 13.61% and 21.71%. Besides, growth of the cross CJ showed positive heterosis in the whole spat and adult stages. In practice, besides the parent population, the selection of suitable parent combinations will take full advantage of heterosis. In a word, the results suggested that the CJ cross was the best with meaningful productive potential. When CC and JJ have been used as the core breeding populations, the cross C♀×J♂ can stably improve growth and survival performance of C. gigas with the increase of selective breeding algebra.
Key words:Crassostrea gigas; diallel cross; heterosis
DOI:10.16441/j.cnki.hdxb.20140365
中图法分类号:S961.5
文献标志码:A
文章编号:1672-5174(2016)02-035-07
作者简介:余勇(1990-),男,硕士生。E-mail: yuyong421127@163.com❋❋通讯作者: E-mail: qili66@ouc.edu.cn
收稿日期:2014-11-19;
修订日期:2015-04-03
基金项目:❋ 国家高技术研究发展计划项目(2012AA10A405);国家自然科学基金项目(31372524);山东省自主创新专项(2013CXC80202)资助
引用格式:余勇, 李琪, 于红, 等. 长牡蛎中国群体和日本群体杂交子代的杂种优势分析[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 35-41.
Supported by National High Technology Research and Development Program (2012AA10A405); National Natural Science Foundation of China (31372524); Shandong Province Independent Innovation Projects(2013CXC80202)
