围生期心肌病的临床特征和预后
2016-03-23刘英,曾勇
刘 英,曾 勇
中国医学科学院 北京协和医学院 北京协和医院 1内科 2心内科,北京 100730
·论著·
围生期心肌病的临床特征和预后
刘英1,曾勇2
中国医学科学院北京协和医学院北京协和医院1内科2心内科,北京 100730
摘要:目的总结围生期心肌病(PPCM)的临床特征及预后。方法回顾性分析北京协和医院1983年1月至2014年12月收治的病例资料较完整的28例PPCM患者的临床资料,随访至少6个月或至全因死亡及心脏移植。结果28例患者均有不同程度的心功能不全表现,基线左心室射血分数(LVEF)平均为(36.2±11.8)%。21例患者进行了随访,中位随访时间27个月,16例(76%)LVEF改善;5例(24%)患者无改善,其中1例死亡。改善组和无改善组患者在基线LVEF(P=0.007)、基线左心室舒张末期内径(LVEDD)(P=0.040)、随访时LVEF(P<0.001)和随访时LVEDD(P<0.001)方面差异均有统计学意义。Cox回归分析结果显示,基线LVEF高(RR:0.89,95%CI:0.83~0.96,P=0.002)和LVEDD小(RR:0.90,95%CI:0.83~0.99,P=0.026)与PPCM患者LVEF改善相关。结论PPCM经及时诊断和正规治疗,部分患者的心功能可明显改善,基线LVEF高或LVEDD小的患者左心室收缩功能恢复的可能性大。
关键词:围生期心肌病;心力衰竭;诊断;预后
ActaAcadMedSin,2016,38(1):78-82
围生期心肌病(peripartum cardiomyopathy,PPCM)是一种不明原因的、以心肌收缩功能障碍为主要表现的特发性心肌病,发生于妊娠最后1月至产后5个月内,既往无心脏病病史。发病率较低,国内报道不一。目前发病机制未明,氧化应激、催乳激素产生的心脏毒性物质可能对PPCM的发生有重要作用。一些患者经过积极的治疗,临床症状和心脏结构及功能可恢复为正常,而有些患者则迅速恶化,药物治疗无效,可进展为严重的心力衰竭,或并发血栓栓塞事件,或并发严重心律失常,甚至出现心源性猝死[1]。本研究总结了28例PPCM患者的临床特征及预后,以期为今后的临床诊治提供帮助。
资料和方法
资料采集1983年1月至2014年12月在北京协和医院诊治且病例资料较完整的PPCM患者28例,对所有患者进行病历回顾,包括一般情况、临床表现、辅助检查、治疗及预后等临床资料。患者出院后由门诊或电话随访至少6个月,或至全因死亡及心脏移植,并收集患者定期复查的超声心动图资料。
诊断标准1971年Demakis等[2]首次提出PPCM的诊断标准,PPCM是指妊娠最后1个月或产后5个月内出现的心力衰竭,现在多数学者采用的是2010年欧洲心脏病学会定义的3条诊断标准:(1)发生于妊娠最后1个月或产后5个月内;(2)可除外其他引起心力衰竭的原因;(3)超声心动图证实为左心室收缩减低,左心室射血分数(left ventricular ejection fraction,LVEF)小于45%,伴或不伴左心室扩大[3]。PPCM的症状、体征及各项检查无特异性,确诊需结合临床特点和超声心动图表现,并排除其他心肌病。
改善标准根据复查超声心动图结果,定义LVEF>50%为左心室收缩功能完全恢复,LVEF<35%为无改善,LVEF在35%~50%且较基线LVEF值增加10%以上为部分改善。左心室收缩功能完全恢复或部分改善均定义为改善。
统计学处理采用SPSS 21.0统计软件,计量资料以均数±标准差表示,组间比较采用t检验;计数资料以率或构成比表示,组间比较采用Fisher精确检验;评估影响左心室收缩功能改善的因素采用Cox回归分析;P<0.05为差异有统计学意义。
结果
一般情况28例患者的平均年龄为(27.8±5.3)岁(18~38岁),高龄产妇(>35岁)3例;初产妇17例(60.7%),经产妇10例(35.7%),1例患者产前死亡;平均妊娠次数(2.3±1.5)次,平均产次(1.0±1.0)次;妊娠最后1个月内发病21例(75.0%),产后1个月内发病6例(21.4%),产后1~5个月发病1例(3.6%);单胎21例(75.0%),双胎5例(17.9%),多胎2例(7.1%);妊娠高血压综合征16例(57.1%),贫血8例(28.6%),肾功能不全3例(10.7%);纽约心脏病协会(New York Heart Association,NYHA)分级Ⅱ、Ⅲ、Ⅳ级分别有1(3.6%)、11(39.3%)、16例(57.1%);中位B型利钠肽(B-type natriuretic peptide,BNP)水平为2580 pg/ml,中位N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)水平为1170 pg/ml;所有患者既往均无心脏病史。
临床表现28例患者均有不同程度的呼吸困难,22例出现端坐呼吸,26例双下肢水肿加重,22例伴咳嗽;3例颈静脉充盈,16例肺部可闻及湿啰音,4例心尖区可闻及病理性杂音,合并多浆膜腔积液者10例。
辅助检查心电图示窦性心动过速(静息心率≥110次/min)4例,室性早搏1例,心房颤动1例,不完全右束支传导阻滞1例。超声心动图检测结果显示,28例患者的平均LVEF为(36.2±11.8)%,平均左心室短轴收缩率为(21.9±11.7)%,平均左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)(56.2±7.2)mm,左室舒张功能不全4例(14.3%),左心房扩大18例(64.3%),二尖瓣关闭不全17例(60.7%),左心室血栓1例(3.6%)。胸片X线检查者16例,其中7例示心影增大。19例患者血NT-proBNP或BNP水平明显增高。
相关并发症28例患者中,5例并发肝功能异常,12例肾功能异常;8例合并Ⅰ型呼吸衰竭,其中7例予以机械通气;6例行气管插管,1例给予持续正压通气(continuous positive airway pressure,CPAP);并发动脉栓塞1例,深静脉血栓形成1例。
治疗与疗效经过休息、吸氧、强心、利尿、扩血管、抗栓塞等治疗,出院时27例患者临床症状缓解或消失,1例死亡。21例产期发病患者中19例经剖宫产适时终止妊娠,2例自然分娩,其中早产13例。
随访及预后28例患者中,21例患者进行了随访,中位随访时间27个月,7例失访。21例随访患者的基线LVEF平均为(36.2±11.8)%,随访时LVEF平均为(50.1±17.4)%。基线LVEF>30%患者的改善率为86.7%,与基线LVEF≤30%患者的50.0%相比差异无统计学意义(P=0.115)(表1)。
21例接受随访的患者中,16例(76.2%)LVEF改善,其中13例(61.9%)完全恢复,3例(14.3%)部分改善;5例(23.8%)LVEF无改善。在13例完全恢复的患者中,3例(23.1%)于确诊后6个月内恢复,其中,恢复时间最短1周,最长10年。
改善组患者的平均LVEF由基线的(39.1±8.6)% 增加至随访时的(58.4±9.3)%,LVEDD由基线的(56.1±5.1)mm减小至随访时的(45.8±7.2)mm;无改善组患者的平均LVEF由基线的(25.4±6.9)%降低至随访时的(23.6±6.2)%,LVEDD由基线的(63.4±9.0)mm增加至随访时的(64.2±10.2)mm;两组患者在基线LVEF(P=0.007)、基线LVEDD(P=0.040)、随访时LVEF(P< 0.001)和随访时LVEDD(P<0.001)方面差异有统计学意义(表2)。Cox回归分析结果显示,基线LVEF及LVEDD是PPCM患者LVEF改善的预测因素,LVEF改善与基线LVEF高(RR:0.89,95%CI:0.83~0.96,P=0.002)和LVEDD小(RR:0.90,95%CI:0.83~0.99,P=0.026)相关。
讨论
PPCM是一种发生于妊娠最后1个月或产后5个月内的以心肌收缩功能障碍为主要表现的特发性心肌病,需排除引起LVEF降低的其他原因。高龄、多胎、妊娠高血压综合征史为可能的危险因素。尽管多产被认为是传统的危险因素,但本研究中经产妇仅占35.7%,且相关研究表明第1次妊娠与第2次妊娠中发展为PPCM的风险相当[4]。PPCM的发病机制尚不清楚,病毒性心肌炎、氧化应激、催乳素代谢产物的毒性、免疫异常、血流动力学急剧改变等可能是致病原因[5]。
目前关于PPCM在围生期内发病时间的报道并不一致。有研究表明,PPCM多发生于产后1个月[6],而本研究中产前发病占绝大多数,因此还有待未来进一步的大规模临床研究。PPCM临床特征缺乏特异性,与其他类型的收缩性心力衰竭表现相同,如气短、乏力、咳嗽、夜间阵发性呼吸困难、心悸、头晕、水肿等,这些症状也见于正常妊娠者及合并重度子痫前期的患者,因此,PPCM早期易漏诊。当临床上怀疑合并心力衰竭时,应及时进行超声心动图检查,检测血浆BNP或NT-proBNP水平也具有重要的临床意义。

表 1 基线与随访时LVEF的分布
LVEF:左心室射血分数
LVEF:left ventricular ejection fraction
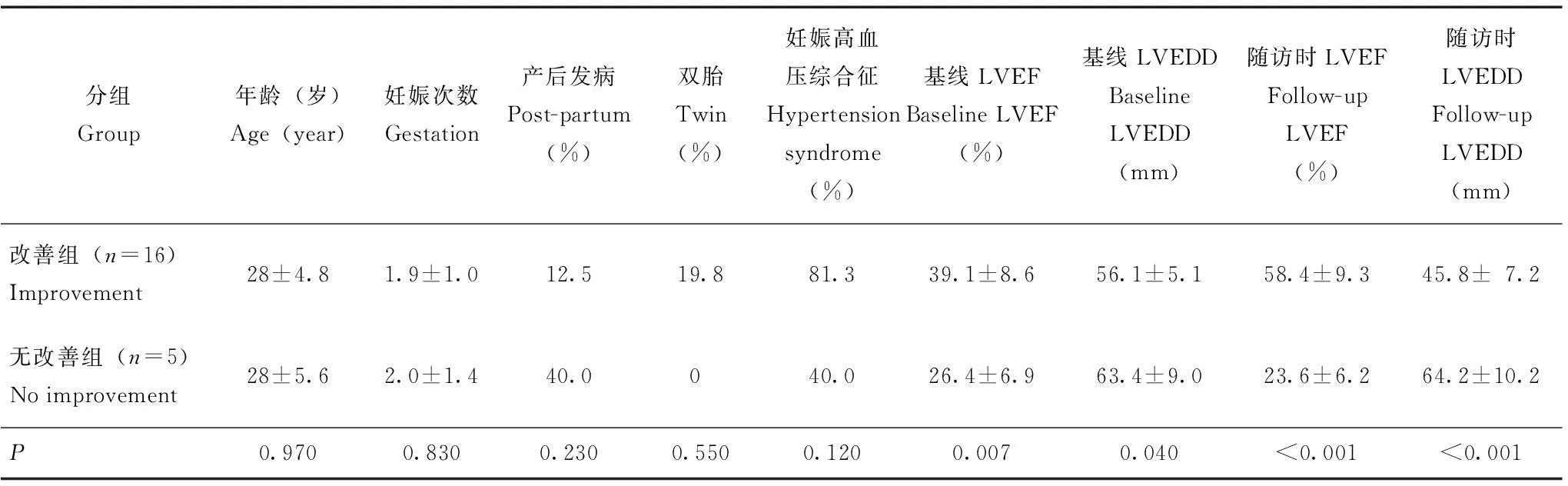
表 2 改善组与无改善组PPCM患者的临床特征
LVEDD:左心室舒张末期内径
LVEDD:left ventricular end-diastolic dimension
超声心动图是诊断PPCM最重要的检查手段,提示左心室收缩功能减低,LVEF<45%(或短轴收缩率<30%)。左心室扩大(LVEDD>50 mm)较多见。此外,可能表现为双房增大、左心室或左心房血栓、右心功能不全、二尖瓣或三尖瓣关闭不全、心包积液等。
血浆BNP或NT-proBNP水平的测定对于可疑心力衰竭患者明确诊断具有指导意义。健康的妇女在妊娠期BNP水平增高一般不超过2倍[7],但明显低于妊娠合并心力衰竭患者。通常认为,BNP>100 pg/ml或NT-proBNP>900 pg/ml对于心力衰竭有诊断意义。BNP>100 pg/ml诊断心力衰竭的灵敏度和精确度分别为90%和76%。NT-proBNP>900 pg/ml与BNP>100 pg/ml诊断心力衰竭上具有同等的准确性。本组PPCM患者BNP或NT-proBNP水平明显增高,而PPCM者中BNP升高的水平是否较其他心肌病高目前尚无研究证实。
PPCM的治疗需要心内科、产科和新生儿科等多科室的协作,采取综合措施以控制心力衰竭的进展,改善预后。本研究中28例患者均采取了休息、吸氧、强心、利尿、扩血管、抗凝等综合治疗,随访的21例患者中,有16例LVEF有改善。
以往认为PPCM者发生严重并发症如严重的心力衰竭、心源性休克、心脏骤停、心律失常甚至死亡等的风险明显增加,本研究中的并发症以肝肾功能异常为主,1例患者因心源性休克死亡,血栓栓塞亦少见。以往认为50%的PPCM患者在产后6个月内心功能可恢复为基线水平,25%表现为持续心功能不全但在药物治疗下保持稳定,25%进展为严重的心力衰竭。而最近更多的研究表明,PPCM的预后明显提高,生存率可达90%~95%[8]。本研究中,76.2%患者左心室收缩功能改善,其中61.9%的患者左心室收缩功能恢复正常,14.3%部分改善。既往研究表明,心功能恢复多见于确诊后6个月内,持续的左心室功能不全提示预后不佳[9]。本研究中,23.1%的患者可在确诊后6个月内恢复,但部分患者存在晚期恢复的可能,其中最长的恢复时间为确诊后10年。
本研究结果显示,基线LVEF高和LVEDD小与PPCM患者LVEF改善相关,与Haghikia等[10]研究结果相似。推测其可能机制是基线LVEF越高,LVEDD越小,提示左心室重构程度越低,恢复的可能性越大。实际上,临床中LVEF及LVEDD是超声心动图中反映PPCM患者恢复潜能及预后的重要指标之一。但也有研究表明,高龄、LVEDD小与LVEF改善相关,而基线LVEF与其不相关[11],随访时间为6个月。本研究经Cox回归分析结果显示,年龄并非LVEF改善的预测因素,而基线LVEF及LVEDD均与LVEF改善相关,推测其原因可能是因为前者随访时间短。近期有研究表明。PPCM患者LVEF可在晚期(大于6个月)恢复[12- 14]。此外,有研究表明,基线LVEF≤30%较基线LVEF>30%的患者LVEF恢复正常的可能性小,建议LVEF≤30%的患者积极进行介入治疗[15],而本研究中两者无明显差异。因此,对于LVEF≤30%的PPCM患者是否需要介入治疗还有待进一步研究。
本研究中,随访的21例患者均未再次妊娠。目前认为,有PPCM病史的患者再次妊娠再发PPCM的风险较无PPCM病史者明显增加,尤其对于持续左心功能不全者。左心功能完全恢复者再次妊娠再发PPCM的风险相对较低,但应进行应激负荷试验评估心脏收缩储备功能,若静息状态下LVEF正常且应激时LVEF增加,PPCM再发的风险较小[16]。再次妊娠前需要经过临床心血管专家的评估并在严密监测下进行。
综上,本研究结果显示,围生期心肌病经及时诊断和正规治疗后,部分患者的心功能可以明显改善,基线LVEF高或LVEDD小的患者左心室收缩功能恢复的可能性大。本研究不足之处在于是小规模、单中心的回顾性研究,今后尚需要进一步进行大规模、多中心的长期、随机、对照研究。
参考文献
[1]Johnson-Coyle L,Jensen L,Sobey A,et al. Peripartum cardiomyophathy:Review and practice guidelines[J]. Am J Crit Care,2012,21(2):89- 98.
[2]Demakis JG,Rahimtoola SH,Sutton GC,et al.Natural course of peripartum cardiomyopathy[J].Circulation,1971,44(6):1053- 1061.
[3]Sliwa K,Hilfiker-Kleiner D,Petrie MC,et al. Current state of knowledge on aetiology,diagnosis,management,and therapy of peripartum cardiomyopathy:a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy[J]. Eur J Heart Fail,2010,12(8):767- 778.
[4]Elkayam U,Akhter MW,Singh H,et al. Pregnancy-associated cardiomyopathy:clinical characteristics and a comparison between early and late presentation[J]. Circulation,2005,111(16):2050- 2055.
[5]Biteker M,Kayatas K,Duman D,et al.Peripartum cardiomyopathy:current state of knowledge,new developments and future directions[J]. Curr Cardiol Rev,2014,10(4):317- 326.
[6]Prasad GS,Bhupali A,Prasad S,et al. Peripartum cardiomyopathy-case series[J]. Indian Heart J,2014,(66):223- 226.
[7]Hameed AB,Chan K,Ghamsary M,et al. Longitudinal changes in the B-Type natriuretic peptide levels in normal pregnancy and postpartum[J]. Clin Cardiol,2009,32(8):E60- E62.
[8]Michael M,Givertz MD. Cardiology patient page:peripartum cardiomyopathy[J].Circulation,2013,127(20):622- 626.
[9]Pearson GD,Veille JC,Rahimtoola S,et al. Peripartum cardiomyopathy:National Heart,Lung and Blood Institute and Office of Rare Diseases(National Institutes of Health) workshop recommendations and review[J]. JAMA,2000,283(9):1183- 1188.
[10]Haghikia A,Podewski E,Libhaber E,et al. Phenotyping and outcome on contemporary management in a German cohort of patients with peripartum cardiomyopathy[J]. Basic Res Cardiol,2013,108(4):366- 378.
[11]Blauwet LA,Libhaber E,Forster O,et al. Predictors of outcome in 176 South African patients with peripartum cardiomyopathy[J]. Heart,2013,99(5):308- 313.
[12]Biteker M,llhan E,Biteker G,et al. Delayed recovery in peripartum cardiomyopathy:an indication for long-term follow-up and sustained therapy[J]. Eur J Heart Fail,2012,14(8):895- 901.
[13]Modi KA,Illum S,Jariatul K,et al. Poor outcome of indigent patients with peripartum cardiomyopathy in the United States[J].Am J Obstet Gynecol,2009,201(2):171.e1-e5.DOI:10.1016/j.ajog.2009.04.037.
[14]Fett JD,Sannon H,Thélisma E,et al. Recovery from severe heart failure following peripartum cardiomyopathy[J]. Int J Gynaecol Obstet,2009,104(2):125- 127.
[15]Fett JD,Markham DW. Discoveries in peripartum cardiomyopathy[J]. Trends Cardiovasc Med,2015,25(5):401- 406.
[16]Elkayam U. Risk of subsequent pregnancy in women with a history of peripartum cardiomyopathy[J]. J Am Coll Cardiol,2014,64(15):1629- 1636.
Clinical Characteristics and Prognosis of Peripartum Cardiomyopathy in 28 Patients
LIU Ying1,ZENG Yong2
1Department of Internal Medicine,2Department of Cardiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China Corresponding author:ZENG YongTel:010- 69155068,E-mail:13501373114@163.com
ABSTRACT:ObjectiveTo analyze the clinical features and prognosis of patients with peripartum cardiomyopathy(PPCM).MethodsThe clinical data of 28 PPCM patients with PPCM diagnosed in Peking Union Medical College Hospital from January 1983 to December 2014 were retrospectively analyzed and followed up for at least 6 months or to death or cardiac transplantation.ResultsAll patients were presented with heart failure. Mean baseline left ventricular ejection fraction(LVEF) was(36.2±11.8)%. After a median follow-up of 27 months,16 of the 21 patients(76%) showed improvement in LVEF and 5 patients(24%) did not have improvement in their LVEF. Only 1 patient died.There were significant differences between improved and non-improved patients in baseline LVEF(P=0.007),baseline left ventricular end-diastolic dismension (LVEDD)(P=0.040),follow-up LVEF(P<0.001),and follow-up LVEDD(P<0.001). Cox regression analysis showed that higher LVEF(RR:0.89,95%CI:0.83- 0.96,P=0.002) and smaller LVEDD(RR:0.90,95%CI:0.83- 0.99,P=0.026) were predictors of improvement in LVEF. ConclusionsEarly diagnosis and regular treatment helps to improve the prognosis of PPCM. Patients with higher LVEF and smaller LVEDD appear to be the most likely to recover.
Key words:peripartum cardiomyopathy;heart failure;diagnosis;prognosis
(收稿日期:2015- 03- 23)
DOI:10.3881/j.issn.1000- 503X.2016.01.014
中图分类号:R541.6
文献标志码:A
文章编号:1000- 503X(2016)01- 0078- 05
通信作者:曾勇电话:010- 69155068,电子邮件:13501373114@163.com
