非编码RNA在血管损伤、重塑和老化中的作用
2016-03-21党延启倪荣镇郭慧宁李玉凤王淑荣许锦文
马 婧,凌 霜,党延启,倪荣镇,郭慧宁,李玉凤,王淑荣,许锦文
(上海中医药大学穆拉德中药现代化研究中心,上海 201203)
非编码RNA在血管损伤、重塑和老化中的作用
马婧,凌霜,党延启,倪荣镇,郭慧宁,李玉凤,王淑荣,许锦文
(上海中医药大学穆拉德中药现代化研究中心,上海201203)
中国图书分类号: R322. 12; R342. 2; R394. 2; R543
摘要:非编码RNA是一类具有多种功能而不翻译蛋白质的RNA。它除了rRNA、tRNA外,还包括MicroRNA、lncRNA、snoRNA等。MicroRNA和lncRNA在血管损伤、重塑和老化中的调控机制越来越受到人们重视。MicroRNA和lncRNA不仅参与氧化应激、炎症、细胞增殖、迁移、表型转换等方面的调控,也参与基因表达各方面的调控,包括转录、加工、转录后修饰和染色质重塑。这些调控与动脉粥样硬化、高血压、心肌梗死、脑卒中、肺动脉高压和糖尿病血管病变等血管系统疾病密切相关,为血管系统疾病的基因诊断与治疗提供新靶点、新思路、新方法。
关键词:MicroRNA; lncRNA ;血管损伤;血管重塑;血管老化;血管系统疾病
许锦文( 1959-),男,博士,教授,博士生导师,研究方向:心血管中药药理学,通讯作者,021-51322532,E-mail: jinwen.xu88@ gmail.com
血管是一个复杂系统,除了作为输送血液的渠道外,还是一个产生和分泌多种生物活性物质的分泌器官,对血压和体液平衡起着重要作用。高血压、动脉粥样硬化、糖尿病、高脂血症、慢性肾病、阻塞性睡眠呼吸暂停、衰老、吸烟、高脂膳食和不良生活方式等生理和病理因素可导致血管损伤、重塑和老化等器质性改变。
非编码RNA是一类具有多种功能而不翻译蛋白质的RNA,除了rRNA、tRNA外,还有近年发现的多种功能的MicroRNA、lncRNA、snoRNA等。其中近60% RNA为非编码RNA。非编码RNA的调控作用显示出机体生物学功能调节的复杂性[1]。它在血管系统疾病中发挥着表观遗传的调控作用[2]。因此,在血管损伤、重塑和老化过程中MicroRNA 和lncRNA的调控成为当前研究的热点。
1 非编码RNA概念
微小RNA( microRNA,miRNA)是一类长度为21~25 nt的单链RNA,属于非编码RNA,广泛存在于生物界。MicroRNA被称为转录后调节器,通过与靶蛋白3'-UTR区域碱基互补配对而抑制靶蛋白mRNA的翻译或促进其降解,从而降低靶蛋白的表达水平。在哺乳动物中,MicroRNA调控大约30%的蛋白编码基因,通过调节多个信号通路而影响细胞的分化、增殖、迁移和凋亡[3]。
长链非编码RNA( long non-coding RNA,lncRNA)是在真核生物中新发现的一类长度大于200 nt的非编码RNA分子,其本身并不编码蛋白,具有mRNA样结构,经过剪接,具有polyA尾巴,与启动子具有结合能力,参与分化过程中基因的动态表达。大多数lncRNA在组织分化、发育过程中,具有明显的时空特异性。越来越多的研究表明,lncRNA广泛存在于真核生物中,作为功能调控元件在真核生物的表达调控中起着重要作用,并参与X染色体沉默、基因组印迹、染色体修饰、转录激活、转录干扰以及核内运输等多种生命过程[4]。lncRNA功能的多样性使其可参与到多种调控机制中,其主要是参与编码基因表达调控的表观遗传学机制[2]。
2 MicroRNA与血管损伤和修复的关系
血管系统有着特别丰富的MicroRNA资源,MicroRNA在血管系统疾病中充当多种角色,或可反映血管对损伤的易感性。
氧化应激是导致血管损伤、病变的重要因素,而MicroRNA通过参与氧化应激介导的基因调控以及血管平滑肌细胞( VSMC)迁移和增殖过程调控血管损伤和修复。Ji等[5]研究发现,在受伤的动脉中miRNA表达异常。芯片的定量PCR结果显示,与对照组相比,miR-21、146、214和352明显上调,而miR-125A、125B、133A、143、145、347和365则明显下调,其中miR-21的增加达5倍以上。细胞实验表明,敲除miR-21可以降低细胞增殖,增加细胞凋亡。在体内球囊损伤大鼠颈动脉中,进一步证实miR-21通过磷酸酯酶与张力蛋白同源物( PTEN)和B淋巴细胞瘤-2基因( Bcl-2)的作用介导细胞效应。该研究小组又进一步证实,过氧化氢处理后的VSMC中miR-21的表达明显上调,而过氧化氢诱导的VSMC凋亡和死亡增加却可被miR-21抑制剂或miR-21前体所降低。程序性细胞死亡4( PDCD4)基因是miR-21的直接靶点,而miR-21前体介导的对VSMC凋亡和死亡的保护作用可被不含miR-21结合位点的PDCD4的导入所阻断。该研究表明,miR-21参与氧化应激介导的基因调控和细胞损伤[6]。另外,在VSMC中X盒结合蛋白1( XBP1)缺陷明显阻止损伤的血管内膜新生。体外实验显示,血小板衍生生长因子激活并触发XBP1剪接,而XBP1s定向控制miR-1274B的转录,下调碱性调宁蛋白( CNN1),增加VSMC的迁移和增殖,导致新生内膜的形成[7]。
血管内皮功能障碍是血管损伤的早期症状,炎症对血管内皮功能障碍具有重要影响。Rom等[8]发现,在原代人脑微血管内皮细胞中,let-7和miR-98被预测为炎症分子CCL2 和CCL5的靶标。体内外的let-7和miR-98的过表达减少小鼠脑血管的白细胞黏附和跨内皮迁移,降低促炎细胞因子表达,增加血脑屏障的气密性和减轻炎症反应条件下血脑屏障的“泄漏”。炎症反应也是导致心脏损伤的重要机制之一,心脏损伤致使MicroRNA表达出现动态变化。在缺血性损伤后,心肌miR-150表达下调,而miR-150基因缺失则引起小鼠心肌缺血后的心脏结构和功能重塑异常。在缺血性损伤时,miR-150的心肌保护作用归因于它们直接抑制促凋亡基因EGR2和P2X7R的表达。因此,miR-150可以作为心脏损伤时心肌细胞存活的重要调节者[9]。以MicroRNA为切入点,研究其调控机制,进而找到治疗疾病的新靶点成为当前研究热点。
血管损伤后修复是维持血管内皮完整性和预防血管疾病发展的关键。研究显示,在体外实验中,吞饮内皮细胞微粒促进内皮修复的两个关键步骤是:内皮细胞的迁移和增殖,加速小鼠体内再内皮化。而miR-126是内皮细胞微粒中主要的miRNA,内皮微粒将有功能的miR-126运输到受体细胞来促进血管内皮修复。在模拟糖尿病的条件下,葡萄糖处理的内皮细胞中,miR-126含量明显降低,导致内皮修复能力降低[10]。此外,miR-126介导的剪切力应激对小鼠颈动脉内膜病变具有抑制作用。miR-126通过抑制内膜病变以及修复血管损伤两方面作用维持内皮完整性,进而预防血管疾病。另有研究报道,miR-92a是缺血后内皮细胞增殖和血管生成的重要调节者,miR-92a前体的过表达可以减少内皮细胞的整合素α5、SIRT1和eNOS表达。并且,miR-92a的表达上升会致使内皮细胞的迁移和增殖受损,而降低miR-92a的表达可以提高再内皮化和防止内膜增厚[11]。Wang等[12]研究发现,miR-195在VSMC中表达丰富,氧化LDL的刺激能够改变VSMC内miR-195的表达。细胞实验证明,miR-195降低VSMC的增殖、迁移和促炎细胞因子IL-1β、IL-6和IL-8的合成。利用生物信息学预测和实验研究表明,miR-195抑制Cdc42、CCND1和FGF1基因的表达。大鼠模型中,miR-195基因导入则大幅度减少球囊损伤的颈动脉新生内膜的形成。该研究表明miR-195能调节细胞的增殖和表型转化,进而调控血管损伤修复。血管内皮祖细胞( EPCs)具有修复血管内皮的能力,维护血管内皮的完整性。研究发现,在动脉粥样硬化患者的EPCs中,miR-221表达明显高于正常对照组,而过表达miR-221能明显降低EPCs的增殖。蛋白激酶( PAK1)是miR-221的一个抑制靶点,并进一步经过c-Raf/MEK/ERK途径抑制EPCs的增殖,显现出miR-221在动脉粥样硬化内皮修复中的重要地位[13]。
3 MicroRNA与血管重塑的关系
血管重塑是众多血管疾病的共同病理性基础,是一个细胞增殖、坏死、迁移、细胞外基质合成和降解所致的动态性血管构型变化的综合过程,与氧化应激、炎症、细胞增殖和凋亡密切相关。
对Dahl盐敏感高血压大鼠模型进行芯片测定发现,高盐饮食诱导miR-320表达增加,而miR-26b和miR-21表达降低。计算机分析发现胰岛素生长因子1受体( IGF1R)是miR-320的靶点,PTEN则是miR-26b和miR-21的靶标。高盐饮食诱导胸主动脉的IGF1R的表达降低,PTEN的表达上升。这一过程可被β1肾上腺素受体选择性阻滞剂和β3活化剂的奈比洛尔所逆转。miR-320的过表达以及miR-26b和miR-21的抑制可逆转或延缓奈比洛尔的影响,表明miR-320、miR-26b和miR-21参与高盐诱导的高血压、氧化应激和血管重塑的调控[14]。在高血压诱导的心脏重塑方面,高盐饮食可以导致左室肥厚和纤维化,降低miR-27a、miR-29a和miR-133a的表达。奈必洛尔不仅具有减轻左心室功能恶化、心肌纤维化和重塑的作用,也可以防止高盐诱导的miR-27a和miR-29a的降低。miR-27a、miR-29a和miR-133a在体外抑制心肌细胞肥大,减少胶原蛋白的表达。miR-27a和-29a的靶点SP1以及miR-133a的靶点Cdc42的药理性抑制可以减弱心肌纤维化和肥大[15]。在高血压大鼠和人类中,MicroRNA-132/-212参与血管紧张素Ⅱ的高血压调控。进一步的研究显示,miR-155、miR-146a/b、miR-132/122和miR-483-3p等miRNA在肾素-血管紧张素-醛固酮系统( RAAS)信号介导的炎症和血管重塑中发挥一定的作用[16]。在肺动脉高压介导的血管重塑中,缺氧是一个主要的病因。缺氧不仅可以增加miR-322的表达,同时也能增加miR-130 及miR-190的表达。其中,缺氧诱导的miR-130的表达能进一步抑制CDKN1A/ p21Cip1的表达。因此,miR-130增强缺氧诱导的VSMC增殖,参与肺动脉高压中右心室肥大和血管重塑的进程[17]。另外,miR-21、miR-27a、miR-17-92簇、miR-12、miR-138、miR-143/145簇、miR-150、miR-190、miR-204、miR-206、miR-210、miR-328、miR-424/503簇等MicroRNA在肺动脉高压介导的血管重塑中也起到重要作用。血管平滑肌细胞增殖和迁移、异常表型转换是动脉粥样硬化和血管成形术后再狭窄等血管疾病的标志。研究发现,miR-17-5p、miR-21、miR-126、miR-221、miR-222和miR-296在静息下的内皮细胞中高表达。当炎症刺激内皮细胞后,miR-221、miR-222以及miR-296表达下降。进一步研究发现,只有miR-222参与炎症介导的血管重塑[18]。在动脉粥样硬化患者血清中,miR-135b-5p和miR-499a-3p表达是有选择性的。它们的直接靶基因MEF2C在调节心血管系统的细胞表型中起重要作用。miR-135b-5p和miR-499a-3p通过抑制MEF2C表达促进VSMC的增殖和迁移[19]。不同的MicroRNA通过不同的信号通路调节VSMC的增殖、内膜增生和血管重塑,如: miR-132通过抑制LRRFIP1,miR-663通过促进JunB /肌球蛋白轻链9的表达,miR-21过表达抑制c-Ski蛋白的表达,miR-130a抑制GAX表达等。其他因素,如牵拉对VSMC增殖和凋亡也有重要影响,miR-21表达受到牵拉调节,且通过调控PDCD4,参与牵拉诱导的人主动脉平滑肌细胞增殖和凋亡。提高牵拉率增加人主动脉平滑肌细胞miR-21的表达,但适度牵拉则使miR-21的表达下降[20]。越来越多的研究表明,MicroRNA通过多途径、多靶点调控血管重塑,体现出MicroRNA在血管重塑及相关性疾病中的重要作用。
4 MicroRNA与血管老化的关系
血管老化是血管结构和功能的退行性变化。内皮细胞衰老是它的主要病理特征之一。因此,内皮细胞是血管老化研究的重点领域。Hackl等[21]发现,在血管内皮细胞、CD8 ( + ) T细胞、肾小管上皮细胞、皮肤成纤维细胞4个细胞体系中,miR-17、miR-19b、miR-20a、miR-106a是伴随衰老而表达降低的。这些miRNA的表达降低是与某些衰老靶基因转录水平增加,特别是与p21/CDKN1A的增加密切相关。因此,miRNA可以作为人类细胞衰老的新标志物。为了进一步确定血管细胞衰老的新标志物,Olivieri等[22]也对多种人原代血管内皮细胞进行了芯片分析,发现miR-146a、miR-9、miR-204和miR-367在过氧化氢诱导的衰老细胞中表达上升,且miR-146a在人主动脉内皮细胞和冠状动脉内皮细胞中表达最高。这些靶点集中在Toll样受体传递信号途径中,如: miR-146a的靶点TRAF6、IRAK1、CD80,miR-9的靶点CXL11、MAP2K7、PIK3R3,miR-204的靶点MAPK1和miR-367的靶点MP2K4、TRAF3、PIK3R3。因而,miR-146a可以作为血管重塑中与细胞衰老相关的促炎状态的标志物。
MicroRNA阻碍长寿基因的表达也是诱导血管衰老的方式之一。通过基因芯片筛选,Menghini等[23]发现,在多种人血管内皮细胞的衰老模型中,miR-217与长寿基因SIRT1的mRNA的3'-UTR结合位点结合,抑制其表达,诱导内皮细胞产生早衰表型,进一步调控FoxO1的表达,促进eNOS乙酰化,导致血管新生能力受损。在人类动脉粥样硬化病灶中,miR-217表达与SIRT1的表达以及FoxO1的乙酰化呈负相关。miR-34a是另一个调控SIRT1的MicroRNA。miR-34a的过表达明显增加血管内皮祖细胞的衰老,且与SIRT1的减少呈正相关,在体外降低血管内皮祖细胞的血管新生能力[24]。
炎症和氧化应激与血管衰老密切相关。临床证据表明,辅酶Q10还原形式( CoQ10H2)能够通过抗氧化和抗炎作用改善血管内皮功能。在人脐静脉血管内皮细胞( HUVEC)的衰老模型中,CoQ10H2明显减弱LPS诱导的miR-146a和IL-1受体相关激酶( IRAK-1)的调节功能,而IRAK-1是miR-146a的一个靶点。这个研究提供了一个miR-146a参与的、CoQ10H2减弱内皮细胞炎症反应,延迟衰老相关分泌型出现的分子机制[25]。另外,研究报道,过氧化氢诱导的HUVEC 中miR-200c和其家族成员表达明显上升。而miR-200c的过表达可以诱导HUVEC生长停滞,细胞凋亡和衰老。在急性下肢缺血的野生型小鼠骨骼肌中miR-200c的表达是增强的,而具有较低氧化应激水平的p66ShcA基因缺失小鼠的miR-200c表达是被遏制的[26]。此外,MicroRNA还能通过其他一些途径调控血管衰老,如: miR-146a通过对NADPH氧化酶亚基NOX4蛋白的直接抑制,降低ROS并参与细胞衰老的调控; miR-10A和miR-21通过抑制HMGA2的表达调控内皮祖细胞的衰老;对氧化应激敏感反应的miR-299-3p通过调节血管内皮细胞的胰岛素样生长因子的分泌参与衰老细胞的调控。
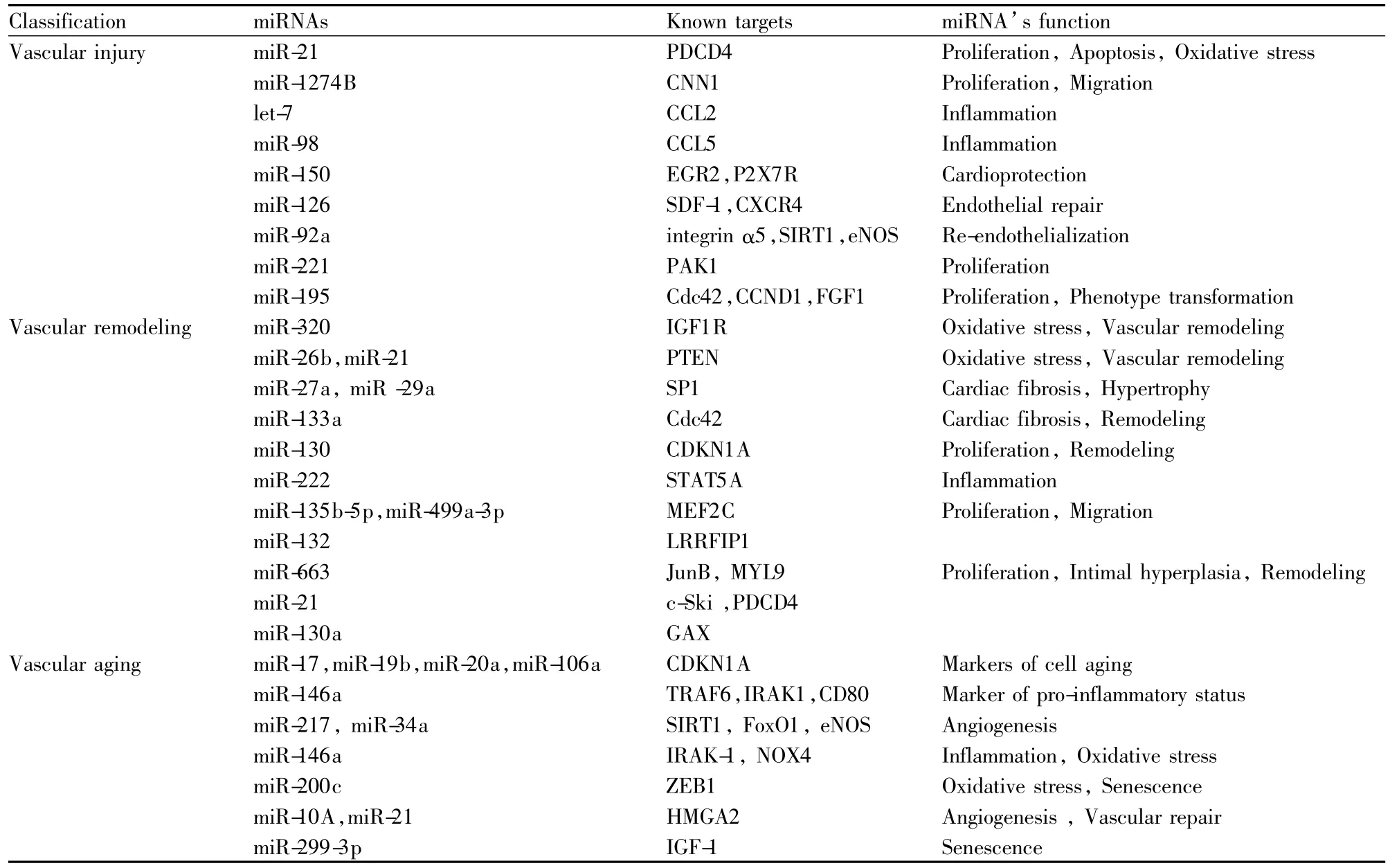
Tab 1 Roles of MicroRNA in vascular injury,remodeling and aging
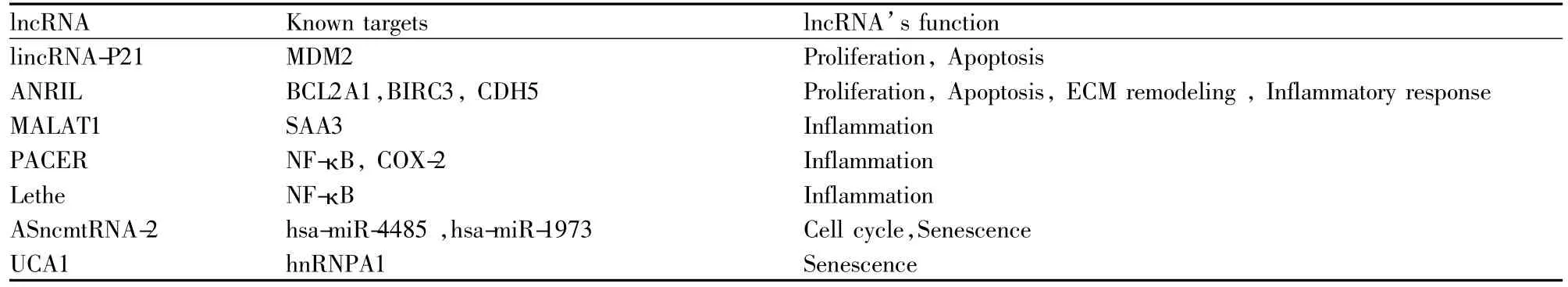
Tab 2 Roles of lncRNA in vascular injury,remodeling and aging
5 lncRNA在血管损伤、重塑和老化中的作用
在血管重塑方面,有研究报道,lincRNA-P21能够明显下调ApoE(-/-)小鼠的动脉粥样硬化斑块,抑制VSMC和小鼠单核巨噬细胞的增殖,诱导细胞凋亡。在颈动脉损伤模型中,抑制lincRNA-p21基因表达可导致内膜增生。而全基因组分析则表明,抑制lincRNA-P21基因表达会异常调节p53的靶基因。此外,lincRNA-P21通过与E3泛素蛋白连接酶MDM2结合,反馈性地增强p53的转录活性[27]。ANRIL ( CDKN2BAS)也是影响血管重塑的重要lncRNA。有研究表明[28],在协调组织重塑中,ANRIL发挥着重要作用,参与细胞增殖、凋亡、细胞外基质重塑和炎症应答基因表达的调节,最终影响心血管疾病和其他疾病的风险。ANRIL基因不仅与动脉粥样硬化、冠状动脉疾病、颅内动脉瘤、2型糖尿病相关,而且也可作为缺血性脑卒中风险的标志物。炎症也是血管重塑的诱因之一。lncRNA MALAT1可以通过激活血清淀粉样蛋白抗原A3( SAA3)调节葡萄糖诱导的炎症介质IL-6 和TNF-α的表达[29]。尽管目前尚缺乏在心血管方面的研究,但一些lncRNA参与炎症调控,显示出在心血管系统的作用能力,如lncRNA PACER通过阻断NF-κB复合物的形成,激活COX-2基因表达[30]。又如: Lethe是一个经由NF-κB通路,被促炎细胞因子或糖皮质激素受体激动剂负反馈调控的lncRNA。它的表达随生物体年龄增加而下降并增强NF-κB的活性,显示Lethe处在炎症和抗炎治疗的对接口[31]。
另一方面,在自然衰老、过氧化氢或UV处理的血管内皮细胞中,影响线粒体DNA转录的lncRNA ASncmtRNA-2表达增加。而ASncmtRNA-2表达增加与p16基因的表达图谱是相似的,提示两基因间存在共调控现象。另外,miR-4485和miR-1973在自然衰老细胞中表达上升,且与ASncmtRNA-2具有良好的同源性。ASncmtRNA-2的过表达也可促进G2/M期内皮细胞的增多。因此推测,ASncmtRNA-2可能通过产生hsa-miR-4485和hsa-miR-1973调控细胞周期处于G2/M期[32]。在增殖细胞中,异构核糖核蛋白A1( hnRNPA1)与CDKN2A结合,动摇p16INK的表达。而在衰老过程中,lncRNA UCA1隔绝hnRNPA1的作用,从而稳定p16INK表达,显示UCA1是一个与衰老相关的lncRNA[33]。也有报道称,RP11-346A9.1、OSTN-AS1-001、BX004987.5、CTD-2021J15.2、RP11-314P12.2等lncRNA在衰老纤维细胞中表达明显上升,而VCAN-AS1-001、LSAMP-AS1-001、MALAT1、XIST、RP11-394O4.4、RP11-255A11.21、MIAT等lncRNA呈下降趋势[34]。
6 展望
MicroRNA和lncRNA在血管损伤、重塑和老化中的调控机制越来越受到人们的关注。它们通过多靶点、多途径调节基因表达的各个方面,包括染色质重塑,转录、加工和转录后修饰(表1,2)。血管系统疾病主要包括动脉粥样硬化、高血压、心肌梗死、脑卒中、肺动脉高压和糖尿病血管病变等一系列常见疾病。因此,探讨MicroRNA和lncRNA与血管系统疾病的关系及临床诊断是非常重要的。但对MicroRNA和lncRNA调控机制的认识仍较肤浅,它们与其他调控机制之间的相互作用有待于继续深入的研究,这将有助于认识MicroRNA和lncRNA在维持血管复杂结构和功能中发挥重要作用。而且,对MicroRNA和lncRNA的研究主要集中在血管内皮细胞和血管平滑肌细胞。研究的范围具有一定的局限性。后期的研究应扩大至MicroRNA和lncRNA在血管的其他细胞成分,如成纤维细胞和巨噬细胞中的作用。除MicroRNA和lncRNA以外,其他非编码RNAs,如rasiRNAs和piRNAs,也可能参与血管相关疾病的发展。因此需要进一步阐明非编码RNA调控机制的普遍性、广泛性,推动以MicroRNA和lncRNA为靶点的血管系统疾病的基因诊断与治疗有重要意义。
参考文献:
[1]Wilczynska A,Bushell M.The complexity of miRNA-mediated repression[J].Cell Death Differ,2015,22( 1) : 22-33.
[2]樊波,徐昌水,梁尚栋.长非编码RNA与人类疾病调控机制的研究进展[J].中国药理学通报,2013,29( 12) : 1629-33.
[2]Fan B,Xu C S,Liang S D.Research development of long noncoding RNA related to the regulation mechanisms of human diseases [J].Chin Pharmacol Bull,2013,29( 12) : 1629-33.
[3]Filipowicz W,Bhattacharyya S N,Sonenberg N.Mechanisms of post-transcriptional regulation by MicroRNAs: are the answers in sight[J].Nat Rev Genet,2008,9( 2) : 102-14.
[4]Batista P J,Chang H Y.Long non-coding RNAs: cellular address codes in development and disease[J].Cell,2013,152( 6) : 1298 -307.
[5]Ji R,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J].Circ Res,2007,100 ( 11) : 1579-88.
[6]Lin Y,Liu X,Cheng Y,et al.Involvement of MicroRNAs in hydrogen peroxide-mediated gene regulation and cellular injury response in vascular smooth muscle cells[J].J Biol Chem,2009,284( 12) : 7903-13.
[7]Zeng L F,Li Y,Yang J Y,et al.XBP 1-deficiency abrogates neointimal lesion of injured vessels via cross talk with the PDGF signaling[J].Arterioscler Thromb Vasc Biol,2015,35( 10) : 2134-44.
[8]Rom S,Dykstra H,Zuluaga-Ramirez V,et al.miR-98 and let-7g * protect the blood-brain barrier under neuroinflammatory conditions[J].Cereb Blood Flow Metab,2015,35( 12) : 1957-65.
[9]Tang Y P,Wang Y C,Park K M,et al.MicroRNA-150 protects the mouse heart from ischaemic injury by regulating cell death[J].Cardiovasc Res,2015,106( 3) : 387-97.
[10]Jansen F,Yang X Y,Hoelscher M,et al.Endothelial microparticle-mediated transfer of MicroRNA-126 promotes vascular endothelial cell repair via SPRED1 and is abrogated in glucose-damaged endothelial microparticles[J].Circulation,2013,128( 18) : 2026 -38.
[11]Daniel J M,Penzkofer D,Teske R,et al.Inhibition of miR-92a improves re-endothelialization and prevents neointima formation following vascular injury[J].Cardiovasc Res,2014,103( 4) : 564-72.
[12]Wang Y S,Wang H Y,Liao Y C,et al.MicroRNA-195 regulates vascular smooth muscle cell phenotype and prevents neointimal formation[J].Cardiovasc Res,2012,95( 4) : 517-26.
[13]Zhang X P,Mao H A,Chen J Y,et al.Increased expression of MicroRNA-221 inhibits PAK1 in endothelial progenitor cells and impairs its function via c-Raf/MEK/ERK pathway[J].BiochemBiophys Res Commun,2013,431( 3) : 404-8.
[14]Ling S K,Nanhwan M,Qian J,et al.Modulation of microRNAs in hypertension-induced arterial remodeling through the β1 and β3-adrenoreceptor pathways[J].J Mol Cell Cardiol,2013,65: 127-36.
[15]Ye H,Ling S,Castillo A C,et al.Nebivolol induces distinct changes in profibrosis MicroRNA expression compared with atenolol in salt-sensitive hypertensive rats[J].Hypertension,2013,61( 5) : 1008-13.
[16]Pacurari M,Tchounwou P B.Role of microRNAs in renin-angiotensin-aldosterone system-mediated cardiovascular inflammation and remodeling[J].Int J Inflam,2015,2015: 101527.
[17]Brock M,Haider T J,Vogel J,et al.The hypoxia-induced MicroRNA-130a controls pulmonary smooth muscle cell proliferation by directly targeting CDKN1A[J].Int J Biochem Cell Biol,2015,61: 129-37.
[18]Dentelli P,Rosso A,Orso F,et al.MicroRNA-222 controls neovascularization by regulating signal transducer and activator of transcription 5A expression[J].Arterioscler Thromb Vasc Biol,2010,30 ( 8) : 1562-8.
[19]Xu Z,Han Y,Liu J,et al.MiR-135b-5p and MiR-499a-3p promote cell proliferation and migration in atherosclerosis by directly targeting MEF2C[J].Sci Rep,2015,5: 12276.
[20]Song Jt,Hu B,Qu Hy,et al.Mechanical stretch modulates MicroRNA 21 expression,participating in proliferation and apoptosis in cultured human aortic smooth muscle cells[J].PLoS One,2012,7( 10) : e47657.
[21]Hackl M,Brunner S,Fortschegger K,et al.miR-17,miR-19b,miR-20a,and miR-106a are down-regulated in human aging[J].Aging Cell,2010,9( 2) : 291-6.
[22]Olivieri F,Lazzarini R,Recchioni R,et al.MiR-146a as marker of senescence-associated pro-inflammatory status in cells involved in vascular remodeling[J].Age( Dordr),2013,35( 4) : 1157-72.
[23]Menghini R,Casagrande V,Cardellini M,et al.MicroRNA 217 modulates endothelial cell senescence via silent information regulator 1[J].Circulation,2009,120( 15) : 1524-32.
[24]Tabuchi T,Satoh M,Itoh T,Nakamura M.MicroRNA-34a regulates the longevity-associated protein SIRT1 in coronary artery disease: effect of statins on SIRT1 and MicroRNA-34a expression [J].Clin Sci( Lond),2012,123( 3) : 161-71.
[25]Olivieri F,Lazzarini R,Babini L,et al.Anti-inflammatory effect of ubiquinol-10 on young and senescent endothelial cells via miR-146a modulation[J].Free Radic Biol Med,2013,63: 410-20.
[26]Magenta A,Cencioni C,Fasanaro P,et al.miR-200c is upregulated by oxidative stress and induces endothelial cell apoptosis and senescence via ZEB1 inhibition[J].Cell Death Differ,2011,18 ( 10) : 1628-39.
[27]Wu G,Cai J,Han Y,et al.LincRNA-p21 regulates neointima formation,vascular smooth muscle cell proliferation,apoptosis,and atherosclerosis by enhancing p53 activity[J].Circulation,2014,130( 17) : 1452-65.
[28]Congrains A,Kamide K,Katsuya T,et al.CVD-associated noncoding RNA,ANRIL,modulates expression of atherogenic pathways in VSMC[J].Biochem Biophys Res Commun,2012,419( 4) : 612-6.
[29]Puthanveetil P,Chen S,Feng B,et al.Long non-coding RNA MALAT1 regulates hyperglycaemia induced inflammatory process in the endothelial cells[J].J Cell Mol Med,2015,19( 6) : 1418-25.
[30]Krawczyk M,Emerson B M.p50-associated COX-2 extragenic RNA ( PACER) activates COX-2 gene expression by occluding repressive NF-κB complexes[J].Elife,2014,3: e01776.
[31]Rapicavoli N A,Qu K,Zhang J,et al.A mammalian pseudogene lncRNA at the interface of inflammation and anti-inflammatory therapeutics[J].Elife,2013,2: e00762.
[32]Bianchessi V,Badi I,Bertolotti M,et al.The mitochondrial lncRNA ASncmtRNA-2 is induced in aging and replicative senescence in Endothelial Cells[J].J Mol Cell Cardiol,2015,81: 62-70.
[33]Kumar P P,Emechebe U,Smith R,et al.Coordinated control of senescence by lncRNA and a novel T-box3 co-repressor complex [J].Elife,2014,3.
[34]Abdelmohsen K,Panda A,Kang M J,et al.Senescence-associated lncRNAs: senescence-associated long noncoding RNAs[J].Aging Cell,2013,12: 890-900.
Role of noncoding RNA in vascular injury,remodeling and aging
MA Jing,LING Shuang,DANG Yan-qi,NI Rong-zhen,GUO Hui-ning,LI Yu-feng,WANG Shu-rong,XU Jin-wen
( Murad Research Institute for Modernized Chinese Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract:Non-coding RNAs ( ncRNA),including ribosomal RNA( rRNA),transfer RNA( tRNA),MicroRNA( miRNA),long noncoding RNA( lncRNA) and small nucleolar RNA( snoRNA),are a class of RNA that have multiple functions and are not translated to proteins.MicroRNA and lncRNA are involved in the injury,remodeling and aging of blood vessels,and it is necessary to understand the regulatory roles of MicroRNA and lncRNA in these processes.It is reported that MicroRNA and lncRNA are not only participated in the regulation of oxidative response,inflammation,cell proliferation and migration,and phenotype transition,they are also involved in the regulation of gene expression by conducting different mechanisms,including transcriptional regulation,post-transcriptional modification and chromatin remodeling.These aspects of regulation by MicroRNA and lncRNA are related to cardiovascular diseases,such as atherosclerosis,hypertension,myocardial infarction,stroke,pulmonary hypertension and diabetes,and thus provide a new way for genetic diagnosis and therapy of cardiovascular diseases.
Key words:MicroRNA; lncRNA ; vascular injury; vascular remodeling; vascular aging; diseases of vascular system
作者简介:马婧( 1989-),女,硕士生,研究方向:心血管中药药理学,E-mail: flyjing1207@163.com;
基金项目:国家自然科学基金资助项目( No 81274130) ;上海市教委085项目高等教育内涵建设基金( No 085ZY1202)
收稿日期:2015-10-14,修回日期: 2015-12-09
文献标志码:A
文章编号:1001-1978( 2016) 01-0014-05
doi:10.3969/j.issn.1001-1978.2016.01.004