中药抗肿瘤血管生成的信号通路研究*
2016-03-20唐德才郭秀霞
张 硕,唐德才,郭秀霞,尹 刚
(南京中医药大学基础医学院 江苏省中医药防治肿瘤协同创新中心 南京 210023)
中药抗肿瘤血管生成的信号通路研究*
张 硕,唐德才**,郭秀霞,尹 刚
(南京中医药大学基础医学院 江苏省中医药防治肿瘤协同创新中心 南京 210023)
血管生成是肿瘤发生和转移的基本条件。调控肿瘤血管生成相关的信号通路包括PI3K/Akt/ mTOR、Ras/Raf/MEK/ERK、Notch转导通路等。中药抗肿瘤血管生成的信号通路研究越来越受关注。调控PI3K/Akt/mTOR通路的中药多集中于抑制Akt的磷酸化,且清热药居多。调控Ras/Raf/MEK/ERK通路的中药多集中于抑制ERK的磷酸化,且活血化瘀药居多。调控Notch转导通路的中药多集中于抑制Notch1的表达,对配体的表达不一。对中药抗肿瘤血管生成的信号通路进行综述,旨在寻求新的血管生成抑制剂,阐明作用靶点,为肿瘤研究提供方向。
肿瘤 血管生成 信号通路 中药
血管生成是在各种生长因子的参与下发生内皮细胞增殖、迁移、排列和管腔形成的过程[1],它是肿瘤发生和转移的基本条件之一。抗血管生成治疗与传统的以肿瘤细胞为靶点相比,无细胞毒性,血管内皮细胞基因组稳定,不易产生耐药性,不受肿瘤间质压力高的影响[2,3]。因此,本文对肿瘤血管生成相关的信号通路及中药作用进行综述,旨在寻求新的血管生成抑制剂,阐明作用靶点,为肿瘤研究提供方向。
1 中医络脉与肿瘤新生血管的相似性
《素问·脉要精微论》云:“夫脉者,血之府也”。可见,中医络脉与西医肿瘤新生血管存在一定的相似性。在结构上,内外病邪侵袭络脉会表现为络体迂曲、扩张,络脉分布异常等,而肿瘤新生血管多为不成熟血管,表现为血管膨胀、迂曲且分布不均,血管内皮细胞排列无序,周细胞连接松散,基底膜厚薄不均[4,5]。在功能上,络脉能够运行血液、渗灌濡养[6]。肿瘤新生血管也能够为瘤体提供氧气、营养物质,清除代谢废物。在病机上,络道亢变是指诸邪侵犯,正邪相争,导致络脉微环境稳态破坏,脉道增生无制,亢变为害[7]。肿瘤血管生成亦是由于血管开关之间的平衡被打破,导致血管生成促进因子增多,血管生成抑制因子相对减少,故表现为血管生成亢进。
络病理论在肿瘤发生、治疗方面的研究日益成熟,为中药抗肿瘤血管生成提供理论依据。肿瘤的发生不外乎机体正气亏虚,血瘀、热毒、痰饮、气滞等邪阻络脉,络脉损伤,痹阻不通,日积成瘤[8,9]。故肿瘤从络病论治应该以通络为大法,同时辨清虚实。偏实者以祛邪通络为主,或祛瘀通络、或清热通络、或化痰通络、或理气通络;偏虚者以补虚通络为主,或益气通络、或补阳通络、或养血通络、或滋阴通络。此外,灵活配伍虫类药,如:全蝎、蜈蚣、斑蝥、水蛭等,其攻逐走窜之性,共奏破积消癥、解毒散结之功[10,11]。
2 调控肿瘤血管生成的信号转导通路
2.1 肿瘤血管生成与PI3K/Akt/mTOR通路
磷脂酰肌醇3激酶(Phosphatidylinositol 3-Kinase,PI3K)信号通路是调控肿瘤血管生成的重要通路。当表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)、血管内皮生长因子受体(Vascular Endothelial Growth Factor Receptor,VEGFR)等受到相应配体刺激后,激活PI3K,促使磷脂酰肌醇二磷酸酯(Phosphtidyli-Nositol(4,5)-Bisphosphate,PIP2)磷酸化为磷脂酰肌醇三磷酸酯(PIP3)。PIP3激活下游的丝氨酸/苏氨酸激酶AKT,活化的AKT磷酸化真核细胞生长的中央控制器,即哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR),通过调控相关基因的转录促进细胞增殖、存活和血管生成[12,13]。
PI3K/AKT/mTOR通路促进肿瘤血管生成的具体机制如下:其一,磷酸酶和张力蛋白同源物(Phosphatase and Tensin Homolog,PTEN)基因编码一种磷酸酶拮抗PI3K的作用,故PTEN的缺失引起PI3K的活化,从而导致缺氧诱导因子1α(Hypoxia Inducible Factor-1α,HIF-1α)稳定介导的血管内皮生长因子(VEGF)表达增加[14];其二,通过调节内皮细胞中一氧化氮(Nitric Oxide,NO)的含量参与血管生成。一氧化氮合酶(NOS)是NO合成的催化酶,Akt通过诱导NOS上1177位丝氨酸残基磷酸化激活NOS,增加NO合成,提高血管通透性,诱导内皮细胞迁移,从而促进肿瘤血管生成[15];其三,热休克蛋白90(Heat Shock Protein,Hsp90)是一组高度保守的分子伴侣,能够结合Akt、HIF-1α等蛋白,同时活化PI3K信号通路,促进肿瘤生长、转移和血管生成[16,17]。
2.2 肿瘤血管生成与Ras/Raf/MEK/ERK通路
Ras/Raf/MEK/ERK信号通路也与肿瘤血管生成密切相关,当G蛋白耦联型受体(G Protein-Coupled Receptor,GPCR)与不同的配体如激素、氨基酸等结合后,三磷酸鸟苷(Guanosine Triphosphate,GTP)大量增加,细胞浆中的Ras-GDP被募集到细胞膜上,转化成有活性的Ras-GTP,Ras再依次激活丝氨酸/苏氨酸蛋白激酶(Raf)、丝裂原细胞外激酶(Mitogen Extracellular Kinase,MEK)、胞外信号调控激酶(ERK)。活化的ERK从Ras/Raf/MEK/ERK复合体中被分离出来,进入细胞核后通过磷酸化作用激活转录因子,诱导基质降解,促进肿瘤生长、转移和血管生成[18]。
Ras/Raf/MEK/ERK信号通路参与肿瘤血管内皮细胞定向迁移,一方面调节细胞突触,促进细胞黏附,另一方面通过钙蛋白酶促进黏附解聚[19,20]。转录因子FOXO参与胚胎期和成年期血管系统的正常运行,ERK能够磷酸化FOXO中的丝氨酸残基,直接调节FOXO的转录活性[21]。Shankar S等[22]研究表明MEK/ERK信号通路通过调控转录因子FOXO促进人脐静脉血管内皮细胞(HUVEC)增殖和迁移,从而促进肿瘤血管生成。MEK/ERK促进肿瘤血管生成的机制还与下调Rho蛋白,上调HIF-1α蛋白的表达,促进内皮细胞的存活和发芽有关[23,24]。
2.3 肿瘤血管生成与Notch转导通路
肿瘤血管生成过程中血管内皮细胞的激活离不开Notch信号通路。在哺乳动物中发现5种Notch配体,即Dll1、Dll3、Dll4、Jagged-1和Jagged-2。Notch受体家族包括Notch1、Notch2、Notch3、Notch4,由胞外域和跨膜区/胞内域组成。当Notch配体与受体结合后触发Notch信号的活化,Notch受体相继发生2次蛋白水解。首先由去整合素-金属蛋白酶(ADAM)在胞外酶解Notch受体,释放胞外域;其次是γ-分泌酶复合体在跨膜区切割并释放Notch受体胞内域[25]。胞内域从膜表面转移至细胞核,与核内DNA结合蛋白CSL结合并使之活化,从而调节下游靶基因的表达[26]。
根据配体的不同,Notch通路促进肿瘤血管生成的作用机制也不同。如阻断Dll/Notch通路以肿瘤血管功能失调为特征抑制肿瘤生长,阻断Jag/Notch通路能够破坏周细胞之间的连接,从而减少肿瘤血管生成和灌注[27,28]。Notch信号通路对肿瘤血管生成亦存在拮抗作用。血管内皮细胞分2种细胞表型:顶端细胞位于血管最前端,感应微环境并引导细胞迁移;柄细胞的主要作用是调控内皮细胞增殖以及管腔形成[29,30]。在柄细胞中Notch协同激活素受体样激酶1(Activin Receptor-Like Kinase1,ALK1)诱导转录抑制因子HEY1和HEY2的表达,从而抑制顶端细胞形成以及血管发芽[31]。内皮特定分子Sox17干扰内皮联接点的稳定,重组细胞骨架结构,从而促进内皮细胞迁移。研究表明Notch信号通路能够通过下调Sox17的表达抑制血管生成[32]。
3 中药抗肿瘤血管生成的信号通路研究
3.1 调控PI3K/Akt/mTOR通路的中药
清热药夏枯草的活性成分熊果酸能够抑制VEGF、碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,bFGF)的表达以及Akt和mTOR下游效应分子p70S6K的活性,从而发挥抗结肠癌生长和血管生成效应[33]。汉黄芩素是从清热药黄芩中提取的黄酮类化合物,Zhou M等[34]研究发现汉黄芩素通过抑制Akt的磷酸化,下调VEGF和核转录因子kappa B(NF-κB)的水平抑制血管生成。清热药青黛及其活性成分色胺酮被认为是一种新型的血管生成抑制剂,能够抑制PI3K/Akt中Akt的磷酸化,从而抑制HUVEC增殖、迁移和管腔形成[35]。清热药白花蛇舌草通过抑制PI3K、Akt、p-Akt的表达抑制肝癌血管生成[36]。Yang Y等[37]证实了逐水药狼毒的根部提取物12-去氧佛波醇-13-棕榈酸酯可能成为治疗乳腺癌的候选药物,其机制与显著地抑制PI3K、Akt和mTOR的磷酸化,以及减少VEGF、HIF-1α的蛋白水平有关。息风止痉药全蝎的化学成分蝎毒多肽也能够抑制PI3K、p-Akt、VEGF、HIF-1α的表达,从而抑制H22型肝癌的血管生成[38]。温里药胡椒的主要成分胡椒碱抑制Akt中Ser473和Thr308残基的磷酸化,该分子是内皮细胞功能和血管生成的重要调节者,从而抑制体外HUVEC增殖和管腔形成,同时抑制体内乳腺癌细胞诱导的血管生成[39]。理气药陈皮的活性成分川陈皮素抗卵巢癌血管生成的机制,与抑制卵巢癌细胞中Akt信号通路以及血管生成相关因子HIF-1α、NF-κB、VEGF的表达有关[40]。详见图1。
3.2 调控Ras/Raf/MEK/ERK通路的中药
活血化瘀药红花的主要水溶性成分羟基红花黄色素A通过抑制ERK和NF-κB的活性以及核转运,从而抗肝癌血管生成[41]。活血化瘀药斑蝥中的去甲斑蝥素不仅能够升高白细胞,而且是肿瘤血管生成重要的抑制剂,Zhang L等[42]研究发现它通过抑制MEK/ERK通路激酶的磷酸化,抑制体外毛细血管管腔形成以及体内结肠癌血管生成。川芎嗪是从活血化瘀药川芎中分离出的一种生物碱,它既能通过PI3K/Akt/mTOR通路调节真核起始因子4E(eIF4E)的活性,又能抑制MEK/ERK通路,从而抑制前列腺癌细胞的生长[43]。二甲马钱子碱是从活血化瘀药马钱子中提取的生物碱,其抗肿瘤血管生成机制为抑制VEGFR2下游蛋白激酶,包括ERK、Akt、mTOR,进一步下调VEGF、NO、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)的表达[44]。Lai L等[45]研究发现祛风湿药百花丹的提取物百花丹素呈剂量依赖方式抑制VEGFR2诱导的MEK和ERK的磷酸化,即通过阻断Ras/Raf/MEK/ERK通路抑制大肠癌血管生成和瘤体生长。补气药人参的活性成分人参皂苷Rg3抑制Lewis肺癌血管生成,其机制与抑制ERK、p-ERK蛋白的表达有关[46]。补阳药补骨脂抑制哺乳动物细胞增殖的机制与下调EGFR,抑制MEK/ERK通路中MEK的磷酸化有关[47]。滋阴补肾方六味地黄丸通过减少VEGF、ERK和下游效应分子细胞周期蛋白(Cyclin D1)的表达促进肿瘤细胞分化、抑制血管生成,从而抑制乳腺癌生长[48]。详见图2。
3.3 调控Notch转导通路的中药
β-榄香烯是从活血化瘀中药温莪术中提取分离得到的化合物,具有抗肿瘤活性。研究表明CD44+胃癌干细胞其微血管密度和致瘤性比CD44-更显著,且β-榄香烯通过干扰Notch1抑制CD44+胃癌干细胞生长和血管生成[49]。活血化瘀药蒲葵子抑制Notch通路中配体Dll4和Jagged-1的表达,从而发挥抗肝癌血管生成活性[50]。清热药冬凌草的抗癌活性成分冬凌草素既能抑制Jagged-2和Notch1的活性,又能下调两者的表达,从而抑制体内外血管生成[51]。在临床拔毒化腐生肌药砒石的主要成分三氧化二砷(As2O3)用来治疗急性早幼粒细胞白血病和某些实体瘤。研究发现As2O3能够显著地抑制体内和体外VEGF、VEGFR2、HIF-1α、Dll4和Notch1的表达,通过抑制肺癌血管生成发挥抗癌活性[52]。此外,以半夏、天南星为君药的复方消痰散结汤也能够通过抑制Notch1的表达抑制胃癌血管生成[53]。
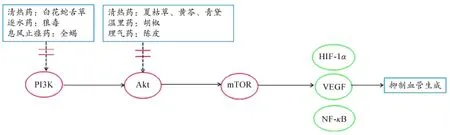
图1 调控PI3K/Akt/mTOR通路的中药

图2 调控Ras/Raf/MEK/ERK通路的中药
4 结语
中药抗肿瘤血管生成的信号通路研究已经越来越受国内外的关注,但目前仍然存在3方面问题:①调控肿瘤血管生成的信号转导通路可以看作是细胞外的刺激因子、细胞膜上的相应受体、细胞质内的调节蛋白、细胞核内的转录因子相互作用的网络系统,不能局限于从单一的信号通路揭示中医药抗肿瘤血管生成机理[54];②单味中药抗肿瘤血管生成效应的研究较多,又多集中在中药活性成分的研究上,缺乏在中医理论指导下的复方配伍研究。此外,“中药不传之秘在于量”,对于肿瘤这样的顽疾,一般的剂量或许达不到抗血管生成的有效浓度;③临床上尚未发现评估抗血管生成疗效的公认指标,仅仅对肿瘤组织进行微血管密度的计数是远远不够的。针对以上问题,我们应该注重网络生物学、复合药理学等多门学科的交叉贯通,加强合适的剂量剂型研究,寻求血管功能评价新技术,建立抗肿瘤血管生成疗效评价标准体系[55]。
1 Carmeliet P. Angiogenesis in health and disease. Nat Med, 2003, 9(6): 653-660.
2 Bergers G, Benjamin L E. Tumorigenesis and the angiogenic switch. Nat Rev Cancer, 2003, 3(6): 401-410.
3 王琪,李嘉姝,程莉莉,等.抗血管生成与肿瘤治疗.检验医学与临床,2012,9(1):56-58.
4 侯超,胡志希.基于血管生成的中医药抗肿瘤实验研究的思考.湖南中医杂志,2014,30(2):133-135.
5 Goel S, Duda D G, Xu L, et al. Normalization of the vasculature for treatment of cancer and other diseases. Physiol Rev, 2011, 91(3): 1071-1121.
6 刘红利,孙颖,魏聪,等.从脉络学说血脉关系探讨动脉粥样硬化形成机制.时珍国医国药,2015,26(7):1694-1696.
7 奚胜艳,高学敏,张建军,等.从中医络病与病络理论认识肿瘤血管生成.北京中医药大学学报,2008,31(12):804-807.
8 王少墨,王庆其.络脉理论与肿瘤临床运用刍议.浙江中医杂志,2012,47(3):157-159.
9 刘永蕙,常靖,郑清莲,等.从络病理论论治肿瘤.现代中西医结合杂志,2010,19(24):3098-3099.
10 戚淑娟,贾建伟.浅谈络病理论与恶性肿瘤.广州中医药大学学报,2013,30(4):586-587.
11 谭兆峰,齐元富,李秀荣.虫类药物在肿瘤疾病中的应用.中医学报,2015,30(6):782-784.
12 Hsieh A C, Liu Y, Edlind M P, et al. The translational landscape of mTOR signalling steers cancer initiation and metastasis. Nature, 2012, 485(7396): 55-61.
13 Keck S, Glencer A C, Rugo H S. Everolimus and its role in hormoneresistant and trastuzumab-resistant metastatic breast cancer. Future Oncol, 2012, 8(11):1383-1396.
14 Zundel W, Schindler C, Haas-Kogan D, et al. Loss of PTEN facilitates HIF-1-mediated gene expression. Genes Dev, 2000, 14(4):391-396.
15 Dimmeler S, Fleming I, Fisslthaler B, et al. Activation of nitric oxide synthase in endothelial cells by Akt-dependent phosphorylation. Nature, 1999, 399(6736): 601-605.
16 孟帅,山广志,李卓荣. Hsp90抑制剂的研究进展.中国抗生素杂志,2011,36(4):241-248.
17 Chen J X, Lawrence M L, Cunningham G, et al. HSP90 and Akt modulate Ang-1-induced angiogenesis via NO in coronary artery endothelium. J Appl Physiol, 1985, 96(2):612-620.
18 Dhillon A S, Meikle S, Yazici Z, et al. Regulation of Raf-1 activation and signaling by dephosphosphorylation. EMBO J, 2002, 21(20):64-71.
19 肖高春,童仕伦,郑勇斌,等. PI3K/AKT及MEK/ERK信号通路在肿瘤血管内皮细胞迁移中的作用.重庆医学,2015,44(11):1452-1456.
20 王彦敏.血管生成因子VEGF研究进展.河北医药, 2010, 32(11): 1456-1458.
21 Asada S, Daitoku H, Matsuzaki H, et al. Mitogen-activated protein kinases, Erk and p38, phosphorylate and regulate Foxo1. Cell Signal, 2007, 19(3): 519-527.
22 Shankar S, Chen Q, Srivastava R K. Inhibition of PI3K/AKT and MEK/ ERK pathways act synergistically to enhance antiangiogenic effects of EGCG through activation of FOXO transcription factor. J Mol Signal, 2008, 3(7):1-11.
23 薛妍,毕锋,刘娜,等. Rho GTPases对肿瘤血管生成相关分子的作用.中国生物化学与分子生物学报,2004,20(5):664-669.
24 Mavria G, Vercoulen Y, Yeo M, et al. ERK-MAPK signaling opposes Rho-kinase to promote endothelial cell survival and sprouting during angiogenesis. Cancer Cell, 2006, 9(1):33-44.
25 Bray S J. Notch signalling: A simple pathway becomes complex. Nat Rev Mol Cell Biol, 2006, 7(9): 678-689.
26 Kuhnert F, Kirshner J R, Thurston G. Dll4-Notch signaling as a therapeutic target in tumor angiogenesis. Vasc Cell, 2011, 3(1):1-8.
27 Ridgway J, Zhang G, Wu Y, et al. Inhibition of Dll4 signalling inhibits tumour growth by deregulating angiogenesis. Nature, 2006, 444(7122):1083-1087.
28 Kangsamaksin T, Murtomaki A, Kofler N M, et al. Notch decoys that selectively block Dll/Notch or Jagged/Notch disrupt angiogenesis by unique mechanisms to inhibit tumor growth. Cancer Discov, 2015, 5(2):182-197.
29 De Smet F, Segura I, De Bock K, et al. Mechanisms of vessel branching: Filopodia on endothelial tip cells lead the way. Arterioscl Throm Vas, 2009, 29(5):639-649.
30 Jakobsson L, Franco C A, Bentley K, et al. Endothelial cells dynamically compete for the tip cell position during angiogenic sprouting. Nat Cell Biol, 2010, 12(10):943-953.
31 Kerr G, Sheldon H, Chaikuad A, et al. A small molecule targeting ALK1 prevents Notch cooperativity and inhibits functional angiogenesis. Angiogenesis, 2015, 18(2):209-217.
32 Lee S H, Lee S, Yang H, et al. Notch pathway targets proangiogenic regulator Sox17 to restrict angiogenesis. Circ Res, 2014, 115(2):215-226.
33 Lin J, Chen Y, Wei L, et al. Ursolic acid inhibits colorectal cancer angiogenesis through suppression of multiple signaling pathways. Int J Oncol, 2013, 43(5):1666-1674.
34 Zhou M, Song X, Huang Y, et al. Wogonin inhibits H2O2-induced angiogenesis via suppressing PI3K/Akt/NF-κB signaling pathway. Vascul Pharmacol, 2014, 60(3):110-119.
35 Chang H N, Huang S T, Yeh Y C, et al. Indigo naturalis and its component tryptanthrin exert anti-angiogenic effect by arresting cell cycle and inhibiting Akt and FAK signaling in human vascular endothelial cells. J Ethnopharmacol, 2015, 174:474-481.
36 章尤权,王清泰,陈旭征,等.白花蛇舌草对人肝癌HepG2细胞裸鼠皮下移植瘤PI3K/Akt信号通路的影响.肿瘤基础与临床,2015,28(4):277-280.
37 Yang Y, Cong H, Han C, et al. 12-Deoxyphorbol 13-palmitate inhibits the expression of VEGF and HIF-1α in MCF-7 cells by blocking the PI3K/Akt/mTOR signaling pathway. Oncol Rep, 2015, 34(4):1755-1760.
38 隋文文,张维东,武利存,等.蝎毒多肽提取物抑制H22肝.癌血管生成的作用机制研究,2014,34(5):581-586.
39 Doucette C D, Hilchie A L, Liwski R, et al. Piperine, a dietary phytochemical, inhibits angiogenesis. J Nutr Biochem, 2013, 24(1):231-239.
40 Chen J, Chen A Y, Huang H, et al. The flavonoid nobiletin inhibits tumor growth and angiogenesis of ovarian cancers via the Akt pathway. Int J Oncol, 2015, 46(6):2629-2638.
41 Yang F, Li J, Zhu J, et al. Hydroxysafflor yellow A inhibits angiogenesis of hepatocellular carcinoma via blocking ERK/MAPK and NF-κB signaling pathway in H22 tumor-bearing mice. Eur J Pharmacol, 2015, 754:105-114.
42 Zhang L, Ji Q, Liu X, et al. Norcantharidin inhibits tumor angiogenesis via blocking VEGFR2/MEK/ERK signaling pathways. Cancer Sci, 2013, 104(5):604-610.
43 Han J, Song J, Li X, et al. Ligustrazine suppresses the growth of HRPC cells through the inhibition of cap-dependent translation via both the mTOR and the MEK/ERK pathways. Anticancer Agents Med Chem, 2015, 15(6):764-772.
44 Saraswati S, Agrawal S S. Brucine, an indole alkaloid from Strychnos nux-vomica attenuates VEGF-induced angiogenesis via inhibiting VEGFR2 signaling pathway in vitro and in vivo. Cancer Lett, 2013, 332(1):83-93.
45 Lai L, Liu J, Zhai D, et al. Plumbagin inhibits tumour angiogenesis and tumour growth through the Ras signalling pathway following activation of the VEGF receptor-2. Br J Pharmacol, 2012, 165(4):1084-1096.
46 许霞辉,贺兼斌,张平.人参皂苷Rg3联合苏拉明对小鼠肺癌生长影响及其机制的探讨.中华肿瘤防治杂志,2013,20(2):97-101.
47 Limper C, Wang Y, Ruhl S, et al. Compounds isolated from Psoralea corylifolia seeds inhibit protein kinase activity and induce apoptotic cell death in mammalian cells. J Pharm Pharmacol, 2013, 65(9):1393-1408.
48 Zheng L, Liu H, Gong Y, et al. Effect of Liuweidihuang pill and Jinkuishenqi pill on inhibition of spontaneous breast carcinoma growth in mice. J Tradit Chin Med, 2015, 35(4):453-459.
49 Yan B, Zhou Y, Feng S, et al. β-elemene-attenuated tumorangiogenesis by targeting Notch-1 in gastric cancer stem-like cells. Evid Based Complement Alternat Med, 2013, 2013:1-12.
50 Lin W, Zhao J, Cao Z, et al. Livistona chinensis seeds inhibit hepatocellular carcinoma angiogenesis in vivo via suppression of the Notch pathway. Oncol Rep, 2014, 31(4):1723-1728.
51 Dong Y, Zhang T, Li J, et al. Oridonin inhibits tumor growth and metastasis through anti-angiogenesis by blocking the Notch signaling. PLoS One, 2014, 9(12):e113830.
52 Yang M H, Zang Y S, Huang H, et al. Arsenic trioxide exerts anti-lung cancer activity by inhibiting angiogenesis. Curr Cancer Drug Targets, 2014, 14(6):557-566.
53 Yan B, Liu L, Zhao Y, et al. Xiaotan Sanjie decoction attenuates tumor angiogenesis by manipulating Notch-1-regulated proliferation of gastric cancer stem-like cells. World J Gastroenterol, 2014, 20(36):13105-13118.
54 周利红,李琦,唐中祥.中医药调控肿瘤信号转导的研究现状与思考.上海中医药大学学报,2008,22(6):77-80.
55 熊露,田少霞.肺癌中医抗血管生成研究的几个关键问题.中医杂志,2009,50(11):965-967.
A Research on Angiogenic Signaling Pathways of Anti-Tumor Therapies in Chinese Metaria Medica (CMM)
Zhang Shuo, Tang Decai, Guo Xiuxia, Yin Gang
(College of Basic Medical Sciences, Nanjing University of Chinese Medicine, Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine Prevention and Treatment of Tumor, Nanjing 210023, China)
Angiogenesis is an essential prerequisite in the process of tumorigenesis and metastasis. Signaling pathways, such as PI3K/AKT/mTOR, Ras/Raf/MEK/ERK and Notch transduction pathway, were involved in the regulation of tumor angiogenesis. More attention has been paid to the signaling pathways of anti-angiogenic CMM studies. Traditional Chinese medications, especially heat clearing drugs, of the regulation of PI3K/AKT/ mTOR pathways chiefly functioned by means of inhibiting the phosphorylation of p-Akt. While activating blood and dissolving stasis drugs in TCM mediated by the Ras/Raf/MEK/ERK pathway in the way of suppressing the phosphorylation of ERK. CMM of regulating the Notch transduction pathway mainly showed inhibitory effect on the expression of Notch1 with its varied expressions of its ligands. This review summarized the angiogenic signaling pathways of anti-tumor therapies in CMM, aiming to develop new angiogenesis inhibitors, expound their targets and make a foundation for tumor studies.
Tumor, angiogenesis, signaling pathways, Chinese metaria medica
10.11842/wst.2016.10.027
R285
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-05-18
修回日期:2016-05-18
* 国家自然科学基金委面上项目(81373990):黄芪、莪术配伍调控肝癌血管生成的体视学及分子机制研究,负责人:唐德才。
** 通讯作者:唐德才,教授,博士生导师,主要研究方向:中药配伍抗肿瘤的理论与实验研究。
