基于中医方证代谢组学的男仕口服液治疗肾阳虚证的物质基础与作用机理研究*
2016-03-20张爱华赵宏伟周小航邹士玉马中华王喜军
张爱华,刘 琦,赵宏伟,孙 晖,周小航,南 洋,孔 玲,关 瑜,邹士玉,马中华,王喜军**
(1. 黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040;2. 无限极(中国)有限公司 广州 510623)
基于中医方证代谢组学的男仕口服液治疗肾阳虚证的物质基础与作用机理研究*
张爱华1,刘 琦1,赵宏伟2,孙 晖1,周小航1,南 洋1,孔 玲1,关 瑜1,邹士玉2,马中华2,王喜军1**
(1. 黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040;2. 无限极(中国)有限公司 广州 510623)
目的:基于中医方证代谢组学技术分析男仕口服液干预皮质酮诱导的肾阳虚证大鼠模型内源性代谢生物标记物的变化趋势,探索男仕口服液入血成分与其治疗肾阳虚证过程的相关代谢物及代谢通路的相关性,挖掘男仕口服液发挥治疗作用的体内直接作用物质及作用机理。方法:检测大鼠“下丘脑-垂体-靶器官轴”各激素水平并观察相应靶器官的组织形态学,评价男仕口服液对肾阳虚证的作用效果;利用模式识别分析各组大鼠尿液代谢谱,研究男仕口服液对肾阳虚证生物标记物影响,同时在显效基础上分析其入血成分与肾阳虚证生物标记物群的相关性,确定其发挥治疗作用的潜在药效物质基础。结果:模型大鼠血清的CRH、CORT、T3、T4、T和尿17-OHCS含量显著下降;男仕口服液可显著提升血清中CRH、CORT、T3、T4、cAMP和尿中17-OHCS水平,调节类固醇激素的生物合成、色氨酸代谢和酪氨酸代谢;PCMS相关分析发现男仕口服液显效剂量下与代谢标记物高度相关的入血成分主要为:水晶兰苷、没食子酸、鸡矢藤苷、莫诺苷葡萄糖醛酸化产物、甜菊苷C、甜菊双糖苷,这些成分是男仕口服液治疗肾阳虚证的药效关键物质基础。结论:本研究运用中医方证代谢组学技术建立了“肾阳虚证代谢标记物-男仕口服液体内直接作用物质-药效关键物质基础”的分析模式,发现水晶兰苷、没食子酸、鸡矢藤苷等成分通过改善多个代谢途径(激素合成途径、酪氨酸代谢中激素合成与释放途径等),从整体上纠正代谢轮廓的改变,体现了男仕口服液治疗肾阳虚证的多途径、多靶点、整体调节的作用特点。该研究为基于临床有效性的创新药物发现提供方法学基础。
中医方证代谢组学 肾阳虚证 男仕口服液 代谢标记物 药效物质基础
中医方证代谢组学(Chinmedomics)[1,2],是将中药血清药物化学和代谢组学有机结合,在研究证候生物标记物的基础上,建立方剂药效生物评价体系,发现并确定中药药效物质基础,为中医证本质的研究、中药方剂现代研究、中药药效物质基础研究、中药产业现代化发展和创新药物设计提供有效的研究方法[3-6],已经广泛用于中药或方剂有效成分的挖掘研究中[7-9]。
男仕口服液是由何首乌、巴戟天、熟地黄、枸杞子、大枣、核桃和金樱子等组成的补肾阳的方剂,具有温补肾阳之效。其方剂组成已被证实对皮质酮诱导的肾阳虚证模型大鼠的神经内分泌系统紊乱、缓解虚寒之证具有改善作用,且明确了其可以有效回调黄尿酸、3-甲氧基肾上腺素等肾阳虚证生物标记物[10]。其中,肾阳虚证模型采用糖皮质激素诱导大鼠出现神经内分泌系统紊乱的症状,模型稳定,可重复,并很好地模拟了肾阳虚证的临床表现[11],已经成为评价方剂的补肾阳作用的经典模型[12-14]。
目前,男仕口服液治疗肾阳虚证的关键药效物质基础尚不明确。因此,本研究采用中医方证代谢组学技术,分析男仕口服液对肾阳虚证生物标记物的影响,探索与肾阳虚证本质密切相关的生物标记物、代谢通路及男仕口服液对这些标记物的调节作用,并在男仕口服液发挥治疗作用基础上分析其入血成分群与肾阳虚证生物标记物的相关性,最终确定其发挥治疗作用的有效成分,为其创新药物发现的临床有效性研究提供方法学依据。
1 材料与方法
1.1 仪器
Waters Acquity TM UPLC 液相色谱仪(美国Waters集团公司);Waters Synapt TM High Definition MS(HDMS/MS)System 质谱仪(美国Waters集团公司);MassLynx V4.1工作站(美国Waters集团公司);KDC-160HR 型高速低温离心机(科大创新股份公司);VX-Ⅱ多管涡旋振荡器(北京踏锦科技有限公司);全自动组织包埋机(美国Thermo HistoStar公司);2145型切片机(德国·佧公司);r-911全自动放免计数仪(中国科技大学实业总公司);酶标仪(美国PerkinElmer公司);DP72型显微镜(日本OLYMPUS公司);BX60型显微镜照相系统(日本OLYMPUS公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);SL-1000XLS型移液器(上海梅特勒·托利多仪器有限公司)规格:100-1000μL;PB1501-N型电子分析天枰(上海梅特勒·托利多仪器有限公司)。
1.2 药品与试剂
男仕口服液(无限极有限公司,批号:20130716);皮质酮(Corticosterone,CORT)放免试剂盒放免试剂盒(北京华英生物有限公司,批号:20140406)、促肾上腺皮质激素(Adrenocorticotropic Hormone,ACTH)放免试剂盒(北京华英生物有限公司,批号:20140401)、促肾上腺皮质激素释放激素(Corticotropin Releasing Hormone,CRH)(北京华英生物有限公司,批号:20140406);三氟甲状原氨酸(Tri-fluorothyronine 3,T3)放免试剂盒(北京北方生物技术研究所,批号:20140305)、睾酮(Testosterone,T)放免试剂盒(北京北方生物技术研究所,批号:20140305)、甲状腺素(Thyroxine 4,T4)放免试剂盒(北京北方生物技术研究所,批号:20140305);17-羟基类固醇(17-hydroxy Corticosteroid,17-OHCS)(南京建成生物工程研究所,批号:20140414)、环磷酸腺苷(cyclic Adenosine Monophosphate,cAMP)活性分析试剂盒(南京建成生物工程研究所,批号:20140320)、环磷酸鸟苷(cyclic Guanosine Monophosphate,cGMP)活性分析试剂盒(南京建成生物工程研究所,批号:20140425);橄榄油(注射级,科密欧化学试剂有限公司,批号:20131206);皮质酮(美国SIGMA技术有限公司,批号:C2505);亮氨酸脑啡肽(美国SIGMA技术有限公司,批号:L9133);乙腈色谱级(德国Merck技术有限公司);甲酸(色谱级,美国SIGMA技术有限公司);蒸馏水(广州屈臣氏食品饮料公司)。
1.3 给药样品的制备
1.3.1 制备皮质酮橄榄油溶液
称取600 mg皮质酮,置于组织研磨器中,向组织研磨器中加入20 mL橄榄油,充分研磨后10 min后,再量取40 mL橄榄油置于皮质酮油溶液中,充分混匀。转移到广口瓶中,充分均质10 min,即得10 mg·mL-1皮质酮橄榄油溶液。
1.3.2 制备男仕口服液
取男仕口服液500 mL[9],减压浓缩至200 mL左右,转移至250 mL容量瓶中,加蒸馏水至刻度线,充分混匀,即得。
1.3.3 制备男仕口服液体外成分分析样本
取男仕口服液2 mL,加入蒸馏水8 mL进行稀释后于4℃,13 000 r·min-1离心15 min,取上清液过0.22 μm滤膜,即得。
1.3.4 制备男仕口服液体内成分分析样本
取大鼠空白血清及给药血清各1.0 mL,加入4%磷酸50 μL,混悬震荡30 s后超声处理1 min,然后上样到预先以2 mL甲醇、2 mL水活化平衡好的SPE柱上,分别以0.5 mL水淋洗,淋洗液弃去,再以1 mL甲醇洗脱,收集洗脱液,于35℃下氮气流吹干,残渣用200 μL 80%甲醇溶液复溶,超声处理1 min,混悬震荡30 s后,于4℃、13 000 rpm条件下离心10 min,取上层清液过0.22 μm滤膜,即得。
2 实验方法
2.1 实验动物分组与给药
清洁级雄性Wistar大鼠24只,体重250±10 g,北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。饲养温度25±3℃,湿度65%-75%,12 h避光,12 h光照,自由摄食饮水;完全随机法分为空白组、模型组和男仕口服液组,每组各8只。空白组大鼠每天按0.01 mL·kg-1体重皮下注射橄榄油液21天,复制肾阳虚证大鼠模型[15],然后每天以0.1 mL·kg-1体重灌胃蒸馏水,连续14天;模型组和男仕口服液组大鼠每天0.01 mL·kg-1体重皮下注射皮质酮橄榄油液21天,复制肾阳虚证大鼠模型,之后模型组大鼠每天按0.1 mL·kg-1体重灌胃蒸馏水,连续14天,男仕口服液组大鼠每天按0.1 mL·kg-1体重灌胃男仕口服液,连续14天。
2.2 实验样本收集
各组大鼠于实验第35天收集累积12 h尿液样本,并经离心处理后冻存于-80℃冰箱。空白组和男仕口服液组大鼠在实验第35天药物灌胃后30 min尾静脉采血2 mL用于体内外成分分析;同时各组均于实验结束(第35天)时对每只大鼠进行腹主动脉采集血样,按照试验程序处理获取血清,在4℃、3 000 r·min-1条件下离心处理10 min以获得血清;下丘脑、垂体、肾上腺和甲状腺在大鼠全身灌注4%多聚甲醛溶液后,取出固定备用。
2.3 临床化学及组织病理学指标检测
按试剂盒说明操作检测血清CRH、CORT、ACTH、T3、T4、T血浆cAMP 和cGMP、尿17-OHCS;按照HE染色方法步骤制备下丘脑、垂体、肾上腺和甲状腺的病理组织切片,并在200倍镜下采集照片。
2.4 代谢组学数据采集
将尿液样本水浴解冻后,加入蒸馏水稀释5倍后,在13 000 rpm、4℃条件下离心10 min,上清液过0.22 μm滤膜,按照表1的色谱条件与表2的质谱条件进行UPLC-HDMS检测法采集尿液样本数据,所用色谱柱型号:ACQUITY UPLCTMHSS T3 色谱柱(100 mm×2.1 mm i.d., 1.8 μm)。
2.5 男仕口服液体内外成分数据采集
将男仕口服液体外样本供试品溶液、空白血清和给药血清样本供试液取大鼠空白血清及给药血清各1 mL,加入4%磷酸混悬震荡1 min超声2 min,上样到预先以2 mL甲醇、2 mL水活化平衡好的SPE柱上,分别以1mL水淋洗,淋洗液弃去,再以1 mL甲醇洗脱,收集洗脱液,于35℃下氮气流吹干,残渣用100 μL流动相复溶,超声处理1 min,混悬震荡30s后,在4℃、13 000 rpm条件下离心处理10 min,取上层清液,进样3 μL供UPLC-HDMS分析具体条件按照表3的色谱条件、表4的质谱条件进行UPLCHDMS血液样本数据采集,所用色谱柱型号:ACQUITY UPLCTMHSS T3(2.1 mm×100 mm, 1.8 μm)。
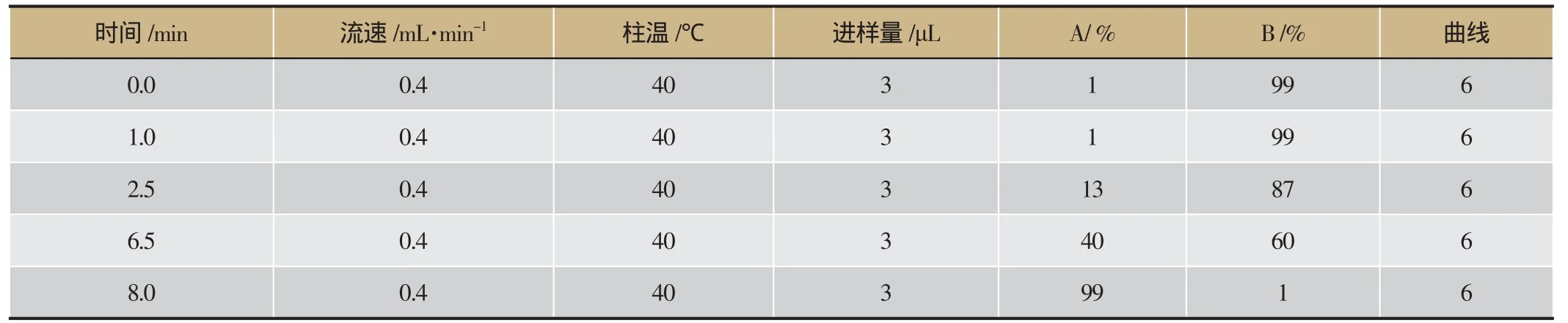
表1 大鼠尿液样品UPLC流动相梯度洗脱方法

表2 大鼠尿液样本HDMS质谱条件

表3 男仕口服液体内外供试品溶液UPLC流动相梯度洗脱方法
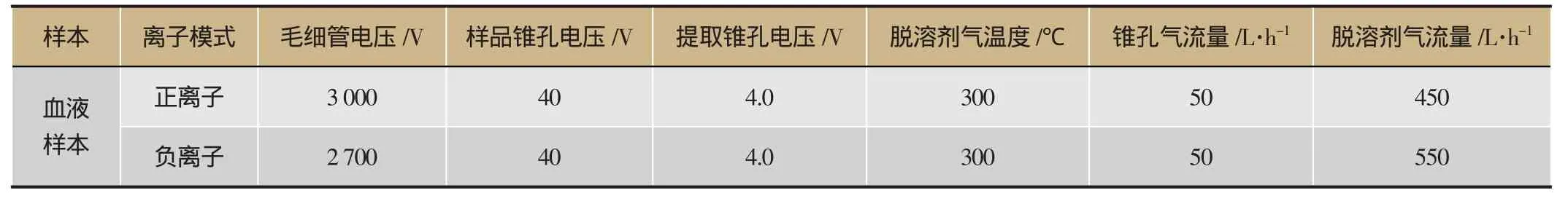
表4 男仕口服液体内外供试品溶液HDMS质谱采集条件
3 数据处理方法
3.1 统计学分析
3.2 男仕口服液对肾阳虚证生物标记物的影响
将所采集到的大鼠尿液代谢轮廓质谱数据全部导入Progenisis QI软件进行数据降维和获取离子信息矩阵信息,进一步利用EZinfo 2.0软件模块对各组数据进行主成分(Principal Components Analysis,PCA)分析,得到二维和三维PCA得分图,反映各组聚类程度,直观观察男仕口服液对整体代谢轮廓的影响。进一步对模型组与空白组大鼠的尿液代谢轮廓质谱数据进行正交偏最小二乘判别分析(Orthonal Partial LeastSquare-Discriminate Analysis,OPLSDA),利用Predictionset模块可以将男仕口服液质谱数据引入差异分析结果中,最终得到了PCA得分评价分数,其中空白组评价分数以“+1”表示,模型组评价分数以“-1”表示,男仕口服液评价分数为-1到+1之间的数值,最终以得分分布情况量化男仕口服液对肾阳虚证大鼠整体尿液代谢轮廓的影响。在此基础上,分析男仕口服液对本课题组前期工作所明确的肾阳虚证尿液生物标记物[10,16,17]的回调效果,用于阐明男仕口服液治疗肾阳虚证的作用机制。
3.3 入血成分鉴定
利用Ezinfo 2.0中模式识别方法,首先将男仕口服液体内外成分质谱数据(空白血清和含药血清)进行PCA分析,在正、负离子模式下可以获得由于外源药物引入在血液中产生的成分差异,使得未给药组即空白组与给药组的血清样品集合相互分离;再进行有监督的正交偏最小二乘法-判别分析,挖掘两组间差异数据,得到对分组贡献大小的离子相关S-plot及VIP图。收集对组间离散贡献较高的(VIP值>2)目标离子,并且满足含药血清数据中存在(响应值值不为0)而空白血清中不存在(响应值为0)的离子作为潜在男仕口服液入血成分,最终以男仕口服液体外样本质谱信息对这些离子进行二级质谱数据采集,结合网络化合物数据库(HMDB、KEGG、Pubchem等)进行结构鉴定,获得入血成分信息。
3.4 药效关键物质成分分析
运用血清化学成分与代谢标记物相关性

善明显(图1-A)。

图1 男仕口服液治疗肾阳虚证的作用效果的代谢组学评价体系图
4.3 代谢组学研究
从图1-D、图1-E可以发现,模型组与空白组在PCA得分图二维空间上仍处于不同空间位置,而经口服男仕口服液治疗14天后,男仕口服液组大鼠PCA得分图在空间上处于远离模型组而靠近空白组的位置,表明男仕口服液具有调节发生偏离的代谢轮廓向健康大鼠代谢轮廓的作用效果,从Predictionset预测图(图1-F)可以发现男仕口服液组整体回调趋向于空白组得分,表明男仕口服液具有良好的治疗效果。

表6 肾阳虚动物模型生物标记物详表
在皮质酮诱导肾阳虚模型大鼠尿液30个生物标记物中(表6、图1-C),男仕口服液可回调其中12个标记物进行,分别为:黄尿酸、3-亚甲二氧基吲哚、烟酰胺、3-甲氧基肾上腺素、胞嘧啶、胸苷、羟苯基乙酰甘氨酸、3β,17α,21-三羟基孕烯醇酮、酪胺、鸟嘌呤、11β,21-二羟基-5β-孕甾烷-3,20-二酮、氢化肉桂酸,由PCA分析得分图也可以发现,通过对生物标记物的有效调整,男仕口服液组大鼠向着远离模型组方向并转向空白组方向聚集,有效回调肾阳虚证模型大鼠的代谢轨迹发生发展的趋势。
4.4 显效状态下男仕口服液的入血成分分析
利用正交偏最小二乘模式识别的方法对比分析了空白组、给药组大鼠血清的质谱数据,从中找出对两组大鼠血清中男仕口服液的入血成分(图2-A、图2-B),按照预先设置的标准共鉴定30个入血成分,全部在负离子条件下检出,详细信息见表7、图2-C,其中24个为原型成分,6个为代谢产物。其中,代谢产物源于何首乌的有4-羟基苯甲醛、阿魏酰酪胺、二苯乙烯苷的葡萄糖醛酸化产物以及6-甲氧基-2-乙酰基-3-甲基-1,4-萘醌-8-O-β-D葡萄糖苷甲基化产物;源于山茱萸的有莫诺苷葡萄糖醛酸化产物;源于金樱子的有23-羟基萎陵菜酸的葡萄糖醛酸化产物。其中,原型成分有源于何首乌的2,3,5,4'-四羟基芪-2,3-葡萄糖苷、二苯乙烯苷、2-羟基,1-甲氧基蒽醌;源于巴戟天的有水晶兰苷、锈色洋地黄醌醇、2,5-莰烷二醇、1-甲氧基-2-羟基蒽醌、鸡屎藤苷、大黄酸;源于山茱萸的有马钱子苷、莫诺忍冬苷、咖啡酸、断氧马钱子苷、葡糖二酸单内酯、没食子酸、苹果酸;源于枸杞的有羟基桂皮酸、色氨酸;源于金樱子的有柠檬酸、23-羟基萎陵菜酸;源于核桃的没食子酸。另外,还有甜味剂的甜叶菊苷A、B、C、甜叶菊苷和甜叶菊双糖苷。
4.5 药效物质基础研究
采用PCMS分析方法,分别计算30个色谱峰的相对峰面积与其对应肾阳虚效应大小的皮尔逊相关系数,结果见Heatmap图(图2-D)。利用相关系数判断相关关系的密切程度,通常认为:0.65<| r |≤1呈显著相关。图2-D横坐标为30个生物标记物,纵坐标为30个入血成分,其中黑色为入血成分与生物标记物极度负相关,蓝色为入血成分与生物标记物高度负相关,红色为入血成分与生物标记物极度正相关,粉色为入血成分与生物标记物高度正相关,绿色为入血成分与生物标记物低度正相关和低度负相关。从图2-D可以得出,男仕口服液体内入血30个化学成分中有6个相关峰满足绝对相关系数值| r |大于0.65的筛选条件,为男仕口服液治疗肾阳虚证的关键药效物质基础,分别为水晶兰苷、没食子酸、鸡矢藤苷、莫诺苷葡萄糖醛酸化产物、甜菊苷C、甜菊双糖苷,这些成分主要来源于方中何首乌、巴戟天和熟地黄。
5 讨论
肾阳虚患者体内类固醇激素含量会出现异常[18-21],在本实验中皮质酮诱导的大鼠肾阳虚模型中类固醇含量较空白组均表现出不同程度的差异,类固醇合成途径发生紊乱。实验组大鼠类固醇代谢通路中的3β,17α,21-三羟基-孕酮的回调现象表明,男仕口服液组对类固醇代谢有修复作用;激素水平恢复正常状态水平,提示着神经内分泌轴的靶器官的功能恢复正常;由肾上腺等HE染色切片观察到其分泌细胞形态基本恢复至正常状态,可验证激素水平的回调与其分泌细胞的完整性密不可分。
肾阳虚证患者在临床表现出精神萎靡等症状,这是神经系统抑制的表现,而色氨酸代谢与神经系统是密不可分的[22,23]。犬尿氨酸是这个途径的中央化合物,既可以转化成神经保护剂犬尿酸,又可以转换成神经毒剂喹啉酸[24]。在许多神经退行性疾病(帕金森病、亨廷顿氏和阿尔茨海默病)、癫痫、多发性硬化症、肌肉萎缩性侧索硬化症、抑郁症等均可观察到这些内源性的化合物的平衡被打破[25,26]。因此,维持正常的大脑功能需要足够量的犬尿氨酸代谢途径的代谢产物(犬尿酸、4,6-二羟基喹啉、黄尿酸、2-氨基粘糠酸-6-半醛等),而预防这个通路的损害可能会减弱一些神经紊乱性疾病的病理过程。由皮质酮诱导大鼠后发现,模型组大鼠色氨酸代谢通路中的黄尿酸、4,6-二羟基喹啉、2-氨基粘糠酸-6-半醛含量均较正常组大鼠降低,表明肾阳虚证大鼠色氨酸代谢已经明显发生紊乱,是造成肾阳虚证大鼠中枢神经系统抑制的直接原因,其中黄尿酸是代谢产物色氨酸代谢的终端产物,其含量的异常与肾损伤、肾毒性有关[27,28];而男仕口服液对色氨酸途径起修复作用主要体现在其可以回调黄尿酸、3-甲基二氢吲哚、5-(γ-羰基-γ-氧代丙基)-4,6-二羟基吡物标志物,它是从代谢综合征进展为糖尿病和动脉粥样硬化性心血管疾病的重要致病机制,已有报导发现糖尿病人尿液中烟尿酸含量高于非糖尿病人,而本实验研究发现,模型组烟尿酸含量明显升高,表明肾阳虚模型大鼠的糖代谢和能量代谢发生紊乱,是导致模型大鼠出现身体蜷缩畏冷的主要原因之一,给予男仕口服液后烟尿酸的含量升高,表明其可以增强机体糖代谢进而恢复能量代谢途径。

图2 显效状态下男仕口服液潜在药效物质基础研究

续图2 显效状态下男仕口服液潜在药效物质基础研究
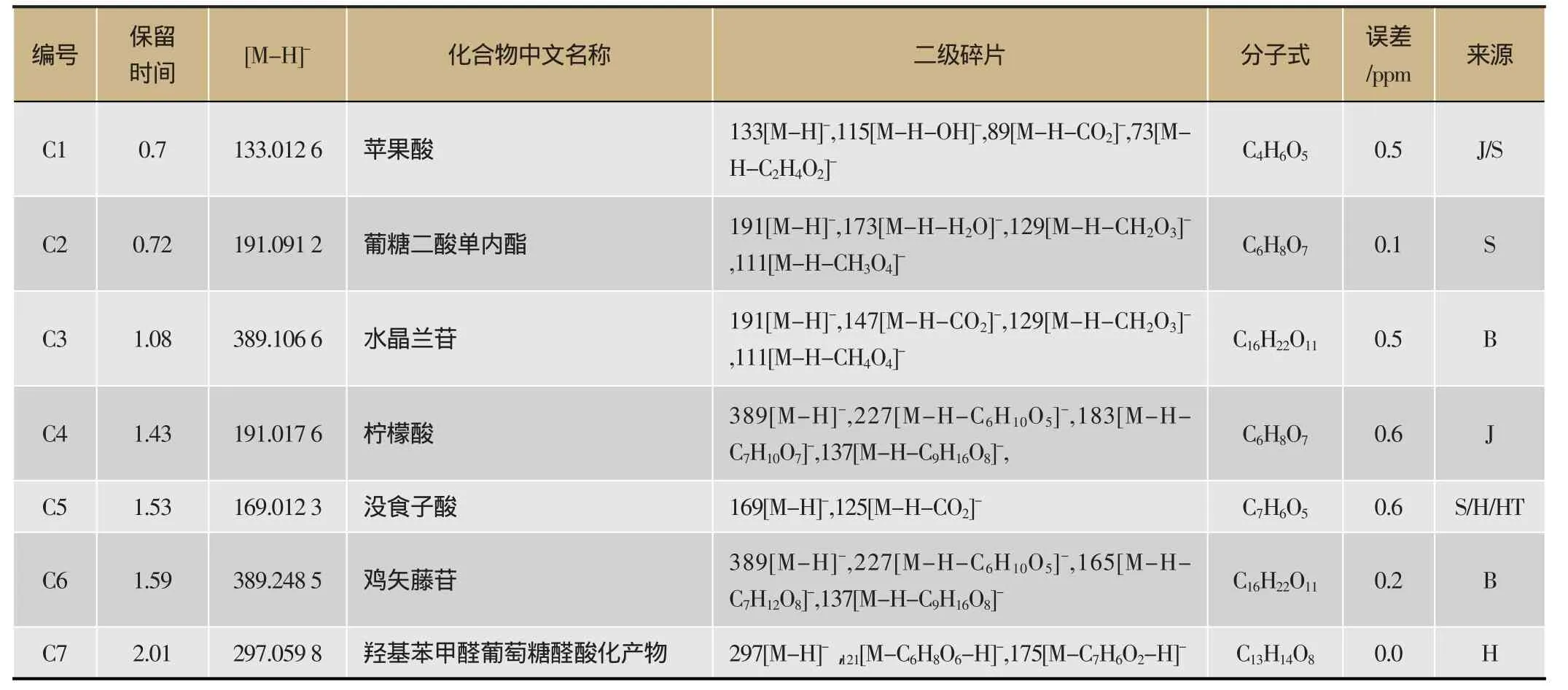
表7 男仕口服液入血成分一级质谱信息表

续表7
进一步研究发现,酪氨酸是参与合成并分泌甲状腺素的主要原料之一,故其可以作为肾阳虚证标记物[29],直接影响甲状腺素由腺泡经过上皮细胞分泌到细胞外的过程;而且,酪氨酸通过脱羧反应生成一种痕量单胺——酪胺,可作为神经递质,具有促进儿茶酚胺类成分去甲肾上腺素和肾上腺素释放的作用,但酪胺并不直接激活肾上腺素受体,它可以作为肾上腺素摄取系统和单胺氧化酶的底物,延长肾上腺素能神经递质的传导行为[30,31],促进肾上腺素的分泌。因此,酪氨酸及其代谢物酪胺的体内代谢水平反映了甲状腺和肾上腺分泌细胞分泌激素的能力。本实验中酪氨酸代谢通路中,乙酰-L-酪氨酸、酪胺、4-羟基苯乙酰谷氨酸出现异常,表明酪氨酸代谢通路的平衡被打破,酪氨酸代谢通路出现异常。男仕口服液给药后,大鼠的酪胺和4-羟基苯乙酰谷氨酸有强烈的回调趋势,表明男仕口服液可调节酪氨酸代谢通路,进而改善甲状腺和肾上腺相应激素的合成与分泌。
嘧啶是DNA和RNA的基本组成部分,可以完成许多生物功能,特别是调节细胞代谢,储存和转移能量,形成辅酶并对磷脂及糖代谢进行调节。在嘧啶代谢循环的众多代谢物中,胞苷是由胞嘧啶经嘧啶核苷磷酸化酶作用代谢而来,并由胞苷脱氨酶催化代谢为尿苷。经过磷酸化作用,尿苷转化为尿嘧啶,接着生成脱氧尿苷,进而生成dUMP,dTMP和胸腺嘧啶核苷,胸腺嘧啶核苷又在胸腺嘧啶核苷磷酸化酶的作用下生成胸腺嘧啶** http∶//www.kegg.jp/kegg-bin/highlight_pathway?scale=1.0&map=map00240&keyword=Pyrimidine%20metabolism。而一些研究报道称,当机体遭遇肾脏病变时,胸腺嘧啶核苷磷酸化酶的活性表达水平有明显差异,从而影响嘧啶代谢[32,33]。本实验发现,肾阳虚证大鼠鸟嘌呤含量升高,表明鸟嘌呤发生堆积,经鸟嘌呤生成尿酸的途径发生影响,会导致尿酸经肾脏排出量降低[34],表明由皮质酮诱导的肾阳虚证大鼠的肾脏系统发生病变是导致嘌呤代谢紊乱的原因之一[35]。而从胞嘧啶到脱氧胞苷最终生成胸苷这一代谢通路的代谢物在肾阳虚证大鼠尿中一致性降低,表明肾阳虚证大鼠的嘧啶代谢发生明显抑制,而男仕口服液可通过升高胞嘧啶水平进而提升胸苷含量,同时也促进了鸟嘌呤的代谢,减轻了肾脏的损伤程度。
因此,经男仕口服液可通过显著回调黄尿酸、羟乙基苯乙酰甘氨酸、酪氨酸等内源性代谢物,进而调节类固醇激素的生物合成途径、色氨酸代谢通路中神经递质合成途径和酪氨酸代谢通路中的神经递质和激素的合成与分泌途径,使得肾阳虚证逆转并向正常状态转归,从代谢组学视角揭示了男仕口服液对肾阳虚证治疗的整体过程。
本研究从经典的临床化学、病理学和代谢组学层面明确男仕口服液治疗肾阳虚证的物质基础,利用中药血清药物化学方法分析口服男仕口服液后的体内直接作用物质,这些化学成分是参与其治疗肾阳虚证的关键成分群,因此,结合肾阳虚证内源性代谢生物标记物的变化规律,建立并完善血清中外源性中药成分与内源性标记物两组变量关联度PCMS分析方法,提取与内源性标记物高度关联的外源性中药化学成分信息,最终共寻得高度关联的6个成分,分别为水晶兰苷、没食子酸、鸡矢藤苷、莫诺苷葡萄糖醛酸化产物、甜菊苷C、甜菊双糖苷,主要来源于方中何首乌、巴戟天和熟地黄三味中药,为男仕口服液治疗肾阳虚证的药效物质基础。
综上所述,男仕口服液通过调节类固醇激素合成途径、色氨酸代谢途径和神经递质合成途径治疗肾阳虚证,影响了黄尿酸、3-亚甲二氧基吲哚、烟酰胺、3-甲氧基肾上腺素、胞嘧啶、胸苷、羟苯基乙酰甘氨酸、3β,17α,21-三羟基孕烯醇酮、酪胺、鸟嘌呤、11β,21-二羟基-5β-孕甾烷-3,20-二酮、氢化肉桂酸等关键代谢标记物的指标水平,其治疗肾阳虚证的关键物质基础是水晶兰苷、没食子酸、鸡矢藤苷、莫诺苷葡萄糖醛酸化产物、甜菊苷C、甜菊双糖苷。
参考文献
1 王喜军. 中药药效物质基础研究的系统方法学——中医方证代谢组学. 中国中药杂志, 2015, 40(1): 13-17.
2 张爱华, 孙晖, 闫广利.中医方证代谢组学——中医药研究的新策略. 中国中药杂志, 2015, 40(4): 569-576.
3 Wang X, Zhang A, Sun H. Future perspectives of Chinese medical formulae: chinmedomics as an effector. OMICS, 2012, 16(7-8): 414-421.
4 张爱华,王喜军. 中医药的代谢组学研究. 世界科学技术-中医药现代化, 2013,15(4):643-647.
5 Wang X, Zhang A, Sun H, et al. Discovery and development of innovative drug from traditional medicine by integrated chinmedomics strategies in the post-genomic era. TrAC-Trend Anal Chem, 2016, 76: 86-94.
6 Wang X, Zhang A, Wang P, et al. Metabolomics coupled with proteomics advancing drug discovery toward more agile development of targeted combination therapies. Mol Cell Proteomics, 2013,12(5):1226-38.
7 Wang X, Zhang A, Sun H. Chinmedomics: The Integration of Serum Pharmacochemistry and Metabolomics to Elucidate the Scientific Value of Traditional Chinese Medicine. Pittsburgh: American Academic Press, 2015.
8 张爱华, 孙晖, 周小航. 基于方证代谢组学的金匮肾气丸治疗肾阳虚证的研究. 第十一届全国博士生学术年会(生物医药专题)论文集(上册,大会报告), 2013.
9 Zhang A, Sun H, Dou S, et al. Metabolomics study on the hepatoprotective effect of scoparone using ultra-performance liquid chromatography/electrospray ionization quadruple time-of-flight mass spectrometry. Analyst, 2013;138(1):353-361.
10 Zhang A, Liu Q, Zhao H, et al. Phenotypic characterization of nanshi oral liquid alters metabolic signatures during disease prevention. Sci Rep, 2016, 6: 19333.
11 沈自尹. 肾阳虚证的定位研究. 中国中西医结合杂志, 1997, 17(1): 50-52.
12 高博,尹桂山. 补肾药对肾阳虚大鼠下丘脑组织蛋白激酶活性的影响. 中国中医基础医学杂志, 2000, 6(1):30-33.
13 蒋淑君,王桂兰,崔存德,等. 淫羊藿总黄酮对肾阳虚大鼠下丘脑-垂体-肾上腺轴钙调蛋白基因表达的影响. 中国应用生理学杂志, 2004, 20(4):341.
14 王粉侠,郭冬,杜霞,等. 首乌补肾胶囊对糖皮质激素致肾阳虚模型小鼠的影响. 陕西中医, 2016, 37(6): 747-748.
15 刘源才,杨跃军,冯声宝. 中国劲酒对肾阳虚模型大鼠下丘脑-垂体-肾上腺轴及免疫功能的影响.中国免疫学杂志, 2011, 27(12): 1080-1084.
16 Yang N, Zhou X, Qi L, et al. Serum metabolomics strategy for understanding pharmacological effects of ShenQi pill acting on kidney yang deficiency syndrome. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1026:217-226.
17 刘琦,赵宏伟,张爱华,等. 基于中医方证代谢组学的男仕胶囊治疗肾阳虚证的药效物质基础及作用机理研究. 中国中药杂志, 2016,41(15):2901-2914.
18 Tan Y, Liu X, Lu C, et al. Metabolic profiling reveals therapeutic biomarkers of processed Aconitum Carmichaeli Debx in treating hydrocortisone induced Kidney-Yang deficiency syndrome rats. J Ethnopharmacol, 2014, 152(3): 585-593.
19 Li B, Luo Q, Nurahmat M, et al. Establishment and comparison of combining disease and syndrome model of asthma with “kidney yang deficiency” and “abnormal savda”. Evid Based Complement Alternat Med, 2013, 658364.
20 Huang D, Yang J, Lu X, et al. An integrated plasma and urinary metabonomic study using UHPLC-MS: Intervention effects of Epimedium koreanum on “Kidney-Yang Deficiency syndrome” rats. J Pharm Biomed Anal, 2013, 76: 200-206.
21 Gong M, Ye W, Xie Y, et al. Metabonomic study of intervention effects of Morinda officinalis on “kidney-yang deficiency syndrome”. Zhongguo Zhong yao za zhi, 2012, 37(11): 1682-1685.
22 Kudielka B M, Schommer N C, Hellhammer D H, et al. Acute HPA axis responses, heart rate, and mood changes to psychosocial stress (TSST) in humans at different times of day. Psychoneuroendocrinology, 2004, 29(8): 983-992.
23 Kirkegaard C, Faber J. The role of thyroid hormones in depression. Eur J Endocrinol, 1998, 138(1): 1-9.
24 Stone T W. Neuropharmacology of quinolinic and kynurenic acids. Pharmocal Rev, 1993, 45(3): 309-379.
25 Németh H, Toldi J, Vécsei L. Kynurenines, Parkinson’s disease and other neurodegenerative disorders: preclinical and clinical studies. J Neural Transm Suppl. 2006, 70: 285-304.
26 Zádori D, Klivényi P, Toldi J, et al. Kynurenines in Parkinson’s disease: therapeutic perspectives. J Neural Transm, 2012, 119(2): 275-283.
27 Pawlak D, Tankiewicz A, Mysliwiec P, et al. Tryptophan metabolism via the kynurenine pathway in experimental chronic renal failure. Nephron, 2002, 90(3): 328-335.
28 Zhao Y. Metabolomics in chronic kidney disease. Clin Chin Acta, 2013, 422: 59-69.
29 Montgomery A J, McTavish S F, Cowen P J, et al. Reduction of Brain Dopamine Concentration With Dietary Tyrosine Plus Phenylalanine Depletion: An [11C] Raclopride PET Study. Am J Psychiatry, 2003, 160(10):1887-1889.
30 Kamer R S, Mason DT, Braunwald E. Augmented sympathetic neurotransmitter activity in the peripheral vascular bed of patients with congestive heart failure and cardiac norepinephrine depletion. Circulation, 1968, 38(4): 629-634.
31 Yamazaki F. Oral vitamin C enhances the adrenergic vasoconstrictor response to local cooling in human skin. J Appl Physiol, 2012, 112(10):1689-1697.
32 刘伟,刘成倍, 徐伟,等. 胸腺嘧啶磷酸化酶表达水平及其对肾癌预后的影响. 中国老年学杂志, 2004, 24(10):917-918.
33 郭英花, 魏丽惠. 胸腺嘧啶核苷磷酸化酶在肿瘤研究中的意义. 中日友好医院学报, 2001, 15(2): 108-110.
34 谷现恩. 高尿酸血症与肾脏损害. 中国临床医生, 2011, 39(3):3-5.
35 王元,邓跃毅. 补肾活血法治疗痛风性肾病的疗效观察. 临床肾脏病杂志, 2014, 14(6):374-375.
A Research of Chinmedomics on the Pharmacodynamic Basis of Nanshi Oral Liquid and Its Mechanism Behind the Efficacy on Kidney-Yang Deficiency Syndrome
Zhang Aihua1, Liu Qi1, Zhao Hongwei2, Sun Hui1, Zhou Xiaohang1, Nan Yang1, Kong Ling1, Guan Yu1, Zou Shiyu2, Ma Zhonghua2, Wang Xijun1
(1. Research Center of Chinmedomics-State Administration of TCM-Laboratory of Metabolomics / National TCM Key Laboratory of Serum Pharmacochemistry / Sino-US Chinmedomics Technology Cooperation Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China;
2. Infinite Pole China Co., Ltd., Guangzhou 510623, China)
This study aimed to explore the constituents migrating to blood and the correlation between the metabolites and metabolic pathways and find out the therapeutic basis and its mechanism behind the efficacy of Nanshi oral liquid (NSOL) by observing the changes of endogenous metabolic biomarkers closely related to kidney-yang deficiency syndrome (KYDS) induced by the administration of corticosterone. The hormone expressions in the hypothalamus-pituitary-target organs axes were detected, while the histomorphology of all target organs was observed to judge the efficacy of NSOL on the KYDS models. Then the serum and urine samples were analyzed using pattern recognition analysis for the verification of the impacts of the biomarkers related to NSOL on the KYDS models. Using the effective dose of NSOL, the correlation between the main constituents migrating to blood and the biomarkers were analyzed and finally confirmed the potential therapeutic basis. It was found that the levels of CRH, CORT, T3, T4, T in the blood and 17-OHCS in the urine significantly decreased, while the hypothalamus-pituitary-target organs axes were inhibited. The contents of CRH, CORT, T3, T4, cAMP in serum and 17-OHCS in the urine significantly increased with the administration of NSOL, and the biosynthesis of steroid hormone and the metabolisms of tryptophan and tyrosine were regulated. PCMS analysis showed that scandoside, monotropeine, gallic acid, stevioside C, steviolbioside and morroniside glucuronide conjugation were the main constituents migrating to blood which positively or negatively correlated with biomarkers under the effective dose, which were deemed as the pharmacodynamic substances of NSOL. In conclusion, technologies of Chinmedomics were adopted to successfully establish the analysis model of “KYDS markers of constituents migrating to blood under effective dose-pharmacodynamic basis of NSOL in vivo”, indicated that scandoside, monotropeine and gallic acid in NSOL improved various metabolic pathways (hormone synthesis pathways, hormone synthesis and release pathway in tyrosine metabolism, etc.) and integrally regulated the metabolic profilings. It was demonstrated that the treatment of NSOL for KYDS featuring the corresponding between“formula” and “syndrome” in traditional Chinese medicine and reflecting its multi-path and multi-target and overall regulation. This study laid a foundation for the discovery of new medications based on their efficacy in clinic.
Chinmedomics, kidney-yang deficiency syndrome, Nanshi oral liquid, metabolic biomarker, pharmacodynamic basis
10.11842/wst.2016.10.007
R285.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-19
修回日期:2016-10-12
* 国家自然科学基金委重点项目(81430093):中药体内药效物质基础的系统分析方法学——中医方证代谢组学研究,负责人:王喜军;科学技术部“重大新药创制”科技重大专项(2015ZX09101043-011):中药经典名方整合作用机制关键技术研究,负责人:王喜军;黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT-2015118):基于方证代谢组学的金匮肾气丸治疗肾阳虚证的药效物质基础和作用机理研究,负责人:张爱华。
** 通讯作者:王喜军,本刊编委,教授,博士生导师,主要研究方向:中医方证代谢组学研究。
