睡眠剥夺诱导小鼠气虚证模型的方法研究*
2016-03-20甘加宽樊憬懿王冬芝任钧国刘建勋
甘加宽,樊憬懿,王冬芝,任钧国,刘建勋
(中国中医科学院西苑医院基础医学研究所/中药药理北京市重点实验室 北京 100091)
睡眠剥夺诱导小鼠气虚证模型的方法研究*
甘加宽,樊憬懿,王冬芝,任钧国**,刘建勋
(中国中医科学院西苑医院基础医学研究所/中药药理北京市重点实验室 北京 100091)
目的:通过比较睡眠剥夺、力竭游泳、睡眠剥夺结合力竭游泳3种造模方法,研究小鼠气虚模型的建立与评价方法。方法:将小鼠分为正常对照组、睡眠剥夺组、力竭游泳组、睡眠剥夺+力竭游泳(简称“复合组”),每组12只,睡眠剥夺组采用多平台水环境法进行睡眠剥夺,每天10 h;力竭游泳组采用负重10%进行力竭游泳,每天一次;复合组两种方法联合使用,连续28天。试验结束后,观察小鼠行为与体重,抓力仪测量小鼠抓力,利用小动物无创监护仪检测脉搏信号(心率、呼吸频率、呼吸幅度、脉搏幅度),采用数码照相机采集舌面图像,利用细胞流式仪检测脾脏T细胞亚群(CD3+、CD4+、CD8+)与B细胞(CD19+)。结果:与正常对照组比较,3组模型小鼠活动能力均降低,呈现疲劳特性,体重、抓力显著降低(P<0.05-0.01);小鼠舌面均见不同程度的变白,仅复合组具有显著性差异(P<0.05);睡眠剥夺组与复合组小鼠心率、呼吸频率、脉搏幅度与呼吸幅度均显著降低(P<0.05-0.01);3组的CD3+、CD4+、CD8+T细胞亚群显著增加(P<0.01),睡眠剥夺组的CD19+B细胞显著减少(P<0.01)。结论:三种方法均可以成功制备气虚小鼠模型,以睡眠剥夺造模最优。
气虚模型 小鼠 睡眠剥夺 力竭游泳
长期以来,动物模型的研制对医学发展有着重要的意义,中医动物模型已成为中医科研方法体系的一个重要组成部分,是开展中医证候及中药新药实验研究的一个重要方法。气虚证作为中医许多疾病的常见证候,以气短、乏力、神疲、脉虚等虚弱证候为主要临床表现。近年来,有关气虚证动物模型的研究取得了一定的进展,造模方法主要有限制饮食法、泻下法、疲劳法、烟熏法、化疗药物法、X线照射法、耗气破气法等[1];常用实验动物主要包括小鼠[2]、大鼠[3]、豚鼠[4]、家兔[5]等。
中医认为,劳倦过度、饮食失节、情志异常等是引起气虚证的主要因素,以往多采用劳倦过度、饮食失节的方法造模,但随着社会的发展,工作、生活、学习的压力和睡眠质量的下降已经成为气虚发生的主要原因。为此,本研究通过比较睡眠剥夺、游泳力竭及双因素复合的方法开展小鼠气虚模型的研究,以期为气虚证动物模型的制备提供一种新方法。
1 材料和方法
1.1 实验材料
1.1.1 动物
SPF级ICR雄性小鼠48只,体质量18-20 g,购自北京维通利华实验动物技术有限公司,合格证:SCXK(京)2012-0001。
1.1.2 仪器
尼康D90单反相机;S-1100型电子天平(长沙湘平科技发展有限公司);MouseOx Plus型小动物无创监护仪(上海玉研科学仪器有限公司);YLS-13A型大小鼠抓力测定仪(北京众实迪创科技发展有限责任公司);NAVIOS流式细胞仪(美国BeckmanCoulter公司)。
1.1.3 试剂
异氟烷(鲁南贝特制药有限公司,批号:64150703);红细胞裂解液(北京中生柏奥生物科技有限责任公司,批号:20160531);PBS(北京中生柏奥生物科技有限责任公司,批号:20160623);小鼠CD3ePE流式试剂(北京利文商贸有限责任公司,批号:C0031010516503);小鼠CD4FITC流式试剂(北京利文商贸有限责任公司,批号:C0041020916353);小鼠CD8aAPC流式试剂(北京利文商贸有限责任公司,批号:C0081031616203);CD19 PE-Cyanine7抗体(武汉爱博泰克生物科技有限公司,批号:E07526-1637)。
1.2 实验方法
1.2.1 分组与处理
将48只ICR雄性小鼠随机分成正常对照组、睡眠剥夺组、游泳组、睡眠剥夺+游泳组,每组12只。睡眠剥夺组[6-8]:利用改良多平台水环境(自制小平台高40 mm,竖管直径10 mm,底盘直径60 mm,平台直径25mm)进行睡眠剥夺,每日8∶00(即开灯时间)至17∶00将小鼠置于水平台,进行部分睡眠剥夺,17∶00以后将其从平台上取下放入鼠笼进行饲养。力竭游泳组[9-11]:在小鼠尾根部负荷其体重10%的铅块作为重物,放入500 mm×350 mm×200 mm的游泳箱内,水深19 cm,水温30±1℃,保证小鼠在水中不能用尾巴接触箱底。当小鼠头部沉入水中,5 s内不能浮出水面自由呼吸时作为力竭标准。睡眠剥夺+游泳组:同时给予睡眠剥夺和力竭游泳干预。正常对照组不做任何处理,上述造模方法均连续4周。
1.2.2 体重
采用电子天平称量各组实验动物的体重。
1.2.3 抓力
采用YLS-13A大小鼠抓力测定仪测定各组实验动物的抓力。
1.2.4 舌像
尼康D90单反相机拍照小鼠舌面,用Adobe Photoshop CS5软件分析舌面,舌背,足部的三原色比例。
1.2.5 脉搏
MouseOx Plus小动物无创监护仪测定小鼠血氧饱和度、心率、呼吸频率、脉搏幅度、呼吸幅度。
1.2.6 脾脏指数与胸腺指数
实验结束后,小鼠摘眼球取血,颈椎脱臼处死小鼠,70%酒精浸泡10 min,无菌条件下剖开小鼠腹腔取脾与胸腺,称重,计算脾脏指数与胸腺指数,公式如下:
脾脏(胸腺)指数(%)=脾脏(胸腺)湿重(g)/小鼠体重(g)×100%
1.2.7 脾脏T细胞亚群与B细胞[12]
取小鼠脾脏研磨过100目筛, PBS5 mL冲洗,收集分离的脾细胞悬液,于1 000 r·min-1,4℃条件下离心5 min,弃上清;加红细胞裂解液Tris-NH4Cl 3mL,混匀脾细胞,静置10 min,加1mL PBS 终止裂解,于1000 r·min-1,4℃条件下离心5 min,取下面白色细胞沉淀,PBS洗2遍,重悬细胞,计数调整细胞浓度为1:107/mL,进行流式细胞术检测样品T细胞亚群与B细胞。
1.2.8 统计学分析
2 结果
2.1 小鼠体重的变化
小鼠体重的变化数据见表1,由表1可知,与正常对照组比较,第2周和第4周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组均能引起小鼠体重明显下降(P<0.01)。与游泳组比较,睡眠剥夺组、睡眠剥夺+游泳组的体重变化不明显(P>0.05)。
2.2 小鼠抓力的变化
小鼠抓力可反映气虚证神疲乏力、少气懒言的症状。由表2可知,与正常对照组比较,2周、4周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组小鼠的抓力均明显下降(P<0.01-0.05)。与游泳组比较,睡眠剥夺组、睡眠剥夺+游泳组小鼠的抓力无明显变化(P>0.05)。
2.3 小鼠舌象的变化
中医气虚证候有舌淡苔白。由表3可知,与正常对照组比较,2周、4周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组小鼠舌像R、G、B、R/G、R/B值均无明显差异(P>0.05)。与游泳组比较,睡眠剥夺组小鼠的舌像数据无明显变化(P>0.05),睡眠剥夺+游泳组数据显示G值、B值变小,R/B值、R/G值偏大,差异有统计学意义(P<0.05)。根据R/B值,R/G值的理论意义,变大说明舌质在变红,可见复合组出现舌面瘀紫。
2.4 小鼠脉搏的变化
中医气虚证候在脉象上是脉细弱。由表4可知,与正常对照组比较,2周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组血氧饱和度无明显差异(P>0.05),心率游泳组偏低(P<0.01);余两组无差异(P>0.05);呼吸频率,脉搏幅度与呼吸幅度无明显差异(P>0.05);与游泳组比较,睡眠剥夺组小鼠的舌像数据无明显变化(P>0.05);睡眠剥夺+游泳组却均心率升高,呼吸频率下降,脉搏幅度升高,呼吸幅度没变化。
由表5可知,在干预4周时,与正常对照组比较,各组的心率均明显下降(P<0.01-0.05),睡眠剥夺组与睡眠剥夺+游泳组呼吸频率,脉搏幅度和呼吸幅度均明显降低(P<0.01-0.05),但游泳组各指标出像明显升高,与小鼠游泳未达到气虚有关(P<0.01)。与游泳组比较,睡眠剥夺组与睡眠剥夺+游泳组血氧饱和度与心率无明显差异(P>0.05),呼吸频率下降,脉搏幅度升高,呼吸幅度均显著性变小(P<0.01-0.05)。
2.5 小鼠脾脏指数与胸腺指数的变化
气虚模型机体免疫功能紊乱降低。由表6可知,与正常对照组比较,4周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组均能引起小鼠脾脏指数下降,但无明显差异(P>0.05)胸腺指数睡眠剥夺组与睡眠剥夺+游泳组变大,差异明显(P<0.01),游泳组无差异(P>0.05)。与游泳组比较,睡眠剥夺组、睡眠剥夺+游泳组脾脏指数与胸腺指数无明显差异(P>0.05)。
2.6 小鼠脾脏淋巴细胞亚群的变化
由表7可知,与正常对照组比较,2周、4周时,睡眠剥夺组、游泳组、睡眠剥夺+游泳组均能引起小鼠体重明显下降(P<0.01)。与游泳组比较,睡眠剥夺组、睡眠剥夺+游泳组的体重变化不明显(P>0.05)。如表7显示,T细胞亚群CD3+,CD4+,CD8+值干预组均明显偏大,而CD19+B细胞活性降低(P<0.01)。
表1 小鼠体质量的变化(x±s,n=12)

表1 小鼠体质量的变化(x±s,n=12)
注:与正常对照组比较,*P<0.05,**P<0.01;与游泳组比较,#P<0.05,##P<0.01。
体重/g1天2周4周正常对照组18.6±1.08 34.5±3.25 37.6±2.71睡眠剥夺组18.7±1.09 30.9±1.99**34.6±1.83*##游泳组18.9±0.90 30.5±2.01**32.2±1.50**睡眠剥夺+游泳组18.6±0.82 28.8±2.27**31.5±2.35**分组

表2 小鼠抓力的变化(x±s,n=12)
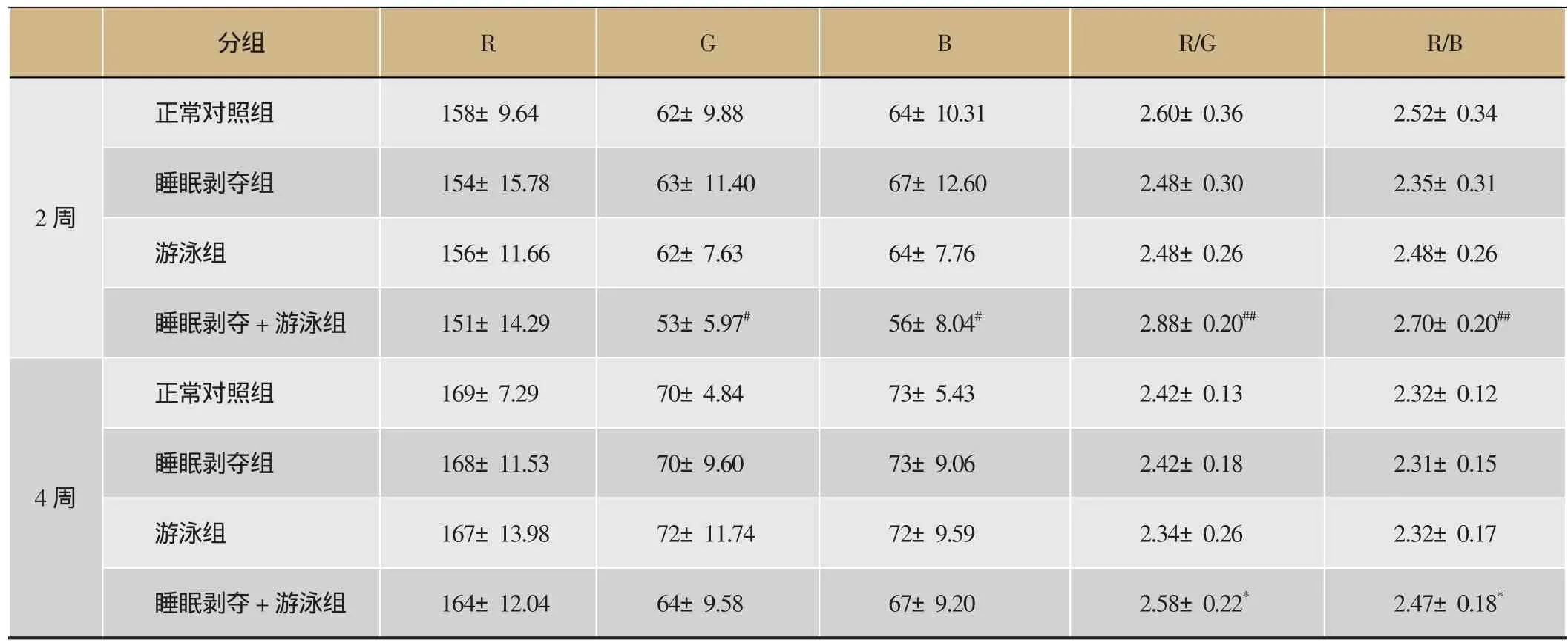
表3 小鼠舌象的变化(x±s,n=12)
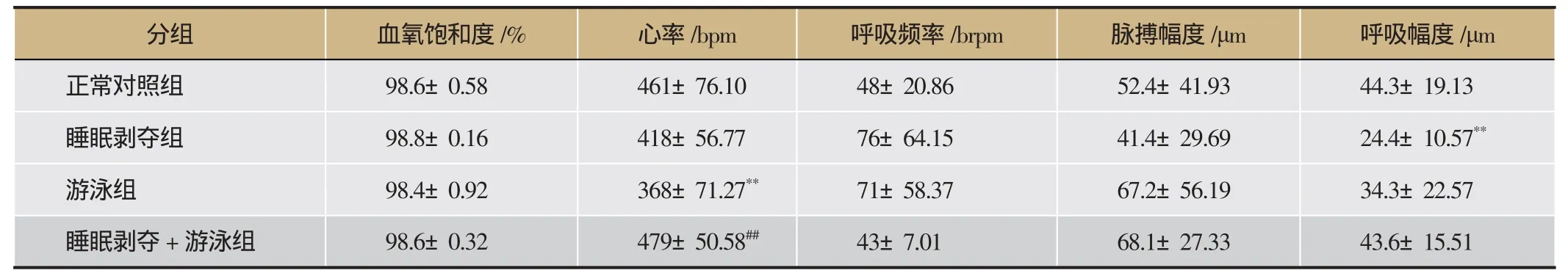
表4 小鼠2周脉搏的变化(x±s,n=12)
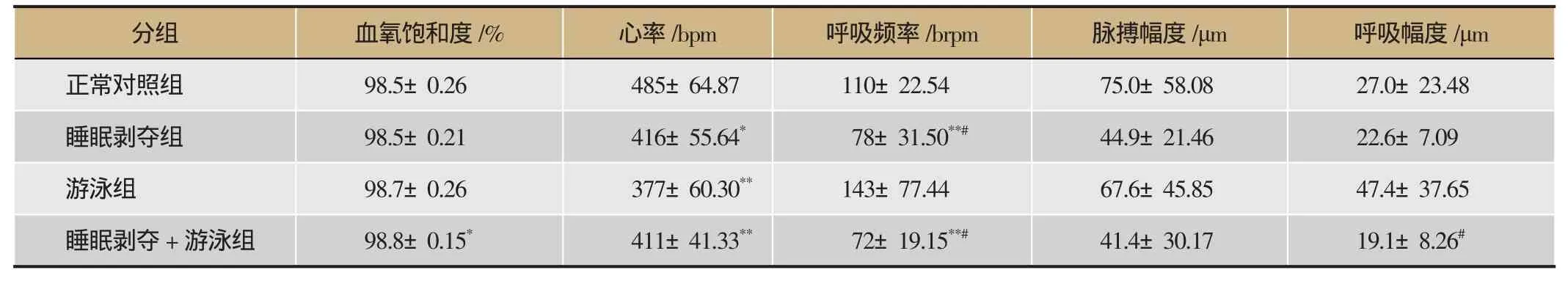
表5 小鼠4周脉搏的变化(x±s,n=12)

表6 小鼠脾脏、胸腺指数的变化(x±s,n=12)
3 讨论
中医气虚证候的临床症状表现为消瘦、神疲乏力、少气懒言、面色淡白、舌淡苔白、脉细弱[13]。结合中医气虚证的理论,根据动物证候模型拟临床研究的方法[14],本课题组制订了小鼠气虚证的判定指标:用体重反映小鼠的消瘦情况,用小鼠抓力反映乏力情况,用舌面颜色变化反映小鼠舌像情况[15],用呼吸幅度反映少气的情况,用小鼠脉搏的幅度反映脉象的情况。
中医理论认为“劳则气耗”,目前开展气虚模型的研究多遵此理论进行。最常用的方法就是力竭运动,如动物力竭游泳制作脾气虚模型[16,17]与心气虚模型[18]。此外,也有结合限制饮食方法制备气虚模型[19]。
疲劳主要分为形体疲劳与神志疲劳,目前最常采用力竭游泳的方法多以“形体疲劳”为主。从目前中医的临床实践来看,情志因素在气虚证的形成过程中具有重要的作用,因此,开展神志疲劳诱导的气虚模型的研究非常必要。睡眠剥夺(SleepDeprivation,SD)是指因环境或自身的原因丧失了所需要的睡眠量的过程或状态[20],其导致的中枢疲劳属于神志疲劳。长时间的SD会使人或动物产生疲劳、免疫功能低下、激惹等不良的情绪状态[21]。有学者采用水环境站台技术剥夺大鼠快速动眼相睡眠来与手术病理造模比较,研究发现:睡眠剥夺可以制备心气虚证大鼠模型[22]。同时,SD不仅引起精神疲劳,也引起机体疲劳,相较游泳力竭实验也具有可操作性。因此,本实验采用睡眠剥夺法制备小鼠气虚模型,同时与力竭游泳进行了比较。

表7 小鼠脾脏淋巴细胞亚群的变化(x±s,n=12)
本实验的结果显示,睡眠剥夺、力竭游泳与睡眠剥夺+力竭游泳干预均能引起小鼠体重下降,抓力的变化与体重一致,表明三种方法均能引起小鼠乏力,三者之间无明显区别。根据实验结果,本实验采取了SD的方法进行气虚模型造模。脉搏幅度与呼吸幅度在两周时模型组比正常组小,四周时差异更明显,说明睡眠剥夺与力竭游泳均能引起小鼠脉象变细。脉搏数据中心率与呼吸频率均变小,说明神劳与体劳均使小鼠脉搏变弱,综合脉搏数据可得:干预组小鼠脉搏为细弱,达到气虚的实验目的。睡眠剥夺组与睡眠剥夺——游泳组脉搏数据各项参数较游泳组均明显降低,且两组间数据无差异,说明单纯的睡眠剥夺法即可引起小鼠脉象呈现气虚模型中的“细脉”与“弱脉”。根据实验结果,睡眠剥夺造成的神疲乏力比游泳力竭造成的肌肉劳累更容易造成气虚,而睡眠剥夺+游泳复合干预因素也未显示明显的气虚效果,故可用睡眠剥夺干预四周模拟临床气虚证候。
临床研究表明,气虚证患者的细胞免疫、非特异性免疫、红细胞免疫功能均降低[23]。本实验结果表明,睡眠剥夺、力竭游泳、睡眠剥夺+力竭游泳三种方法均可使小鼠脾脏的T淋巴细胞升高,而B淋巴细胞确降低,且睡眠剥夺对小鼠淋巴细胞数的影响较强。进一步说明睡眠剥夺单因素即能够影响机体免疫功能,从而达到中医气虚证候。
综上所述,本实验中三种造模方法均可成功制备气虚模型。其中,睡眠剥夺造模方法简单、可操作性强、重复性好。并且,睡眠剥夺法更能从病因角度反映“气虚证”的形成过程,更符合现代人因不良生活方式而导致亚健康状态的发病现状。因此,从实验结果分析及病因角度考虑,睡眠剥夺可以成为制备气虚模型的一种首选方法。
1 李军兰,方肇勤. 气虚证动物模型造摸方法综述. 上海中医药大学学报, 2004,18(3):56-60.
2 卢文丽,方肇勤,潘志强,等. 四种不同品系小鼠气虚血虚证候的比较与评价. 辽宁中医杂志, 2007,34(4):519-522.
3 袁国强,吴以岭,贾振华,等. 缺氧气虚大鼠NEI网络共同化学信号分子变化规律及通心络干预作用. 第二军医大学学报, 2008,29(7):787-791.
4 席斌,田道法. 变应性鼻炎肺气虚证与血清IL-4和IFN-7相关性的实验研究. 时珍国医国药,2007,15(3):166-170.
5 明海霞,金戈,刘喜平,等. 益气活血中药对心气虚证家兔血浆NO、ET的影响. 中医研究, 2008,20(10):6-8.
6 杨遥,刘静,徐江涛,等. REM睡眠剥夺对小鼠海马tau蛋白磷酸化的影响. 临床和实验医学杂志, 2014,13(1):4-7.
7 许光辉,吴艳萍,罗友华,等. 刺五加增强小鼠睡眠剥夺模型免疫功能和抗疲劳能力的实验研究. 中国实验方剂学杂志, 2012,18(23):173-175.
8 邹慧莉,赵广宇,宿长军,等. 快速眼动睡眠剥夺对中枢5-羟色胺缺失小鼠orexin阳性神经元活性的影响. 神经解剖学杂志, 2009,25(3):312-316.
9 韩小燕,刘春雨. 蜂胶对力竭游泳小鼠红细胞的保护作用. 贵州体育科技, 2014,(2):58-60.
10 刘佳,龙娟,胡维新,等. 人参茎叶总皂苷对负重游泳小鼠抗疲劳作用及其机制. 青岛大学医学院学报, 2013,49(3):221-223.
11 池爱平,郭欢欢,康堔喆,等. 五味子多糖的提取及其对高温下游泳小鼠代谢的影响. 四川体育科学, 2014,(6):25-27.
12 王朝霞,王兆朋,贾青,等. 蝎毒多肽提取物对5-Fu干预H22荷瘤小鼠免疫功能的影响. 药物评价研究, 2016,39(1):46-51.
13 冷伟,杨霓芝,朴胜华,等. 通脉口服液对气虚血瘀证单侧输尿管梗阻大鼠肾小管间质病变的影响. 时珍国医国药, 2010,21(3):579-581.
14 刘洋,刘旭东,刘文俊,等. 基于脾气虚的脾阳虚大鼠模型的复制方法及评价标准研究. 中国医学创新, 2016,13(3):25-28.
15 冯玄超,郭淑贞,武志黔,等. 慢性心率衰竭模型大鼠气虚血瘀证相关信息的评价. 中华中医药杂志, 2014,29(5):1563-1567.
16 施旭光,曾云桂,林荣锋,等. 补中益气汤不同黄芪药量对脾气虚大鼠糖代谢酶的影响. 中医药信息,2014,31(5) :23-26.
17 施旭光,王闽予,翟理祥,等. 补中益气汤配伍对脾气虚大鼠胃泌素及其基因表达的影响.中药新药与临床药理, 2012,23(6):609-612.
18 唐烨霞,程志清,姚立,等. 大鼠心气虚模型的制备方法. 包头医学院学报, 2009,25(1):5-6.
19 黄志远,黄家涛. 黄芪多糖对气虚小鼠免疫功能的作用研究. 中国当代医药,2014,21(20):14-21.
20 赵翠霞,谢韬,袁雪芬,等. 睡眠剥夺对机体神经行为机能的损害.中国慢性病预防与控制,2010,19(5) :541-543.
21 徐健,颜崇淮,沈晓月. 睡眠剥夺损害学习记忆能力的研究. 中国预防医学杂志,2004,38(2):134-137.
22 赵明镜,王硕仁,于成瑶,等. 两种心气虚证动物模型的对比研究.北京中医药大学学报,2006,29(8):525-529.
23 张茜,刘向国,武松. 肺气肿肺气虚证模型大鼠脾脏指数、胸腺指数变化的实验研究. 甘肃中医学院学报,2006,23(1):20-22.
The Establishment and Evaluation of Qi Deficiency Syndrome of Mouse Model Induced by Sleep Deprivation
Gan Jiakuan, Fan Jingyi, Wang Dongzhi, Ren Junguo, Liu Jianxun
(Institute of Basic Medical Sciences / Key Laboratory of Pharmacology of Chinese Materia in Beijing, Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China)
This study aimed at investigating the establishment and evaluation of qi deficiency syndrome in mice by comparing the three modeling methods involving sleep deprivation, exhausted swimming and the combination of sleep deprivation and exhaustive swimming. The mice were randomly divided into the control group, the sleep deprivation group, the exhausted swimming group and the combined group (sleep deprivation combined with exhausted swimming) with 12 ones in each group. Multi-platform water environment was applied to the mice of the sleep deprivation group with a 10-hour swim each day. Mice of the exhausted swimming group received loading swim of 10% of the body weight once a day. The mice of the combination group had accepted both the tests for 28 days. At the end of the experiment, the behavior tests and body weight were recorded, so were the holding force measured by force gauge, the heart rate, respiratory rate, respiratory amplitude and pulse amplitude tested by small animal noninvasive monitor, tongue images collected by digital camera and T cell subsets (CD3+, CD4+and CD8+) and B cell (CD19+) in the spleen detected by flow cytometry. Compared with the control group, it was found that the activity was reduced featuring fatigue in mice, while the body weight and holding force significantly decreased in the three groups (P < 0.05 or 0.01). The tongue complexions of mice whitened in different degrees only in the combined group (P < 0.05). And the heart rate, respiratory rate, pulse amplitude and respiratory amplitude were significantly decreased in mice of the sleep deprivation group and the combined group (P < 0.05 or 0.01). The CD3+, CD4+, CD8+T cell subsets significantly increased in mice of the three groups (P < 0.01), while CD19+B cells significantly decreased in mice of the sleep deprivation group (P < 0.01). It was concluded that the three methods successfully built the mouse model of qi deficiency syndrome, while the sleep deprivation was the optimum modeling method.
Qi deficiency model, mouse, sleep deprivation, exhausted swimming
10.11842/wst.2016.10.022
R285.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-28
修回日期:2016-10-25
* 科学技术部国家重点基础研究发展计划(973计划)项目(2015CB554405):气血相关理论的生物学基础研究,负责人:刘建勋。
** 通讯作者:任钧国,研究员,主要研究方向:中药药理研究。
