基于代谢组学的茵陈蒿汤及组分配伍对大鼠酒精性肝损伤的保护作用研究*
2016-03-20闫广利周小航王扬阳王玉影王玉美张爱华王喜军
闫广利,周小航,孙 晖,王扬阳,王玉影,王玉美,张爱华,王喜军
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
基于代谢组学的茵陈蒿汤及组分配伍对大鼠酒精性肝损伤的保护作用研究*
闫广利,周小航,孙 晖,王扬阳,王玉影,王玉美,张爱华,王喜军**
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
目的:利用代谢组学技术,结合临床生化检测和组织病理学,评价茵陈蒿汤及其组分配伍对长期过量摄入酒精诱导肝损伤的保护作用。方法:对Wistar大鼠进行“白酒—玉米油—吡唑”混合溶液灌胃和饲喂高脂饲料12周制备酒精性肝损伤大鼠模型,茵陈蒿汤及其组分配伍组分别于造模开始每日灌胃给予茵陈蒿汤和6,7-二甲氧基香豆素、京尼平苷、大黄酸配伍组合,12周末测定血清ALT、AST、ALP、TG、T-BIL、TP、ALB、CHOL、HA、LN、PCIIINP、CIV浓度和肝脏组织HYP、γ-GT、MDA、TBA、SOD和GSHPX含量,观察肝左叶HE和Masson染色病理组织切片,并利用UPLC-Q/TOF-MS技术采集尿液代谢轮廓数据,提取各组样品中酒精性肝损伤生物标记物信息,分析空白对照组、模型对照组、茵陈蒿汤组及茵陈蒿汤组分配伍组之间大鼠代谢轮廓及生物标记物的变化。结果:茵陈蒿汤及其组分配伍均能显著抑制酒精性肝损伤大鼠血清ALT、AST、ALP、TG、T-BIL、TP、ALB、CHOL、HA、LN、PCIIINP、CIV浓度和肝脏组织HYP、γ-GT、MDA、TBA、SOD和GSH-PX含量的变化,减少肝脏细胞炎性浸润和肝纤维化,并使肝损伤大鼠整体代谢轮廓远离模型对照组而靠近正常对照组,使10个生物标记物趋于正常水平。结论 茵陈蒿汤对大鼠酒精性肝损伤具有显著的保护作用,其3个组分6,7-二甲氧基香豆素、京尼平苷和大黄酸的配伍组合能够有效表达茵陈蒿汤的生物效应,是其主要有效组分,为茵陈蒿汤防治酒精性肝损伤疾病的创新药物开发奠定了基础。
茵陈蒿汤 6,7-二甲氧基香豆素 京尼平苷 大黄酸 酒精性肝损伤 干预作用 代谢组学
酗酒损害人的身体机能,甚至引起一系列的肝脏病变,例如酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化等肝损伤疾病[1]。随着经济的发展,酒精消耗量在逐年上升,酒精性肝损伤疾病的发病率随之不断上涨,且已成为仅次于传染性肝病的第二大类肝病。因此,亟待开发用于防治长期过量摄入酒精而诱导肝损伤疾病的有效药物[2]。中医学认为酒为湿热有毒之品,长期过量饮酒引起湿热蕴结之证,治以清热利湿为主[3,4]。茵陈蒿汤出自汉代张仲景《伤寒论》,具有清热、利湿、退黄的功用,是治疗湿热黄疸的经典方剂,临床常用于治疗病毒性肝炎、胆囊炎、胆石症、钩端螺旋体病等所引起的黄疸等证属湿热内蕴者[5]。文献报道,临床以茵陈蒿汤为基础方治疗酒精性肝病[6,7],相关药效学研究表明:茵陈蒿汤能够有效干预和治疗长期酒精摄入诱导的大鼠肝损伤[8,9],而且认为酒精性肝病与茵陈蒿汤存在方证对应关系[10]。
本课题组前期利用代谢组学技术结合肝功能检测评价了茵陈蒿汤对酒精诱导的急性肝损伤的保护作用[11],并结合中药血清药物化学方法,确证了6,7-二甲氧基香豆素、京尼平苷、大黄酸为茵陈蒿汤保肝作用的主要有效组分[12]。本研究制备慢性酒精性肝损伤大鼠模型,进一步利用代谢组学技术,结合肝胆功能、肝脏脂肪病变、肝纤维化等相关临床生化指标和组织病理变化,评价茵陈蒿汤及其组分配伍对大鼠长期过量酒精摄入诱导肝损伤的保护作用,促进茵陈蒿汤在防治酒精性肝损伤疾病中的应用,以及为基于茵陈蒿汤的防治酒精性肝病创新药物开发奠定基础。
1 材料
1.1 仪器
Acquity UPLC超高效液相色谱仪(美国Waters公司);Micromass Q/TOF micro四级杆串联飞行时间质谱仪(美国Waters公司);ULTRA-TURRAX T25 Basic高速匀浆机(德国IKA公司);KDC-160HR型高速冷冻离心机(中国科大创新股份公司);电子分析天平(上海梅特勒·托利多有限公司);SECOMAN BASIC半自动生化分析仪(法国SECOMAN公司);UV MINI-1240型紫外分光光度计(日本SHIMADZU公司);VX-II型多管涡旋振荡器(北京踏锦科技有限公司);Rotavapor R-3水浴加热器(瑞士Buchi公司)。
1.2 药品与试剂
茵陈蒿汤冻干粉:准确称取18 g茵陈蒿,加1.40 L水,煮沸,保持沸腾煎煮至700 mL,再加入9 g栀子和6 g大黄,再保持沸腾煎煮10 min,煎煮液纱布过滤,滤液浓缩至约1 g·mL-1,制成冻干粉。6,7-二甲氧基香豆素(纯度达98%)、京尼平苷(纯度达95%)、大黄酸(纯度达95%),均为自制。
色谱级乙腈、色谱级甲酸(美国迪马公司,批号分别为70121、12117);蒸馏水(广州屈臣氏食品饮料公司,批号:20130208)。60℃红星二锅头酒(北京红星股份有限公司,批号:20121130),玉米油(黑龙江兴贸食品公司,批号:20120421),吡唑(美国阿拉丁公司,批号:S33638-326),生理盐水(哈尔滨三联药业有限公司,批号:20130131D1),乌拉坦(上海山浦化工有限公司,批号:20121011)。碱性磷酸酶(Alkaline Phosphatase,ALP)测定试剂盒、总胆红素(Total Bilirubin,T-BIL)测定试剂盒、白蛋白(Albumin,ALB)测定试剂盒、总胆固醇(Cholesterol,CHOL)测定试剂盒、甘油三酯(Triglyceride,TG)测定试剂盒、丙氨酸氨基转移酶(Alanine Aminotransferase,ALT)测定试剂盒、天门冬氨酸氨基转移酶(Aspartate Amino Transferase,AST)测定试剂盒(中生北控生物科技股份有限公司,批号分别是130571、130961、130871、130261、130771、130370、131171);羟脯氨酸(Hydroxyproline,HYP)试剂盒、超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(Glutathion Peroxidase,GSH-PX)试剂盒、丙二醛(Malondialdehyde,MDA)试剂盒、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)试剂盒、总胆汁酸(Total Bile Acid,TBA)试剂盒、考马斯亮蓝总蛋白(KMAS)试剂盒(南京建成生物工程研究所,批号分别是20130512、20130315、20130612、20130423、230130202、20130325、20130421);透明质酸(Hyaluronic Acid,HA)试剂盒、Ⅲ型前胶原肽(Procollagen III N-termi,PIIINP)试剂盒、Ⅳ型胶原(Collagen IV,CIV)试剂盒,层粘连蛋白(Laminin,LN)试剂盒(北京北方生物工程研究所,批号分别是130420、130420、130420、130420)。
1.3 实验动物
Wistar大鼠(清洁级),雄性,体重200±20 g,北京维通利华实验动物技术有限公司提供。饲养温度25±3℃,湿度65%-75%,12 h蔽光,12 h光照,自由饮水饮食,适应一周后开始实验。
2 实验方法
2.1 茵陈蒿汤及其组分配伍灌胃溶液的制备
取冻干粉适量,用0.3%CMC-Na溶液混悬,制成含生药1.2 g·mL-1的溶液,作为茵陈蒿汤灌胃溶液。
精密称取6,7-二甲氧基香豆素180 mg、京尼平苷90 mg、大黄酸60 mg,加少量甲醇制成真溶液,再用60 mL 0.3%CMC-Na溶液稀释,研磨均匀,即得茵陈蒿汤组分配伍灌胃溶液。
2.2 动物分组及给药
取预适应的Wistar大鼠,按体重随机分为空白对照组、模型对照组、茵陈蒿汤给药组、组分配伍给药组,每组12只。模型对照组、茵陈蒿汤给药组和组分配伍给药组大鼠每天灌胃给予“白酒-玉米油-吡唑”按6、2、24 g·kg-1的浓度组合混合成溶液(剂量为8 mL·kg-1),及饲喂高脂饲料(基础饲料∶胆固醇∶猪大油=79∶1∶20),进行造模[13];同时,茵陈蒿汤给药组和组分配伍组分别以10 mL·kg-1的剂量每天灌胃给予大鼠茵陈蒿汤灌胃溶液和3个组分配伍灌胃溶液,干预肝损伤病变过程。另外,空白对照组及模型对照组大鼠每天灌胃加入少量甲醇的0.3%CMC-Na溶液,并且空白对照组大鼠给予普通饲料喂养。各组大鼠于开始试验后12周末,收集尿液、血液、肝组织,进行临床生化、组织病理和代谢组学评价。
2.3 样品采集与处理
各组大鼠于末次给药后禁食,收集夜晚12 h尿液,-80℃贮存;分析前水浴解冻,在4℃,13 000 r·min-1离心10 min,过0.22 μm滤膜,供UPLC-MS分析。收集尿液后,经麻醉处理,腹主动脉采集血液样本,室温静置30 min后,在4℃条件下5 000 rpm离心10 min,分离上层血清,按试剂盒说明操作,检测血清ALT、AST、ALP、TG、T-BIL、ALB、CHOL、HA、LN、PCIIINP、CIV。大鼠取血后,用0.9%生理盐水灌流1 min左右,至肝脏无色后摘取肝左叶按照HE和Masson染色方法制备病理组织切片,在200倍镜下采集照片;其余肝脏组织制备成匀浆,按试剂盒说明操作,测定HYP、γ-GT、MDA、TBA、SOD和GSH-PX及蛋白定量。
2.4 代谢组学数据采集
2.4.1 色谱条件
色谱柱:ACQUITY UPLCTMHSS T3(100 mm×2.1 mm i.d.,1.8 μm)(美国Waters公司);流动相:流动相A为0.1%甲酸乙腈,流动相B为0.1%甲酸水,线性梯度洗脱,0-2.5 min,1%-11%A;2.5-4.5 min,11%-21%A;4.5-7.0 min,21%-40%A;7.0-7.5 min,40%-50%A;7.5-10.0 min,50%-99%A;柱温:45 ℃;流速:0.4 mL·min-1;进样量:3 μL。
2.4.2 质谱条件
正、负离子扫描模式。电喷雾离子源;毛细管电压3 000V;样品锥孔电压正离子模式25 V,负离子模式30 V;提取锥孔电压正离子3.0 V,负离子模式2.5 V;脱溶剂气温度300℃;锥孔气流量50 L·h-1;脱溶剂气流量500 L·h-1。准确质量测定采用亮氨酸-脑啡肽(Leucine-Enkephalin,[M+H]+=556.277 1, [M-H]-=554.261 5)溶液为锁定质量溶液。质量扫描范围:m/z 50-1 000 Da。
2.5 数据统计与分析
组间数据用统计学软件SPSS 18.0中的单因素方差分析(One-way ANOVA)进行分析,以均值±标准差(±s) 表示,两组均数间的比较采用t检验,P<0.05认为差异有统计学意义。
尿液样品UPLC-MS数据导入Markerlynx软件,设置参数提取每个样品的“保留时间_质荷比_峰面积”信息,经标准化处理后利用嵌套的EZinfo 2.0模块对各组数据进行非监督的主成分分析(Principle Components Analysis,PCA),得到反映各组聚类程度的得分图(Scores Plot),对模型组与空白对照组大鼠的尿液代谢轮廓数据进行正交偏最小二乘判别分析(Orthonal Partial Least Square-Discriminate Analysis,OPLS-DA),获得反映变量贡献度大小的VIP-plot图,选取VIP>1.5且组间t检验P<0.05的变量离子,作为潜在生物标记物集合,进一步利用二级质谱信息及结合HMDB、KEGG、METLIN等组学数据库进行结构鉴定,确定酒精性肝损伤的生物标记物,并利用MetPA数据库构建内源性生物标记物的关联代谢通路。观察各给药组对生物标记物的回调程度,选取能够显著回调的生物标记物作为各组的效应生物标记物,评价茵陈蒿汤及其组分配伍对酒精性肝损伤的干预作用。
3 实验结果
3.1 对临床生化指标的影响
按照试剂盒说明书操作,测定各组大鼠临床生化指标,包括肝功能指标血清AST、ALT浓度,肝纤维化指标血清HA、LN、CIV、PIIINP浓度和肝组织HYP含量,肝脏氧化损伤指标肝脏中SOD、GSH和MDA含量,脂代谢指标血清TG、CHOL浓度,胆功能指标血清ALP、TBA、ALB浓度和肝脏中γ-GT、TB含量,结果见表1、表2、表3。与空白对照组比较,模型对照组中各测定指标均有极显著差异(P<0.01),表明大鼠长期摄入酒精并结合高脂饮食,其肝胆多种功能出现显著损伤,并出现肝脂代谢紊乱和肝纤维化病变。与模型对照组比较,茵陈蒿汤组除了血清CHOL浓度的变化无显著差异(P>0.05)外,血清GSH浓度的回调具有显著差异(P<0.05),其它指标的回调均具有极显著差异(P<0.01);组分配伍组血清γ-GT、GSH、MDA浓度的回调具有显著差异(P<0.05),其它指标的回调均具有极显著差异(P<0.01),表明茵陈蒿汤及其组分配伍均显著抑制了大鼠肝胆功能损伤、肝脏氧化损伤、肝脏脂代谢紊乱及肝纤维化,具有显著的保护酒精性肝损伤的作用。
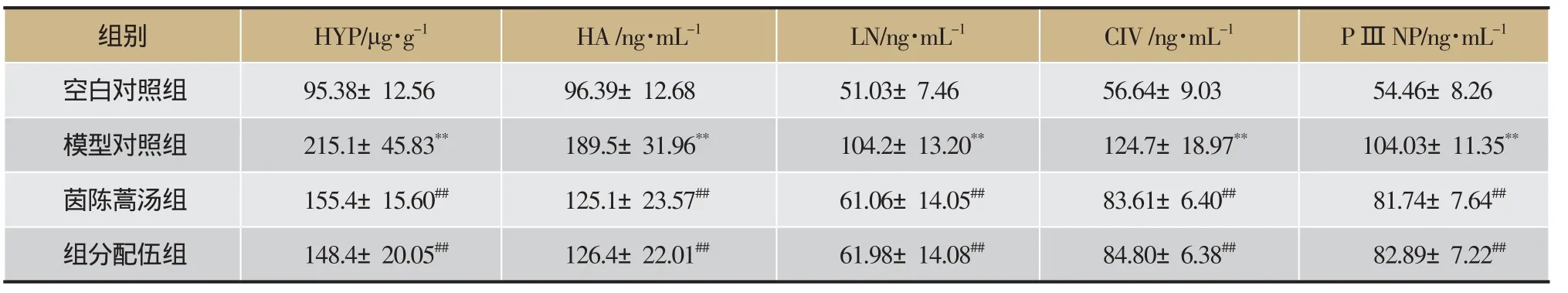
表1 茵陈蒿汤及其组分配伍对酒精性肝损伤大鼠肝纤维化指标的影响
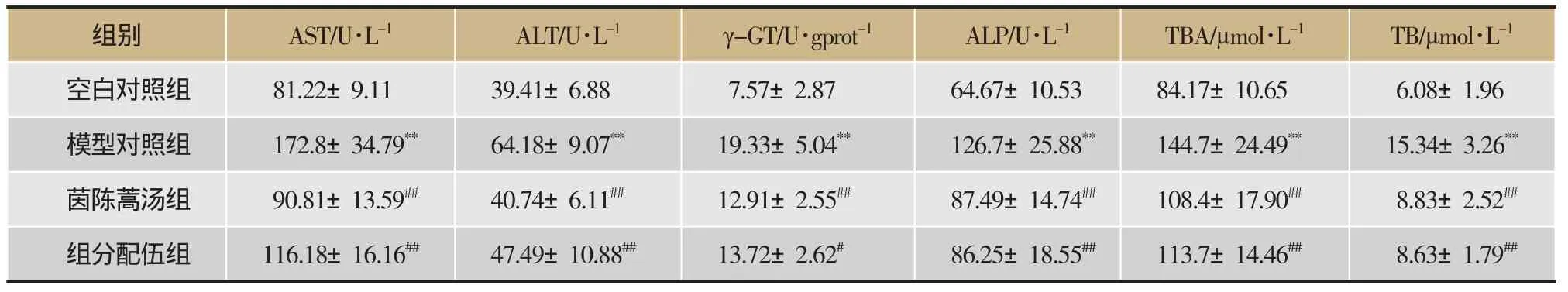
表2 茵陈蒿汤及其组分配伍对酒精性肝损伤大鼠肝功能及胆功能指标的影响

表3 茵陈蒿汤及其组分配伍对酒精性肝损伤大鼠血清白蛋白、脂代谢及肝脏氧化损伤指标的影响
3.2 对组织病理学指标的影响
各组大鼠肝左叶典型HE染色图见图1(A-D),图中可见空白组大鼠肝小叶结构完整,肝细胞以中央静脉为中心呈放射状排列,染色均匀;模型组大鼠肝细胞排列紊乱,汇管区可见炎性细胞浸润及肝窦充血;茵陈蒿汤组和组分配伍组均见大鼠肝小叶结构趋于正常,肝细胞呈放射状排列,肝窦无充血。
各组大鼠肝左叶典型Masson染色图见图1(EH),图中可见胶原纤维呈蓝色,空白组大鼠有含量很少且规则排布的胶原纤维;模型组大鼠蓝色区域成片,显示有大量的胶原纤维;茵陈蒿汤组和组分配伍组大鼠与模型组大鼠相比,蓝色区域均明显减少。
3.3 对整体代谢轮廓及生物标记物的影响
上述临床生化及组织病理学观察结果表明,结合高脂饮食,大鼠灌胃酒精12周诱导了肝胆功能损伤、肝氧化损伤、肝脂肪变及肝纤维化等肝损伤病变,酒精性肝损伤大鼠模型制备成功。利用UPLC-Q/TOF-MS技术采集12周末正常对照组、模型对照组、茵陈蒿汤组、茵陈蒿汤组分配伍组大鼠尿液的代谢轮廓数据,标准化处理后PCA分析的得分图(见图2),图中可见各组数据聚类明显,其中空白对照组与模型对照组偏离最远,茵陈蒿汤组和组分配伍组交织在一起,接近空白对照组,表明茵陈蒿汤和组分配伍组能够抑制酒精性肝损伤大鼠代谢网络的紊乱,并且具有相似的保护作用。
对空白对照组和模型对照组大鼠尿液UPLC-MS数据进行OPLS-DA分析,提取对组间分类贡献度较大且t检验P<0.05的变量离子进行鉴定,结果确定了21个长期摄入酒精诱导大鼠肝损伤的生物标记物[14]。从空白对照组、模型对照组、茵陈蒿汤组、组分配伍组经标准化处理后的尿液UPLC-MS数据中,提取这21个肝损伤生物标记物的峰面积信息,作为它们在各大鼠体内的相对表达水平,经组间t检验分析,选取茵陈蒿汤组、组分配伍组分别与模型对照组比较具有显著差异(P<0.05)的标记物作为效应生物标记物,结果发现在21个肝损伤生物标记物中,茵陈蒿汤及其3个组分配伍均对其中10个生物标记物具有显著回调作用,见图3。利用MetPA数据库构建生物标记物的关联代谢通路,主要涉及牛磺酸和亚牛磺酸代谢通路,缬氨酸、亮氨酸和异亮氨酸生物合成通路,丙酮酸酯代谢,苯基丙氨酸代谢,表明6,7-二甲氧基香豆素、京尼平苷、大黄酸的配伍组合有效表达了茵陈蒿汤对酒精性肝损伤的保护作用,是茵陈蒿汤的主要有效组分。
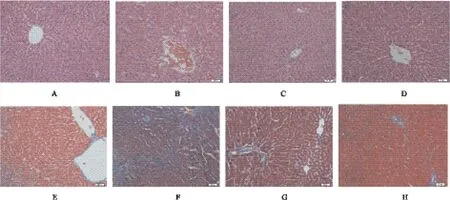
图1 茵陈蒿汤及其组分配伍对长期摄入酒精诱导肝损伤大鼠的肝脏组织病理学影响

图2 茵陈蒿汤及其组分配伍对长期摄入酒精诱导肝损伤大鼠尿液代谢轮廓的影响
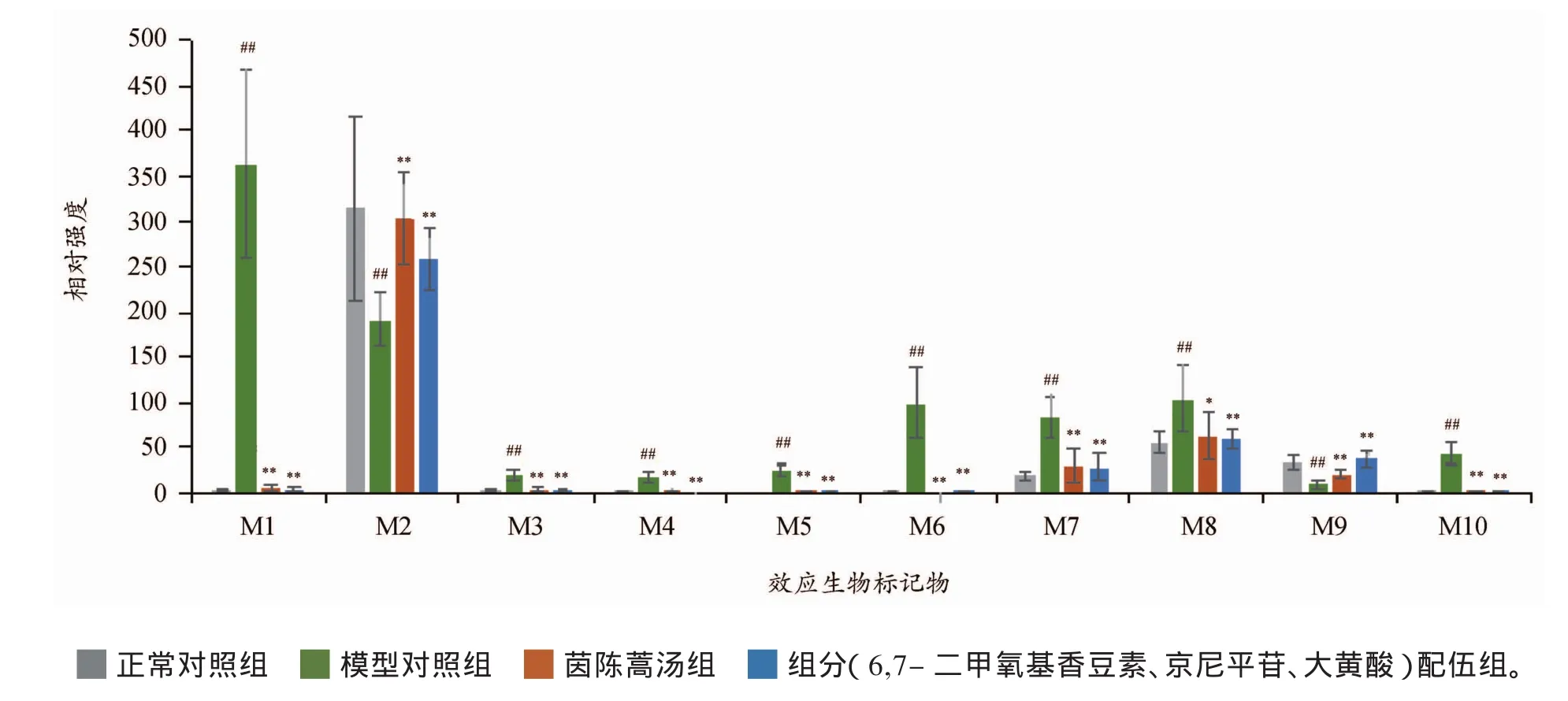
图3 茵陈蒿汤及其组分配伍保护长期摄入酒精诱导大鼠肝损伤的效应生物标记物相对表达强度的比较
4 讨论
长期过量饮酒引起的肝脏损伤涉及多个连续的病理变化,在启动期及发展期依次出现酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化的病理过程,而肝纤维化进一步发展可引起肝小叶结构改建、假小叶及结节形成,即肝硬化。早期肝纤维化具有可逆性,但到后期有再生结节形成出现肝硬化时则不可逆,故酒精性肝纤维化的预防和逆转对酒精性肝病的治疗起着决定性作用[15]。本研究参考文献[13],采用白酒-玉米油-吡唑混合液灌胃结合喂饲高脂饮食的造模方法制备了伴有肝纤维化病变的酒精性肝损伤大鼠模型,在3个月的模型制备过程中,动态观察了4周、7周、12周大鼠血清及肝组织的生化、病理变化,确定在第12周末造模大鼠出现肝纤维化病变,并伴有局部肝细胞脂肪变性和炎性浸润的脂肪肝、肝炎病变,以及肝胆功能损伤和肝氧化损伤,表明典型酒精性肝损伤模型制备成功[14]。
茵陈蒿汤和6,7-二甲氧基香豆素、京尼平苷、大黄酸三个组分配伍组合均能够抑制肝功能标志物血清AST、ALT浓度的升高和ALB浓度的降低,抑制肝纤维化标志物血清HA、LN、CIV、PIIINP浓度和肝组织HYP含量的升高,增加肝脏SOD、GSH含量和减少MDA含量,抑制脂代谢标志物血清TG、CHOL浓度的升高,抑制胆功能指标血清ALP、TBA浓度和肝脏中γ-GT、TB含量的升高,抑制肝细胞炎症浸润和纤维组织增生,表明茵陈蒿汤及其组分配伍能够降低长期过量摄入酒精导致的肝胆功能损伤、肝脏脂质过氧化损伤,并抑制肝纤维化和炎性病变,对酒精性肝损伤具有显著的保护作用。而且,茵陈蒿汤与其三个组分的配伍组合对酒精性肝损伤的保护作用无显著差异,表明6,7-二甲氧基香豆素、京尼平苷、大黄酸配伍组合有效表达了茵陈蒿汤对酒精性肝损伤的保护作用。
长期过量摄入酒精对机体的损伤是多方面的,其中肝损伤是主要病理变化。代谢组学从机体整体代谢表型的变化中表征外源性扰动对机体功能的影响,并探索与代谢表型变化相关的分子机制。本研究在成功制备酒精性肝损伤大鼠模型基础上,利用代谢组学技术鉴定了21个关联的生物标记物,对酒精性肝损伤具有显著保护作用的茵陈蒿汤能够抑制其中10个生物标记物的变化,使其趋于正常水平。文献报道[10],酒精性肝损伤大鼠模型病机为脾气不足、湿热内蕴,而茵陈蒿汤能够调控10个模型相关生物标记物的变化,从以方测证角度分析认为这10个生物标记物可能反映了酒精性肝损伤大鼠模型湿热内蕴的生物学本质。茵陈蒿汤10个效应生物标记物主要涉及牛磺酸和亚牛磺酸代谢通路,缬氨酸、亮氨酸和异亮氨酸生物合成通路,丙酮酸酯代谢通路,苯基丙氨酸代谢通路,其中,苯丙氨酸代谢通路中马尿酸合成的减少与肝损伤存在密切相关关系,长期过量摄入酒精能够减少体内马尿酸的合成,减低尿液中马尿酸的浓度[16];牛磺酸和亚牛磺酸代谢通路中牛磺酸可转化为2-羟基乙烷磺酸,而牛磺酸对肝脏具有保护作用[17];缬氨酸、亮氨酸、异亮氨酸生物合成通路和丙酮酸酯代谢通路的紊乱表明酒精性肝损伤造成机体氨基酸和糖类代谢的异常,这与文献报道一致[18,19]。另外,值得注意的是,2-羟基乙烷磺酸、辛二酸在急性酒精性肝损伤大鼠模型中也发生代谢异常[20]。因此,茵陈蒿汤的10个效应生物标记物在多个代谢通路上反映了酒精性肝损伤湿热内蕴的生物学本质。
综上所述,茵陈蒿汤和6,7-二甲氧基香豆素、京尼平苷、大黄酸的配伍组合均能抑制肝胆功能损伤、肝脏脂质过氧化损伤及肝纤维化和炎性病变,并均能使10个酒精性肝损伤生物标记物趋于正常水平,对酒精性肝损伤具有相似的保护作用,6,7-二甲氧基香豆素、京尼平苷和大黄酸有效表达了茵陈蒿汤的生物效应,是其保肝作用的主要有效组分。
1 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组. 酒精性肝病诊断标准. 中华肝脏病杂志, 2003,11(2):72.
2 梁列新, 侯晓华. 酒精性肝病的流行病学和预后. 临床内科杂志, 2004,21(2):80-82.
3 师宁, 苏泽琦, 李培彩, 等. 酒精性肝纤维化中医证候分类研究.中华中医药杂志(原中国医药学报), 2013,28(7):2119-2122.
4 刘宇飞, 潘军英, 滕林, 等. 酒精性肝损伤中医药用药特点研究.中医药信息, 2016,33(3):126-128.
5 李冀. 方剂学. 北京:中国中医药出版社, 2006:336-337.
6 张九香. 浅谈酒精性肝病的中医治疗. 湖南中医杂志,2006,22(2):75.
7 马力, 马军梅. 茵陈蒿汤加味治疗酒精性肝病的临床观察. 宁夏医学杂志, 2009,31(10):923-924.
8 王磊, 王恵娟, 吴凯, 等. 茵陈蒿汤改善酒精性肝病大鼠肝脏及小肠病变的组织病理学研究. 环球中医药,2015,8(11):1329-1332.
9 洪敏,董自波,孙小玉,等. 茵陈蒿汤对大鼠酒精性肝损伤的保护作用. 南京中医药大学学报,2004,20(5):303-305.
10 王磊,吴凯,候辰阳. 四君子汤等四首方剂干预酒精性肝病的方证研究. 山东中医杂志, 2013,32(11):822-825.
11 Wang X, Lv H, Sun H, et al. Metabolic urinary profiling of alcohol hepatotoxicity and intervention effects of Yin Chen Hao Tang in rats using ultra-performance liquid chromatography/ electrospray ionization quadruple time-of-flight mass spectrometry. J Pharm Biomed Anal, 2008,48(4):1161-1168.
12 Wang X, Zhang A, Wang P, et al. Metabolomics coupled with proteomics advancing drug discovery toward more agile development of targeted combination therapies. Mol Cell Proteomics, 2013,12(5):1226-1238.
13 丁霞,蒙一纯,贲长恩,等. 酒精性肝纤维化动物模型的建立. 中国中医基础医学杂志,1999,5(7):47-48.
14 Zhang A, Yan G, Zhou X, et al. High resolution metabolomics technology reveals widespread pathway changes of alcoholic liver disease. Mol Biosyst, 2016,12(1):262-273.
15 聂青和. 肝纤维化的逆转策略及研究现状. 世界华人消化杂志, 2005,13(10):1165- 1174.
16 孙月庭,刘斌剑,万军,等. 对氨基苯甲酸甘氨酸结合代谢率定量检测试验对白兔肝功能的研究. 中华肝脏病杂志, 2001, 9(4):240-241.
17 Nagai K, Fukuno S, Oda A, et al. Protective effects of taurine on doxorubicin-induced acute hepatotoxicity through suppression of oxidative stress and apoptotic responses. Anticancer Drugs, 2016,27(1):17-23.
18 劳美铃,郎江明. 酒精性肝病糖代谢异常的中西医结合治疗. 环球中医药,2010,3(1);68-70.
19 冯小平,蒋滢,黄美英. 急性肝损伤大鼠模型的血浆氨基酸代谢变化模式. 氨基酸杂志,1994,1:17-19.
20 李慧,刘其南,高叶,等. 二至丸干预大鼠急性酒精肝损伤的尿液代谢组学研究. 中国医院药学杂志, 2016,36(19):1665-1670.
A Metabonomic Study on the Protective Effects of Yin Chen Hao Decoction and Its Component Group on Rats with Alcoholic Liver Injury
Yan Guangli, Zhou Xiaohang, Sun Hui, Wang Yangyang, Wang Yuying, Wang Yumei, Zhang Aihua, Wang Xijun
(Research Center of Chinmedomics-State Administration of TCM-Laboratory of Metabolomics / National TCM KeyLaboratory of Serum Pharmacochemistry / Sino-US Chinmedomics Technology Cooperation Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
The present investigation was designed to evaluate the protective effects of Yin Chen Hao Decoction (YCHD) and its component group consisting of scoparone, geniposide and rhein on rats with liver injury induced by long-term excessive intake of alcohol using metabonomic technologies and typical pharmacodynamics indexes. Wistar rats had been administered with the mixed solution of alcohol, corn oil and pyrazole and high fat diet for 12 weeks to establish the alcoholic liver injury rat model. At the start day of modeling, rats were intragastricly administered with YCHD and its component group involving scoparone, geniposide and rhein. At the end of the 12thweek, the serum concentrations of ALT, AST, ALP, TG, T-BIL, TP, ALB, CHOL, HA, LN, PCIIINP and CIV were detected and so were the contents of HYP, γ-GT, MDA, TBA, SOD and GSH-PX in the liver. Meanwhile, the pathological examinations of left lobe of liver sections were implemented with HE and Masson staining. Finally, urine endogenic metabolites profiling data and vital biological information of alcoholic liver injury were gleaned using UPLC-Q/TOF-MS-based metabonomic technology. The regulations of biomarkers in the control group, the model group, the YCHD group and the component group were quantified with the pattern recognition and statistics technology. As a result, YCHD and its component group successfully suppressed the changes of ALT, AST, ALP, TG, T-BIL, TP, ALB, CHOL, HA, LN, PCIIINP, CIA, Hyp, γ-GT, MDA, TBA, SOD and GSH-Px with the long-term excessive intake of alcohol. Liver inflammatory cell infiltration and liver fibrosis were improved, while the metabolic profile was far from the model group but close to the control group. Among the 21 biomarkers of alcoholic liver injury rats, 10 biomarkers recovered to normal levels. In conclusion, YCHD presented favorable effects on liver injury rats induced by the long-term excessive intake of alcohol. The combination of scoparone, geniposide and rhein played a representative biological role in the treatment of YCHD, which laid a foundation for the development of some innovative drugs of alcohol liver injury.
Yin Chen Hao decoction, scoparone, geniposide, rhein, alcoholic liver injury, therapeutic effect, metabonomics
10.11842/wst.2016.10.014
R285.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-19
修回日期:2016-10-12
* 国家自然科学基金委重点项目(81430093):中药体内药效物质基础的系统分析方法学——中医方证代谢组学研究,负责人:王喜军;科学技术部“重大新药创制”国家科技重大专项(2015ZX09101043-011):中药经典名方整合作用机制关键技术研究,负责人:王喜军。
** 通讯作者:王喜军,本刊编委,教授,博士生导师,主要研究方向:中药血清药物化学及中医方证代谢组学研究。
