基于细胞代谢组学技术的关黄柏潜在有效成分木兰碱对前列腺癌细胞的治疗作用研究*
2016-03-20张天雷李先娜张爱华
张天雷,邱 时,李先娜,张爱华,孙 晖
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
基于细胞代谢组学技术的关黄柏潜在有效成分木兰碱对前列腺癌细胞的治疗作用研究*
张天雷,邱 时,李先娜,张爱华,孙 晖**
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
目的:本文在木兰碱药效学研究基础之上,进行基于UPLC-HDMS/MS技术的细胞代谢组学研究,探讨木兰碱抗前列腺癌的潜在作用机制。方法:将对数期22RV1前列腺癌细胞以适宜密度接种并分为空白组及木兰碱给药组,以细胞形态学观察、MTT比色法以及流式细胞术分析前列腺癌细胞系22RV1在给药前后的细胞形态变化、细胞存活和增殖状况以及药物诱导凋亡的作用和作用强度,从药效学角度评价木兰碱的体外抗前列腺癌活性。进一步提取前列腺癌细胞内液并利用高通量液质联用技术平台对细胞代谢轨迹进行研究,揭示木兰碱给药前后内源性差异代谢物变化情况。结果:研究发现木兰碱能通过诱导22RV1前列腺癌细胞凋亡而抑制其增殖,给药后细胞生长状况明显变差,显微镜下难以见到分裂细胞,培养基中散在大量细胞碎片。本研究共鉴定了肌醇、鞘磷脂等13个药效生物标志物;代谢经路研究显示包括淀粉和蔗糖代谢、核黄素代谢、半胱氨酸和蛋氨酸代谢等7条能量代谢及氨基酸代谢途径发生明显扰动。结论:木兰碱对22RV1前列腺癌细胞系有明显体外增殖抑制作用,潜在机制为对多种能量及氨基酸等代谢途径的干预作用。本研究阐明木兰碱治疗前列腺癌的整体效应机制,可为发现临床有效且毒副作用小的抗前列腺癌药物提供一定依据。
木兰碱 前列腺癌 代谢组学 生物标志物
前列腺癌(Prostate Cancer,PCa)是一种临床常见的男性恶性肿瘤,发病隐匿、早期诊断较为困难,至症状出现并采取治疗措施时往往已错过最佳时机,还易发生淋巴转移及骨转移[1],在欧美国家发病率居男性恶性肿瘤之首,死亡率则仅次于肺癌。近年来中国前列腺癌发病率也呈快速上升趋势,严重威胁男性健康。传统的治疗手法包括激素治疗及手术摘除,晚期前列腺癌以放、化疗和免疫疗法为主。但晚期前列腺癌病程后期往往转化为激素抵抗型前列腺癌,内分泌疗法难以奏效[2-4]。同时传统化疗药物有很大毒副作用以及多耐药问题。因此从天然药物中寻找高效低毒的抗癌活性成分,成为新药研发的重要途径。关黄柏为常用传统中药,被《神农本草经》列为上品,是芸香科黄柏属植物黄檗Phellodendron amurense Rupr.的干燥树皮。多种针对关黄柏的研究证实其具有抗菌消炎、抗癌、前列腺渗透、改善免疫力以及降压等功效。近年来对黄柏所含的多种化学活性成分展开了深入研究,关黄柏主要活性成分是生物碱类,被认为是其药效的主要部分,如:小檗碱、木兰碱等。本课题组前期研究表明木兰碱是关黄柏主要入血成分之一。本研究以关黄柏潜在有效成分木兰碱为研究对象,进行前列腺癌细胞系22RV1体外增殖抑制的代谢组学研究,在药效评价的基础之上确定木兰碱抗前列腺癌的药效生物标志物并进行代谢通路的分析。
1 材料与方法
1.1 细胞系
本研究采用22RV1前列腺癌细胞系,该细胞系是常见的恶性前列腺癌细胞系,也是研究高侵袭性激素抵抗型前列腺癌的理想细胞系[5]。该细胞系经由南京科佰生物科技有限公司进口自美国ATCC细胞库。
1.2 药品与试剂
木兰碱标准品购自中国药品生物制品检定所。胎牛血清(美国Gibico公司,批号:10099-141);胰蛋白酶(美国Hyclone公司,批号:SH30042.01B);二甲基亚砜(DMSO)、MTT(美国Sigma公司,批号:M2128-100MG);RPMI-1640细胞培养液(美国Hyclone公司,批号:SH30027.01 1X);Viacount细胞计数试剂、细胞凋亡检测试剂盒(美国Millipore公司,批号:PF032-1EACN)。亮氨酸脑啡肽(美国Sigma公司);乙腈、甲醇(色谱级,德国Merck技术有限公司);甲酸(色谱级,天津科密欧化学试剂有限公司);蒸馏水(广州屈臣氏食品饮料公司)。
1.3 仪器与耗材
生物安全柜(北京东联哈尔仪器制造有限公司,型号:BSC-1100-LIIA2);数显加热锅(德国IKA公司,型号:HB10 digital);流式细胞仪(美国Merck-Millipore公司); CO2培养箱(日本SANYO公司,型号:MCO-175);倒置式基础型显微镜(日本OLYMPUS公司,型号:IX51);酶联免疫分析仪(美国PerkinElmer公司);高速低温离心机(美国ThermoFisher公司,型号:ST-16R);PB1501-N型电子分析天平(瑞士Mettler-Toledo公司);Waters AcquityTM UPLC液相色谱仪、Waters SynaptTM High Definition MS(HDMS/MS)System质谱仪、MassLynx V4.1工作站(美国Waters集团公司);微孔滤器(美国Millipore公司);多规格培养皿(丹麦Nunc公司)。
2 方法
2.1 细胞培养
液氮冻存的22RV1人前列腺癌细胞系 37℃水浴快速融化,离心弃上清后细胞以含有10%胎牛血清的RPMI1640培养基重悬,于CO2培养箱(37℃,5%CO2,饱和湿度)内进行培养,次日换液,并于倒置显微镜下观察细胞生长状态。当细胞生长至培养贴壁面积的 80%-90%时进行传递培养。
2.2 体外肿瘤生长抑制试验
MTT比色法是用来检测细胞存活和生长的一种方法。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。该方法已广泛用于一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等。利用MTT法检测木兰碱是否对22RV1前列腺癌细胞系具有增殖抑制作用,计算其抑制率及IC50值。精密称定木兰碱标准品5.48 mg以1 mL DMSO配制成16 mM浓度的母液,避光-20℃冷冻保存。临用时以RPMI1640培养液稀释至工作浓度(5、10、20、40、80、160 μM)进行体外增殖抑制作用考察,考察时间设置为24、48、72 h。观察药物的体外增殖抑制作用,对照组抑制率为0%。
取对数生长期细胞按适宜密度接种于96孔培养板中,边缘孔加入200 μL PBS溶液。培养24 h后按组别加入不同浓度的木兰碱含药培养液,设置空白培养基对照,每组设置6个平行孔,继续培养24、48、72 h。到达相应时间后用倒置光学显微镜观察细胞生长状况及形态改变并拍照记录。然后先离心弃去培养液,每孔以PBS小心润洗2-3遍后均加入20 μL MTT溶液(5 mg·mL-1),继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入150 mL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD 570 nm处测量各孔的吸光值。实验重复3次,得到的各个孔吸光度OD值按以下公式计算抑制率:
抑制率%=(1-OD加药组/OD对照组)×100%用平均抑制率作图,应用SPSS 19.0软件计算IC50值。
2.3 Annexin V/PI双染法检测细胞凋亡
凋亡是细胞死亡的一种基本形式,它在胚胎发育、组织分化和一些疾病发生过程中起着重要的调控作用。在该方法中FITC 标记的Annexin V可以用来检测细胞凋亡。Propidium Iodide(PI)被用来区分存活的早期细胞和坏死或晚期凋亡细胞。本文研究木兰碱对22RV1前列腺癌细胞系是否有诱导凋亡的作用。
调整细胞密度到大约 1×106细胞/mL。将 0.5 mL细胞悬液从细胞培养瓶中(5×105个细胞)转移到一个干净的离心管内。加入10 μL培养基结合试剂。加入1.25 μL Annexin V-FITC。室温(18-24℃)避光反应15 min。室温1 000×g离心5 min,去除培养基。将细胞用0.5 mL 1×结合缓冲液轻轻重悬。加入10 μL PI。将样本放置在冰上避光保存。立即用流式细胞仪检测分析。
2.4 细胞代谢组学样本制备
取对数生长期细胞按合适密度接种于48孔培养板中,边缘孔加入200 μL PBS缓冲液。培养24 h后给药组加入含木兰碱40 μM的培养液,设置空白培养基对照,每组设置6个平行孔。继续培养72 h后分别吸取培养液至标记好的、对应的A组洁净离心管中,4℃、1 500 rpm离心5 min。以胰蛋白酶消化细胞,待细胞开始变圆脱落后终止消化迅速转移至标记好的、对应的B组洁净离心管中,4℃、1 500 rpm离心5 min。A、B组均小心弃去上清,以PBS缓冲液合并对应的A、B两组离心后底层的细胞。以移液器轻轻吹打混匀后4℃、1 500 rpm离心5 min。弃去上清后重复PBS溶液清洗离心步骤一次。再次弃去上清后迅速加入1 mL 20℃冷甲醇淬灭细胞。适当涡旋后将淬灭后的细胞于冰浴下超声波破碎(20 W,3 min),充分释放细胞内容物。4℃、10 000 rpm离心15 min后取上清,过0.22 μm微孔滤膜后滤液供代谢组学分析。
2.5 细胞代谢组学数据采集
色谱条件:ACQUITY UPLCTM BEH C18(100 mm ×2.1 mm i.d.,1.7 μm)色谱柱;柱温:40℃;流速:0.4 mL·min-1;进样量3 μL。流动相0.1%甲酸乙腈(A)-0.1%甲酸水(B);梯度洗脱条件:0-1 min,1%A;1-2 min,1%-40%A;2-5 min,40%-75%A;5-8 min,75%-99%A。质谱条件:正、负离子模式,毛细管电压正离子模式3.0 kV,负离子模式2.8 kV;锥孔电压正离子模式30 V,负离子模式35 V;提取电压3.0 V,离子源温度110℃,脱溶剂气温度350℃,锥孔气流量为50 L·h-1,脱溶剂气流量600 L·h-1。亮氨酸-脑啡肽([M+H]+=556.277 1,[M-H]-=554.277 1)溶液为锁定质量溶液。质量扫描范围:m/z 50-1 000。
2.6 数据处理
利用已建立的分析方法进行样品正、负离子模式全扫描,得到样品组个体样本的内含三维信息的代谢轮廓图。采用MassLynx V4.1软件进行色谱峰识别匹配,对数据提取和标准化处理后,利用Ezinfo 2.0软件首先进行无监督模式的主成分分析(PCA),绘制出反映组间聚集和离散程度的PCA得分图和3D-PCA得分图。之后提取空白对照组及72 h给药时间点样本数据,进行PCA分析,排除其他因素干扰获得与药物作用相关的得分图。
为了找到对代谢轮廓变化起关键性作用的内源性代谢物,对细胞代谢轮廓数据进行配对偏最小二乘判别分析(Orthonal Partial Least Square-Discriminate Analysis,OPLS-DA)分析,获得VIPPlot、Loading Plot。离中心越远的离子对对其分组贡献越大。结合相关的反应离子贡献度的变量权重值(VIP)进行分析,在VIP散点图中,离子碎片呈V型排列,底部离子(VIP值小),对代谢轮廓轨迹产生变化的贡献率小;顶端离子(VIP值大),对代谢轮廓轨迹产生变化的贡献率大。在Loading plot中,依据载荷图中距离远点越远,离子对代谢轮廓轨迹产生变化的贡献越大。同时对各组所获得计量资料信息数据进行统计学分析,比较两组间差别是否具有统计学意义,基于P<0.05作为筛查条件,作为潜在生物标记物集合。为了验证多维统计中找到的差异物是否在统计上具有显著差别,使用SPSS 19.0软件进行统计学处理,组间比较采用t检验,检验标志性代谢物组间差异的显著性。通过代谢物的精确质核比在HMDB*http∶//www.hmdb.ca/https∶//metlin.scripps.edu/和MTELIN**http∶//www.hmdb.ca/https∶//metlin.scripps.edu/数据库中搜索可能的结构式进行推测,对由统计学意义的代谢物进行检索对比,确定差异代谢物及相关代谢途径。
3 结果
3.1 体外肿瘤生长抑制实验
MTT实验显示,木兰碱对22RV1前列腺癌细胞系具有一定的增殖抑制作用,在设置的浓度范围内具有明显的剂量和时间依赖性:木兰碱作用浓度较低、作用时间较短时抑制作用较差,随着剂量和作用时间的增加,抑制作用逐渐增强,48、72 h呈现较为明显的增殖抑制作用。经计算48 h的木兰碱IC50值为到73.613 μM;72 h的木兰碱IC50值达到45.455 μM。以上结果显示木兰碱对22RV1人前列腺癌细胞系较强的抗癌活性。详见表1。
显微观察显示,对照组细胞贴壁良好、延展充分、折光度好,培养基清澈无杂质,可见大量分裂期细胞。而随着木兰碱作用时间的延长、浓度的升高,细胞呈现明显生长抑制状态:贴壁细胞数量逐渐减少,培养液中密布细胞碎片。剩余贴壁细胞生长状态较差,间距变大,生长受限,视野少见分裂期细胞。尤其160 μM木兰碱作用72 h后可见视野中仅剩余少量贴壁细胞且生长状态很差,多数细胞已经死亡。详见图1。
3.2 Annexin V/PI双染法检测细胞凋亡
Annexin V-FITC和PI双染结果显示:空白对照组细胞集中分布于流式散点图左下象限,有极少荧光信号,说明对照组细胞无凋亡情况。而木兰碱给药组(160 μM)作用于22RV1前列腺癌细胞系24、48、72 h后,可见凋亡细胞比例逐渐增高并与72 h达到最高62.92%±2.21%(P<0.01)。上述结果表明木兰碱能显著诱导22RV1前列腺癌细胞凋亡的发生,这一点与文献报道一致。详见图2。
3.3 细胞代谢组学分析
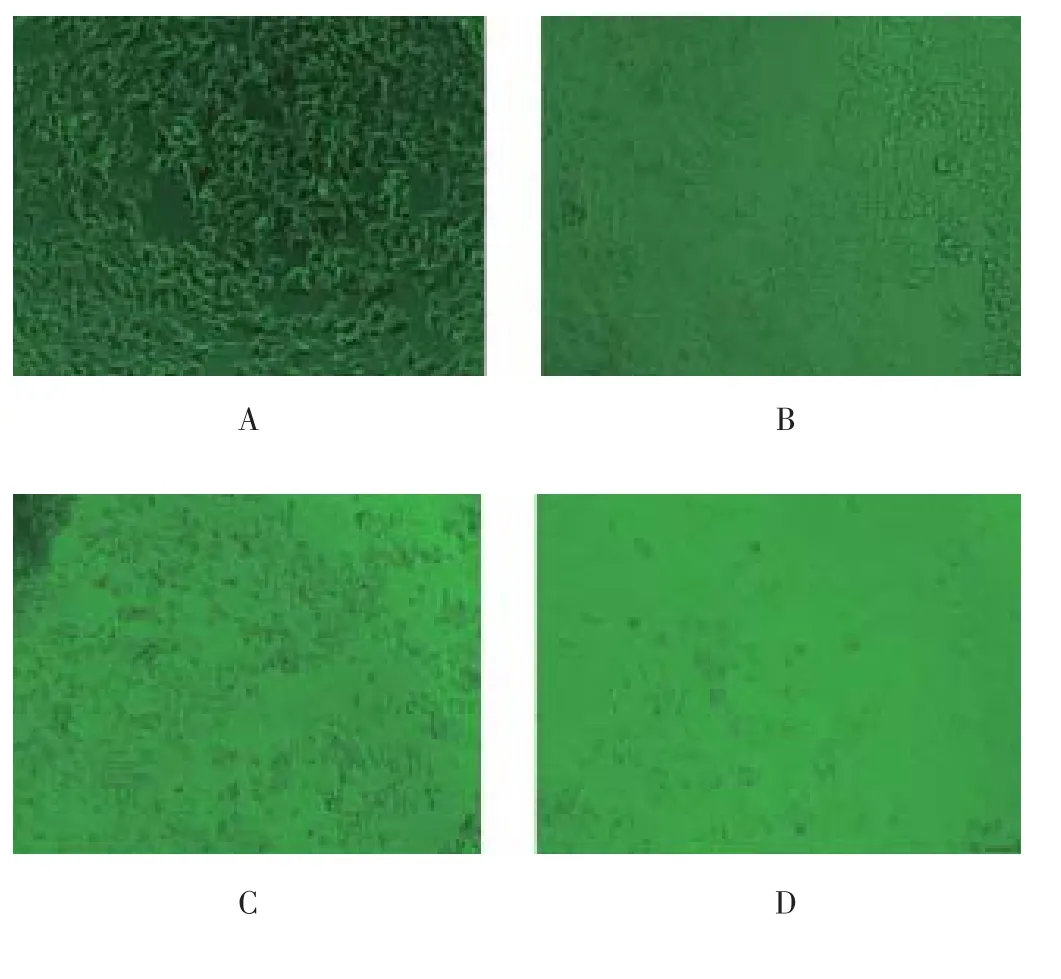
图1 22RV1前列腺癌细胞形态观察(×100)

表1 木兰碱对22RV1前列腺癌细胞系增殖抑制作用(n=6)
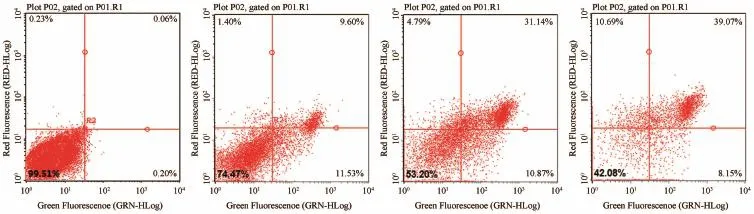
图2 木兰碱诱导前列腺癌细胞系22RV1凋亡作用
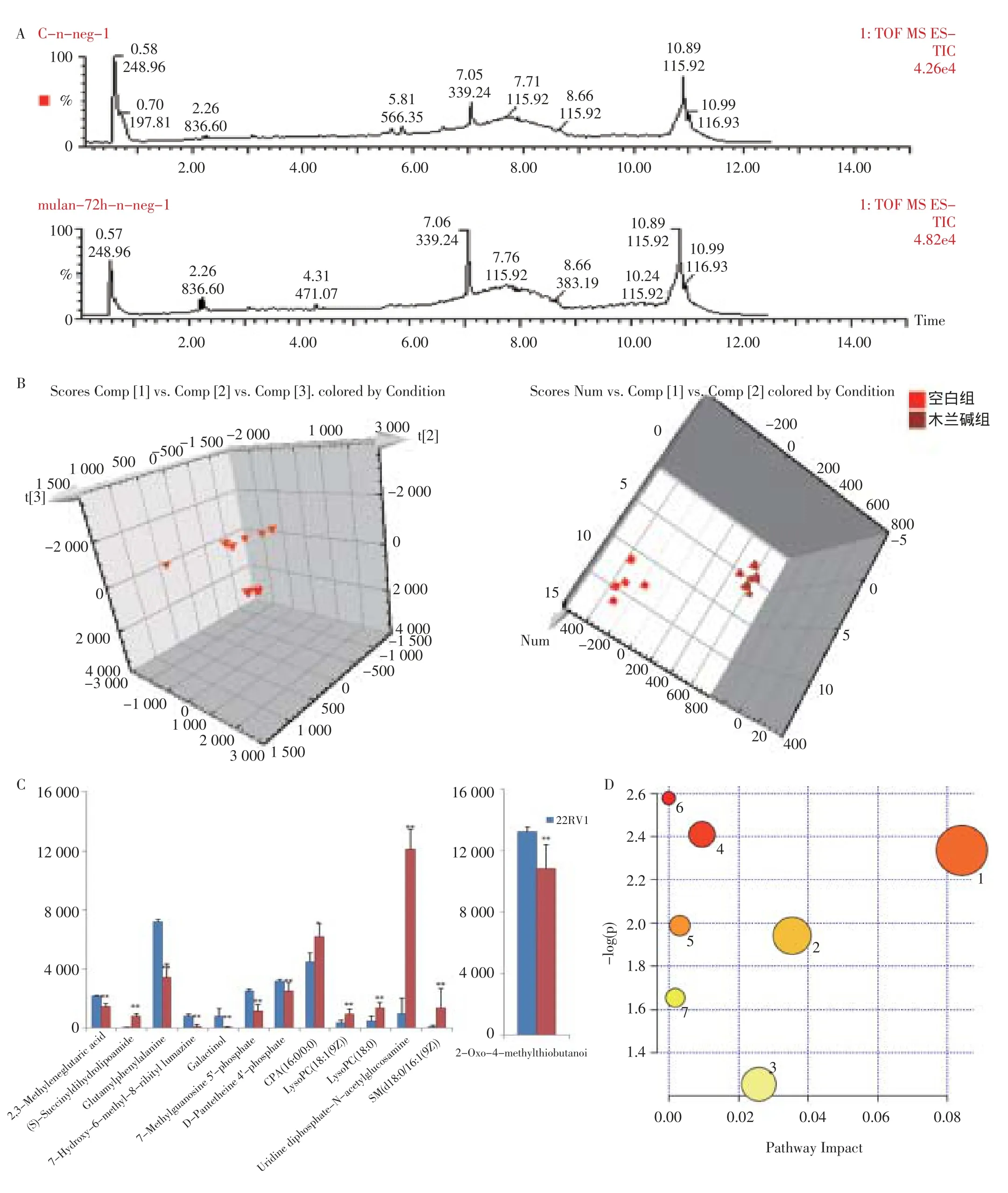
图3 木兰碱对22RV1前列腺癌细胞系体外增殖抑制作用的代谢组学评价
利用已建立的分析方法进行样品正、负离子模式全扫描,得到样品组个体样本的内含三维信息的代谢轮廓图。细胞代谢样本的典型总离子流图见图3A。正、负离子模式下的PCA分析结果显示空白组及木兰碱组内聚类良好并且在三维空间上组间组分明显,表明木兰碱给药后22RV1前列腺癌细胞系代谢轮廓发生明显改变(图3B)。对VIP值贡献大的潜在生物标记物进行结构解析,确定内源性生物标记物。采用HDMS/MS的方法测定标记物的精确信息,得到测定误差范围内相应的可能的化学物分子式;通过分子式及分子质量在HMDB及KEGG等检索数据库进行检索,结合MS/MS选出可能的一种或几种化合物,最终通过色谱保留行为以及MS/MS数据来确定标记物的化学结构。共鉴定出木兰碱抗22RV1增殖作用的13个潜在生物标记物,分别为:2-氧代-4硫代甲基丁酸(2-Oxo-4-methylthiobutanoic acid),2,3-亚甲戊二酸 (2,3-Methyleneglutaric acid),s-琥珀酰二氢硫辛酰胺((S)-Succinyldihydrolipoamide),谷氨酰苯丙氨酸(Glutamylphenylalanine),7-羟基-6-甲基-8-核糖基二氢蝶呤(7-Hydroxy-6-methyl-8-ribityl lumazine),肌醇(Galactinol),泛酸4’-磷酸(D-Pantetheine 4'-phosphate),7-甲基鸟苷5磷酸(7-Methylguanosine 5'-phosphate),环状磷脂酸(16∶0/0∶0)(CPA(16∶0/0∶0)),溶血磷脂酰胆碱(18∶1(9Z))(LysoPC(18∶1(9Z))),溶血磷脂酰胆碱(18∶0)(LysoPC(18∶0)),尿苷二磷酸乙酰葡萄糖胺(Uridine diphosphate-N-acetylglucosamine),鞘磷脂(d18∶0/16∶1(9Z))(SM(d18∶0/16∶1(9Z)))。详见表2。
将鉴定得到的木兰碱抗前列腺癌相关的生物标记物进行MetPA分析,得到与治疗作用密切相关的7个代谢通路,包括淀粉和蔗糖代谢、核黄素代谢、戊糖、葡萄糖醛酸转换、半乳糖代谢、半胱氨酸和蛋氨酸代谢、鞘脂类代谢、精氨酸和脯氨酸代谢。这些结果说明这些内源性代谢产物在整个代谢轨迹中产生了强烈的扰动并且与木兰碱治疗作用密切相关(图3D)。
4 讨论
肿瘤是遗传事件异常的不良后果,这一观点得到了广泛认可[6-9]。基因在系统生物学中处于上游部位,上游的异常经过一系列级联反应不断放大最终在多种层面产生一系列复杂后果。肿瘤细胞的代谢重编程包含了能量代谢、核酸代谢、脂肪酸代谢异常等多种事件的显著改变[10]。代谢组学可以作为癌症研究的一项有力工具[11]。关黄柏为常用传统中药,被《神农本草经》列为上品,关黄柏性味苦寒,清热泻火而坚阴“主五脏肠胃中结热、黄疸、肠痔、止泻痢、女子漏下赤白、阴伤蚀疮”[12,13]。关黄柏主要活性成分是生物碱类,被认为是其药效的主要部分。按照结构可划分为原小檗碱类生物碱、阿扑吗啡类生物碱、喹啉类生物碱和单萜吲哚类生物碱[14]。其中木兰碱属于阿扑吗啡类生物碱。生物碱类多数具有生理活性,往往是许多中药的起效成分[15]。结合细胞生物学药效学研究部分可以看出,木兰碱对前列腺癌细胞系22RV1的体外增殖有明确抑制效果。本研究在药物治疗有效的基础之上,从代谢谱的角度,揭示治疗前后,对代谢轮廓的区分影响较大的生物标志物以及相关代谢通路。通过标志物的归类、比较可以看出,代谢谱作为系统生物学下游的、具有终端表征特点的一类观察角度,可以很好的反映药效。
2,3-亚甲戊二酸是支链脂肪酸家族的一员。前列腺癌细胞的旺盛增殖和迁移、浸润需要大量的能量,其能量需求依赖于线粒体脂肪酸β-氧化,即2,3-亚甲戊二酸参与的β-氧化过程很可能是前列腺癌细胞发生、发展过程中的主要能量来源,能够促进前列腺癌细胞在代谢应激状态下的存活与增殖[16]。同时肿瘤细胞的大量增殖也需要膜的合成,这一过程同时依赖于脂肪酸的从头合成过程。因此前列腺癌组织可见明显的脂类代谢异常,支链脂肪酸如∶2,3-亚甲戊二酸的代谢异常介导了前列腺癌细胞的恶性增殖[17]。药物治疗后支链脂肪酸的水平降低表明黄柏活性成分木兰碱能够抑制前列腺癌细胞系22RV1的能量代谢,从一定程度上逆转脂肪酸β-氧化代谢的异常,抑制前列腺癌细胞的增殖,促进肿瘤细胞干性丢失。
谷氨酰苯丙氨酸是γ-谷氨酰转肽酶(Gamma-Glutamyltransferase,γ-GT)这一关键酶作用于底物谷胱甘肽及苯丙氨酸的代谢产物。谷氨酰苯丙氨酸水平的异常增高可以反映谷胱甘肽代谢关键酶γ-GT活性的异常增高,使得谷胱甘肽经过γ-GT作用与游离氨基酸结合,造成底物耗竭。谷胱甘肽是凋亡小体形成的必要条件之一,内源性谷胱甘肽的含量降低使的其原生的诱导细胞凋亡的效果减弱[18,19]。谷氨酰苯丙氨酸在给药后显著降低,可能是木兰碱能够抑制γ-GT活性,稳定谷胱甘肽代谢从而改善前列腺癌发生时前列腺功能和症状。
7-羟基-6-甲基-8-核糖基二氢蝶呤(7-Hydroxy-6-methyl-8-ribityl lumazine)简称CRM,是核黄素代谢的产物,由6,7-二甲基-8-(1-D-核糖基)24
二氢蝶呤( 6,7-Dimethyl-8-(1-D-ribityl)lumazine,DMDRL)转化而来。核黄素代谢途径的生理活性十分广泛,是许多氧化还原酶系统的辅酶,因而核黄素代谢异常可以影响许多代谢过程的正常进行,如:能量代谢。核黄素稳态增加可能是癌症发生的一个环节,这一现象有助于增强癌细胞的能量代谢水平从而维持其快速生长和分裂过程[20]。在本实验中观察到前列腺癌组由DMDRL转化为CRM的途径较给药治疗组为高,而治疗后这一情况得到逆转,由于核黄素代谢途径影响的广泛性,多种酶系的异常都可能得到一定程度的纠正,从而起到治疗效果。

表2 木兰碱抗22RV1增殖作用的潜在生物标记物信息
2-氧代-4硫代甲基丁酸(2-Oxo-4-methylthiobutanoic acid,KMTB),是半胱氨酸和蛋氨酸代谢途径的重要节点物质之一,是甲硫基丙醛的直接前体物质,而研究表明甲硫基丙醛具有强烈的诱导凋亡效果[21]。KMTB同时参与维持细胞膜结构的完整性与稳定性。它可以参与泛酸和辅酶A代谢途径中重要节点物质硫酸泛酰巯基乙胺(又名泛酸-4-磷酸,D-Pantetheine 4'-phosphate)的合成,后者是泛酸和辅酶A生物合成的主要产物之一。KMTB的显著降低可能与硫酸泛酰巯基乙胺含量呈现直接相关,木兰碱给药组即可观察到这两种小分子代谢产物相比前列腺癌组均呈现显著下降趋势。给药后KMTB含量的下降,其直接原因可能是进入下一步合成促凋亡物质甲硫基丙醛合成增多,同时其稳定膜结构功能减弱,从而促进肿瘤细胞凋亡;另外半胱氨酸和蛋氨酸代谢途径与下游的泛酸及辅酶A代谢有内在联系,后者直接参与包括能量代谢及多种物质合成反应的酶体系,其缺乏会导致相应辅酶而受限,导致肿瘤细胞增殖障碍,而起到增殖抑制效果。
参与细胞膜结构的磷脂类物质在代谢中会产生许多磷脂代谢产物其中有许多物质属于重要的信号分子,直接参与细胞生长调控。环状溶血磷脂酸CPA(16:0/0:0)是溶血磷脂酸类物质的一种,该物质经给药治疗后明显上升。它对DNA聚合酶有抑制作用的物质,其含量升高可以对肿瘤细胞的迁移及浸润起到显著抑制效果,很可能与药效学形态学观察时,前列腺癌细胞的贴附以及伸展能力的降低直接相关,在体时应能明显抑制肿瘤细胞的运动能力,这一作用也可能与CPA(16:0/0:0)参与膜结构运动能力相关[22]。SM(d18:0/16:1(9Z))、LysoPC(18:0)以及LysoPC(18:1(9Z))均属于磷脂代谢的信号物质分子,这些物质的显著改变表征了磷脂代谢紊乱所导致的细胞生长失调是癌症进程的一个重要标志。
从以上潜在生物标志物的生物学意义可以看出肿瘤在体内是十分独立而又独特的代谢体系,木兰碱能够从一定程度上逆转肿瘤这一代谢体系的代谢重编程过程,有助于肿瘤细胞内异常代谢过程的纠正,从而平衡细胞凋亡逃逸、过度增殖等不良事件。从以上论述还可以看出一个问题,代谢限速酶作为复杂生化反应体系当中的关键成员,在代谢的重编程中占有重要地位,影响其下游多种物质的代谢。因此,可以合理推断木兰碱对关键酶的影响可能是其作用关键之一,对关键限速酶活性的调节,抑制了包括能量代谢以及肿瘤营养供给等多个节点,造成肿瘤细胞增殖过程中的多个环节向正常组织细胞的方向回调从而产生治疗作用。
1 温思萌.去势抵抗性前列腺癌增殖转移机制及其干预治疗.天津:天津医科大学博士学位论文,2014:39-40.
2 刘欢欢.去势抵抗性黄檗叶提取物及黄柏苷对HepG2细胞的影响.长春:吉林大学硕士学位论文,2015:2-6.
3 田原僮.小檗碱通过靶向AKR1C3抑制去势抵抗性前列腺癌细胞生长的作用及机制研究.长春:吉林大学博士学位论文, 2014:12-20.
4 Lu W, Du S, Wang J. Berberine inhibits the proliferation of prostate cancer cells and induces G0/G1or G2/M phase arrest at different concentrations. Mol Med Rep, 2015(11):3920-3924.
5 Liu C H, Tang W C. Berberine inhibits the metastatic ability of prostate cancer cells by suppressing epithelial-to-mesenchymal transition (EMT)-associated genes with predictive and prognostic relevance. Int J Med Sci, 2015(12): 63-71.
6 肖兰博. EB病毒介导的肿瘤细胞代谢改变及其重编程的分子机制研究.长沙:中南大学,2013.
7 Venkatanarayan A, Raulji P, Norton W, et al. IAPP-driven metabolic reprogramming induces regression of p53-deficient tumours in vivo. Nature, 2015, 517(7536): 626-630.
8 Jin G Z, Yu W L, Dong H, et al. SUOX is a promising diagnostic and prognostic biomarker for hepatocellular carcinoma. J Hepatol, 2013, 59(3): 510-517.
9 Tan J, Jin X, Zhao R, et al. Beneficial effect of T follicular helper cells on antibody class switching of B cells in prostate cancer. Oncol Rep,2015, 33(3): 1512-1518.
10 杜稳斌.前列腺癌组织中谷胱甘肽S转移酶P1基因启动子区域甲基化序列分析.上海:第二军医大学,2008.
11 Zhang A, Sun H, Xu H, et al. Cell metabolomics. OMICS, 2013, 17(10): 495-501.
12 刘元丰.雄激素受体基因多态性ARStuI与前列腺癌关系的研究.重庆:第三军医大学硕士学位论文,2005:1-10.
13 中国植物志编委会.中国植物志.科学出版社,1997:99-103.
14 国家药典委员会.中华人民共和国药典(2010版第一部).中国医药科技出版社, 2010.
15 李丹丹,江培.黄柏的化学成分、药理作用及临床应用的研究进展.黑龙江医药,2014(3):601-605.
16 水冰. AMACR,p63和HCK及PSAP表达在前列腺癌诊断中的价值.上海:第二军医大学硕士学位论文,2006:3-18.
17 Wu X, Daniels G, Peng L, et al. Lipid metabolism in prostate cancer. Am J Clin Exp Urol, 2013,2(2):111-120.
18 李墨农.谷氨酰半胱氨酸连接酶在膀胱癌中表达的研究.济南:山东大学博士学位论文,2014:2-20.
19 Huang J, Mondul A M, Weinstein S J, et al. Serum metabolomic profiling of prostate cancer risk in the prostate, lung, colorectal, and ovarian cancer screening trial. Br J Cancer, 2016, 115(9): 1087-1095.
20 Bassett J K, Severi G, Hodge A M, et al. Dietary intake of B vitamins and methionine and prostate cancer incidence and mortality. Cancer Causes Control, 2012, 23(6): 855-863.
21 Quash G, Roch A M, Chantepie J, et al. Methional derived from 4-methylthio-2-oxobutanoate is a cellular mediator of apoptosis in BAF3 lymphoid cells. Biochem J, 1995, 305(Pt3): 1017-1025.
22 Baker D L, Fujiwara Y, Pigg K R, et al. Carba analogs of cyclic phosphatidic acid are selective inhibitors of autotaxin and cancer cell invasion and metastasis. J Biol Chem, 2006(32): 22786-22793.
Therapeutic Effects of Magnoline Acting as a Potential Effective Component of Phellodendron Amurense Rupr. on Prostate Cancer Based on the Cell Metabolomics
Zhang Tianlei, Qiu Shi, Li Xianna, Zhang Aihua, Sun Hui
(Research Center of Chinmedomics-State Administration of TCM-Laboratory of Metabolomics / National TCM Key Laboratory of Serum Pharmacochemistry / Sino-US Chinmedomics Technology Cooperation Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
This study explored the mechanism behind the inhibitory effects of magnoline on proliferation of human prostate cancer cell line 22RV1 with cell metabolomic technology, for example, the UPLC-HDMS/ MS, based on pharmacodynamics studies of magnoline. The prostate cancer cell line, 22RV1, in the period of logarithmic phase, was inoculated with an appropriate density and divided into the control group and the magnoline group. Compared with those before any treatment, cell morphological changes, cell survival rate, its proliferation, the effectiveness of drug induced apoptosis and its intensity were analyzed after administration, with the cell morphological observation, MTT assay and flow cytometry analysis. On the basis, the antitumor activity of magnoline in prostate cancer was evaluated in vitro in terms of pharmacodynamics. Moreover, the intercellular fluid of prostate cancer cells was extracted to explore the cellular metabolic trajectory with the utilization of high-throughput HPLCMS technology and expounded the differences of endogenous metabolites before and after the administration of magnoline. It was found that magnolia inhibited the proliferation of 22RV1 in a dose and time dependent manner by the apoptosis induction of 22RV1 compared with the control group. And the cells were growing in a state of sickness after administration featuring rare sprinter cells and massive cell debris under the microscope. Furthermore, the cell metabolomic study based on UPLC-HDMS/MS was conducted to reveal the underlying mechanism of pesticide effect. A total of 13 pharmacodynamic biomarkers with the instance of inositol and sphingomyelin were identified. Metpa analysis was applied to find out 7 obviously disturbed metabolic pathways, including starch and sucrose metabolism, riboflavin metabolism, cysteine and methionine metabolism. In conclusion, magnoline suppressed the proliferation of the prostate cancer cell line, 22RV1, in vitro, behind which the potential mechanism was the therapeutic effect of metabolic pathways, such as energenic metabolism and amino acid metabolism. This study elucidated the integral effect of magnoline on treating prostate cancer, which laid a foundation for the development of anti-tumor drugs of prostate cancer with favorable efficacy and less side effect in clinic.
Magnoline, prostate cancer, metabolomics, biomarkers
10.11842/wst.2016.10.013
R285
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-09-19
修回日期:2016-10-13
* 国家自然科学基金委面上项目(81173500):基于知柏地黄丸配伍环境的关黄柏治疗肾阴虚相火亢盛的药效物质基础研究;负责人:孙晖。
** 通讯作者:孙晖,教授,博士生导师,主要研究方向:中药血清药物化学及中医方证代谢组学研究。
