利用血液代谢组学研究关黄柏生物碱对慢性非细菌性前列腺炎模型大鼠的干预作用*
2016-03-20李先娜李瑞芳岳姝崎张爱华王喜军
孙 晖,李先娜,张 颖,李瑞芳,岳姝崎,张爱华,王喜军
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
利用血液代谢组学研究关黄柏生物碱对慢性非细菌性前列腺炎模型大鼠的干预作用*
孙 晖,李先娜,张 颖,李瑞芳,岳姝崎,张爱华,王喜军**
(黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心/国家中医药管理局中药血清药物化学重点研究室/中美中医方证代谢组学技术合作中心 哈尔滨 150040)
目的:本研究应用行为学、组织病理学和代谢组学技术研究关黄柏生物碱对慢性非细菌性前列腺炎(Chronic Nonbacterial Prostatitis,CNP)的干预作用,从血液代谢组学角度阐释关黄柏生物碱对CNP模型大鼠体内代谢水平的影响及其作用机制。方法:通过对关黄柏进行分离纯化得到含量较高的关黄柏生物碱富集物,采用前列腺注射辣椒素的方法制备CNP模型大鼠,应用UPLC-Triple TOF-MS/MS联用技术建立CNP血液代谢组学研究方法,鉴定CNP生物标记物及代谢通路,确定关黄柏生物碱对CNP干预作用的代谢途径。结果:确定了与CNP密切相关的18个生物标记物及14个代谢通路。关黄柏生物碱通过对花生四烯酸代谢、甘油磷脂代谢、嘌呤代谢等代谢通路的调节,可显著对各项指标及12个CNP生物标记物产生回调作用。结论:关黄柏生物碱可以有效干预CNP的发生与发展,本研究为抗CNP药物的研究与开发提供科学的实验数据。
关黄柏 生物碱 代谢组学 慢性非细菌性前列腺炎
近几年,中医药对疾病的诊疗效果被越来越多的国内外学者所关注[1-3],但由于缺少科学的实验数据阐释中医药治疗疾病的作用机理,制约了中医药现代化的发展进程。代谢组学将先进的分析技术平台与多变量统计学分析相结合,通过对机体整体代谢轮廓的改变进行分析,科学地阐释中医药对疾病的治疗效果及其作用机制,为中药现代化发展提供科学的研究理念与技术方法[4-9]。
慢性非细菌性前列腺炎(Chronic Nonbacterial Prostatitis,CNP)是男性泌尿系统常见疾病之一,隶属于中医学的“精浊”、“白淫”、“淋证”范畴,其发病原因与肾气亏虚、湿热下注、瘀血阻止等病因相关[10,11]。关黄柏为芸香科植物黄檗Phellodendron amurense Rupr.的干燥树皮,具有清热燥湿、泻火解毒,除骨蒸、退虚热的功效[12-14]。研究显示关黄柏对骨关节炎、前列腺癌等相关疾病有显著的治疗效果[15-17],结果充分证实了关黄柏作为传统道地药材治疗肾阴虚相火亢盛及湿热下注之痹症的科学价值。然而关黄柏研究过多集中于化学成分及药效研究,缺乏对其药效物质基础及作用机制的深入阐释[18]。文献记载生物碱作为关黄柏主要有效成分,具有抗肿瘤、抗炎、抗菌、镇静、镇痛等药理作用[19-22]。本研究采用前列腺注射辣椒素的方法制备CNP模型大鼠,探究关黄柏生物碱对CNP的干预作用及其作用机制,为关黄柏治疗CNP的药效物质基础研究及CNP新药开发提供科学的实验数据。
1 材料
1.1 仪器
紫外可见分光光度计(日本岛津公司,型号:UVmini-1240);分析天平(瑞士梅特勒公司,型号:PB1501-N型);旋转蒸发仪(瑞士BUCHI公司,型号:Rotavapor R-3);低温超高速离心机(美国Thermo公司,型号:Sorvall ST 16R);液相色谱仪(美国AB Sciex公司,型号:ekspert ultra LC);质谱分析系统(美国AB Sciex公司,型号:Triple TOF);色谱柱(美国Waters公司,型号:ACQUITYTM UPLC HSS T3);研究型显微镜(日本奥林巴斯公司,型号BX60);Waters Progenesis®QI(美国Waters公司,型号:LITR134789504);MassLynx V4.1工作站(美国Waters公司,型号:720001408EN);微量取样器(日本NICHIRYO公司,型号:Nichipet EX)。
1.2 药品与试剂
关黄柏Phellodendron amurense Rupr.(哈尔滨世一堂药店,批号:140702),该药材经检测符合药典标准。97%辣椒素(美国阿拉丁工业公司,批号:V107237);吐温80(天津市博迪化工有限公司,批号:津 Q/HG 3020-85);甲酰胺(天津市科密欧化学试剂有限公司,批号:140915);伊文思蓝(上海蓝季科技发展有限公司,批号:JK2513);95%乙醇(北京试剂厂,批号:140921);盐酸小檗碱对照品(西安开来生物工程有限公司,批号:140701); D151型阳离子交换树脂(天津海光化工有限公司);乙腈(德国Merck公司,批号:1491530121);甲酸(天津科密欧化学试剂有限公司,批号:20140812);甲醇(天津市富宇精细化工有限公司,批号:140215);蒸馏水(广州屈臣氏,批号:20140506)。
1.3 样品的制备
1.3.1 关黄柏生物碱的纯化和富集
关黄柏粗粉500 g,加入10倍量70%乙醇回流提取3次,每次60 min,滤过,滤液置于分液漏斗中,加入乙酸乙酯萃取2次,合并水层溶液,减压干燥,得关黄柏提取物。关黄柏提取物粉末加蒸馏水定容至1 000 mL,4 000 r·min-1离心10 min,上清液作为预处理药液上样至活化好的D151型阳离子树脂,控制交换流速为1倍柱体积(BV)·h-1进行吸附上样,加入蒸馏水洗脱至无色,再加入50%乙醇洗脱除杂,最后用含5%盐酸的70%乙醇以2.5 BV·h-1流速洗脱,收集9 BV洗脱液,将收集的洗脱液转移至蒸发皿中,水浴挥干,减压干燥得生物碱富集物。
1.3.2 辣椒素溶液的制备
精密称定辣椒素23.472 g溶于10%乙醇溶液,10%吐温80及80%生理盐水溶液,配置成1 000 μmol·L-1辣椒素溶液。
2 试验方法
2.1 关黄柏生物碱及其富集物含量测定
2.1.1 对照品溶液的制备
精密称定盐酸小檗碱对照品25 mg,置于250 mL容量瓶中,甲醇定容,即得对照品溶液。
2.1.2 供试品溶液的制备
精密称定3批关黄柏提取物200 mg、关黄柏生物碱富集物25 mg,置于250 mL容量瓶中,甲醇定容,即得关黄柏提取物供试品溶液和关黄柏生物碱富集物供试品溶液。
2.1.3 测定方法
精密吸取1 mL供试品溶液及对照品溶液置于分液漏斗中,加入pH 4.0的缓冲液7.5 mL,溴酚蓝酸性染料溶液1.5 mL,振摇1 min,静置10 min后加入氯仿10 mL,振摇1 min,静置15 min,取下层溶液在UVmini-1240紫外可见分光光度计上于414.5 nm处测定吸光度。另取1.0 mL蒸馏水按上述方法进行操作作为空白对照溶液。
2.1.4 方法学考察
线性关系考察:精密吸取盐酸小檗碱对照品溶液5.0、6.0、7.0、8.0、9.0、10.0 mL置于10 mL容量瓶中,甲醇定容,摇匀,精密吸取1.0 mL于分液漏斗中,按2.1.3项下测定方法进行操作,在414.5 nm处测定吸光度值,以吸光度A值为纵坐标,浓度(mg·mL-1)为横坐标,绘制标准曲线。
重复性考察:平行制备6份关黄柏提取物供试品溶液,按2.1.3项下测定方法进行操作,在414.5 nm处测定吸光度值并计算RSD值。
稳定性考察:精密吸取1 mL供试品溶液,按2.1.3项下测定方法分别于0、1、2、6、12 h测定414.5 nm处测定吸光度。
加样回收实验:精密称定已知含量关黄柏生物碱提取物粉末适量与容量瓶中,加入一定体积对照品溶液,按2.1.3项下测定方法进行操作,在414.5 nm处测定吸光度值,计算回收率及RSD值。
2.2 动物分组与给药
雄性Wistar大鼠(清洁级),体质量250±10 g,饲养温度24±3℃,湿度65%-75%,自由摄食饮水,由黑龙江中医药大学实验动物中心提供,合格证号:SCXK黑2015014。按照体重随机分为空白组(KB)、模型组(MOD)、关黄柏生物碱给药组(SWJ)每组10只。精密称取关黄柏生物碱富集物适量,溶于0.5%CMC溶液中,配置成含关黄柏生物碱浓度为5.5 mg·mL-1灌胃溶液(给药剂量以药典记载人服用关黄柏临床4倍剂量及经测定关黄柏中生物碱含量换算关黄柏生物碱富集物给药量),以10 mL·kg-1大鼠质量给予灌胃溶液,空白组给予等体积CMC-Na溶液。给药7天后,模型组和关黄柏生物碱给药组大鼠制备CNP模型。造模方法:3%戊巴比妥钠0.3 mL/100 g腹腔注射麻醉,腹部中下部切开小口,两叶前列腺各注射0.1 mL辣椒素溶液,缝合。空白组为假手术组,腹部切开后,不注射辣椒素溶液,直接进行缝合。
2.3 生物样品采集与处理
造模第二天用3%戊巴比妥钠0.3 mL/100 g腹腔注射麻醉,每组随机选取5只大鼠,以50 kg·kg-1剂量股静脉注射伊文思蓝溶液,30 min后取大鼠前列腺,称重,用于前列腺蛋白渗出量测定。另取剩余5只大鼠麻醉后,剥离出前列腺,剥离的新鲜前列腺组织放入生理盐水中洗去血渍和污渍,用滤纸吸干,置福尔马林中用于组织病理学检测。
Wistar大鼠用3%戊巴比妥钠0.3 mL/100 g腹腔注射麻醉后,腹主动脉取血,静置20 min后4 000 r·min-1的条件下离心15 min,取血浆样品2 mL,精密加入甲醇-乙醇(1:1)溶液8 mL,震荡15 min,超声3 min,13 000 r·min-1的条件下离心20 min;取上清液过0.22 μm滤膜,供UPLC-Triple TOF-MS/MS分析,用于血液代谢组学检测。
2.4 行为学及组织病理学研究
2.4.1 经典行为学研究
大鼠行为学观察用来检测模型大鼠注射辣椒素后是否出现疼痛症状,造模清醒后30 min内,每10 min记录大鼠闭眼及活动状态。闭眼评分标准:5分即完全睁开,1分即完全闭眼。移动评分:5分即四周不停活动,1分即完全不动。各组得分经SPSS 19.0软件进行统计学分析。
2.4.2 前列腺蛋白渗出量的评价
伊文思蓝染色的前列腺组织称重后置于3 mL甲酰胺中,室温静置72 h后提取组织中伊文思蓝,取出前列腺组织,溶液于4℃、12 000 r·min-1的条件下离心20 min在UVmini-1240紫外可见分光光度计上于620 nm处测定吸光度,染料含量以μg·g-1(湿重)表示。
标准曲线制备:精密称定伊文思蓝粉末10 mg置于 1 000 mL容量瓶中,甲酰胺定容,配置浓度为0.01 mg·mL-1溶液。精密吸取1.0、3.0、5.0、7.0、9.0 mL于10 mL容量瓶中,用甲酰胺定容,配置浓度为1、3、5、7、9 μg·mL-1。于620 nm处测定吸光度A值,制作伊文思蓝标准曲线。
2.4.3 病理组织学评价
前列腺组织置于中性福尔马林溶液中固定,将固定后的前列腺组织切成适宜大小后进行梯度酒精脱水、二甲苯透明、石蜡包埋、切片后进行HE染色,最终树脂封片。光学显微镜下观察前列腺组织形态学变化。
2.5 血液代谢组学研究
2.5.1 代谢组学数据采集
血浆样品预处理后经0.22 μm滤膜过滤,取上清液供UPLC-Triple TOF-MS/MS分析。色谱条件Waters ACQUITY UPLCTMHSS T3色谱柱(2.1 mm ×100 mm,1.8 μm);流速0.4 mL·min-1;柱温45℃;流动相0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱条件:0-2.0 min,1%-65% A;2.0-8.0 min,65%-90%A;8.0-9.0 min,90%-99% A;样品室温度4℃;进样量6 μL。质谱条件:采用电喷雾离子源(ESI),正、负离子(ESI+、ESI-)两种模式采集数据。正离子模式质谱条件:离子源气帘气流速(CUR):30 L·min-1;离子源雾化气流速(GS1):55 L·min-1;离子源脱溶剂气流速(GS2):55 L·min-1;离子源电压(ISVF):5 500 V;解簇电(DP):100.0 V;碰撞能(CE):10.0 V;离子源温度(TEM):600℃。负离子模式质谱条件:离子源气帘气流速(CUR):30 L·min-1;离子源雾化气流速(GS1):55 L·min-1;离子源脱溶剂气流速(GS2):55 L·min-1;离子源电压(ISVF):-4 000 V;解簇电(DP):-100.0 V;碰撞能(CE):-10.0 V;离子源温度(TEM):600℃。质量扫描范围m/z:50-1 000。
2.5.2 代谢组学数据处理
利用Progensis QI对所获得血液数据进行标准化分析,进一步将所得预处理数据导入Marker Lynx软件,对各组数据进行主成分分析(Principal Components Analysis,PCA),观察造模后大鼠体内代谢轮廓所发生的改变。进一步对模型组与空白组血液代谢轮廓进行正交偏最小二乘分析(Orthogonal Partial Least Squares Discriminant Analysis,OPLSDA),获得能够反映组间贡献率的VIP-plot和S-plot图。对所获得数据进行统计学分析,选择P<0.05且VIP值大于1的内源性标记物作为CNP潜在生物标记物。通过HMDB、KEGG、MetPA等数据库对潜在生物标记物进行结构解析及代谢通路拓扑分析,最终确定与CNP密切相关的潜在生物标记物与相关代谢通路。
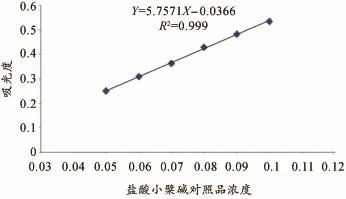
图1 盐酸小檗碱对照品的标准曲线
2.6 统计方法
使用SPSS V19.0数据软件包对各组数据进行统计学分析,结果采用平均数±标准差,即±s表示。P<0.05认为差异具有统计学意义。
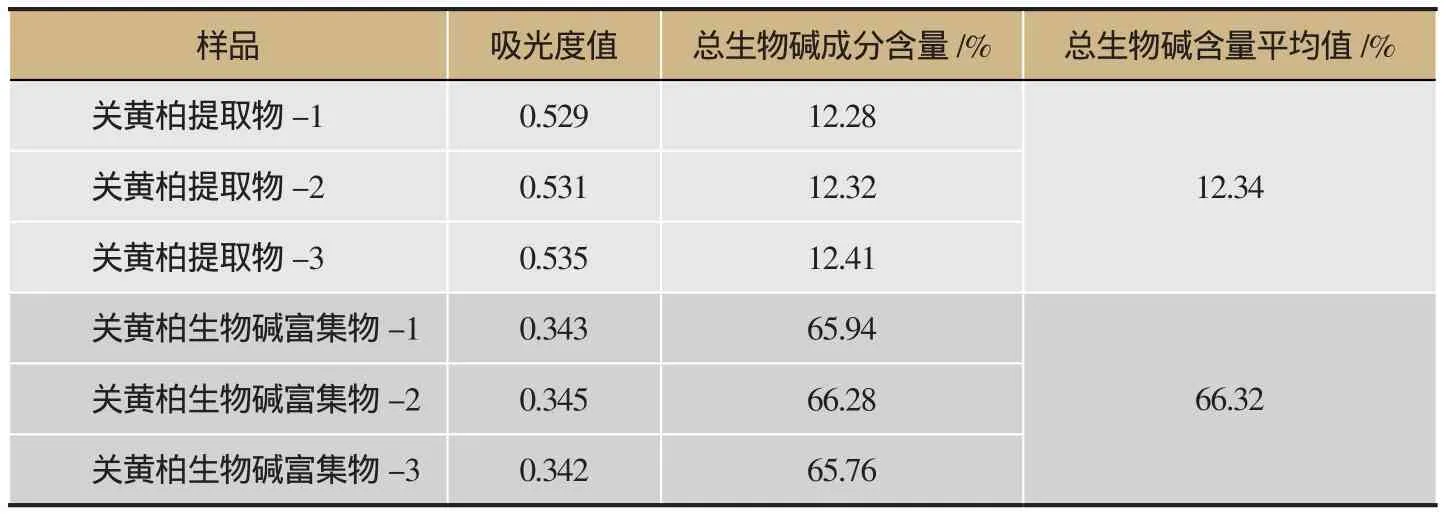
表2 总生物碱含量测定结果(n=3)
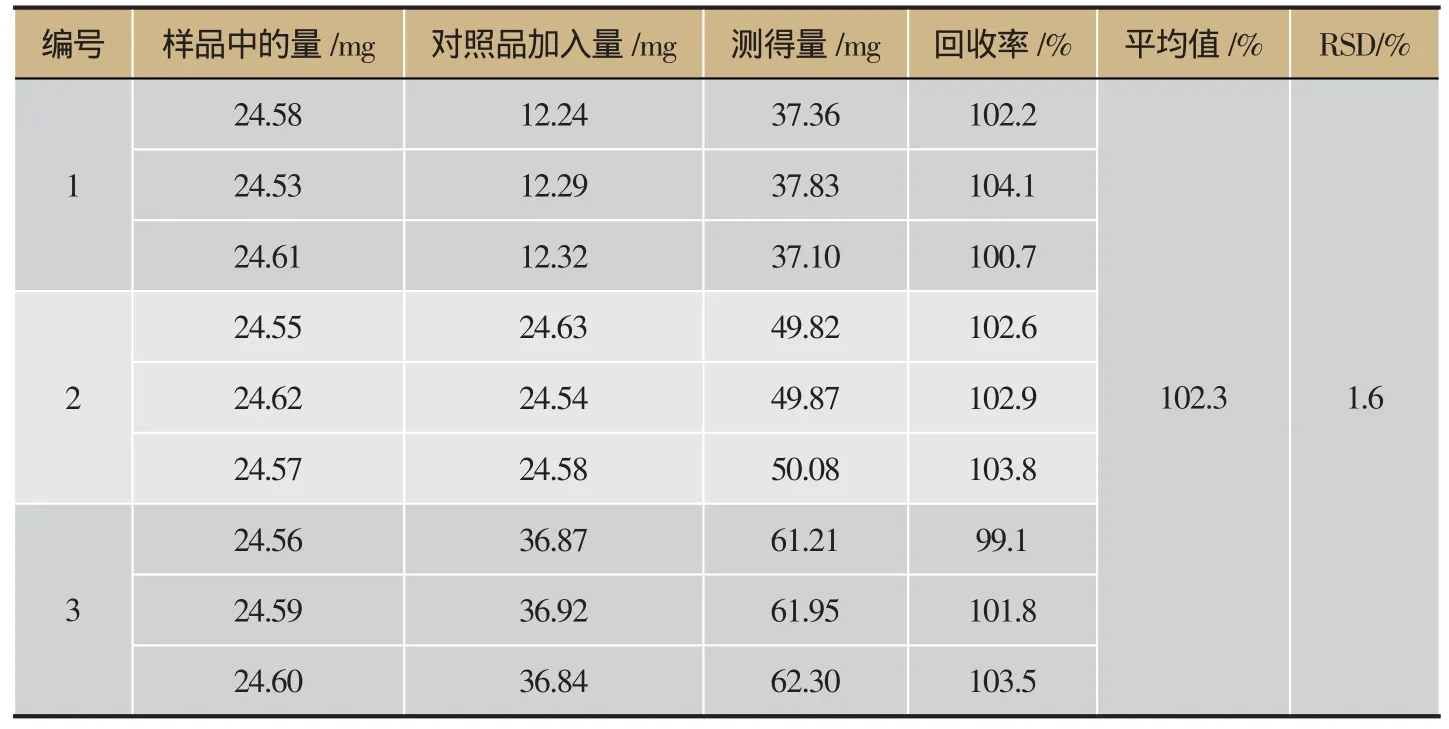
表1 加样回收率试验结果(n=3)
3 结果
3.1 关黄柏生物碱富集物含量测定
采用酸性染料比色法测定关黄柏提取物中关黄柏生物碱的含量,经方法学考察可知回归方程为Y=5.757 1X-0.036 6,R2=0.999,加样回收率为102.3%及RSD=1.6%,重复性RSD=1.3%,12 h内稳定性好,为关黄柏提取物中生物碱的质量控制提供了一个可行的方法,详见图1、表1。关黄柏总生物碱含量测定结果显示关黄柏提取物总生物碱含量为12.34%、关黄柏生物碱富集物总生物碱含量为66.32%,详见表2。
3.2 慢性非细菌性前列腺炎模型的评价
3.2.1 行为学研究
行为学研究结果显示,模型组大鼠注射辣椒素后,出现疲倦、闭眼、缩尾等由于疼痛而引起的行为学表现,导致模型组大鼠眼动得分与活动得分明显低于空白组(P<0.01),详见表3、图2。实验过程中,所有大鼠均可自由活动,未见死亡。
3.2.2 前列腺蛋白渗出量研究
伊文思蓝标准曲线回归方程:Y=0.075X+0.017,R2=0.998(图3A),线性关系良好,为各组前列腺蛋白渗出量测定提供了一个可行的含量测定方法。结果显示模型组前列腺蛋白渗出量明显高于空白组(P<0.01),详见表4、图3B,表明模型组大鼠前列腺组织中神经源性血浆外渗增加,前列腺出现损伤。
3.2.3 组织病理学研究
组织病理学结果显示:空白组前列腺腺泡分布均匀,炎性细胞零星散在,间质不扩张水肿;模型组前列腺腺泡大小不一、间质水肿、结缔组织明显增生、血管扩张充血、主要表现为淋巴细胞、浆细胞等炎性细胞侵润为主的慢性炎症。研究结果表明,慢性非细菌性前列腺炎大鼠模型复制成功,详见图4A、图4B。
3.3 关黄柏生物碱对慢性非细菌性前列腺炎模型大鼠的干预作用研究
3.3.1 行为学研究
行为学研究结果可以看出(见表3、图2),模型组眼动得分与活动得分明显低于空白组(P<0.01),给予关黄柏生物碱后可明显增加大鼠眼动和活动次数,给药组眼动得分与活动得分显著高于模型组(P<0.01)。结果表明,关黄柏生物碱给药可以有效抑制慢性前列腺炎模型的发生与发展。
3.3.2 前列腺蛋白渗出量研究
按照本文3.2.2项建立的伊文思蓝标准曲线对空白组、模型组、关黄柏生物碱给药组前列腺蛋白渗出量进行含量测定。结果显示模型组前列腺蛋白渗出量明显高于空白组(P<0.01),关黄柏生物碱可显著减少前列腺蛋白渗出量,关黄柏生物碱给药组与模型组比较有极显著性差异(P<0.01),详见表4。
3.3.3 组织病理学研究
组织病理学结果显示:关黄柏生物碱给药组前列腺腺泡大小基本一致,血管无充血,炎症细胞散在分布,淋巴细胞少见,详见图4C。
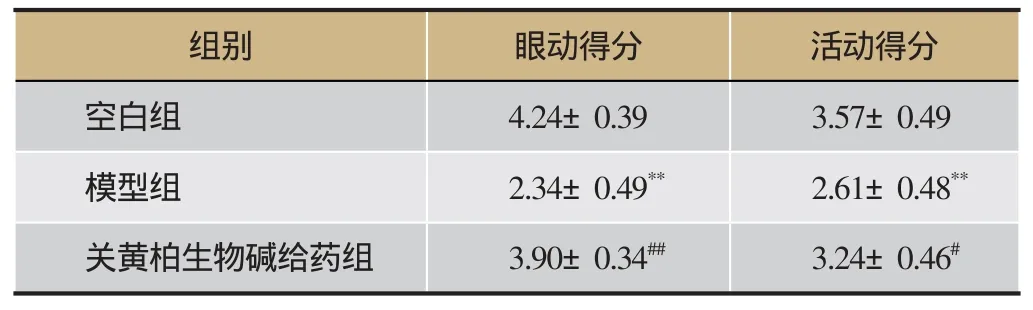
表3 各组大鼠在造模后的行为学比较结果表(n=10)

表4 前列腺血浆蛋白渗出量比较结果
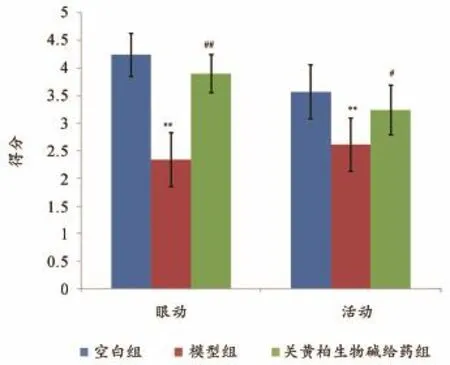
图2 各组大鼠在造模后的行为学比较结果图
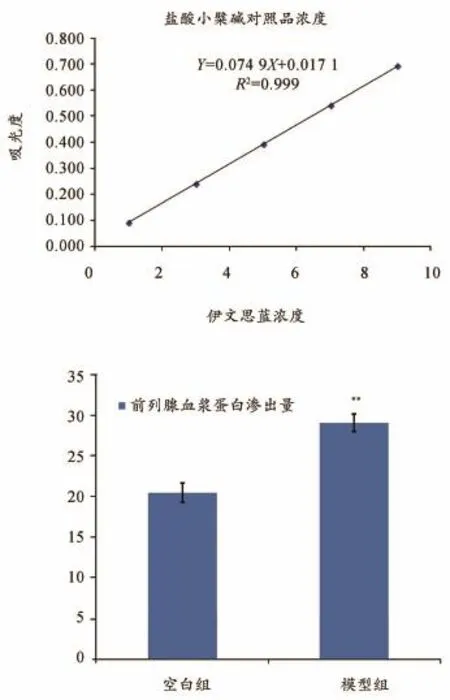
图3 前列腺蛋白渗出量研究结果
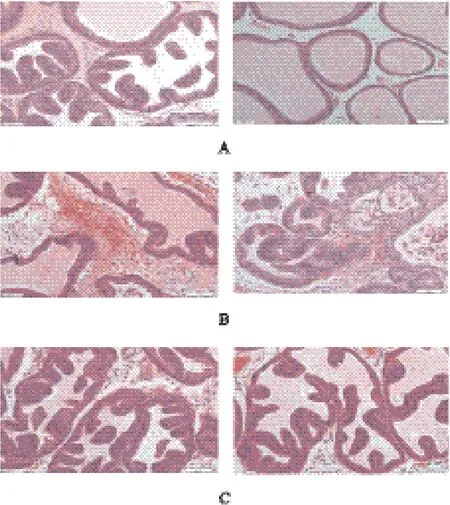
图4 各实验组病理组织HE染色结果
3.3.4 血液代谢组学研究
PCA得分图可见空白组与模型组体内代谢轮廓明显分离,结果提示,模型组大鼠体内代谢轮廓发生明显扰动间接预示着CNP的发生与发展,详见图5A、图5B。进一步对两组大鼠血液代谢轮廓数据进行OPLS-DA分析,得到能够反映组间贡献率的S-plot和VIP-plot图,对所获得数据进行独立样本t检验,筛选P<0.05且VIP值大于1的潜在内源性生物标记物,详见图5C、图5D。通过参照文献及HMDB和Metlin等数据检索平台对潜在内源性标记物MS/MS数据进行结构解析,共鉴定18个潜在内源性生物标记物,主要涉及14个代谢通路,详见表5、图6。
通过对实验第9天空白组、模型组、关黄柏高剂量给药组大鼠血液代谢轮廓进行PCA分析,结果显示,关黄柏高剂量给药组大鼠血液代谢轮廓明显远离模型组且靠近空白组。结果表明关黄柏生物碱可明显回调CNP模型大鼠体内代谢轮廓至健康状态,进一步预示关黄柏生物碱对CNP的发生与发展起到干预作用,详见图7A、图7B。以造模成功后的所获得的18个生物标记物为标准,分析口服关黄柏生物碱后大鼠体内生物标记物的含量变化趋势。结果表明关黄柏生物碱可回调12个生物标记物(图7-C),主要调节10个代谢通路,包括甘油磷脂代谢、苯丙氨酸代谢、氨酰-tRNA生物合成、花生四烯酸代谢、酪氨酸代谢、亚油酸代谢、α-亚麻酸代谢、脂肪酸代谢、嘌呤代谢、类固醇激素的合成。
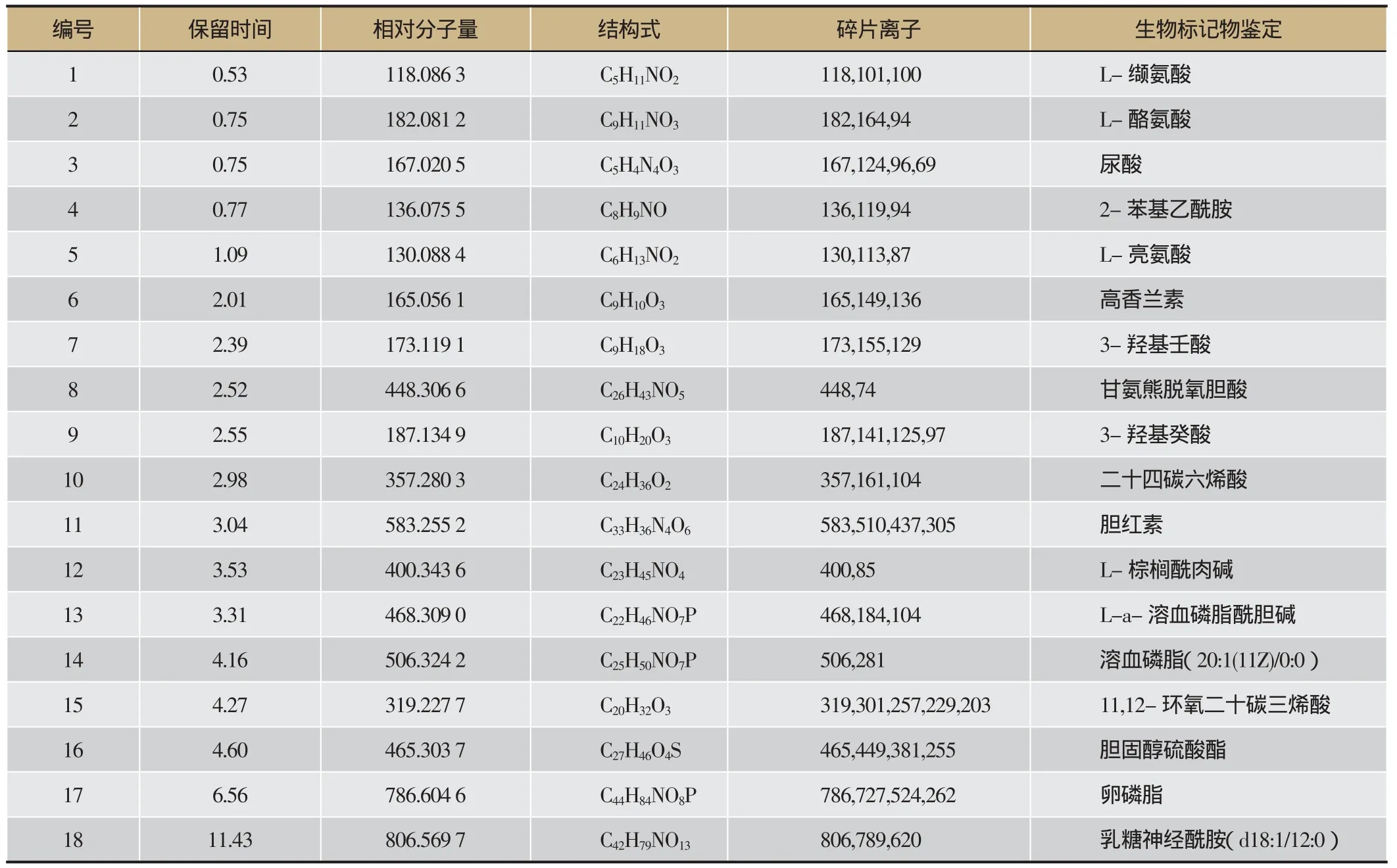
表5 CNP模型生物标记物结构鉴定信息表
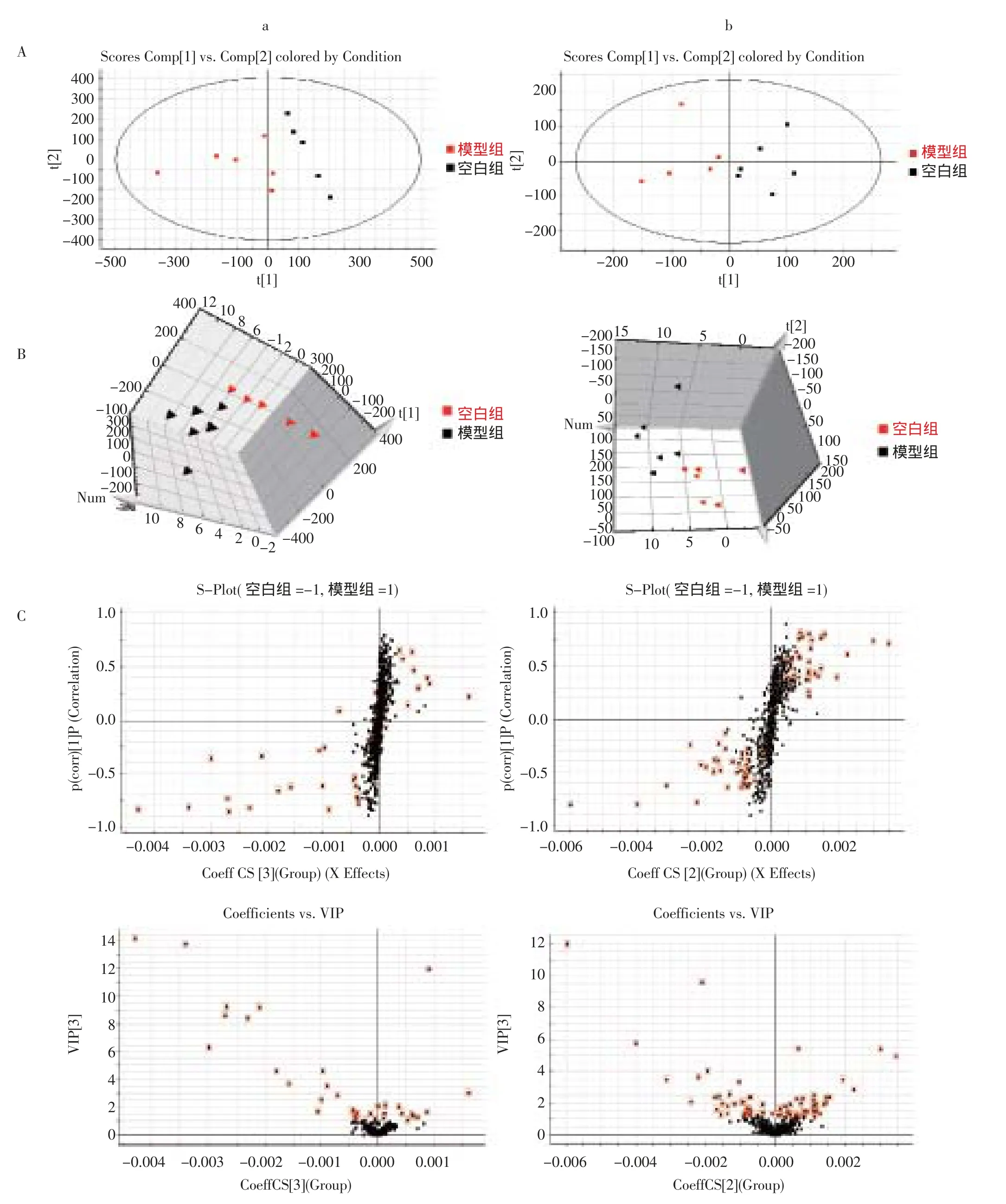
图5 模型组与空白组模式识别分析图谱
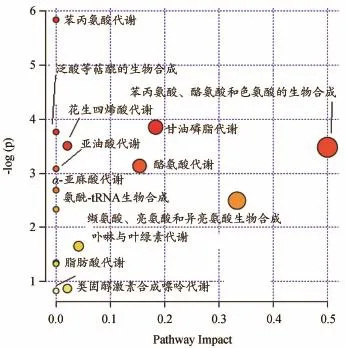
图6 MetPA代谢路径分析
4 讨论
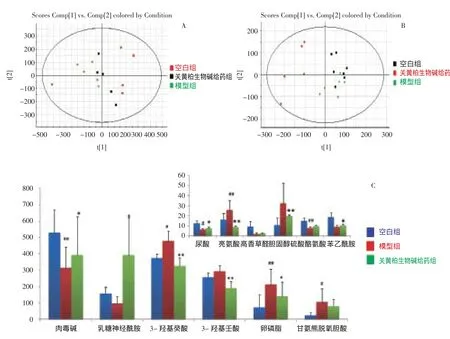
图7 模型组、空白组、关黄柏生物碱给药组模式识别分析图谱
慢性非细菌性前列腺炎(CNP)是男性泌尿系统常见疾病之一,具有发病率高、发病机制复杂等特点。本研究基于辣椒素致CNP大鼠模型,通过运用行为学、组织病理学和代谢组学等研究方法,对辣椒素致CNP大鼠模型进行模型评价研究并揭示关黄柏生物碱对慢性CNP的干预作用。结果表明大鼠前列组腺注射辣椒素的方法复制CNP大鼠模型成功。行为学结果显示关黄柏生物碱可显著回调CNP模型大鼠的眼动和活动评分同时减少前列腺蛋白渗出量。组织病理学结果显示给药组前列腺腺泡大小基本一致,血管无充血,炎症细胞散在分布,淋巴细胞少见。结果表明关黄柏生物碱对CNP的发生和发展起到明显的干预作用。
利用血液代谢组学研究方法对口服给予关黄柏生物碱后CNP模型大鼠血液代谢轮廓进行分析,初步表征18个与CNP密切相关的潜在生物标记物,主要涉及14个代谢通路。文献报道花生四烯酸代谢与氧化应激密切相关,其在炎症的发生和发展中起重要作用[23]。本实验中模型组大鼠血液中二十四碳六烯酸、11,12-环氧二十碳三烯酸体内表达水平异常,预示着大鼠体内大量花生四烯酸解离,致使非酰化花生四烯酸和其他类花生酸含量增加,进而促使炎症的产生。氨基酸是蛋白质的组成单位,同时也是嘌呤、嘧啶等激素生物合成的前体物质,缬氨酸在模型组中含量降低,推测其可能由于CNP模型大鼠体内氨基酸代谢发生紊乱进而导致支链氨基酸水平下降[24]。研究显示生物体内甘油磷脂代谢的异常预示着机体内炎性微环境的产生,模型组酪氨酸、苯乙酰胺、溶血磷脂酰胆碱、肉毒碱在大鼠血中表达水平异常,预示着体内炎症因子释放导致基质膜损伤,干预了体内膜磷脂胆碱代谢,影响细胞膜完整性。血清中的尿酸由黄嘌呤和次黄嘌呤在黄嘌呤氧化还原酶的作用下氧化产生,其具有抗氧化能力,可以阻止炎性环境的发展进程[25-27]。本实验模型组尿酸体内表达水平异常,表明机体内自由基活性增强,致使组织细胞受到严重损伤。通过对口服给予关黄柏生物碱后大鼠体内代谢轮廓进行分析,结果表明在18个CNP潜在生物标记物中,关黄柏生物碱能不同程度调节12种异常代谢物的水平向正常状态逆转,使其内源性代谢物的水平得到改善。主要涉及甘油磷脂代谢、苯丙氨酸代谢、花生四烯酸代谢、酪氨酸代谢、嘌呤代谢等代谢通路。
综上所述,通过对关黄柏生物碱干预CNP进行系统的药理学研究,结果表明关黄柏生物碱可以有效地干预CNP的发生与发展。首次确定了关黄柏生物碱干预CNP的生物标记物,明确了其作用机制,为发现临床有效且毒副作用小的抗CNP药物提供一定的科学依据。
1 McPherson L, Cochrane S, Zhu X. Current usage of traditional Chinese medicine in the management of breast cancer: A practitioner's perspective. Integr Cancer Ther, 2016, 15(3): 335-342.
2 Conroy S F, Taggart H M. The impact of a cultural immersion study abroad experience in traditional Chinese medicine. J Holist Nurs, 2016, 34(3): 229-235.
3 Cao H, Zhang A, Sun H, et al. Metabolomics-proteomics profiles delineate metabolic changes in kidney fibrosis disease. Proteomics, 2015, 15(21): 3699-3710.
4 Wang X, Zhang A, Zhou X, et al. An integrated chinmedomics strategy for discovery of effective constituents from traditional herbal medicine. Sci Rep, 2016, 6:18997.
5 Wang X, Zhang A, Sun H, et al. Discovery and development of innovative drug from traditional medicine by integrated Chinmedomics strategies in the post-genomic era. TrAC, 2016, 76: 86-94.
6 Chu H, Zhang A, Han Y, et al. Metabolomics approach to explore the effects of Kai-Xin-San on Alzheimer's disease using UPLC/ESI-QTOF mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 15(1015-1016): 50-61.
7 Nan Y, Zhou X, Liu Q, et al. Serum metabolomics strategy for understanding pharmacological effects of Shen Qi pill acting on kidney yang deficiency syndrome. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 15(1026): 217-226.
8 Zhang A, Yan G, Sun H, et al. Deciphering the biological effects of acupuncture treatment modulating multiple metabolism pathways. Sci Rep, 2016, 16(6): 19942.
9 Zhang A, Sun H, Yan G, et al. Mass spectrometry-based metabolomics: Applications to biomarker and metabolic pathway research. Biomed Chromatogr, 2016, 30(1): 7-12.
10 Liu Y J, Song G H, Liu G T, et al. Investigation of the effect of traditional Chinese medicine on pain and inflammation in chronic nonbacterial prostatitis in rats. Andrologia, 2016, 48(6): 714-722.
11 王权胜,宾彬,唐乾利.浅释合理运用中成药治疗前列腺炎.中国男科学杂志,2013,26(9):59-60.
12 汤欢,向丽,赵莎,等.应用DNA条形码ITS2序列对市售药材黄柏的鉴定研究.世界科学技术-中医药现代化,2016,18(2):184-190.
13 Wang H, Yan G, Zhang A, et al. Rapid discovery and global characterization of chemical constituents and rats metabolites of Phellodendri amurensis cortex by ultra-performance liquid chromatography-electrospray ionization/ quadrupole-time-of-flight mass spectrometry coupled with pattern recognition approach. Analyst,2013, 138(11): 3303-3312.
14 Wang H, Sun H, Zhang A, et al. Rapid identification and comparative analysis of the chemical constituents and metabolites of Phellodendri amurensis cortex and Zhibai Dihuang pill by ultra-performance liquid chromatography with quadrupole TOF-MS. J Sep Sci, 2013, 36(24): 3874-3882.
15 Lee S H, Kwak S C, Kim D K, et al. Effects of Huang Bai (Phellodendri Cortex) and three other herbs on GnRH and GH levels in GT1-7 and GH3 cells. Evid Based Complement Alternat Med, 2016, 2016: 9389028. 16 Wang W, Zu Y, Fu Y, et al. In vitro antioxidant, antimicrobial and antiherpes simplex virus type 1 activity of Phellodendron amurense Rupr. from China. Am J Chin Med, 2009, 37(1): 195-203.
17 Swanson G P, Jones W E 3rd, Ha C S, et al. Tolerance of Phellodendron amurense bark extract (Nexrutine®) in patients with human prostate cancer. Phytother Res, 2015, 29(1): 40-42.
18 Sun H, Wang H, Zhang A, et al. Chemical discrimination of cortex Phellodendri amurensis and cortex Phellodendri chinensis by multivariate analysis approach. Phcog Mag, 2016, 12: 41-49.
19 Sun H, Wang H, Zhang A, et al. Berberine ameliorates nonbacterial prostatitis via multi-target metabolic network regulation. OMICS, 2015, 19(3): 186-195.
20 Wang W, Li Q, Liu Y, et al. Ionic liquid-aqueous solution ultrasonicassisted extraction of three kinds of alkaloids from Phellodendron amurense Rupr. and optimize conditions use response surface. Ultrason Sonochem, 2015, 24: 13-18.
21 Mohan V, Agarwal R, Singh R P. A novel alkaloid, evodiamine causes nuclear localization of cytochrome-c and induces apoptosis independent of p53 in human lung cancer cells. Biochem Biophys Res Commun, 2016, 477(4): 1065-1071.
22 Bribi N, Algieri F, Rodriguez-Nogales A, et al. Intestinal antiinflammatory effects of total alkaloid extract from Fumaria capreolata in the DNBS model of mice colitis and intestinal epithelial CMT93 cells. Phytomedicine, 2016, 23(9): 901-913.
23 Bian Q, Wang W, Wang N, et al. Arachidonic acid metabolomic study of BPH in rats and the interventional effects of Zishen pill, a traditional Chinese medicine. J Pharm Biomed Anal, 2016, 5(128): 149-157.
24 Jia J, Liu Z, Xiao X, et al. Identification of protein-protein binding sites by incorporating the physicochemical properties and stationary wavelet transforms into pseudo amino acid composition. J Biomol Struct Dyn, 2016, 34(9): 1946-1961.
25 Liu J, Xu C, Ying L, et al. Relationship of serum uric acid level with non-alcoholic fatty liver disease and its inflammation progression in non-obese adults. Hepatol Res, 2016. [Epub ahead of print]
26 Malik R, Aneni E C, Shahrayar S, et al. Elevated serum uric acid is associated with vascular inflammation but not coronary artery calcification in the healthy octogenarians: The Brazilian study on healthy aging. Aging Clin Exp Res, 2016, 28(2): 359-362.
27 Alemzadeh R, Kichler J. Uric acid-induced inflammation is mediated by the parathyroid hormone: 25-Hydroxyvitamin D ratio in Obese Adolescents. Metab Syndr Relat Disord, 2016, 14(3): 167-174.
A Metabolomic Study on the Intervention Effect of Phellodenron Amurense Rupr. Alkaloid Protects Against Chronic Nonbacterial Prostatitis In Rats
Sun Hui, Li Xianna, Zhang Ying, Li Ruifang, Yue Shuqi, Aihua Zhang, Wang Xijun
(Sino-US Chinmedomics Technology Cooperation Center, National TCM Key Laboratory of Serum Pharmacochemistry, Research Center of Chinmedomics-State Administration of TCM-Laboratory of Metabolomics, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
This study aimed to analyze the effecacy of Phellodendron amurense Rupr. (GHB) alkaloid on chronic nonbacterial prostatitis (CNP) in rats. Metabolomic experiments, including behavioral test and tissue pathological approaches were performed to interpret the effectiveness and action of GHB alkaloid against CNP. Through separated and purified GHB alkaloid, a higher concentration of total alkaloid was obtained in this study. CNP model rats were established by means of intraprostatic injection of capsaicin. UPLC-Triple TOF-MS/MS technique was utilized for the establishment of blood metabolomics method of rats, the identification of CNP potential biomarkers and relative pathways. And then the mechanism behind the action of GHB alkaloid against CNP was explained. As a result, 14 potential biomarkers and 14 pathways which were closely related to CNP in aggregate were found out. GHB alkaloid improved the activity scores and the prostate protein exudation of CNP model rats. As the complicated regulation of arachidonic acid metabolism, glycerophospholipid metabolism, purine metabolism and any other pathways, alkaloid succesfully mediated 12 CNP potential biomarkers to the normal levels. In conclusion, it was the first experiment to evaluate the effect and clarify the mechanism behindmetabolic pathway of Phellodendron amurense Rupr. alkaloid against CNP, which was proved by the fact that Phellodendron amurense Rupr. alkaloid effectively prevented the development of CNP with the provision of scientific experimental data for anti-CNP drug studies.
Phellodendron amurense Rupr., alkaloid, metabolomics, chronic nonbacterial prostatitis
10.11842/wst.2016.10.010
R285
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-09-02
修回日期:2016-10-11
* 国家自然科学基金委重点项目(81430093):中药体内药效物质基础的系统分析方法学——中医方证代谢组学研究,负责人:王喜军;科学技术部“重大新药创制”国家科技重大专项(2015ZX09101043-011):中药经典名方整合作用机制关键技术研究,负责人:王喜军;国家自然科学基金面上项目(81173500):基于知柏地黄丸配伍环境的关黄柏治疗肾阴虚相火亢盛的药效物质基础研究,负责人:孙晖。
** 通讯作者:王喜军,本刊编委,教授,博士生导师,主要研究方向:中药血清药物化学及中医方证代谢组学研究。
