DTI对阻塞性睡眠呼吸暂停低通气综合征患者脑白质损害的评价
2016-03-19徐海如姚世文杨志勇钱小建
徐海如,姚世文,杨志勇,倪 建,钱小建,陈 龙,肖 晶
(江苏省如皋市人民医院①放射科,②呼吸内科,③神经内科,江苏如皋226500)
DTI对阻塞性睡眠呼吸暂停低通气综合征患者脑白质损害的评价
徐海如1,姚世文1,杨志勇1,倪建1,钱小建1,陈龙2,肖晶3
(江苏省如皋市人民医院①放射科,②呼吸内科,③神经内科,江苏如皋226500)
[摘要]目的:运用DTI研究阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea syndrome,OSAHS)患者脑白质损害的特点,评价OSAHS患者的轻度认知功能障碍(mild cognitive impairment,MCI)及行为改变。方法:选取36例OSAHS患者(中度组10例,重度组26例)及健康体检者17例(对照组),行蒙特利尔认知评估量表(MoCA)、Epworth嗜睡量表(ESS)测试,判断参加者是否存在MCI,分别行常规MRI及DTI检查。选择脑内25处脑白质区作为ROI,分别测量部分各向异性分数值(FA)、ADC值,并对3组资料进行相关性分析。结果:OSAHS患者双侧额叶、左侧前扣带回、半卵圆中心、双侧侧脑室后角周围白质、海马旁回及胼胝体压部FA值明显降低,与对照组比较差异有统计学意义(P<0.05),MoCA亚项分析重度组记忆或延迟回忆评分明显降低。结论:OSAHS患者存在广泛的白质结构损伤,与记忆相关的部分灰质也存在损害,DTI能早期发现OSAHS患者的MCI,结合MoCA评分可为临床早期干预提供依据。
[关键词]睡眠呼吸暂停,阻塞性;脑白质病;弥散张量成像
Magnetic resonance diffusion tensor imaging in obstructive sleep apnea syndrome in patients with cerebral white matterdamage evaluation of comprehensive low ventilation
XU Hairu,YAO Shiwen,YANG Zhiyong,NI Jian,QIAN Xiaojian,CHEN Long,XIAO Jing. The People's Hospital of Rugao City,Rugao,226500,China.
[Abstract]Objective:Using diffusion tensor imaging(DTI)method to study the characteristics of the OSAHS patients with cerebral white matter damage,the assessment of mild cognitive dysfunction in patients with OSAHS(MCI)and behavioral change. Methods:Selection of 36 patients with OSAHS(moderate group 10 cases,severe group 26 cases)and physical health of 17 cases(control group),line the Montreal cognitive assessment scale(MoCA),the Epworth sleepiness scale(ESS)test,determine whether participants MCI,conventional MRI and DTI inspections respectively,select 25 cerebral white matter in the brain area as the interest area(ROI),anisotropic fractions were measured values(FA),the average diffusion coefficient(ADC),and correlation analysis of three sets of data. Results:OSAHS group of patients with bilateral frontal lobe,left anterior cingulate,half egg circle around the center,after bilateral lateral ventricle Angle of white matter,parahippocampal gyrus and corpus callosum FA values decreased obviously,there were significant difference compared with control group(P<0.05),while the analysis/delayed recall memory score severe group was obviously reduced. Conclusion:OSAHS patients exist extensive white matter structure damage,gray matter there is damage to a part related to memory,DTI can early detect of OSAHS patients with mild cognitive dysfunction,combined with MoCA scores may provide the basis for early clinical intervention.
[Key words]Sleep apnea,obstructive;Leukoencephalopathies;Diffusion tensor imaging
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea syndrome,OSAHS)是以睡眠结构紊乱、反复出现夜间呼吸暂停、低氧血症为特征,导致多系统器官功能损害的一种临床综合征[1]。神经精神系统的损害是OSAHS主要并发症之一[2],尤其是脑白质损害,常导致轻度的认知障碍(mild cognitive impair ment,MCI),表现为注意力、记忆力及执行能力下降,易焦虑、抑郁,甚至发展为痴呆。本研究旨在利用DTI定量测量其脑白质部分各向异性(fractional anisotropy,FA),结合传统的神经心理测试量表,从不同侧面评价OSAHS患者的脑白质损害程度,为临床早期识别OSAHS患者MCI及行为改变提供依据。
1 资料与方法
1.1一般资料收集2012年1月至2014年12月我院呼吸内科睡眠监测中心诊断为OSAHS患者36例,其中男32例,女4例;年龄21~59岁,平均(41.2±9.4)岁。选择同期17例健康体检者作为对照组。患者入组标准:①初中文化以上程度,同意参加睡眠研究。②参照国内OSAHS诊治指南[3]进行诊断和严重程度分级,诊断标准:白天嗜睡、睡眠时严重打鼾,每夜7 h睡眠中呼吸暂停及低通气反复发作在30次以上,或AHI(睡眠中平均每小时发生呼吸暂停及低通气的次数)≥5,呼吸暂停以阻塞性为主,影像学检查显示上气道结构异常;分级标准:根据多导睡眠图(PGS)监测结果,36例均为中重度(AHI>15)OSAHS患者,其中,中度组10例(15<AHI<30),重度组26例(AHI>30);病程1.5~5年,平均3年。③视力、听力正常。④简易精神状态量表(MMSE)≥27分,初筛除外痴呆。排除标准:①合并脑血管病、癫痫、精神病(包括临床已诊断的抑郁症)、脑瘤、颅脑外伤史;②倒班;③吸毒;④酗酒(≥100 g/d);⑤应用任何药物影响呼吸功能、睡眠及认知功能;⑥MMSE≤26分,小学及以下受教育水平;⑦既往已诊断,并接受治疗的OSAHS患者;⑧其他原因引起的睡眠障碍。对照组入选标准:①年龄18~60岁,同意参加研究;②经临床诊断可排除OSAHS。排除标准同患者组。
1.2仪器与方法
1.2.1仪器及DTI数据处理、测量使用Siemens Magnetom Avanto 1.5 T超导型MRI扫描仪,8通道头颈联合线圈,对2组行常规MRI及DTI检查。常规颅脑MRI扫描包括横轴位T1WI、T2WI、FLAIR及矢状位T1WI。DTI采用单次激发EPI序列,TR/TE 3 600 ms/109 ms,FOV 230 mm×230 mm,矩阵192× 192,层厚5mm,NEX 3次,扩散梯度b值0、1000s/mm2。扫描范围从头顶至颅底连续45个层面。数据导入Siemens工作站进行后处理,产生FA伪彩色图和ADC图。分别测量双侧额叶白质、尾状核头部、丘脑、内囊前后肢、视放射、半卵圆中心、侧脑室前角及后角周围白质、前扣带回、海马旁回及胼胝体膝、体、压部等25处脑白质区的FA值和ADC值。在FA图中白质纤维束强度最大的层面选取ROI(图1),均为9 mm2,由同一影像医师选取同一部位测量2次,取其均值。
1.2.2相关量表由一名经过培训的医师进行病史采集(包括姓名、性别、年龄、身高、体质量、受教育年限、既往病史)及以下神经心理量表测试。2组均行蒙特利尔认知评估量表(MoCA)、Epworth嗜睡量表(ESS)测试,MoCA评分≥26分为正常,如受教育年限≤12年则加1分,<26分为MCI。ESS评分>9分为白天嗜睡。
1.3统计学方法采用SPSS 17.0统计软件进行分析,所有数据以±s表示,一般临床资料及各量表评分资料,组间比较采用秩和检验;FA、ADC值组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.13组一般情况的比较(表1,2)与对照组比较,重度组MoCA评分明显降低(F=3.954,P<0.05),重度组MoCA评分亚项中仅记忆/延迟回忆差异有统计学意义(Z=17.073,P<0.01)。
表1 3组一般情况比较(±s)
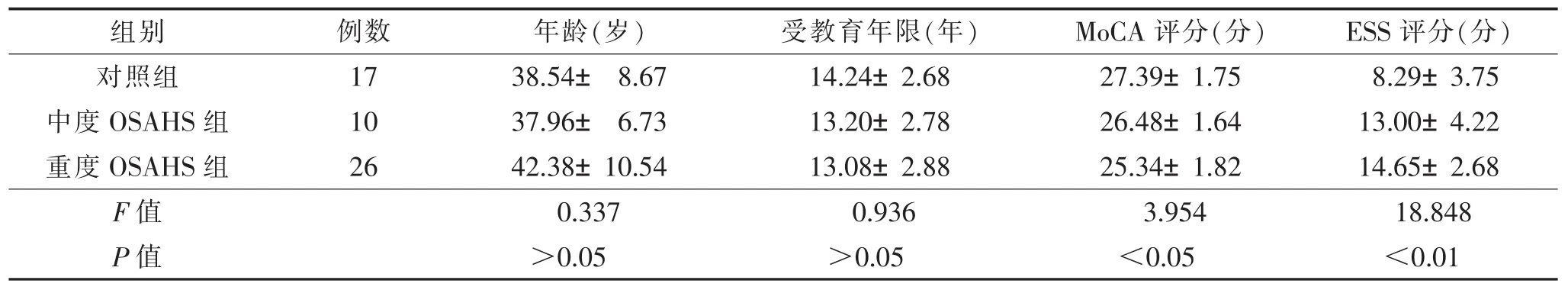
表1 3组一般情况比较(±s)
注:OSAHS,阻塞性睡眠呼吸暂停低通气综合征;MoCA,蒙特利尔认知评估量表;ESS,Epworth嗜睡量表。
组别 例数 年龄(岁) 受教育年限(年) MoCA评分(分) ESS评分(分)对照组 17 38.54±8.67 14.24±2.68 27.39±1.75 8.29±3.75中度OSAHS组 10 37.96±6.73 13.20±2.78 26.48±1.64 13.00±4.22重度OSAHS组 26 42.38±10.54 13.08±2.88 25.34±1.82 14.65±2.68 F值 0.337 0.936 3.954 18.848 P值 >0.05 >0.05 <0.05 <0.01
表2 3组MoCA亚项评分结果比较(分,±s)
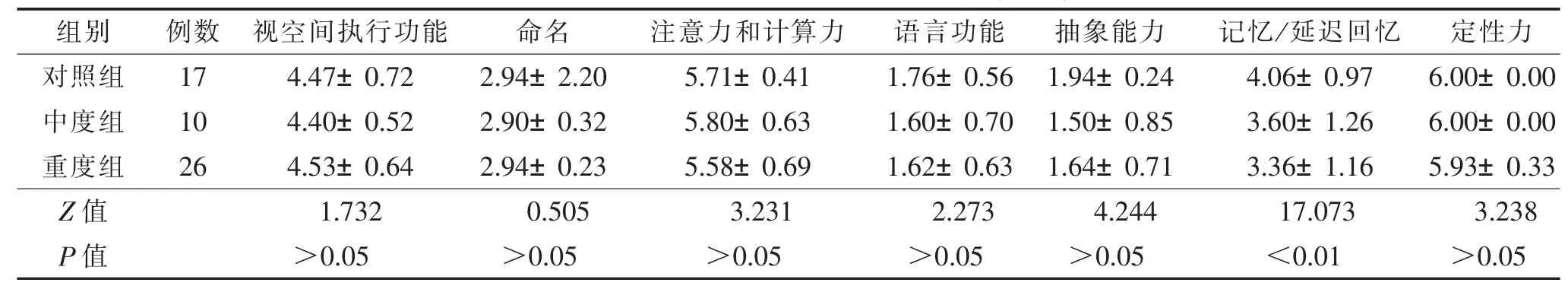
表2 3组MoCA亚项评分结果比较(分,±s)
?
2.23组FA值比较(表3)中、重度组多个脑区FA值减低,双侧额叶、左侧前扣带回、左侧半卵圆中心、双侧侧脑室后角周围白质、双侧海马旁回以及胼胝体压部FA值较对照组明显降低(P<0.05),而其余16处脑白质区的FA值与对照组比较差异均无统计学意义(均P>0.05);中度组与重度组脑部各ROI区FA值比较差异均无统计学意义(均P>0.05)。
2.33组ADC值比较中、重度组仅部分脑区ADC值升高,右侧额叶白质、左侧半卵圆中心、左侧脑室后角周围白质与对照组比较差异有统计学意义(P<0.05),其余脑区ADC值与对照组比较差异无统计学意义(P>0.05)。
表3 3组脑部各感兴趣区的FA值比较(±s)
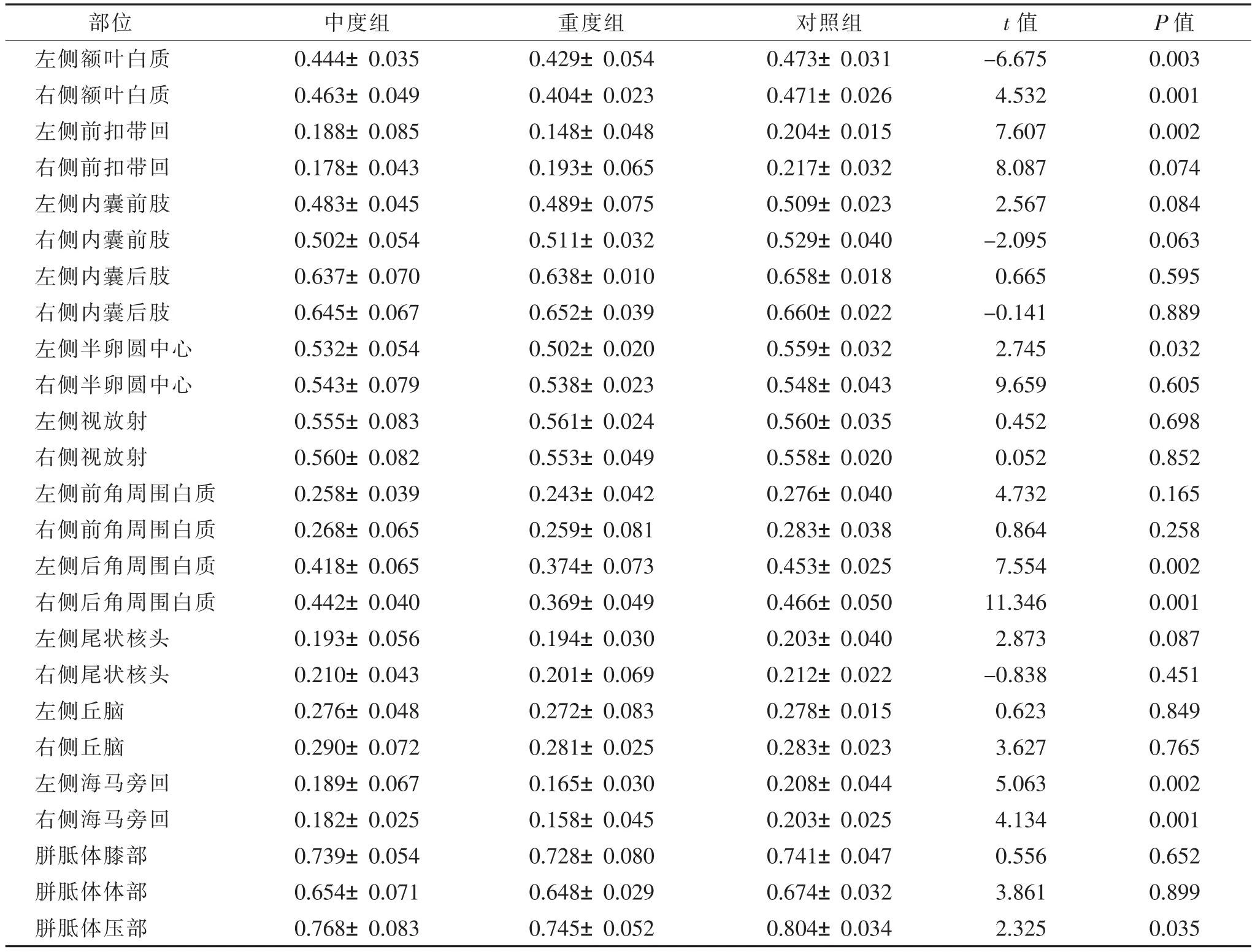
表3 3组脑部各感兴趣区的FA值比较(±s)
部位 中度组 重度组 对照组 t值 P值左侧额叶白质 0.444±0.035 0.429±0.054 0.473±0.031 -6.675 0.003右侧额叶白质 0.463±0.049 0.404±0.023 0.471±0.026 4.532 0.001左侧前扣带回 0.188±0.085 0.148±0.048 0.204±0.015 7.607 0.002右侧前扣带回 0.178±0.043 0.193±0.065 0.217±0.032 8.087 0.074左侧内囊前肢 0.483±0.045 0.489±0.075 0.509±0.023 2.567 0.084右侧内囊前肢 0.502±0.054 0.511±0.032 0.529±0.040 -2.095 0.063左侧内囊后肢 0.637±0.070 0.638±0.010 0.658±0.018 0.665 0.595右侧内囊后肢 0.645±0.067 0.652±0.039 0.660±0.022 -0.141 0.889左侧半卵圆中心 0.532±0.054 0.502±0.020 0.559±0.032 2.745 0.032右侧半卵圆中心 0.543±0.079 0.538±0.023 0.548±0.043 9.659 0.605左侧视放射 0.555±0.083 0.561±0.024 0.560±0.035 0.452 0.698右侧视放射 0.560±0.082 0.553±0.049 0.558±0.020 0.052 0.852左侧前角周围白质 0.258±0.039 0.243±0.042 0.276±0.040 4.732 0.165右侧前角周围白质 0.268±0.065 0.259±0.081 0.283±0.038 0.864 0.258左侧后角周围白质 0.418±0.065 0.374±0.073 0.453±0.025 7.554 0.002右侧后角周围白质 0.442±0.040 0.369±0.049 0.466±0.050 11.346 0.001左侧尾状核头 0.193±0.056 0.194±0.030 0.203±0.040 2.873 0.087右侧尾状核头 0.210±0.043 0.201±0.069 0.212±0.022 -0.838 0.451左侧丘脑 0.276±0.048 0.272±0.083 0.278±0.015 0.623 0.849右侧丘脑 0.290±0.072 0.281±0.025 0.283±0.023 3.627 0.765左侧海马旁回 0.189±0.067 0.165±0.030 0.208±0.044 5.063 0.002右侧海马旁回 0.182±0.025 0.158±0.045 0.203±0.025 4.134 0.001胼胝体膝部 0.739±0.054 0.728±0.080 0.741±0.047 0.556 0.652胼胝体体部 0.654±0.071 0.648±0.029 0.674±0.032 3.861 0.899胼胝体压部 0.768±0.083 0.745±0.052 0.804±0.034 2.325 0.035
3 讨论
OSAHS患者在睡眠过程中频繁打鼾,反复发生间歇性缺氧和高碳酸血症,引起睡眠结构紊乱和睡眠不足,导致白天嗜睡及MCI,生活质量明显下降[4]。常规MRI检查尽管能发现OSAHS患者伴发的脑血管病变,但难以显示潜在的脑结构改变,而DTI可早期发现和识别MCI。
DTI是基于DWI的用于描述水分子扩散方向特征的MRI新技术,采用快速成像的单次激发EPI,使用伪彩色或灰度阶进行成像,反映活体组织空间组成信息及病理状态下组织结构间水分子的运动状态[5]。受神经髓鞘及轴索排列方向的影响,水分子沿神经纤维走行方向的扩散比垂直方向更便捷。因此,不同部位神经纤维其各向异性存在差别。临床上常用ADC值和FA值来定量描述水分子在组织中的扩散能力和扩散各向异性程度。其中FA值反映组织的各向异性最灵敏,受神经纤维组织的直径、髓鞘完整性及排列紧密程度的影响[6],其FA值在0~1之间变化。FA值越大,则水分子扩散的各向异性越大,说明组织排列越紧密;FA值越小,则水分子扩散的各向异性越小,组织排列越松散。
本研究发现,OSAHS患者的双侧额叶、左侧前扣带、左侧半卵圆中心、双侧侧脑室后角周围白质、双侧海马旁回及胼胝体压部等多个脑白质区域FA值明显降低,与对照组比较差异有统计学意义,提示患者多种白质纤维受损。其中额叶是连接同侧大脑半球的联络纤维,半卵圆中心是连接大脑皮层与皮层下结构的投射纤维,而胼胝体则是连接双侧大脑半球的连合纤维。由此可见,脑内不同功能、不同走行方向的3种白质纤维均不同程度受累。白质损伤范围比应用MRS、神经化学方法研究发现的额叶白质等受损区域更为广泛[7]。且右侧前扣带回也出现FA值下降,虽与对照组比较差异无统计学意义,但P值接近0.05,提示增大样本量后有可能发现更大范围的白质受累。Macey等[8]研究发现,多个脑区FA值降低,表明OSAHS患者存在广泛的白质结构损伤。其病理机制可能是:OSAHS患者夜间反复低氧血症、血压波动,引起营养深部白质的小动脉硬化、磨玻璃样变性,而这些小动脉多呈直角发出,相互间的吻合支很少,不能建立有效的侧支循环,深部白质区域长期呈低灌注状态,产生慢性缺血缺氧变,轴突细胞膜和髓鞘的完整性遭到破坏,导致轴突变性、脱髓鞘改变。此时常规MRI检查技术尚未能发现明显异常,但实际上深部白质的完整性和功能已经遭到破坏。另外,FA值降低的区域,如右侧额叶白质、左侧半卵圆中心、左侧脑室后角周围白质等处ADC值也升高,提示上述部位水分子扩散速度加快。但ADC值升高区域明显小于FA值减少区域,说明对白质损伤的检出FA值较ADC值更为敏感。
记忆损害是OSAHS患者就诊的主要症状之一。李琳等[9]观察到间歇性低氧可降低大鼠的学习记忆能力,且低氧时间越长,学习记忆能力损伤越明显,其与大鼠的海马区神经细胞超微结构损伤有关。本研究发现,OSAHS组患者的前扣带回、海马旁回等与记忆相关的灰质区域FA值也出现明显降低,与对照组比较差异有统计学意义。海马周围神经纤维丰富,是脑缺血后较易受累的区域。有研究显示[10],穹窿区FA值的变化能更好地体现疾病进展。Macey等[11]发现OSAHS患者的额颞顶叶、前扣带、海马和小脑等多个脑区的体积减少。其可能的机制是反复发生的低氧血症可引起扣带回、海马旁回灰质减少。FA越弱,局部组织的排列就越松散。这从解剖学的角度对OSAHS患者出现记忆障碍作出了合理的解释。
MoCA是一种方便的、独立的认知评估方法,涵盖了各种重要的神经认知功能领域,具有较高的敏感性和特异性[12]。本研究发现,OSAHS重度组MoCA评分均值低于26分,比对照组低,表明重度OSAHS患者存在MCI。而且MoCA亚项评分中仅有记忆/延迟回忆得分,OSAHS重度组显著低于对照组(P<0.01)。MoCA评分越低,OSAHS患者的认知功能损害程度可能越重,尤其是注意、记忆方面。低氧可引起神经元损伤和海马萎缩,导致认知功能下降,据推测OSAHS患者夜间睡眠时反复发生呼吸暂停和低氧血症是认知功能损害的病理生理基础[13]。何丽等[14]研究也发现,双侧海马旁回、左侧颞叶、右侧侧脑室前角旁脑白质FA值与MoCA评分呈显著正相关,说明这些区域脑白质损害程度与临床上认知损害严重程度密切相关,与本研究相似;这一结果也为孙云闯等[12]提出的MoCA评分在诊断MCI的敏感性优于MMSE评分的理论提供了影像学证据。
有研究表明[15],睡眠参与了学习记忆的形成过程。睡眠期间,脑内某些靶向蛋白质合成速度加快,有利于新突触联系的建立,促进学习记忆,有利于将短时记忆碎片融合成长时程记忆,剥夺睡眠则适得其反[15]。OSAHS患者经常出现的睡眠剥夺和睡眠结构紊乱,可能引起脑内神经递质系统失衡,抑制或破坏记忆通路,使得突触结构的信号传递效率发生改变[16]。
本研究存在一定的局限性,本组中没有轻度OSAHS患者,重度患者占了很大的比例(72.2%),与样本量较小有一定关系,且患者病情总体较重,有可能被忽略。另外,对照组例数较少,病例数不同对研究结果可能也会产生一些影响。
总之,OSAHS患者神经精神系统损害的严重程度影响其认知功能及行为改变,从神经心理测试量表评价,重度组患者MoCA评分总分及MoCA亚项中记忆/延迟回忆均值明显降低。DTI检查显示OSAHS患者不但存在联络纤维、投射纤维、连合纤维等3种白质纤维的受累,部分大脑皮质如海马旁回、前扣带回等也有累及。DTI是目前唯一在活体上无创研究脑白质方向性和完整性的影像学方法[17],可早期发现OSAHS患者的白质损害,与传统的神经心理测试量表结合能更加全面客观地反映患者神经精神损害及严重程度,帮助临床医师更早地识别OSAHS患者认知功能损害,为早期干预提供依据。

图1 ADC图上ROI区的选取 图1 a颞叶和枕叶 图1 b额叶,顶叶,胼胝体膝部与压部,内囊前肢与后肢 图1 c胼胝体体部、放射冠区图1 d半卵圆中心
[参考文献]
[1]Marik PE.Leptin,obesity and obst ructive sleep apnea[J].Chest,2000,118:569-571.
[2]张泉,张云亭.阻塞性睡眠呼吸暂停低通气综合征的神经影像学研究进展[J].国际医学放射学杂志,2012,35(3):220-224.
[3]中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[4]甘柳萍,林琳.阻塞性睡眠呼吸暂停综合征患者健康状况与生活质量的研究进展[J].中华现代护理杂志,2012,18(10):1222-1224.
[5]刘松江,张体江,张国明,等.DTI在基底节、放射冠区急性期脑梗死预后评估中的应用[J].实用放射学杂志,2014,30(11):1791-1794.
[6]段金海,汪华侨,陈少琼,等.阿尔茨海默病患者扣带回后部各向异性与葡萄糖代谢关系研究[J].中风与神经疾病杂志,2008,25 (4):398-400.
[7]Zimmerman ME,Aloia MS.A review of neuroimaging in obstructive sleep apnea[J].J Clin Sleep Med,2006,2:461-471.
[8]Macey PM,Kumar R,Woo MA,et al.Brain structural changes in obstructive sleep apnea[J].Sleep,2008,31:967-977.
[9]李琳,王红阳,陈宝元,等.重度间歇性低氧对大鼠认知功能及海马超微结构的影响[J].西安交通大学学报:医学版,2011,32(6):687-689.
[10]Mielke MM,Okonkwo OC,Oishi K,et al.Fornix integrity and hippocampal volume predict memory decline and progression to Alzheimer’s disease[J].Alzheimers Dement,2012,8:105-113.
[11]Macey PM,Henderson LA,Macey KE,et al.Brain morphology associated with obstructive sleep apnea[J].Am J Respir Crit Care Med,2002,166:1382-1387.
[12]孙云闯,秦斌.MoCA和MMSE在轻度认知障碍中的应用比较[J].中国神经免疫学和神经病学杂志,2010,17(2):138-140.
[13]张峰,姚红兵,李兵,等.儿童阻塞性睡眠呼吸暂停低通气综合征与认知障碍[J].国际耳鼻咽喉头颈外科杂志,2012,36(5):284-287.
[14]何丽,刘斋,任庆云,等.轻度认知障碍的MR扩散张量成像研究[J].实用放射学杂志,2014,30(8):1255-1258.
[15]隋月林,李吉勇,胡庆,等.睡眠剥夺与学习记忆[J].四川解剖学杂志,2006,14(4):36-37.
[16]吕祥兄,张建军,毛洪刚,等.睡眠呼吸暂停综合征患者脑白质病变与认知功能的相关性[J].浙江医学,2012,34(11):860-862.
[17]李亚迪,冯晓源,何慧瑾,等.基于体素的遗忘型轻度认知障碍和轻度阿尔茨海默病全脑白质MR扩散张量成像分析[J].中华放射学杂志,2011,45(4):341-347.
短篇论著
收稿日期(2015-06-24)
[通信作者]徐海如,E-mail:doone315@163.com。
DOI:10.3969/j.issn.1672-0512.2016.01.014
