牛卵母细胞体外成熟减数分裂进程及核型变化的研究
2016-03-18吐逊吾守尔新疆阿瓦提县畜禽改良站新疆阿瓦提843200
吐逊.吾守尔(新疆阿瓦提县畜禽改良站,新疆 阿瓦提 843200)
牛卵母细胞体外成熟减数分裂进程及核型变化的研究
吐逊.吾守尔(新疆阿瓦提县畜禽改良站,新疆阿瓦提843200)
摘要:为了更加深入了解牛卵母细胞体外成熟减数分裂及其伴随该进程中核型的变化,实验采用常规的牛卵母细胞体外成熟方法及核型染色方法对成熟过程中减数分裂恢复情况及其对应的核型进行了研究。结果表明:牛卵母细胞体外成熟8 h减数分裂抑制恢复率达45.26%,成熟12 h时绝大部分卵母细胞(81.63%)已经恢复了减数分裂抑制状态,正常成熟24 h后GVBD率达91.67%。说明在对牛卵母细胞进行体外成熟过程中卵母细胞可以按照正常的减数分裂进程发育至受精前阶段,经染色后可以较为清楚识别减数分裂各时期细胞核核型形态及其变化规律,为研究牛卵母细胞体外成熟减数分裂抑制恢复的分子机制探讨及体外成熟效率的提高提供了参考价值。
关键词:牛卵母细胞;体外成熟;减数分裂;核型
10.16863/j.cnki.1003-6377.2016.01.005
体外胚胎生产技术(IVP)是集体外受精技术(IVF)、体外胚胎培养技术(IVC)和体外胚胎移植技术(ET)于一体的体外快速生产胚胎的生物技术,也称辅助生殖技术(ART)。其技术流程主要包括:卵母细胞采集,卵母细胞体外成熟、卵母细胞体外受精、早期胚胎培养、胚胎移植[1]。家畜卵母细胞体外成熟(In Vitro Maturation,IVM),是体外胚胎生产技术的重要环节,理想的体外成熟体系可以使卵母细胞获得充分的受精和发育能力,进而提高胚胎体外生产效率[2.3]。减数分裂是配子形成过程中生殖细胞的一种独特的分裂方式。雌性哺乳动物出生前后,卵原细胞停止增殖,之后,经细线期、偶线期、粗线期发育到双线期,其中双线期染色质高度疏松,具有完整的细胞核膜,又称为核网期,即生发泡(Germinal Vesicle,GV)[4.5]。卵母细胞将在这一时期休止时间不同物种存在显著差异,数日至数年不等。将体内卵母细胞移至体外培养环境中其会发生自发的减数分裂恢复现象,而伴随这一现象的是细胞核核相的一系列变化,生发泡破裂(Germinal Vesicle Breakdown,GVBD)是卵母细胞减数分裂抑制恢复的标志。故体外成熟过程中卵母细胞的减数分裂是一个重要的生理学事件,因此研究牛卵母细胞体外成熟过程中减数分裂进程以及相应的核相变化对于理解配子发生分子机制及提高卵母细胞体外成熟质量和胚胎体外生产效率有重大理论意义。
1 材料与方法
1.1实验材料及试剂
恒温水浴锅,超净工作台,自动灭菌锅,高速冷冻离心机,CO2培养箱,屠宰场来源牛卵巢,20 mL医用注射器,体视显微镜,荧光显微镜,洗卵液TCM199(含有hepes),成熟液基础培养基TCM199,双抗,DAPI,PBS等
1.2实验方法
1.2.1主要试剂配制
吸卵液:含有Hepes的TCM199 + 2% FBS + 1% (Antibiotic-Antimycotic)+ 50 mg/mL肝素钠;成熟培养基:TCM199+10 ug/mL FSH+ 10 ug/mlLH+ 1 ug/mlE2+ 10% FBS+1%双抗+100 uM半胱氨酸。
1.2.2卵母细胞采集
屠宰场收集牛卵巢,置于30℃~35℃的生理盐水,(4~5)h内运回实验室。生理盐水洗三遍,使用针刺破卵泡,放出壁层颗粒细胞和卵丘卵母细胞复合体,采用18 g针头的注射器抽取卵巢表面(3~8)mm直径大小的卵泡内容物,将所采集的卵泡液置于无菌的培养皿内。采卵完毕后,在体式显微镜下挑选A级(胞质均匀带有数层致密卵丘细胞)、B级(胞质均匀带有数层较疏松的卵丘细胞及部分裸露)卵母细胞[6]。
1.2.3卵母细胞体外成熟
将挑选出的A级和B级COCs在洗卵液及成熟液中分别洗涤3次,然后放入预先在CO2培养箱中平衡2 h以上的成熟培养液中培养(四孔板培养,500 uL体积成熟液,50枚左右卵母)培养条件为含5% CO2的空气,温度39℃,饱和湿度,培养时间为24 h[7]。
1.2.4卵母细胞核型鉴定
卵母细胞在体外成熟不同时间点采集后,利用口吸管吸出卵丘卵母细胞复合体置入0.1%的透明质酸酶中培养箱内处理5 min;使用移液枪反复轻轻吹打,然后在洗卵液中洗涤并分离卵丘颗粒细胞与卵母细胞,将透明带上无颗粒细胞的裸卵洗静放入4%的多聚甲醛室温固定(2~4)h;固定后在PBS中洗涤3次置入0.5%的triton处理30 min;然后口吸管吸出卵母细胞放到载玻片上滴加1.5 uLDAPI染色后盖上盖玻片,在黑暗条件荧光显微镜检测卵母细胞核处于GV阶段及GVBD的比例[8.9]。
2 实验结果及分析
2.1牛卵母细胞减数分裂进程
将体外成熟不同时间点卵母细胞经固定,染色后统计GVBD比率。
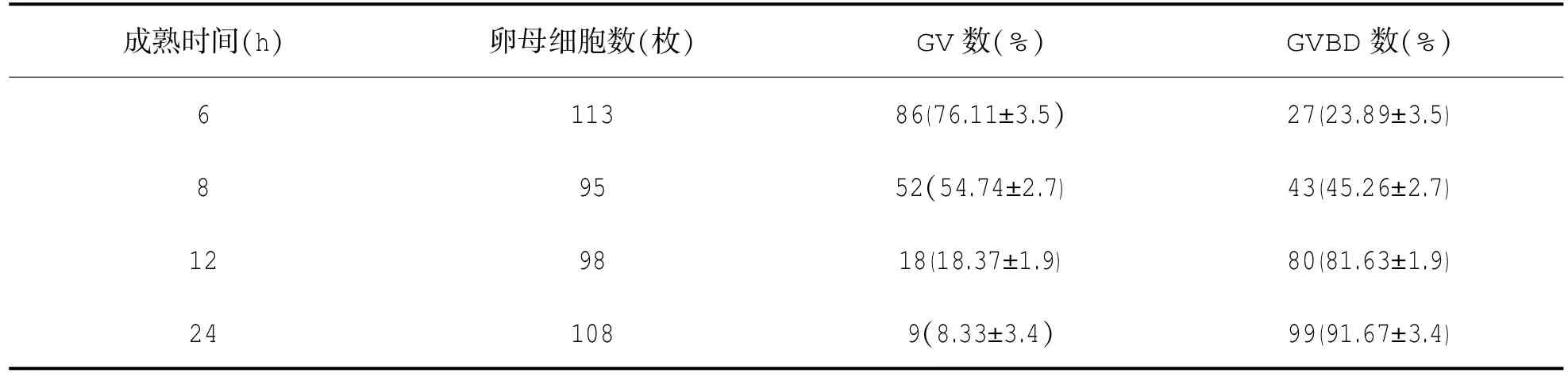
表1 牛卵母细胞体外成熟进程
表1说明牛卵母细胞体外成熟8 h减数分裂抑制恢复率达45.26%,成熟12 h时绝大部分卵母细胞(81.63%)已经恢复了减数分裂抑制状态,正常成熟24 h后GVBD率达91.67%。
2.2牛卵母细胞体外成熟过程中核型鉴定
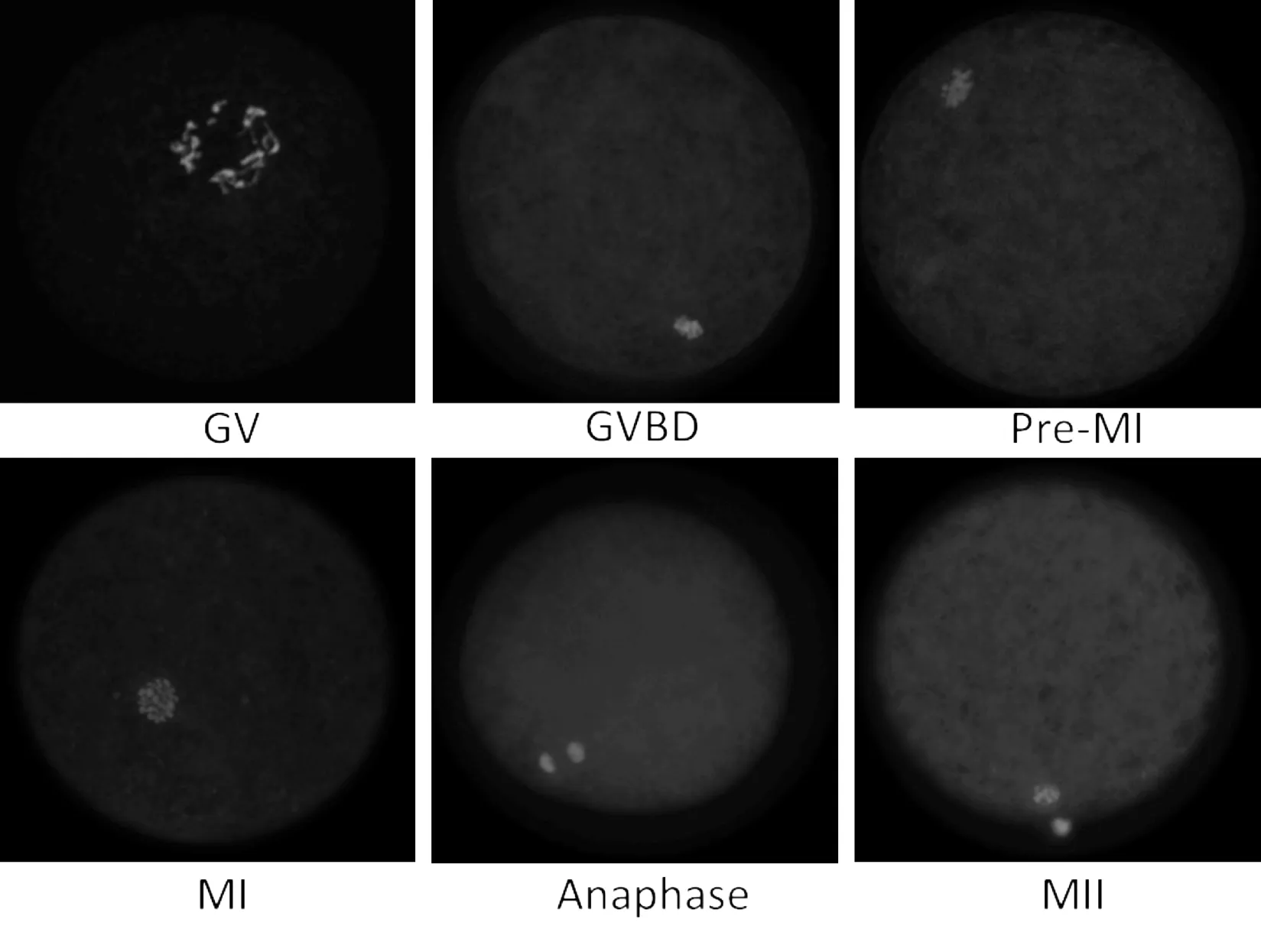
图1 牛卵母细胞体外成熟减数分裂各时期核型
图1显示了牛卵母细胞体外成熟过程总减数分裂进程各个时期典型的细胞核核型,GV期细胞质呈纤维状弥散状态分布于细胞核内,随着GVBD的发生细胞质进一步发生凝集,最终形成高度致密化的染色体形态,随着MI期的到来,凝集的染色体被纺锤体牵引到赤道板上,第一次减数分裂后期(anaphase),染色体发生分离,MII期是极体部分染色体被排出到卵母细胞外,伴随着卵母细胞内染色体又重新排列在赤道板上。
3 结 论
在对牛卵母细胞正常体外成熟过程中统计了不同时期GVBD发生率,并对减数分裂不同时期的典型核型进行了鉴定,体外成熟24 h后,牛卵母细胞GVBD发生率达91.67±3.4%,这与李青洋[10]实验结果中的对照组一致。各个时期均可以清楚的观察到典型的细胞核型,进一步深入了解了牛卵母细胞体外成熟过程中减数分裂抑制恢复的进程,为今后相关工作奠定了一定的理论基础。
参考文章:
[1]Moreno D,Neira A,Dubreil L,.In vitro bovine embryo production in a synthetic medium [J].Embryo development,cryosurvival,and establishment of pregnancy.THERIOGENOLOGY 2015,(84):1053-60.
[2] Gilchrist RB, Thompson JG. Oocyte maturation: emerging concepts and technologies to improve developmental potential in vitro[J].THERIOGENOLOGY 2007,(67):6-15.
[3]Sauerbrun-Cutler MT,Vega M,Keltz M,McGovern PG.In vitromaturation and its role in clinical assisted reproductive technology[J].OBSTET GYNECOL SURV 2015,(70):45-57.
[4]孙岩.TBP在减数分裂和胚胎早期发育过程中的动力学变化[D].南京:南京农业大学,2007,48.
[5]张杰.大鼠卵母细胞生长和成熟过程中GV染色质构型的变化[D].哈尔滨:东北农业大学,2008,
[6]滑志民.影响山羊活体采卵与体外受精效果的研究[D].保定:河北农业大学,2007:57.
[7]赵红卫.HA对牛卵母细胞IVM、早期胚胎IVC及冷冻保存影响的研究[D].杨凌:西北农林科技大学, 2004:72.
[8]Karja NW ,Otoi T,MurakamiM,Fahrudin M,Suzuki T.In vitromaturation,fertilization and development of domestic cat oocytes recovered from ovaries collected at three stages of the reproductive cycle[J]. THERIOGENOLOGY 2002;(57):2289-98.
[9] Martins LR,Fernandes CB,Minto BW ,Landim-Alvarenga FC,Lopes MD.Ultrastructural characteristics of non-matured and in vitromatured oocytes collected from pre-pubertal and adult domestic cat ovaries[J]. REPROD DOMEST ANIM 2009,44 Suppl(2):251-4.
[10]李青洋.减数分裂抑制剂对水牛卵母细胞减数分裂恢复及胚胎发育的影响[D].西宁:广西大学, 2012,72.
Research on the Bovine Oocyte Meiosis in-vitro Maturation and Karyotype Changes
TUXUN.Wushouer
(Xinjiang Awat County Livestock Improvement Station,Awat Xinjiang 843200,China)
Abstract:To further understand the bovine oocyte meiosis in-vitro maturation and karyotype changes along with the process,this paper studies the recovery status of meiosis in the process of maturation and the corresponding karyotype by the regularmethod of bovine oocyte in-vitro maturation and karyotype analysis.It is showed that the recovery rate ofmeiosis reaches 45.26% when bovine oocyte matures in vitro for 8 hours, while the rate reaches to 81.63% and 91.67% for 12 hours and 24 hours respectively,which demonstates that oocytes can grow and reach to the status prior to fertilization with normalmeiosis process during the period of in-vitro maturation of bovine oocytes,and that the form of cellula karyotype and its rules in all period of meiosis can be identified clearly when the oocytes are dyed,which provides reference for the study of molecular mechanisms of bovine oocyte meiosis maturation and the improvement of efficiency of in-vitro maturation.
Key words:bovine oocytes;in-vitromaturation;meiosis;karyotype
收稿日期:2015-10-20,修回日期:2016-01-13
作者简介:吐逊.吾守尔(1964—)男,在职硕士,高级畜牧师,从事动物遗传育种与繁殖研究工作。
基金项目:国家“十二五”肉牛产业体系项目。
中图分类号:S814
文献标识码:A
文章编号:1003-6377(2016)01-0019-04
