胃上部癌术前放化疗的有效性及安全性分析
2016-03-18符涛步召德李子禹武爱文张霁吴晓江张连海季鑫季加孚
符涛 步召德 李子禹 武爱文 张霁 吴晓江 张连海 季鑫 季加孚
胃上部癌术前放化疗的有效性及安全性分析
符涛步召德李子禹武爱文张霁吴晓江张连海季鑫季加孚
摘要目的:探讨进展期胃上部癌术前放化疗的短期有效性、治疗安全耐受性及生存预后情况。方法:回顾性分析北京大学肿瘤医院胃肠肿瘤外科2011年11月至2014年11月间收治的行术前放化疗或术前化疗并后续标准D2根治手术的62例进展期胃上部癌患者病历资料,分析比较两组患者各项短期疗效指标、安全性指标及不良反应的差异,并进行随访资料的生存分析。结果:术后病理结果中术前放化疗组pT4期及pN3患者数量明显减少(P<0.05),手术安全性及放化疗不良反应两组间差异无统计学意义,生存分析两组间差异无统计学意义。结论:术前放化疗可改良胃上部癌患者生存预后。相较于术前化疗,术前放化疗没有增加手术难度及风险,放化疗毒性在可控范围内。术前放化疗能有效提高局部控制率尤其是区域淋巴转移,其客观缓解率与术前化疗相当。但是,生存预后的最终结论仍有待于长期随访的进一步分析。
关键词胃上部癌术前放化疗有效性安全性
Preoperative chemoradiation therapy for upper gastric cancer: a retrospective study for its efficacy and safety
Tao FU, Zhaode BU, Ziyu LI, Aiwen WU, Ji ZHANG, Xiaojiang WU, Lianhai ZHANG, Xin JI, Jiafu JI
Correspondence to: Zhaode BU; E-mail: buzhaode@cjcrcn.org
Department of Gastrointestinal Surgery, Beijing Cancer Hospital & Institute, Peking University School of Oncology, Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Beijing 100142, China
Abstract Objective: To investigate the efficacy, safety, and overall survival of advanced upper gastric cancer patients who received preoperative chemoradiation therapy. Methods: A total of 62 patients who received preoperative chemotherapy or chemoradiation therapy in the Department of Gastrointestinal Surgery of Beijing Cancer Hospital & Institute were retrospectively observed to determine the efficacy and safety and to perform survival analysis of preoperative chemoradiation therapy. Results: Results of the postoperative pathology showed that the number of patients with T4and N3stages was significantly lower in the preoperative chemoradiation therapy group than in the preoperative chemotherapy group (P<0.05). In addition, the differences between the two groups in terms of safety and toxicity were not significant (P≥0.05). Analysis also showed that the differences between the two groups in terms of survival were not significant (P≥0.05). Conclusion: Patients with advanced upper gastric cancer can gain a potential survival advantage from preoperative chemoradiation therapy. Compared with preoperative chemotherapy, preoperative chemoradiation therapy was performed without increased risk of toxicity and insecurity. Preoperative chemoradiation therapy can also improve the local control ratio, especially the control ratio of lymphatic metastasis. However, the final results of survival analysis depend on long-term follow-up of patients.
Keywords:upper gastric cancer, preoperative chemoradiation therapy, efficacy, safety
根据世界卫生组织的报道,胃癌的发病率居于恶性肿瘤全球发病率的第5位,其死亡率更是高居第3位,仅次于肺癌与肝癌。中国每年胃癌新发病例占世界新发病例40%以上,相较于欧美地区相对较低的胃癌发病率及日韩地区相对较高的早期胃癌诊断率,我国对胃癌患者的诊治面临着十分严峻的形势。
胃上部癌病变范围包括食管胃结合部、胃底部,发病率逐年上升,其淋巴引流范围较为复杂,手术治疗涉及联合开胸、一定难度的消化道吻合重建及食管下段、膈肌、腹腔血管周围淋巴结清扫,单纯手术预后欠佳,因此对肿瘤局部控制有着较高的需求[1-3]。三维适形调强放射治疗技术的发展为胃上部癌的综合治疗带来了新的契机,考虑到放射治疗对肿瘤局部病灶较好的控制力和三维调强放疗的精准定位及较小的放疗损伤[4],结合术前化疗对肿瘤微转移的抑制作用,术前联合放化疗成为了胃癌综合治疗新的研究热点[5]。
近年来,国际上相继开展了一些有关胃食管癌术前放化疗的临床研究,但是包括CROSS研究、PO⁃ET研究在内的大型随机对照临床试验尚未就胃上部癌术前放化疗疗效得到一个明确的结论[6-7],虽然一些荟萃分析认为对比单纯手术术前放化疗能够使患者生存获益,但是目前术前放化疗与术前化疗的对比尚无令人信服的证据[8-9]。因此通过设计一项回顾性研究来探索胃上部癌术前放化疗的安全性及有效性,试图证明对比于术前化疗,胃上部癌术前放化疗具有提高总生存率及无病生存率的潜力,不增加手术难度及风险,放化疗不良反应在可控范围内,能有效提高局部控制率及客观缓解率,从而降低复发风险。
1 材料与方法
1.1一般资料
收集北京大学肿瘤医院胃肠肿瘤外科2011年11月至2014年11月间收治的行术前放化疗或术前化疗并后续标准D2根治手术的62例进展期胃上部癌患者病历资料。所有患者病历资料、随访资料均清晰完整,术前放化疗或术前化疗方案均由本院相关科室制定及实施。所有患者无严重并发症,无胃癌合并症(出血、穿孔、梗阻)而需急诊手术。所有患者未参加其他临床研究或加入其他治疗、诊断试验组。
1.2治疗方法
所有纳入病例均接受治疗前胃镜检查,经胃镜活检确定病理类型,临床分期依据腹部增强CT/MRI及超声胃镜检查结果,分期标准参照AJCC-UICC TNM分期第7版。术前化疗方案为:治疗第1 d奥沙利铂130mg/m2静脉注射2h,治疗1~14d替吉奥80mg/m2口服或希罗达2 000 mg/m2口服。治疗3 w为一完整治疗周期,术前共进行2个周期。术前放化疗具体治疗方案为:三维适形调强放射治疗GTV=50Gy/2Gy,CTV=45Gy/1.8 Gy,共25次,每周第1 d至第5 d治疗,共进行5周;同步化疗方案为:治疗第1、8、15、22、29 d奥沙利铂40 mg/m2静脉注射,治疗每周1~5 d替吉奥60 mg/m2口服。手术淋巴结清扫范围遵循卫生部胃癌诊疗规范及日本胃癌治疗指南,包括:1、2、3、4sa、4sb、4d、5、6、7、8a、9、10、11p、11d、12a组淋巴结,消化道重建采用Roux-en-Y式吻合,所有患者均接受根治性全胃切除手术。临床评效为影像学CT及超声内镜评效,即参照RECIST1.1疗效评价标准依据治疗前后检查结果对比进行评价[10];术后病理学评效采用日本胃癌研究协会1995年第1版中制定标准[11]、Becker标准及NCCN指南2013年第2版标准[12-13]。术前放疗不良反应评价参照RTOG急性放射反应评价标准,术前化疗不良反应评价参照常用药物毒性标准。
1.3统计学方法
SPSS 19.0统计软件进行分析处理。对计量资料首先进行正态分布检验,组间计量资料比较,采用独立样本t检验或非参数秩和检验;组间计数资料比较采用Pearson卡方、Fisher精确检验或连续校正卡方检验。对于总生存率、无病生存率等采用Kaplan-Meier法进行估计,组间生存曲线的比较采用Log-rank检验,预后因素使用Kaplan-Meier单因素分析,单因素分析中有预测价值的指标使用Cox比例风险模型进行多因素回归分析。所有的统计学检验均使用双侧检验,当P值<0.05为差异具有统计学意义。
2 结果
2.1一般资料
共纳入符合要求患者62例,一般情况及基线资料见表1。两组患者在性别方面组间差异具有统计学意义(P=0.042),术前化疗组女性患者比例明显高于术前放化疗组。在其余基线指标包括年龄、Siewert分型、活检病理类型、临床T分期及N分期方面,组间差异无统计学意义(P<0.05)。除性别外,两组患者术前情况基本一致,临床病理基线资料齐性较好(表1)。
2.2手术、病理及疗效
淋巴结清扫数目上两组间差异具有统计学意义,考虑可能与放疗后局部淋巴组织纤维化有一定关系,即使如此,两组清扫均数均大于15枚,均符合D2根治术基本原则。在衡量短期有效性的相关指标中,脉管神经侵犯情况、手术R0切除率、pCR、淋巴结全阴性率等均无明显差异。但是值得注意的是术后病理结果中,pT4a及pN3期患者数目术前放化疗组明显减少(P<0.05),考虑到治疗前两组N分期无显著性差异而术前化疗组术后病理N3分期比例显著更高,因此术前放化疗组N分期实际降期程度可能升高,此结果提示术前放化疗具有良好的局部控制能力。术后病理学评效方面,无论是日本标准、NCCN标准还是Becker标准,组间差异均无统计学意义。尽管如此,我们仍然注意到,术前放化疗组中病理高度缓解患者比例高于术前化疗组(表2)。
2.3治疗安全性
放疗在破坏肿瘤组织的同时,会造成周围区域正常组织出现溃疡、水肿、炎性浸润、出血坏死及纤维化等反应,因此有可能增加手术难度并导致术后恢复缓慢甚至出现围术期手术相关并发症。对比手术安全性指标,手术时间、术中出血量、术后住院时间、围术期并发症率、二次手术率、联合脏器切除率、围手术期死亡率两组间差异均无统计学意义。术前放化疗组术后出血比例略高于术前化疗组,而术前化疗组中排空障碍人数略高于前者,在术前化疗组中,1例患者因术后出现吻合口瘘行二次手术医治无效而死亡。该结果提示,相较于术前化疗,术前放化疗并未增加手术的难度,无明显延缓术后患者的恢复过程及时间,同时,术后并发症的发生率及围手术期死亡风险均与术前化疗相一致。
有关放化疗不良反应评价方面,术前放化疗组中3~4级不良反应共3例,2例因存在严重的骨髓抑制及放射性食管炎中断了术前放化疗;而术前化疗组中,3~4级不良反应共5例,1例因存在严重的骨髓抑制及无法耐受的消化道反应中断了术前化疗,两组中最常见的不良反应均为骨髓抑制,化疗组中食欲下降、恶心呕吐发生次数较多。经检验,两组间不良反应差异无统计学意义,可以认为相较于术前化疗,术前放化疗具有相同的耐受性,其不良反应未显著增加,术前治疗的安全性基本一致(表3)。
2.4生存分析
术前放化疗组中位随访时间17(7~35)个月,术前化疗组中位随访时间34(6~44)个月。术前放化疗组22例患者中,共计4例死亡,无带病生存患者。组内最长生存时间35个月,最快进展时间12个月,总生存率81.8%,无病生存率81.8%;术前化疗组40例患者中,共计10例死亡,带病生存患者4例,组内最长生存时间44个月,最快进展时间4个月。总生存率75%,无病生存率65%。对于总生存率,经Logrank检验,两组间总生存率组间差异无统计学意义(P=0.659);对于无病生存率,两组间总生存率组间差异同样无统计学意义(P=0.876,图1,2)。
针对生存预后进行Kaplan-Meier单因素分析中,年龄、临床N分期、术后病理N分期、淋巴结全阴性率、脉管癌栓/神经侵犯情况等与生存预后明显相关。将上述五项指标以及本研究的核心问题术前治疗方式纳入Cox多因素分析,结果示术后病理N分期和年龄为总生存的独立影响因素(表4)。

表1 一般情况及基线资料Table 1 General condition and baseline information
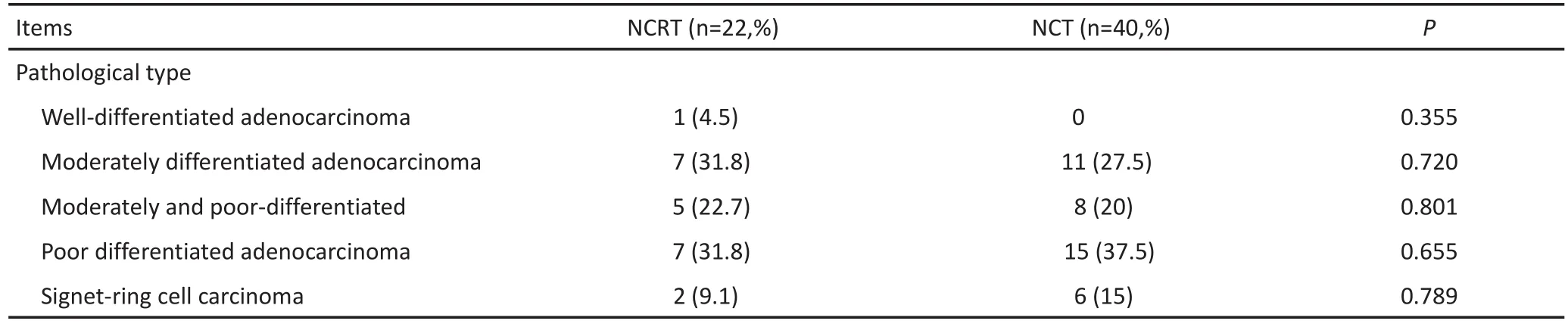
表1 一般情况及基线资料(续表1)Table 1 General condition and baseline information
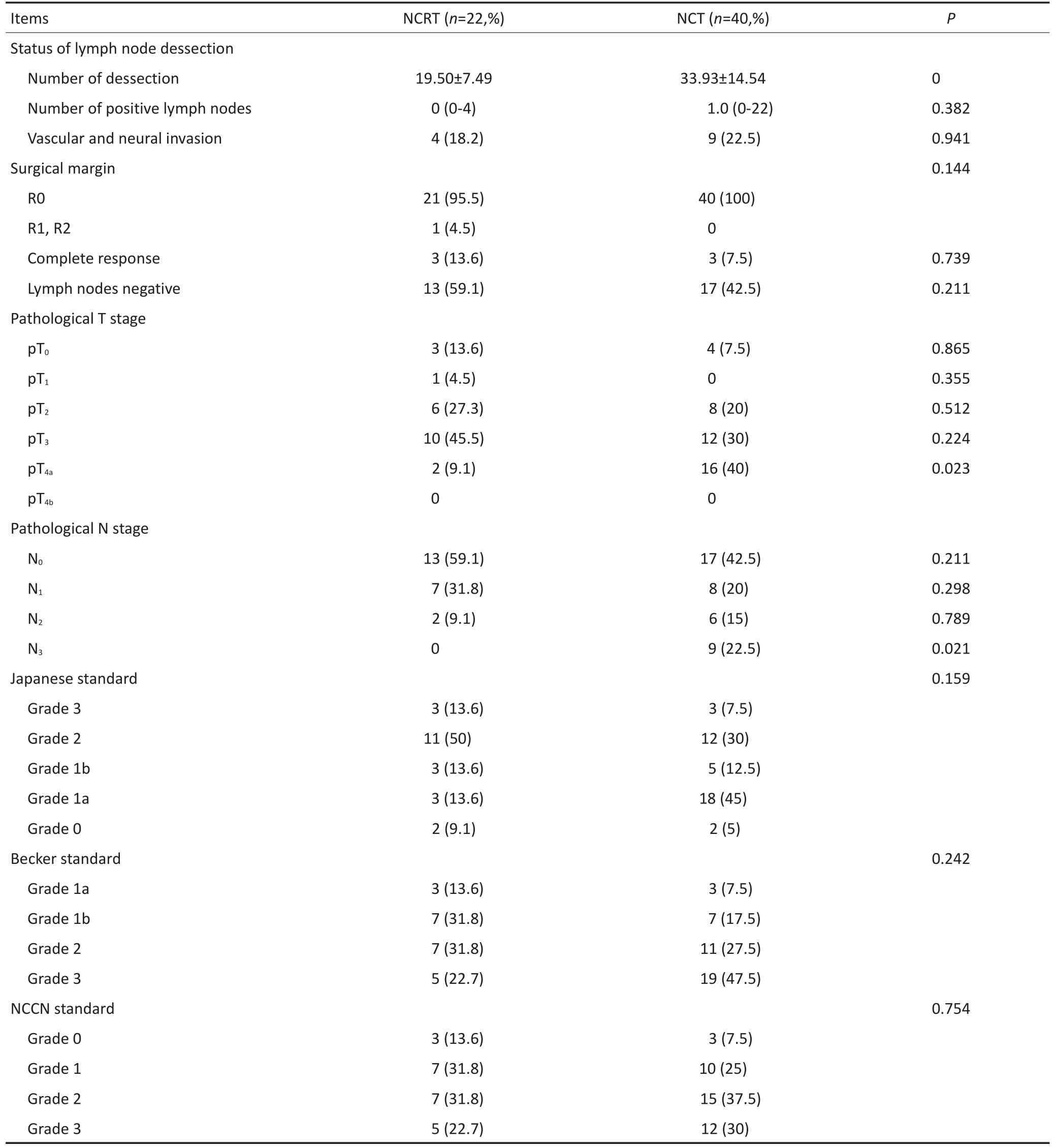
表2 手术、病理及疗效Table 2 Operation, pathology, and evaluation
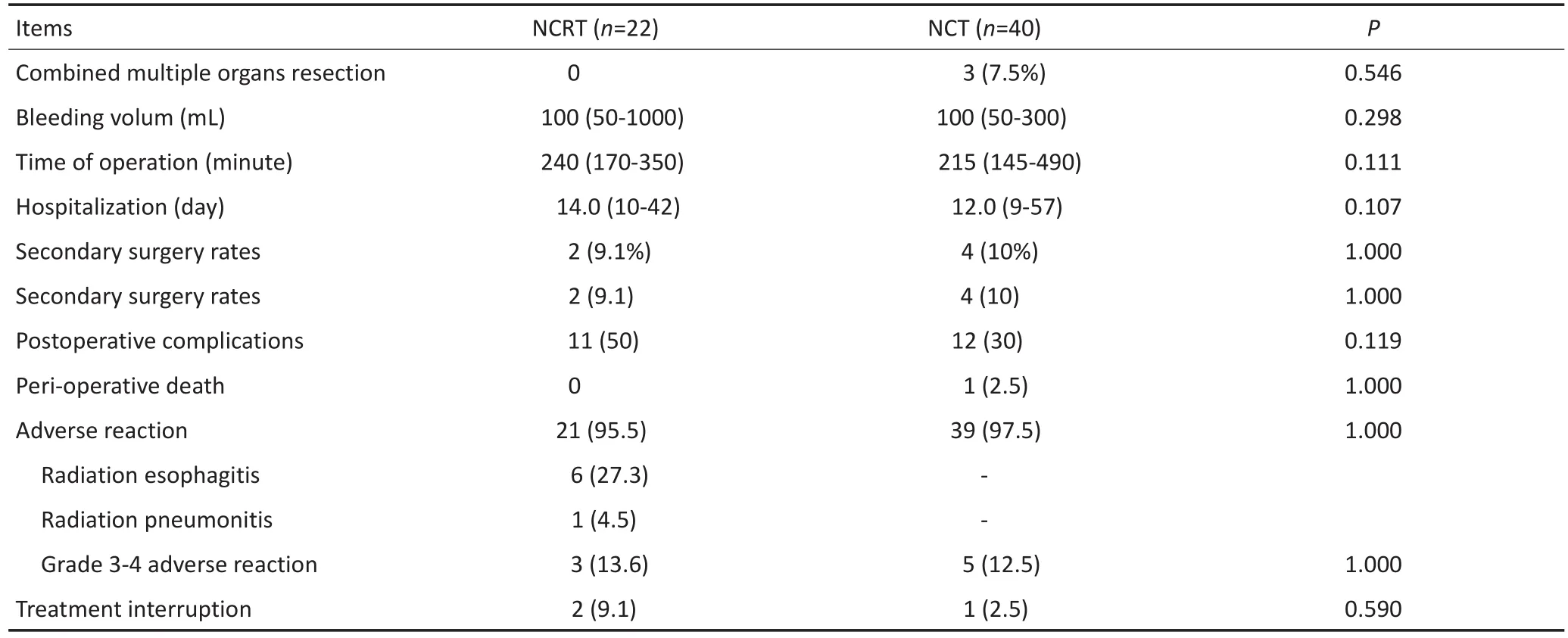
表3 手术、放化疗安全性Talbe 3 Therapeutic safety

图1 无病生存率比较Figure 1 Comparison of progression-free survival
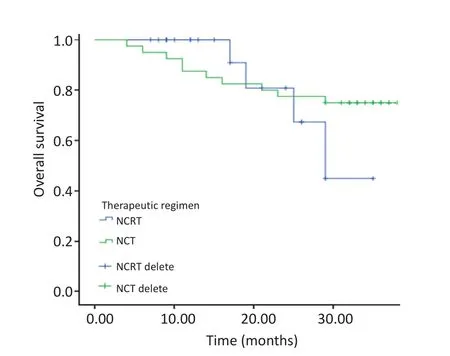
图2 总生存率比较Figure 2 Comparison of overall survival

表4 Cox多因素分析结果Table 4 Cox multiple factor analysis
3 讨论
术前放化疗应用于胃癌的综合治疗已有十年以上的历史,在局部控制率的提高和延长患者生存方面显示出了重要的作用。早在1978年,我国学者即开展了有关术前放化疗的初步研究,确认了术前放化疗能够使食管胃结合部癌患者术后获益并具有良好的安全性[14]。此后,国际上相继开展了一些小样本量的Ⅰ期或Ⅱ期研究,进一步证明了术前放化疗的安全性及耐受性[15-16]。2009年,德国学者发表了POET研究的结果[7],该研究首次排除了食管鳞癌,集中关注了胃上部腺癌患者接受术前放化疗与术前化疗后的疗效对比,令人遗憾的是该研究虽然发现术前放化疗组患者具有生存获益的趋势,但是并未达到统计学差异,其死亡风险比为0.67(95%CI 0.41~1.09)。2012年著名的荷兰CROSS研究发表了最终研究结果[6],该研究在排除食管鳞癌后术前放化疗死亡风险比为0.73(95%CI:0.54~1.00),其结果并无统计学意义。基于上述报道,本研究试图进一步分析胃上部癌术前放化疗的有效性及安全性。
就治疗安全性而言,我们进行了手术安全性及放化疗不良反应两方面评价。在研究中,两组患者手术时间、术中出血量及术后住院时间基本一致,虽然术前放化疗组有一例术中出血量高达1 000 mL,但是可以认为是孤立事件。该结果与其他一项临床研究类似,在CALGB 9781研究中术前放化疗组术后中位住院时间为11.5 d[17]。手术并发症情况两组基本一致,术前放化疗组术后出血比例略多,考虑可能与放疗导致局部组织溃疡、水肿、炎性浸润、出血坏死及纤维化有关。在术前化疗组中,1例患者因术后出现吻合口瘘行二次手术医治无效而死亡,术前放化疗组中没有出现围术期死亡情况。在CROSS研究中,术前放化疗组患者吻合口瘘发生概率较高,考虑可能与该研究中食道癌患者比例较高,手术吻合重建难度较大及手术麻醉插管时间较长有一定关系[6]。据此,认为术前放化疗并未增加胃上部癌手术难度,未显著增加术后并发症及围术期死亡风险尚。
两组患者在放化疗不良反应方面组间差异无统计学意义,最常见的不良反应为骨髓抑制,对比其他研究如Walsh、TROG的研究等[18-19],本文发现3~4级严重骨髓抑制的比例并未增加,同时由于严重骨髓抑制或其他3~4级严重不良反应导致的感染风险、出血风险及术前治疗中断比例同样尚未明显上升。但是,值得注意的是,本研究中有6例患者出现不同程度的放射性食管炎,在制定三维适形调强放疗计划及勾画靶区时,仍应当尽可能有效控制照射范围及照射强度,尽可能减少不必要的放射线副损伤。综上,相较于术前化疗,术前放化疗具有相同的耐受性,其不良反应并未显著增加,术前治疗的安全性基本一致。
就治疗有效性而言,本文分别关注短期有效性及中长期生存预后分析。两组患者在R0切除率、pCR、淋巴结全阴性率及脉管癌栓神经侵犯率方面组间差异均无统计学意义,两组患者在术后病理结果方面,术前放化疗组中pT4期及pN3期患者比例明显减少(P<0.05),同时淋巴结全阴性率比例高于术前化疗组,考虑到治疗前两组患者基线资料基本一致,因此术前放化疗实际肿瘤降期效果更好,反映出其具有良好的局部控制能力。三种病理学评效结果虽然尚无明显差异,但是术前放化疗组高度缓解患者比例更高,该结果同样印证了上述观点。
在生存分析中,两组总生存率与无病生存率无明显差异,但是术前放化疗组曲线波动较大,死亡及疾病进展事件出现频数较少,考虑随访时间较短,部分疾病事件可能尚未发生。因此,并不能够通过该分析完全确定两组患者生存预后无差异,在有限的随访时间内,术前放化疗组与术前化疗组患者之间的生存差异有可能并未完全显现,仍需要延长随访时间进一步观察。经Cox多因素分析,术后病理N分期和年龄为总生存的独立影响因素,同时,在单因素分析中,治疗前N分期及术后病理N分期以及淋巴结全阴性率与预后密切相关,据此推测局部淋巴转移的控制是术前治疗的关键所在。短期有效性分析中注意到,术前放化疗组局部控制效果更好,术后N分期显著降低,高度缓解患者比例更高,因此,考虑术前放化疗有提高区域淋巴转移控制率的趋势,从而具有提高总生存时间及预后的潜在可能。一篇德国大型荟萃分析结果同样提示,术前放化疗局部控制率明显提升,但是生存方面改善并不明显[8]。
综上所述,术前放化疗具有提高胃上部癌患者生存预后的潜在趋势。相较于术前化疗,术前放化疗没有增加手术难度及风险,放化疗毒性在可控范围内。术前放化疗能有效提高局部控制率尤其是区域淋巴转移控制,其客观缓解率与术前化疗相当。但是,生存预后的最终结论仍有赖于长期生存随访的进一步结果。
参考文献
[1] Crew KD, Neugut AI. Epidemiology of upper gastrointestinal malignancies[J]. SeminOncol, 2004, 31(4):450-464.
[2] Siewert JR, Feith M, Stein HJ. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction: relevance of a topographic- anatomic subclassification[J]. J Surg Oncol, 2005, 90(3): 139-146.
[3] Kurokawa Y, Sasako M, Doki Y. Treatment approaches to esophagogastric junction tumors[J]. Dig Surg, 2013, 30(2):169-173.
[4] Pepek JM, Chino JP, Willett CG, et al. Preoperative chemoradiotherapy for locally advanced gastric cancer[J]. Radiat Oncol, 2013, 8:6.
[5] Lawrence TS, Blackstock AW, McGinn C. The mechanism of action of radiosensitization of conventional chemotherapeutic agents[J]. Semin Radiat Oncol, 2003, 13(1):13-21.
[6] van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med, 2012, 366(22):2074-2084.
[7] Stahl M, Walz MK, Stuschke M, et al. PhaseⅢcomparison of pre-operative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction[J]. J Clin Oncol, 2009, 27(6):851-856.
[8] Ronellenfitsch U, Schwarzbach M, Hofheinz R, et al. Preoperative chemo(radio)therapy versus primary surgery for gastroesophageal adenocarcinoma: systematic review with meta-analysis combining individual patient and aggregate data[J]. Eur J Cancer, 2013, 49(15): 3149-3158.
[9] Fiorica F, Di Bona D, Schepis F, et al. Preoperative chemoradiotherapy for oesophageal cancer: a systematic review and meta-analysis [J]. Gut, 2004, 53(7):925-930.
[10] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2):228-247.
[11] Sano T, Aiko T. New Japanese classifications and treatment guidelines for gastric cancer: revision concepts and major revised points [J]. Gastric Cancer, 2011, 14(2):97-100.
[12] Becker K, Mueller JD, Schulmacher C, et al. Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy[J]. Cancer, 2003, 98(7):1521-1530.
[13] Cox JD, Stetz J, Pajak TF. Randomized clinical trial on the combination of preoperative irradiation and surgery in the treatment of adenocarcinoma of gastric cardia (AGC)-report on 370 patients [J]. Int J RadiatOncol Biol Phys, 1995, 31(5):1341-1346.
[14] Zhang ZX, Gu XZ, Yin WB, et al. Randomized clinical trial on the combination of preoperative irradiation and surgery in the treatment of adenocarcinoma of gastric cardia (AGC)-report on 370 patients[J]. Int J Radiat Oncol Biol Phys, 1998, 42(5):929-934.
[15] Pera M, Gallego R, Montagut C, et al. PhaseⅡtrial of preoperative chemoradiotherapy with oxaliplatin, cisplatin, and 5-FU in locally advanced esophageal and gastric cancer[J]. Ann Oncol. 2012, 23(3): 664-670.
[16] Wydmański J, Suwinski R, Poltorak S, et al. The tolerance and efficacy of preoperative chemoradiotherapy followed by gastrectomy in operable gastric cancer, a phaseⅡstudy[J]. Radiother Oncol, 2007, 82(2):132-136.
[17] Tepper J, Krasna MJ, Niedzwiecki D, et al. PhaseⅢtrial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781 [J]. J Clin Oncol, 2008 Mar 1, 26(7):1086-1092.
[18] Walsh TN, Noonan N, Hollywood D, et al. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma[J]. N Engl J Med, 1996, 335(7):462-467.
[19] Burmeister BH, Smithers BM, Gebski V, et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial[J]. Lancet Oncol, 2005, 6(9):659-668.
(2015-08-10收稿)
(2015-10-15修回)
(编辑:周晓颖)

符涛专业方向为胃肠肿瘤的综合治疗。E-mail:Futao916@163.com
·读者·作者·编者·
作者简介
通信作者:步召德buzhaode@cjcrcn.org
doi:10.3969/j.issn.1000-8179.2016.01.223
作者单位:北京大学临床肿瘤学院,北京市肿瘤防治研究所,恶性肿瘤发病机制及转化研究教育部重点实验窒,北京肿瘤医院胃肠肿瘤中心(北京市100142)
