深低温冻存胃癌样本的核酸与蛋白质质量控制研究*
2016-03-18张佳年计骏刘炳亚朱正纲傅国辉于颖彦
张佳年 计骏 刘炳亚 朱正纲 傅国辉 于颖彦
深低温冻存胃癌样本的核酸与蛋白质质量控制研究*
张佳年①②计骏②刘炳亚②朱正纲②傅国辉①于颖彦②
摘要目的:探索上海市瑞金医院低温冻存0~10年胃癌样本的核酸与蛋白质质量。方法:随机抽取2003年至2014年间库存手术切除胃癌标本24对(共48份)。1%琼脂糖凝胶电泳检测DNA与RNA纯度及完整性,同时增加了RIN值评估法检测RNA完整性;BCA法检测样本蛋白质浓度,考马斯亮蓝法测定蛋白质分子完整性。结果:将组织标本按冻存年限分成四组(<2年、3~5年、6~8年和>9年),各组之间DNA完整性差异无统计学意义(P>0.05),正常胃组织的DNA降解程度比胃癌组织高(P=0.023);四组之间的RIN值检测显示,冻存6年以上组的RIN值有明显下降(P=0.018);各组间的蛋白质浓度无显著性差异,考马斯亮蓝法测定蛋白质分子条带完整性存在显著性差异。冻存>9年组仅出现少量低分子量条带(平均36.5 kD),冻存6~8年组尚有中等分子量(平均65.63 kD)条带,冻存3~5年组有高分子量(平均127.5 kD)条带,冻存短于2年组仍可见大分子量(平均160 kD)条带。结论:长期低温冻存对DNA影响最小,超过5年组RNA和大分子量蛋白质降解较多,但中小分子量蛋白质保存完好。
关键词生物样本胃癌低温保存核酸蛋白质质量控制
*本文课题受国家高技术研究发展计划“863”项目(编号:2012AA02A504,2012AA02A203)、国家自然科学基金项目(编号:81172329,81372644)、上海交通大学医学院转化医学创新基金(编号:15ZH1002,15ZH4001)和“985”生物样本库建设基金资助
Quality control of nucleic acids and protein of freeze-preserving gastric cancer samples
Jianian ZHANG1,2, Jun JI2, Bingya LIU2, Zhenggang ZHU2, Guohui FU1, Yingyan YU2
Correspondence to: Yingyan YU, E-mail: ruijinhospitalyyy@163.com; Guohui FU, E-mail: fuguhu@263.net
1Department of Pathology, Basic Medical College, Shanghai Jiao Tong University;2School of Medicine and Shanghai Ruijin Hospital, Shanghai Institute of Digestive Surgery, the Key Laboratory of Gastric Tumor of Shanghai City, Shanghai 200025, China
This work was supported by the Chinese National High Tech Program (No. 2012AA02A504 and 2012AA02A203), National Natural Science Foundation of China (No. 81172329 and 81372644), Innovation Foundation of Translational Medicine of Shanghai Jiao Tong University School of Medicine (No. 15ZH1002 and 15ZH4001), and Project of Biobank of Gastrointestinal Carcinoma of Shanghai Jiao Tong University School of Medicine
Abstract Objective: To explore the quality of inventory samples of a biobank stored in a deep freezer from 0 to over 10 years in Shanghai Ruijin Hospital. Methods: We extracted 24 pairs of stocked gastric cancer samples between 2003 and 2014. We used 1% agarose gel electrophoresis to analyze DNA and RNA purity and integrity while adding the RNA integrity number (RIN) for precise analysis. Bicinchonininc acid (BCA) assay was used for protein concentration evaluation. Coomassie brilliant blue method was used for protein integrity assay. Results: The samples were divided into four groups according to cryopreservation period (<2 years, 3-5 years, 6-8 years, and >9 years). No significant difference in DNA integrity was found between the groups (P>0.05); however, DNA degradation in normal gastric mucosa was faster than that in gastric cancer tissue (P=0.023). The RIN significantly declined when the storage period was 6 years or longer (P=0.018). No significant difference in protein concentration was observed between different groups. Using Coomassie brilliant blue method, we found significant differences in preserved proteins with different molecular weights. Proteins with varying molecular weights were detected in the groups with the following cryopreservation periods: >9 years, a small number of lowmolecular-weight (average 36.5 KD) proteins; 6-8 years, medium-molecular-weight (average 65.63KD) proteins; 3-5 years, high-molecular-weight (average 127.5 KD) proteins; <2 years, high-molecular-weight (average 160 KD) proteins. Conclusion: Cryopreservation does not exert an obvious effect on DNA. If the cryopreservation period is more than 5 years, serious degradation of RNA should occur; likewise, degradation of proteins with higher molecular weight should occur.
Keywords:biosample, gastric cancer, cryo preservation, nucleic acid, protein, quality control
肿瘤分子生物学与转化医学研究对高质量新鲜肿瘤标本的需求日益增长,生物样本库建设是后基因组时代的重要课题。肿瘤生物样本收集从既往根据课题研究需要临时收集转向专业性、规模性收集。肿瘤生物样本库建设始于20世纪90年代后期。目前,美国、英国、法国、德国、意大利和澳大利亚等国家的研究机构建立有较为完善的肿瘤生物标本库[1-5],不仅为肿瘤基础与临床研究提供重要的标本,并在核酸与蛋白质的提取、分析和建立肿瘤细胞系方面取得成果[6-8]。中国肿瘤生物样本库建设已有十余年历史,近年来又成立了全国范围内的生物样本库协会。北京大学临床肿瘤学院较早地建立了肿瘤标本库,较好地促进了胃肠道肿瘤基础研究与靶向治疗研究[9]。上海市瑞金医院自2001年起开展胃肠道肿瘤生物样本库建设[10],并注重低温冻存生物样本质量控制。如在肿瘤样本保存满5年时进行过随机样本的生物大分子质量控制研究[11]。目前,有较大比例生物样本保存时间已经长达10年之久。为分析长期冷冻保存肿瘤样本是否适合分子生物学实验,本文探讨了低温样本库的储存年限与核酸和蛋白质的分子完整性关系,以期为高质量生物样本库建设以及肿瘤转化医学研究提供参考。
1 材料与方法
1.1胃癌样本
随机抽取上海交通大学医学院附属瑞金医院胃肠肿瘤样本库中2003年至2014年间库存手术切除胃癌标本24对,共48份。所有样本均为胃肠外科资深医师行胃癌根治术切取的胃癌标本,标本离体后30 min内取材、分装在低温冻存管后投于液氮内,然后转入-80℃深低温冰箱保存。低温冻存时间在数月至10年以上不等。样本编号N代表正常胃组织,T代表胃癌组织。所有患者术前均未接受放化疗。标本编号与储存时间的对应关系见表1。
1.2样本中肿瘤细胞含量评估
本样本库所有组织均同时留存一份于10%中性福尔马林固定、石蜡包埋后制备组织切片,由专职病理医师进行肿瘤组织学分类以及肿瘤细胞含量评估,本研究所有样本的肿瘤细胞含量均大于60%。
1.3核酸抽提与质控
DNA抽提使用QIAamp DNA Mini Kit(Qiagen,Hilden,德国)。利用分光光度计(赛默飞Nano⁃Drop2000,美国)测定A260/A280比值。1%琼脂糖凝胶电泳观察DNA条带完整性:DNA样本上样量为5 μL,电泳时间为30 min,于凝胶图像分析仪(Fluor-STM Multimanger,BIO-RAD,美国)观察电泳条带。RNA抽提采用Trizol(Invitrogen,CA,美国)抽提法。分光光度计测定A260/A280比值,1%琼脂糖凝胶电泳测量28S和18S核糖体RNA条带。RNA上样量为4 μL,电泳时间30 min,于凝胶图像分析仪观察电泳条带;Ag⁃ilent 2100生物分析仪(Agilent,CA,美国)测量RNA完整数值(RNA integrity number,RIN)[12-13]。
1.4蛋白质抽提与质控
采用哺乳动物总蛋白提取试剂盒M-PER®(Pierce,美国)抽提蛋白质。BCA法(Pierce,美国)测蛋白质浓度(3 μL蛋白质与227 μL BCA工作液混匀,37℃孵育30 min后于572 nm检测其A值)。考马斯亮蓝(Coomassie brilliant blue,SIGMA公司,美国)法测定蛋白质分子完整性[14]。各组蛋白质样本30 μg 于12.5%聚丙烯凝胶电泳2 h,然后取下整块凝胶于固定液中固定1 h(固定液:用水配成10 mL溶液中含40%甲醇、10%乙酸)后染色30 min(染色液:浓度0.5%,0.5 g考马斯亮蓝粉剂+100 mL脱色液);最后置于脱色液中多次脱色直至肉眼可见清晰条带(脱色液:用水配成10 mL溶液,含30%甲醇、10%乙酸)。
1.5统计学方法
所有实验数据应用SPSS 13.0统计软件分析。DNA的A260/A280比值、RNA的A260/A280比值、RIN值采用单向ANOVA检验,蛋白质浓度、考马斯亮蓝染色条带数采用配对ANOVA检验。P<0.05为差异有统计学意义。
2 结果
2.1 DNA分子完整性及质量分级
采用1%琼脂糖凝胶电泳图分析胃癌样本DNA完整性得到图1。该图DNA样本完整性主要观察高分子量位置上的DNA分子条带亮度与有无拖尾出现。若条带清晰、明亮、无拖尾,将其归为质量A级;有清晰条带,但有一定的拖尾,将其归为质量B级;无明确条带而是在泳道上呈现弥散带状,将其归为质量C级。本组样本DNA分子的质控检测与储存年限关系见表2。可见,长期低温冻存对组织样本DNA质量有一定影响,其中对正常胃组织样本(N)的影响明显大于对胃癌组织样本(T)的影响,正常胃组织A、B、C级别样本数目与胃癌组织A、B、C级别样本数目之比为8:14:2 vs. 17:5:2(P=0.023)。本研究组将组织标本按年限分成四组,分别为<2年、3~5年、6~8年、>9年,各个年限A、B、C级样本数目之比为7:3:2、4:6:2、9:3:0和5:7:0,经统计学分析未见显著性差异(P>0.05)。
2.2 RNA分子完整性及质量分级

图1 1%凝胶电泳检测DNA分子完整性质量分级Figure 1 Presentation of DNA integrity analysis by 1% gel electrophoresis
既往分析样本RNA质量与完整性主要参照在1%琼脂糖凝胶电泳图上28S与18S条带情况。如在1%琼脂糖凝胶电泳图上有清晰的28S与18S两条主带则定义为A,若能看到两个条带但清晰度下降且28S条带模糊定义为B,若28S与18S两个条带均消失呈涂抹状则定义为C。自Agilent 2100生物分析仪问世后则可以根据RIN判断RNA分子完整性。在Agi⁃lent 2100生物分析仪检测的RIN值评价中,RIN>7表示质量好;RIN为4~7表示质量较好;RIN<4表示有严重的RNA降解。图2是样本中RNA的1%凝胶电泳检测图与RIN值检测图示。本组样本的RNA分子的质控结果与储存年限关系见表3。
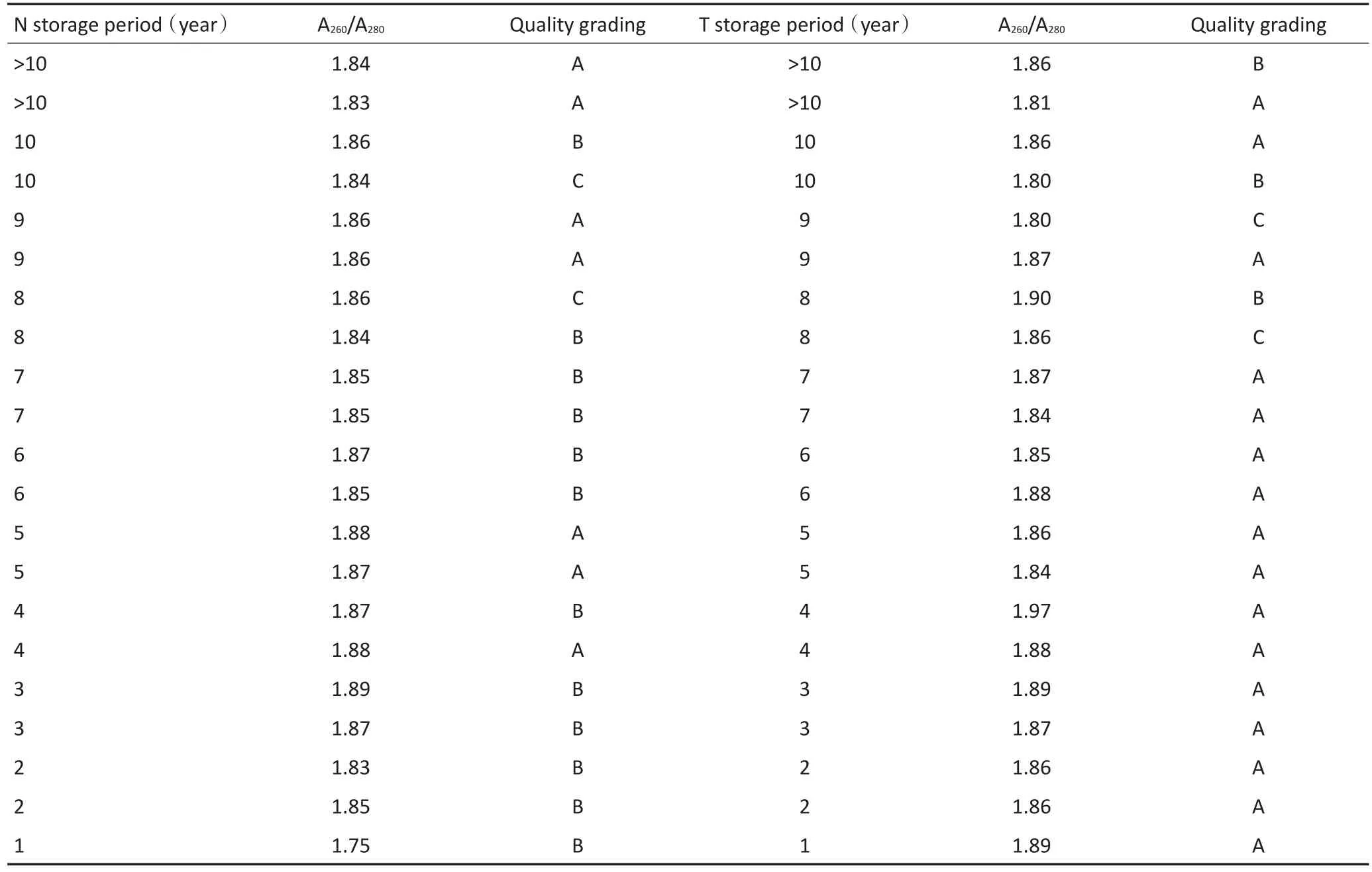
表2 冻存样本的DNA质控分级与储存年限关系Table 2 Association of DNA quality grading with cryopreservation periods

表2 冻存样本的DNA质控分级与储存年限关系(续表2)Table 2 Association of DNA quality grading with cryopreservation periods


图2 RNA分子完整性检测Figure 2 Examination of RNA integnity
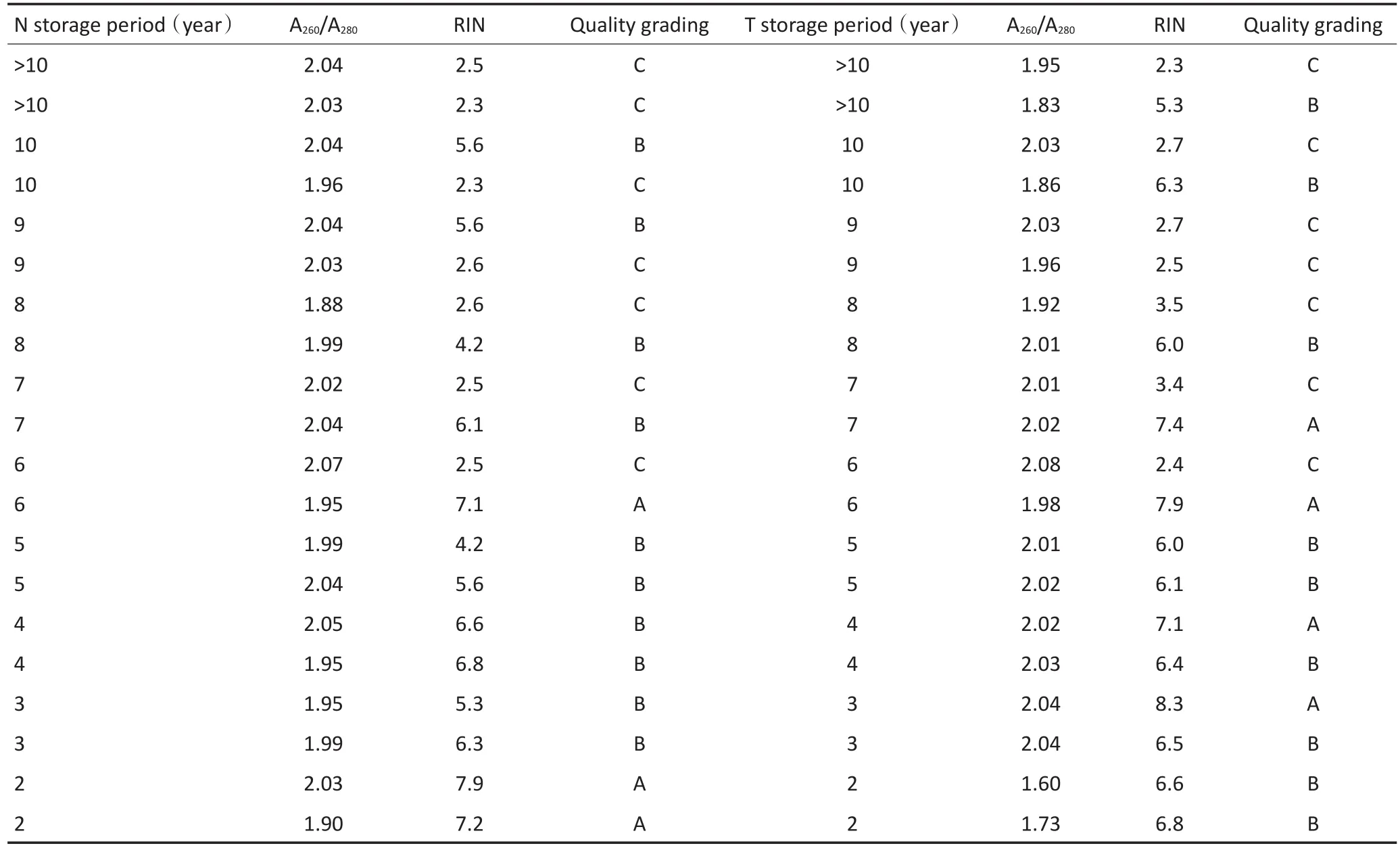
表3 冻存样本的RNA质控分级与储存年限关系(依据RIN值)Table 3 Association of RNA quality grading (RIN) with cryopreservation periods

表3 冻存样本的RNA质控分级与储存年限关系(依据RIN值)(续表3)Table 3 Association of RNA quality grading (RIN) with cryopreservation periods
将组织标本按年限分成四组,分别为<2年、3~5年、6~8年、>9年,统计分析了四组间A260/A280差异,结果示无显著性差异(图3A,P=0.13)。比较了四组之间RIN值差异,结果显示,当样本低温冻存>9年后,其RIN值较6~8年组(P<0.05)和<2年组有明显下降(P<0.05,图3B);且6~8年组较<2年组也有明显下降(P=0.018)。提示冻存时间超过5年的标本RNA存在严重的降解。
2.3蛋白质分子完整性及质量分级
首先采用BCA法检测了不同低温保存年限的蛋白浓度(μg/μL)。将组织标本按照低温冻存年限分成4组,分别为<2年、3~5年、6~8年和>9年,4组的蛋白质浓度无显著性差异(图4,P=0.483 5)。
将样本按照冻存年限分成4组,考马斯亮蓝染色检测低温冻存<2年、3~5年、6~8年和>9年样本的蛋白质完整性,及各样本中不同分子量的蛋白质条带(图5)。由图5A可以看出,当组织样本低温冻存> 9年时,电泳图上几乎无任何分子量的清晰条带,各泳道均呈涂抹状;低温冻存6~8年的组织样本在72 kD以下尚可见电泳条带,而72 kD以上条带已经消失,肉眼平均可见电泳条带数为3条。在低温冻存3~5年组和<2年组的电泳图中,肉眼可见电泳条带平均为5条,显著多于冻存>6年组(P<0.05,图5B)。通过与分子量指示剂对比分析,冻存>9年组仅在低分子量处依稀可辨少量条带(平均36.5 kD),冻存时间6~8年组在中等分子量处可见条带(平均65.63 kD),冻存时间3~5年组在高分子量处仍可见条带(平均127.5 kD),冻存时间<2年组在最大分子量指示剂处仍可见条带(平均160 kD)。经统计学分析,各组织间具有显著性差异(P<0.05),但冻存3~5年组与<2年组之间未见显著性差异(P=0.24,图5C)。然而,在冻存3~5年组有一部分样本在170 kD处缺乏条带显示,说明存在大分子量蛋白质的降解。将低温冻存正常胃组织或者胃癌组织的蛋白质质量也分成三个等级:A级:电泳条带从低分子量至高分子量均清晰可见;B级:电泳条图上缺乏高分子量条带,但中小分子条带依然有部分清晰可见;C级:电泳图上几乎无可见清晰电泳条带,各泳道均呈涂抹状。本组不同保存年限与蛋白质质量关系见表4。
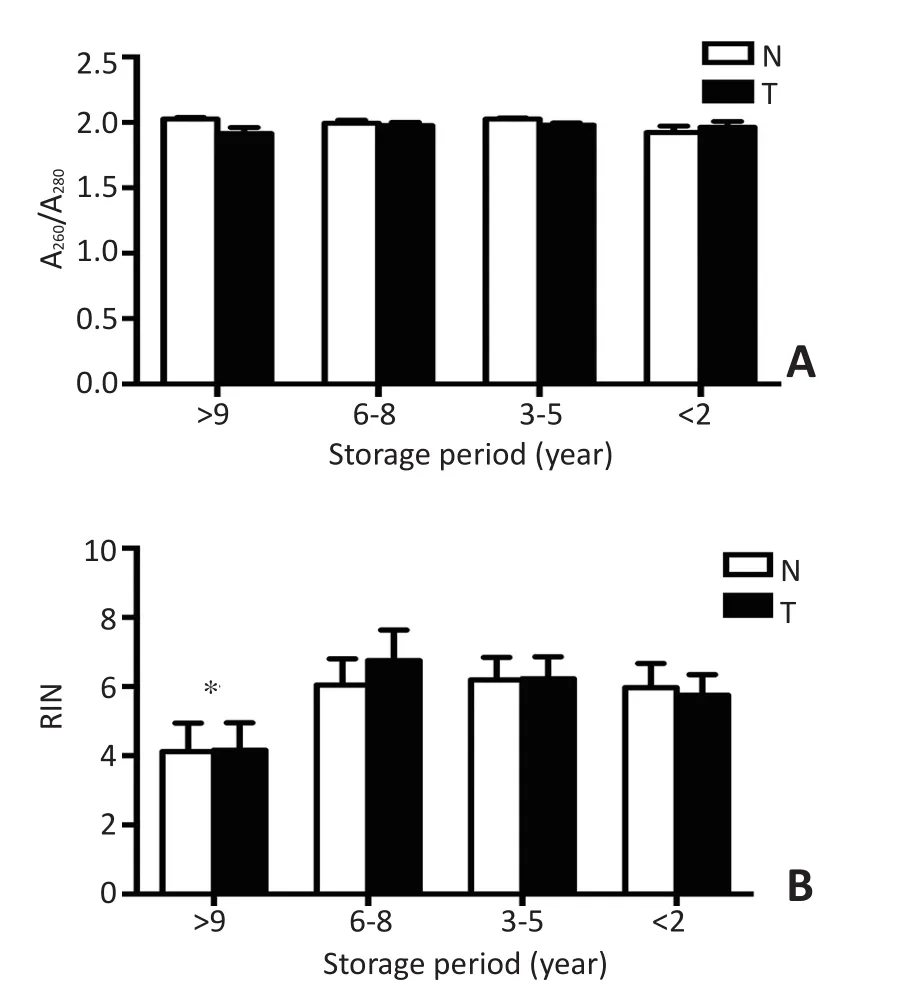
图3 不同冻存有限样本RNA质量比较Figure 3 Dffferenes of RNAquality in samples with different frozen periods

图4 不同冻存年限样本的蛋白质浓度比较Figure 4 No significant difference in protein concentration between different cryopreservation periods (P=0.4835)


图5 不同冻存年限样本的蛋白质完整性分析Figure 5 Protein integrity analysis of samples with different cryopreservation periods
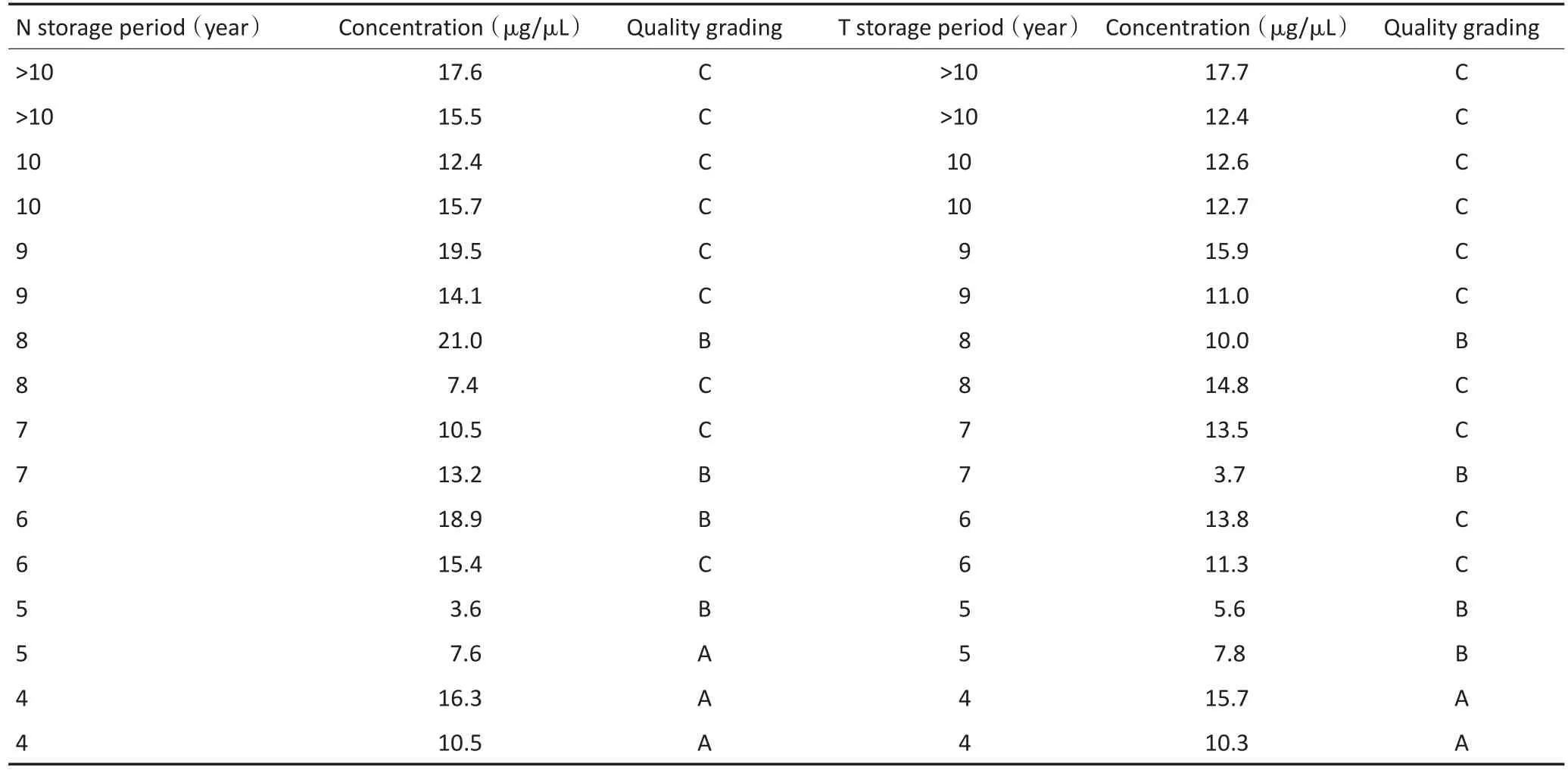
表4 冻存样本的蛋白质质控分级与储存年限关系Table 4 Association of protein quality grade with cryopreservation periods
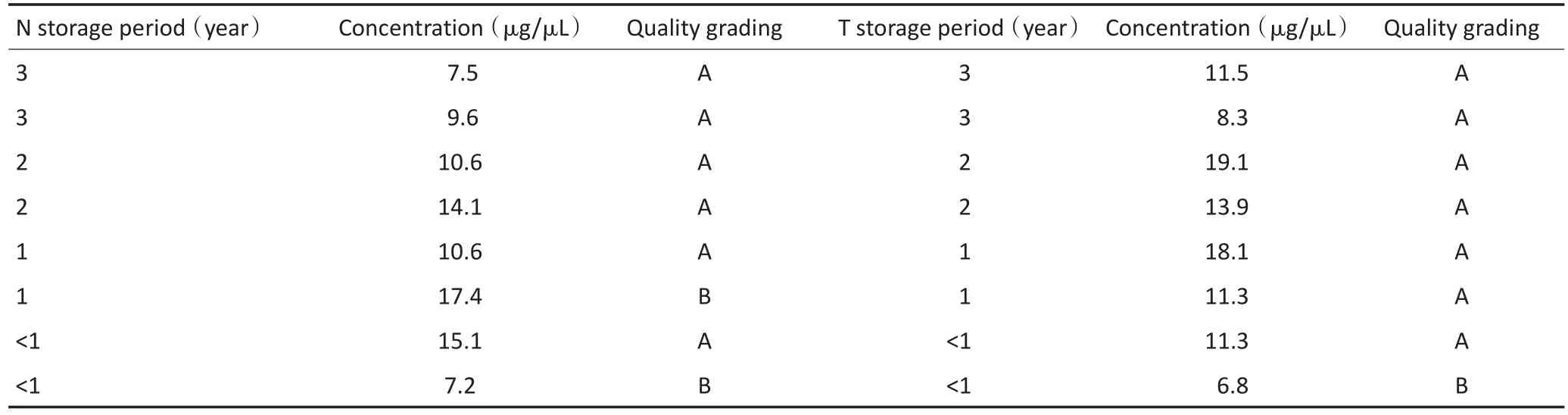
表4 冻存样本的蛋白质质控分级与储存年限关系(续表4)Table 4 Association of protein quality grade with cryopreservation periods
3 讨论
肿瘤生物样本库的核心是温度与质量,国际上在样本核酸质量分析中,A260、A280及其比值是判断DNA与RNA样本纯度的指标;电泳法检测DNA完整性;RNA的完整性可用琼脂糖凝胶电泳测量28S和18S核糖体RNA(rRNA)条带法和RIN值检测法。A260代表核酸(DNA,RNA)吸光度,A280代表蛋白质吸光度,在植物样本分析中还会关注A230值(代表多糖类吸光度)。人类组织样本由于多糖类残留的可能性比较低,故可以不去关注A230值。纯净的DNA其A260/ A280≈1.8,比值在1.8~1.9为优秀,>1.9表明有RNA污染,可考虑用RNA酶纯化样本;当A260/A280比值为1.6~1.8之间为良好,比值<1.6表明有蛋白质或酚等的污染[15]。纯净的RNA其A260/A280比值为1.7~2.0,比值<1.7表明有蛋白质或酚类污染,比值>2.0表明可能有异硫氰酸胍残留。对于RNA完整性的评价目前主要有两种方法,包括琼脂糖凝胶电泳测量28S 和18S核糖体RNA(rRNA)条带法和RIN值检测法。rRNA占整个RNA分子的80%,而mRNA仅占RNA分子的3%,故检测mRNA并不容易,而检测含量高的rRNA相对容易。在琼脂糖凝胶电泳中,当28S和18S 的rRNA条带亮度比例为2时便被认为RNA完整。RNA是极易降解的生物分子,由于缺血、凋亡及坏死等影响,28S的rRNA比18S的rRNA更易退化,所以28S和18S的比值为2难以实现。RIN的计算采用了“RIN软件算法”,检测结果以1到10数字表示,完整的RNA为10。根据现有实验报道,RIN值>7可视为优秀,适用于高质量的RNA研究,如基因芯片检测;RIN值为4~7视为良好,可以用于一般分子生物学研究,如定量PCR;当RNA完全降解时RIN值为1。自RIN检测方法开发以来,被广泛用来评价RNA完整性。有文献提出,对于有一定程度RNA降解的样本,也可以进行定量PCR检测获得目的基因的相对表达量,从而提高了一批珍稀样本利用率。有关RNA分子的稳定性尚有争议,如有研究人员在室温下切除离体组织检测RNA质量,发现室温下长达3~5 h RNA依然完整[16-17]。本研究仅对胃及胃癌组织进行了评估,尚不能反映全身组织情况。
以往对于生物样本库样本的质量评估均围绕DNA与RNA进行,少见有蛋白质质量评估的报道。参考了Ku等[18]研究报道,将考马斯亮蓝染色法引入蛋白质完整性评估中。考马斯亮蓝法是利用蛋白质与染料结合的原理,可以实现定量蛋白浓度的方法,被认为是目前灵敏度最高的蛋白质测定法[19-20]。考马斯亮兰G-250染料在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置由465 nm变为595 nm,溶液的颜色由棕黑色变为兰色。通过测定595 nm处光吸收的增加量可知结合的蛋白质量。已知染料主要是与蛋白质中的碱性氨基酸(如精氨酸)和芳香族氨相结合。通过本文探索性研究,可以清晰地获得不同冻存时间组织标本的蛋白质电泳条带数目与电泳条带分子量差异。表明考马斯亮蓝法染色检测聚丙烯凝胶蛋白质电泳条带是一种方便可行的蛋白质质量评估方法。根据本次对于生物样本库评估结果,建议将样本的蛋白质质量也分成三个等级。A级:各种分子量蛋白质保存完好,适合多种蛋白质实验研究;B级:大分子量蛋白质已有降解,但中低分子量蛋白质尚保存,可以满足部分蛋白质实验研究需求(用户可根据目的蛋白分子量决定);C级:无论大小分子量蛋白质均有降解,无法满足蛋白质研究的基本需求。以胃肠肿瘤生物样本库为例,保存<5年的样本仍可进行蛋白质实验研究,冻存>6年的样本由于大分子量的蛋白质降解明显,只适合根据候选基因编码蛋白的分子量选择性进行Western blot或者ELISA等实验研究。
由于本研究组主要从事胃癌组织样本库建设,故本文的质控研究仅围绕胃癌样本展开,缺乏其他实体瘤生物样本的长期保存质控研究数据,有关内容还有待国内外同道积累并报道更多的经验。
参考文献
[1] Tschulik A, Zadoukal K. The increasing importance of tumor and tissue banks in the light of genomic and proteomie research[J]. Pathology, 2001, 22(5):310-315.
[2] Whyte B. National tumor bank set up in United Kingdom[J]. J Natal Cancer Inst, 2003, 95(10):706.
[3] Howe M. National prostate tumor bank launched in Australia[J]. Lancet Oncol, 2001, 2(11):656.
[4] Kerr C. UK launch "virtual" tumor bank to improve treatment research [J]. Lancet Onco1, 2003, 4(5):264.
[5] Spirmey L. UK launches tumor bank to match maligned biobank[J]. Nat Med, 2003, 9(5):491.
[6] Malone T, Catalano PJ, O'Dwyer PJ, et al. High rate of consent to bank biologic samples for future research: the Eastern Cooperative Oncology Group experience[J]. J Natl Cancer Inst, 2002, 94(10):769-771.
[7] Hwang RF, Wang H, Lara A, et al. Development of an integrated biospecimen bank and multidisciplinary clinical database for pancreatic cancer[J]. Ann Surg Oncol, 2008, 15(5):1356-1366.
[8] Suh KS, Remache YK, Patel JS, et al. Informatics-guided procurement of patient samples for biomarker discovery projects in cancer research [J]. Cell Tissue Bank, 2009, 10(1):43-48.
[9] Ji JF. Establishment of tumor biaobank in cancer hospital of Peking University[J]. Journal of Peking University(Health Sciences), 2005,37 (3):329-330.[季加孚.北京大学临床肿瘤学院标本库的建设[J].北京大学学报(医学版),2005,37(3):329-330].
[10] Yu YY, Zhu ZG. Significance of biological resource collection and tumor tissue bank creation[J]. World J Gastrointest Oncol, 2010, 2(1):5-8.
[11] Zhang JN, Yu YY, Ji J, et al. Effect of freeze-preserving on biological macromolecules of tumor tissue[J]. Jouoral of Diagnostics Concepts & Practilt, 2009, 8(1):38-42.[张佳年,于颖彦,计骏,等.低温冻存时间对肿瘤组织生物大分子的影响[J].诊断学理论与实践,2009,8(1): 38-42.
[12] Schroeder A, Mueller O, Stocker S, et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements[J]. BMC Mol Biol, 2006, 7:3.
[13] Salazar MA1, Fernando LP, Baig F, et al. The effects of protein solubility on the RNA Integrity Number (RIN) for recombinant Escherichia coli[J]. Biochem Eng J, 2013, 79:129-135.
[14] Spector T. Refinement of the coomassie blue method of protein quantitation. A simple and linear spectrophotometric assay for less than or equal to 0.5 to 50 microgram of protein[J]. Anal Bichem, 1978, 86(1):142-146.
[15] Siwoski A, Ishkanian A, Garnis C, et al. An efficient method for the assessment of DNA quality of archival microdissected specimens[J]. Mod Pathol, 2002, 15(8): 889-892.
[16] Micke P, Ohshima M, Tahmasebpoor S, et al. Biobanking of fresh frozen tissue:RNA is stable in nonfixed surgical specimens[J]. Lab Invest. 2006, 86(2):202-211.
[17] Sandusky GE, Teheny KH, Esterman M, et al. Quality control of human tissues-experience from the Indiana University Cancer Center-Lilly Research Labs human tissue bank[J]. Cell Tissue Bank, 2007, 8(4):287-295.
[18] Ku HK, Lim HM, Oh KH, et al. Interpretation of protein quantitation using the Bradford assay: Comparison with two calculation models[J]. Anal Biochem, 2013, 434(1):178-180.
[19] Atherton BA, Cunningham EL, Splittgerber AG. A mathematical model for the description of the Coomassie Brilliant Blue protein assay[J]. Anal Biochem, 1996, 233(2):160-168.
[20] Georgiou CD, Grintzalis K, Zervoudakis G, et al. Mechanism of Coomassie Brilliant Blue G-250 binding to proteins: a hydrophobic assay for nanogram quantities of proteins[J]. Anal Bioanal Chem, 2008, 391 (1):391-403.
(2015-09-28收稿)
(2015-12-23修回)
(编辑:郑莉)

张佳年专业方向为胃肠肿瘤生物样本库建设与分子病理学实验研究。
E-mail:happynian@hotmail.com
·临床研究与应用·

步召德,北京大学肿瘤医院胃肠肿瘤中心主任医师,二病区主任;外科教研室副主任;《Chinese Journal of Cancer Research》英文期刊编辑部主任。从事胃肠肿瘤的临床和科研工作。积极参与消化道肿瘤治疗的众多新领域:早期胃癌的缩小手术、胃癌的新辅助化疗和规范化手术、胃肠肿瘤的个体化治疗。参与了国家“863”项目、国家自然科学基金项目、北京市科委项目等多项重大课题的研究,参加肿瘤组织标本库的建设。发表多篇科研论文,作为主编或副主编出版了《癌症治疗新方法》、《普通外科疾病诊治思路》、《肿瘤组织标本库常用技术手册》、《Bethesda临床肿瘤学手册》等专著或译著。
作者简介
通信作者:于颖彦ruijinhospitalyyy@163.com,傅国辉fuguhu@263.net
doi:10.3969/j.issn.1000-8179.2016.01.077
作者单位:①上海交通大学基础医学院病理教研室(上海市200025);②上海交通大学医学院附属瑞金医院消化外科研究所,上海市胃肿瘤重点实验室
