蜂蜜蛋白提取以及双向电泳技术分析蜂蜜蛋白条件优化
2016-03-16周莉质吕侠影余晓峰
周莉质,宗 凯,吕侠影,余晓峰*,姚 剑
(1.安徽出入境检验检疫局,安徽合肥 230022;2.安徽农业大学,安徽合肥 230036)
蜂蜜蛋白提取以及双向电泳技术分析蜂蜜蛋白条件优化
周莉质1,2,宗 凯1,吕侠影1,余晓峰1*,姚 剑1
(1.安徽出入境检验检疫局,安徽合肥 230022;2.安徽农业大学,安徽合肥 230036)
摘要[目的]研究蜂蜜中蛋白质提取的有效方法,优化蜂蜜蛋白电泳条件。[方法]该试验使用丙酮、钨酸钠、硫酸铵、尿素-硫脲4种方法提取蜂蜜中的蛋白并进行比较,然后进行双向电泳分析,对影响双向蛋白电泳的IPG胶条的选择、蛋白质上样量、等电聚焦时间等主要因素进行优化。[结果]试验表明,采用硫脲法提取蜂蜜蛋白获得的蛋白含量最高,硫脲法和丙酮沉淀法获得的蛋白纯度最好,而硫脲法因干扰物质较少、易于裂解适于双向电泳技术,采用硫脲法提取的蜂蜜蛋白选择IPG胶条pH 5~8,蛋白上样量为150 μg,等电聚焦时间达到32 000 V·h的情况下能充分地聚焦,获得的双向电泳图谱最佳,优化后的洋槐蜜双向电泳图谱上可检测到326个蛋白点,重复性和分辨率均较好。[结论]蜂蜜类含糖样品中使用硫脲法提取蛋白能减少糖类物质干扰。
关键词蜂蜜蛋白;双向电泳;蛋白提取
Extraction of Protein from Honey and Its Optimization by Two-dimensional Electrophoresis
ZHOU Li-zhi1,2, ZONG Kai1, LYU Xia-ying1, YU Xiao-feng1*et al(1. Anhui Entry-Exit Inspection and Quarantine Bureau, Hefei, Anhui 230022; 2.Anhui Agricultural University, Hefei, Anhui 230036)
Abstract[Objective] To research a effective method for protein extraction from honey, and to optimize the protein electrophoresis conditions of honey. [Method] Protein was extracted from honey by acetone, sodium tungstate, ammonium sulfate and urea-thiourea. Their results were compared and two-dimensional electrophoresis was analyzed. [Result] Protein content was the maximum by thiourea method; protein purity was the highest in thiourea method and acetone precipitation method. Since thiourea method had few interfering substances, and was suitable for two-dimensional electrophoresis technology, we selected thiourea method to extract protein. The IPG adhesive tape was pH 5-8; loading quantity of protein was 150 μg; isoelectric focusing time was 32 000V h. Under these conditions, the optimal two-dimensional electrophoretogram was obtained. A total of 326 protein spots were detected with relatively good repeatability and resolution. [Conclusion] Extracting protein from honey by thiourea method reduces the interference of glucose.
Key wordsHoney protein; Two-dimensional electrophoresis; Protein extraction
蜂蜜是由糖、花粉、蛋白和氨基酸以及少量维生素、矿物质组成的天然食品,是由蜜蜂采集花蜜酿造而成。蜂蜜蛋白是蜂蜜中重要的组成部分,含量一般为0~10 mg/g,主要来自蜜蜂和花粉。目前,从蜂蜜中提取蜂蜜蛋白主要有盐析法、有机溶剂沉淀等。叶云等按照85%的硫酸铵饱和度加入硫酸铵并水处理沉淀蜂蜜蛋白[1],胡庆银等采用0.335 mol/L硫酸和10%钨酸钠沉淀蜂蜜中蛋白[2],Won S R等采用透析过夜再超滤离心浓缩获得分泌蛋白用于后续电泳分析和质谱鉴定[3]。笔者拟比较4种不同的蛋白提取方法对蜂蜜中蛋白提取含量的影响,选择提取含量相对较高,且适合用于后续电泳的蜂蜜蛋白提取方法。
双向电泳技术是分析蛋白组学的经典方法,优化蜂蜜蛋白电泳条件对于蜂蜜蛋白种类鉴定是十分必要的。清晰的可重复的2-DE电泳图是对蜂蜜蛋白鉴定的必要条件。笔者主要比较了几种提取蜂蜜蛋白的方法,选择合适2-DE的电泳条件,包括IPG胶条的选择、蛋白质上样量、等电聚焦时间等,以期获得分辨率高、质量好的2-DE图。
1材料与方法
1.1材料试验所用蜂蜜为原蜜,未加工,由阜阳市百合食品有限公司提供,分别编号为5号墨西哥尤卡坦蜜、9号新西兰麦奴卡蜜、58号中国油菜蜜。
蛋白电泳系统为美国伯乐BIO-RAD公司产品:Mini-PROTEAN3垂直电泳系统、等点聚焦电泳仪。
1.2蜂蜜总蛋白提取方法比较
1.2.1TCA丙酮法。称取5 g蜂蜜入 40 mL 离心管中,加入5 mL超纯水溶解蜂蜜之后加入 30 mL 预冷的三氯乙酸(TCA)丙酮溶液(TCA∶丙酮=1∶9),混匀,-20 ℃ 沉淀过夜,离心弃上清。加入20 mL预冷的丙酮清洗沉淀块(重复1次),放入通风橱风干。称取约20 mg沉淀粉末,加入1 mL上样缓冲液混匀,沸水浴5 min。超声破碎(80 W,超声10 s,间歇15 s,共10次),沸水浴5 min,离心取上清。
1.2.2钨酸钠沉淀法。取蜂蜜5 mL 放入40 mL的离心管,往离心管中加入 10 mL超纯水,摇匀。向离心管中分别加入5 mL 10%的钨酸钠溶液和5 mL 0.335 mol/L硫酸溶液,迅速混匀,放在80 ℃水浴中加热30 min。在加热过程中每隔5~10 min旋转并混合离心管中内容物20 s,会有絮状沉淀析出。用超纯水注满离心管并混合后,在1 500 r/min下离心5 min,倾掉上层清液,再以约 5 mL 水充分洗涤沉淀物并离心,如此反复洗涤沉淀物5 次,最后倒干上清液,沉淀即为所得蜂蜜的蛋白质样品。向蛋白质样品中加入超纯水 60 μL,充分混匀溶解。将所得蛋白样品 1 000 r/min离心2 min,取上清液作为待测样品。
1.2.3硫酸铵盐析法。将蜂蜜与0.01 mol/L pH 8.0的Tris缓冲液按1∶4的比例混合均匀,按85%的硫酸铵饱和度加入硫酸铵,搅拌使硫酸铵溶解,在冰水中放置8 h左右,离心(12 000 r/min,10 min),弃上清液,再用一定量的0.01 mol/L pH 8.0的Tris缓冲液溶解沉淀,置于4 ℃备用。
1.2.4尿素-硫脲法。称取5 g蜂蜜,加入5 mL提取液(5 mol/L尿素,2 mol/L硫脲,10% SDS,2 g/L DTT),常温下振荡1.5 h,12 000 r/min离心10 min,转移上清到新的离心管中,上清加入3倍体积丙酮,-20 ℃过夜。离心后收集沉淀,沉淀加入100 μL裂解液裂解备用。
1.3蜂蜜总蛋白含量的测定上述方法提取的蜂蜜总蛋白采用BCA法测定蛋白浓度。
1.4蜂蜜蛋白2-DE条件优化
1.4.1第一向IEF等电聚焦IPG胶条的选择。以洋槐蜜为研究对象,采用Bio-Rad IEF等电聚焦系统,7 cm IPG预制胶条选择pH 3~10、5~8、4~7范围的胶条进行优化。
1.4.2蛋白质上样量优化。每根胶条加135 μL水化上样缓冲液,蛋白质上样量根据试验设计分别调整为50、150、250 μg,采用被动水化,放置4 ℃冰箱15~18 h。
1.4.3等电聚焦参数的设置。表1为等电聚焦参数设置情况。聚焦时间根据试验设计分别调整为 20 000、32 000、40 000 V·h,聚焦温度为20 ℃,每根胶条的限制电流为50 μA。
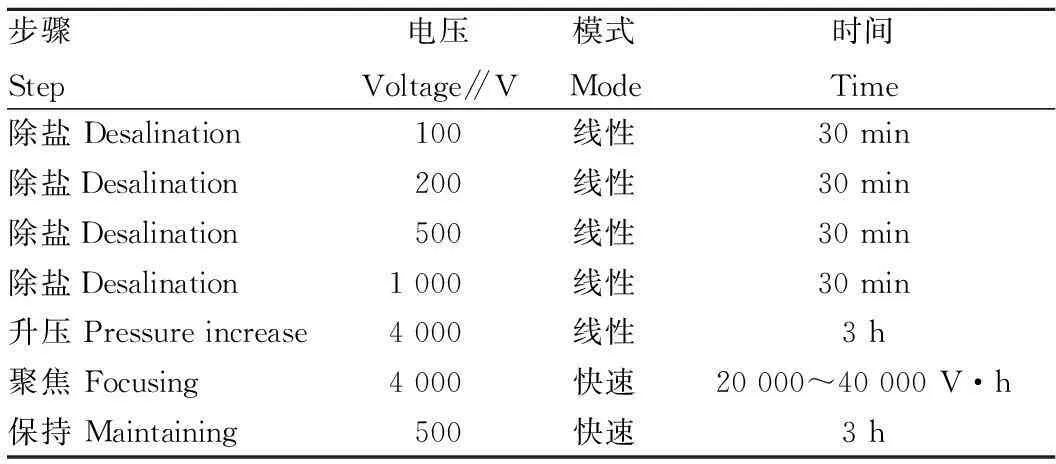
表1 等电聚焦参数
2结果与分析
2.1比较4种蜂蜜蛋白提取方法查找相关文献,拟比较4种不同的蛋白提取方法对蜂蜜中蛋白提取的影响。以5号墨西哥尤卡坦原蜜和9号新西兰麦奴卡原蜜为研究对象,按照“1.2”中4种蜂蜜蛋白提取方法,比较4种方法提取蜂蜜蛋白效果,结果见图1。

注:图(a)中从左到右依次为marker,5号硫酸铵盐析法,9号硫酸铵盐析法,5号TCA-丙酮法,9号TCA-丙酮法,5号尿素-硫脲法,9号尿素-硫脲法,5号钨酸钠法,9号钨酸钠法,marker;图(b)中从左到右依次为marker,58号硫酸铵盐析法,58号TCA-丙酮法,58号尿素-硫脲法,58号钨酸钠法。Note:In Fig.(a),bands from left to right were marker,honey 5 by ammonium sulfate salting out method,honey 9 by ammonium sulfate salting out method,honey 5 by TCA-acetone method,honey 9 by TCA-acetone method,honey 5 by urea - thiourea method,honey 9 by urea - thiourea method,honey 5 by sodium tungstate method,honey 9 by sodium tungstate method, marker. In Fig.(b),bands from left to right were marker,honey 58 by ammonium sulfate salting out method,honey 58 by TCA- acetone method,honey 58 by urea - thiourea method, honey 58 by sodium tungstate method.图1 5号、9号和58号原蜜用4种方法提取蛋白进行SDS-PAGE电泳银染图Fig.1 SDS-PAGE electrophoretogram of protein extracted from honey 5,9 and 58 by four methods
从图1可以看出,4种蜂蜜蛋白提取方法,均能从蜂蜜样品中提取蛋白,泳道内蛋白条带染色清晰。从SDS-PAGE电泳银染结果看,盐析法提取的蜂蜜蛋白样品电泳条整体带较其他3种淡,表明盐析法提取蜂蜜蛋白浓度较低;以尿素-硫脲法提取的蜂蜜蛋白样品电泳条带染色最深,条带最清晰;TCA-丙酮法和钨酸钠法次之。试验采用非干扰型试剂盒对5号、9号和58号原蜜3种蜂蜜4种提取方法获得的蛋白含量进行了比较(表2),结果得出,试剂盒法测定蛋白的浓度与电泳银染结果对照表明,尿素-硫脲法、TCA丙酮法提取的蜂蜜蛋白浓度较高,电泳分离条带背景较清晰。
2.2蜂蜜蛋白2-DE条件优化
2.2.1第一向IEF等电聚焦IPG胶条的选择。由图2可见,pH 3~10能较好地呈现蜂蜜中蛋白分布特征,但是蛋白点过于紧密地分布在凝胶的中间区域,造成大量蛋白堆积或重叠在一起,未能有效分开,不便于质谱分析。pH 4~7能较好地拉开左半部分55 K和72 K大小的蛋白,但是右半部分蛋白等电点超过7不能完整在凝胶上呈现。pH 5~8能完整地呈现右半部分蛋白,能将同一分子量的蛋白在不同等电点上拉开。通过PDQuest软件对pH 3~10、5~8、4~7的3张凝胶图进行蛋白点提取,分别提取到148、312、294个蛋白点,比较之下pH 5~8获得的蛋白点较多,pH 3~10图谱相对较完整地分离蜂蜜蛋白点。
表25号、9号和58号原蜜用4种方法提取蛋白含量测定
Table 2 Protein content detection in honey 5,9 and 58 by four methods

序号Honeynumber蜂蜜产地与品种Productionareaandcultivarofhoney提取方法Extractionmethod蛋白浓度Proteinconcentrationmg/g5号墨西哥尤卡坦蜜硫酸铵盐析法1.94TCA-丙酮法3.02尿素-硫脲法3.22钨酸钠法1.989号新西兰唛奴卡蜜硫酸铵盐析法2.14TCA-丙酮法3.06尿素-硫脲法4.98钨酸钠法5.1058号中国洋槐蜜硫酸铵盐析法0.919TCA-丙酮法3.898尿素-硫脲法7.609钨酸钠法1.319

图2 58号洋槐蜜选用不同pH范围IPG胶条2-DE电泳结果Fig.2 Two-dimensional electrophoresis of IPG adhesive tapes of honey 58 in different pH ranges
2.2.2蛋白质上样量。试验采用7 cm pH 5~8 IPG预制胶条,所得图谱经PDQuest软件分析。选择合适的上样量对获得清晰的双向凝胶电泳图谱十分重要,蛋白上样量过低会造成低丰度蛋白不能在凝胶上显现,上样量过高则会造成高丰度蛋白浓度过大成片状或连成线,不能使蛋白以单个点状呈现。该试验选择7 cm的pH 5~8的IPG胶条,考马斯亮蓝G-250进行染色,当上样量为50 μg时,通过PDQuest分析,只有130个蛋白点较清晰,能采用的蛋白点少且模糊。当上样量为150 μg时,检测到181个蛋白点,蛋白点增多。蛋白质上样量为250 μg时,蛋白点清晰,可在凝胶上检测到的蛋白点最多,聚焦效果好,分辨率高,图谱的质量最佳。
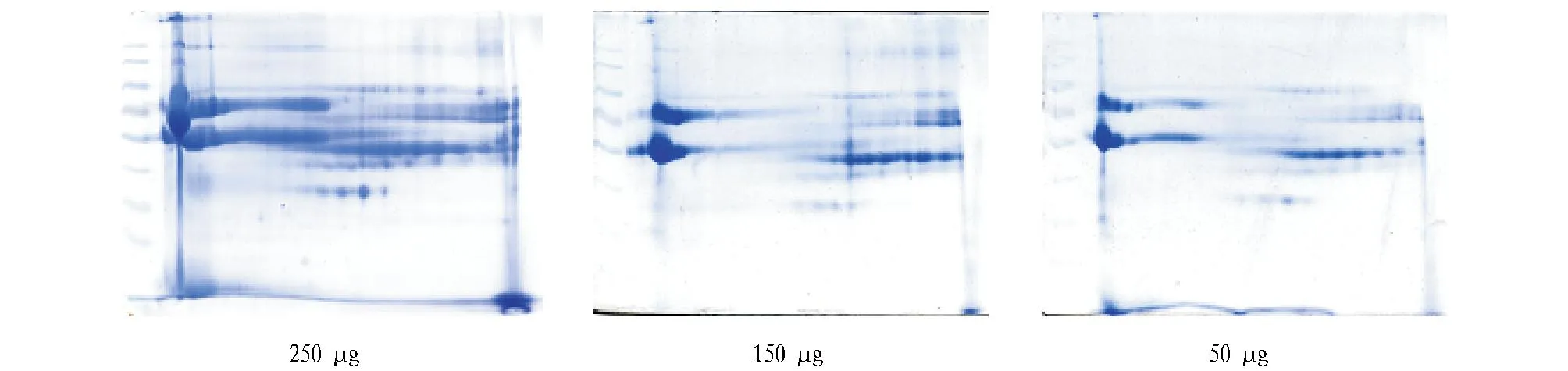
图3 58号洋槐蜜不同上样量的2-DE电泳结果Fig.3 Two-dimensional electrophoresis of honey 58 under different loading quantities
2.2.3等电聚焦参数的设置。试验进一步对等电聚焦电泳的聚焦时间进行了优化。聚焦时间的长短直接影响凝胶中蛋白成像质量,聚焦时间过短容易造成蜂蜜蛋白聚焦不完全、蛋白点成像不规整等;聚焦时间过长则有可能造成横向拖尾,因此选择合适的聚焦时间对获得清晰、高质量的凝胶图谱十分重要。试验选择等电聚焦时间分别设定为20 000、32 000、40 000 V·h,当聚集时间为20 000 V·h时,发现凝胶中100 kD左右蛋白区域蛋白连成一条很细的线,不见规整的蛋白点;当聚集时间为40 000 V·h时,凝胶中55 kD靠中间区域以及72 kD附近靠右侧蛋白丰度过高,蛋白点堆积严重,图像模糊;在32 000 V·h聚焦时,在凝胶上显现的蛋白质点多且清晰,PDQuest软件分析检测到蛋白点数为326个。
3结论与讨论
从蜂蜜中提取蛋白是分析蜂蜜蛋白的第一步,能否有效地从蜂蜜样品中尽可能多地获得较高的蜂蜜蛋白含量是关键。该研究比较了4种从蜂蜜中提取蛋白的方法,硫酸铵盐析法是蛋白质提取的最常用方法,提取的蛋白进行除盐后可以再次溶解,提取过程中蛋白未变性处理,适用于蛋白活性研究,但是盐析法提取蛋白的浓度较低。钨酸钠法虽然提取蛋白含量较高,但是因酸化干扰,SDS-PAGE电泳背景较黑,分离的蛋白条在凝胶上呈现不清晰。丙酮法和尿素-硫脲法提取效果相差不大,尿素-硫脲能够有效减少糖类与蛋白的结合,综合比较,选择尿素-硫脲法提取蜂蜜蛋白。
目前,分析蜂蜜中蛋白多采用SDS-PAGE电泳,如邓建军等采用蛋白质电泳技术对蜂蜜的电泳行为进行分析,测定不同品种、不同产地的蜂蜜与掺假蜂蜜蛋白质含量以及SDS-PAGE电泳行为[4]。但是蜂蜜蛋白主要是由蜜蜂咽下腺分泌的MRJP家族蛋白,分子量主要集中在55~72 kD,属于蜂蜜中高丰度蛋白家族,SDS-PAGE电泳不能将这些蛋白分离开,因此需要2-DE电泳从分子量和等电点两向将这些蛋白在凝胶上拉开分离[5]。目前采用2DE电泳多用来分析蜂王浆中蛋白[6-9],采用2DE电泳对于蜂蜜中蛋白分析较少,主要是因为蜂蜜中蛋白含量远低于蜂王浆,通常含量只有0.1~10.0 mg/g;其次,蜂蜜含糖量非常高,要将蜂蜜中糖除去很

图4 58号洋槐蜜不同聚焦时间的2-DE电泳结果Fig.4 Two-dimensional electrophoresis of honey 58 under different focusing times
困难,残存在蜂蜜蛋白中对凝胶分析影响大。因此采用合适的蜂蜜蛋白提取纯化方式以及合适的2-DE电泳条件对于获得高质量的2-DE蜂蜜蛋白电泳图谱至关重要。该研究选择IPG胶条的pH、上样量、聚焦时间作为优化2-DE电泳的主要和关键因素,每块凝胶重复3次,结合PDQuest软件分析扫描后的凝胶图像,可以为下一步研究比较不同产地和品种蜂蜜中蛋白2-DE电泳图谱寻找差异蛋白以及对2-DE电泳图谱中蛋白点结合质谱技术进行鉴定打下基础。
参考文献
[1] 叶云,梁超香,李军生,等.利用同工酶技术检测蜂蜜品质的新方法[J].食品科学,2006,27(6):177-178.
[2] 胡庆银.不同蜂蜜中蛋白的差异研究[D].福州:福建农林大学,2010.
[3] WON S R,LEE D C,KO S H,et al.Honey major protein characterization and its application to adulteration detection[J].Food research international,2008,41(10):952-956.
[4] 邓建军,焦霞,杨海霞,等.利用聚丙烯酰胺凝胶电泳技术分析蜂蜜蛋白质行为[J].食品科学,2012,33(14):188-191.
[5] 柳丹丹.王浆主蛋白MRJP-1分离测定及对细胞的促生长作用研究[D].杭州:浙江大学,2013.
[6] 赵方圆,吴亚君,韩建勋,等.适合蜂王浆蛋白质组的双向电泳技术[J].食品科学,2013,34(9):14-18.
[7] 李东栋,何韶衡.木麻黄花粉变应原蛋白质组分的双向电泳分析[J].分子植物育种,2006,4(1):83-87.
[8] BARONI M V,CHIABRANDO G A,COSTA C,et al.Assessment of the floral origin of honey by SDS-page immunoblot techniques[J].Journal of agricultural and food chemistry,2002,50(6):1362-1367.
[9] FURUSAWA T,RAKWAL R,NAM H W,et al.Comprehensive royal jelly(RJ)proteomics using one-and two-dimensional proteomics platforms reveals novel RJ proteins and potential phospho/glycoproteins[J].Journal of proteome research,2008,7(8):3194-3229.
[10] SIVAKESAVA S,IRUDAYARAJ J.Classification of simple and complex sugar adulterants in honey by mid-infrared spectroscopy[J].International journal of food science & technology,2002,37(4):351-360.
[11] ALONSO-TORRE S R,CAVIA M M,FERNNDEZ-MUIO M A,et al.Evolution of acid phosphatase activity of honeys from different climates[J].Food chemistry,2006,97(4):750-755.
[12] KELLY J D,PETISCO C,DOWNEY G.Application of Fourier transform midinfrared spectroscopy to the discrimination between Irish artisanal honey and such honey adulterated with various sugar syrups[J].Journal of agricultural and food chemistry,2006,54(17):6166-6171.
[13] SHI J,LUA S,DU N,et al.Identification,recombinant production and structural characterization of four silk proteins from the Asiatic honeybeeApiscerana[J].Biomaterials,2008,29(18):2820-2828.
收稿日期2015-12-24
作者简介周莉质(1990-),女,云南普洱人,硕士研究生,研究方向:植物检疫。*通讯作者,研究员,硕士,从事微生物研究。
基金项目国家质检总局科技计划项目(2014IK087)。
中图分类号S 896.1
文献标识码A
文章编号0517-6611(2016)03-085-03
