适用于双向电泳分析的链格孢菌体蛋白提取方法的筛选
2019-06-27李贞彪王军节王鹏
李贞彪 王军节 王鹏

摘要 为筛选出一套适用于双向电泳分析的链格孢菌蛋白的提取方法,以该菌为研究材料,首先采用TCA丙酮法、磷酸TCA丙酮法、SDS提取法和TCA/丙酮SDS/酚抽提法分别提取菌丝蛋白质,然后进行蛋白质浓度的测定和单向SDSPAGE试验,并建立双向电泳体系。结果表明:TCA/丙酮SDS/酚抽提法所获得的蛋白质浓度为15.9 mg/mL,分别是其他三种方法所得蛋白浓度的2.64、4.61和1.43倍;SDSPAGE图谱中形成的条带数目最多、丰度最好;所获得的2DE图谱背景清晰干净,无明显的横纵条纹,分辨率高,可辨别的蛋白质点数为1 138个,是TCA丙酮法所分离蛋白点数的1.89倍。由此可知,TCA/丙酮SDS/酚抽提法为链格孢菌蛋白提取的最优方法,该方法所提取的蛋白质适用于双向电泳分析及后续的蛋白质组学研究。
关键词 链格孢; 采后病害; 蛋白质提取; 双向电泳; TCA/丙酮SDS/酚抽提法
中图分类号: S 432.1
文献标识码: ADOI: 10.16688/j.zwbh.2018285
Abstract In order to screen the extraction methods of total protein from Alternaria alternata suitable for twodimensional electrophoresis analysis, the mycelia proteins in the pathogen were extracted by four methods of TCAacetone, phosphateTCAacetone, SDS and TCA/acetoneSDS/phenol, respectively. Furthermore, the protein concentration was analyzed and the separation effect of total protein was detected by SDSPAGE.In addition, a suitable 2D gel electrophoresis system for mycelia protein was established. The results showed that the protein concentration extracted by the method of TCA/acetoneSDS/phenol reached 15.9 mg/mL, which was 2.64, 4.61 and 1.43 times of that extracted by the methods of TCAacetone, phosphateTCAacetone and SDS, respectively. Moreover, the most and clearest protein strips in SDSPAGE gel were obtained by TCA/acetoneSDS/phenol extraction method, and the 2DE map with a distinct background, high resolution, without obvious horizontal and vertical stripes were also obtained. The number of protein points reached 1 138, which is 1.89 times of that isolated by the TCAacetone method. It is suggested that the TCA/acetoneSDS/phenol extraction method is the best extraction method of mycelia protein from Alternaria alternata. Meanwhile, the protein extracted by the method is suitable for twodimensional electrophoresis analysis and subsequent proteomic research.
Key words Alternaria alternata; postharvest disease; protein extraction; twodimensional electrophoresis; TCA/acetoneSDS/phenol method
鏈格孢Alternaria alternata是一种能侵染多种农作物和经济作物的重要植物病原真菌,广泛分布在土壤、空气和农作物残体中,可寄生、腐生和兼性寄生或腐生[1]。A.alternata是半知菌亚门链格孢属的模式种[2],其菌落边缘整齐,初白色,而后逐渐变为不同程度的褐色,气生菌丝呈短绒状,其分生孢子梗为深色,单枝,顶端单生或串生分生孢子,分生孢子呈黑褐色,形状大小不一,呈倒棍棒状或倒梨形,有横隔膜[3]。该菌可侵染苹果[4]、梨[5]、草莓[6]、柑橘[7]、枸杞[89]、甜瓜[10]、番茄[11]等多种果蔬,引起采后烂损,并且其侵染过程产生的交链孢霉毒素给果蔬及其制品销售带来食品安全隐患[12]。全面解析病菌的分子致病机理对制定该病害的有效控制策略有重要意义。目前,已有研究人员对该病菌分子致病机理开展了较为广泛的研究,但研究主要集中在毒素[13]和代谢产物[1415]上,从蛋白质水平揭示链格孢分子致病机理的研究尚未见报道。
近年来,蛋白质组技术已经广泛应用于植物病原真菌致病机理的研究中。双向电泳(twodimensional gel electrophoresis, 2DE)技术是蛋白质组学研究中一种有效的蛋白质分离方法,而获得高分辨率2DE图谱的关键步骤是蛋白质提取[16]。目前,适用于2DE技术的植物病原真菌总蛋白提取常用TCA/丙酮法[17]、酚抽提法[18]及其衍生的改良方法。江珊等[19]采用改进的TCA/丙酮法对稻瘟病菌Magnaporthe oryzae菌丝体蛋白质进行双向电泳分析,获得了高分辨率电泳图谱,较改进前TCA/丙酮法蛋白质点数量平均提高687个点。FernándezAcero等[20]研究了磷酸盐缓冲液预处理对TCA丙酮法提取灰葡萄孢Botrytis cinerea菌丝体总蛋白的效果,发现在TCA/丙酮沉淀蛋白质样品之前使用磷酸盐缓冲液进行预处理可显著提高灰葡萄孢菌丝体总蛋白的提取效果。González等[21]研究发现TCA/丙酮结合苯酚提取法所提取的灰葡萄孢菌丝体蛋白含量高于磷酸TCA丙酮法,且该方法提高了蛋白点的分辨率,减少了拖尾,有更多的蛋白点被检测出。舒灿伟等[22]对采用不同蛋白提取方法所提取的水稻纹枯病菌Rhizoctonia solani蛋白质样品质量进行比较研究,结果表明,优化的TCA/丙酮酚/SDS联合抽提法适用于进行双向电泳的水稻纹枯病菌蛋白质的提取。但目前有关链格孢中蛋白质的有效提取方法研究鲜有报道。
本研究采用TCA丙酮、磷酸TCA丙酮、SDS提取和TCA/丙酮SDS/酚联合抽提等方法提取链格孢总蛋白,从蛋白质浓度和电泳分辨率等方面比较了不同提取方法的提取效果,对较理想的两种方法进行双向电泳对比分析,旨在探索优化出一套适合双向电泳分析的链格孢总蛋白的提取方法,为相关研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
链格孢Alternaria alternata由本实验室分离自黑霉病发病枸杞果实。
1.1.2 主要试剂和仪器
丙烯酰胺、N,N甲叉双丙烯酰胺、Tris、二硫苏糖醇(DTT)、溴酚蓝、过硫酸铵(Ap)、甘氨酸、尿素、硫脲、碘乙酰胺(IAA)、四甲基乙二胺(TEMED)、考马斯亮蓝R250购自Amresco公司;IPG胶条(pH 3~10,17 cm,非线性)、两性电解质BioLyte(pH 3~7)、矿物油为BioRad公司产品;其他试剂均为国产分析纯。
IEF等电聚焦电泳仪、双向垂直板电泳仪、制冷水浴循环器、UV凝胶成像系统、GS800 Calibrated Imaging Densitometer型彩色扫描仪,为BioRad公司产品;低溫高速离心机为长沙湘仪离心机仪器有限公司生产;紫外可见分光光度计为上海元析仪器有限公司生产。
1.2 方法
1.2.1 病原菌培养与收集
参照赵明治等[23]的方法并略作修改。将链格孢接种于PDA平板上,于28℃培养箱中培养7 d后,用5 mm直径的无菌打孔器在菌落边缘打取菌饼,取3~5个菌饼接入装有100 mL PDB的250 mL三角瓶中,置于28℃、170 r/min下恒温振荡培养3 d,收集菌丝,超纯水洗涤3次,用真空抽滤器将培养的菌丝体抽滤成干燥的菌饼后立刻用液氮冷冻于-80℃保存,备用。
1.2.2 菌体蛋白的提取
分别采用TCA丙酮法、磷酸TCA丙酮法、SDS提取法和TCA/丙酮SDS/酚联合抽提法提取菌丝蛋白,操作流程见图1。
TCA丙酮法参照Damerval 等[24]的方法,略作修改。取2 g干燥的菌丝置于研钵中,加液氮研磨至细粉,转入50 mL离心管中。加入30 mL预冷的质量分数为10% TCA丙酮溶液(含体积分数0.07%的巯基乙醇),涡旋振荡混匀,-20℃过夜沉淀蛋白质。4℃、12 000 r/min离心20 min,弃上清;再加入含体积分数0.07%巯基乙醇的预冷丙酮,充分混匀,-20℃静置1 h;重复离心洗涤沉淀3次以去除残留的TCA;室温下,将沉淀置于通风橱内,使蛋白质沉淀中残留的丙酮挥发干净;收集干燥后的蛋白质干粉,于-20℃下保存。
磷酸TCA丙酮法参照FernándezAcero等[20]和张小泉[25]的方法,略作修改。将2 g干燥的菌丝液氮研磨至细粉后转入50 mL离心管,加入30 mL预冷的10 mmol/L磷酸钾磷酸缓冲液(pH 7.4,含体积分数0.07%的巯基乙醇),涡旋振荡混匀,-20℃下静置2 h;4℃、12 000 r/min离心20 min,弃上清;将得到的沉淀重悬于预冷的质量分数为10% TCA丙酮溶液(含0.07%的巯基乙醇)中,涡旋振荡混匀,-20℃过夜沉淀蛋白质;4℃、12 000 r/min离心20 min,弃上清;加入含体积分数0.07%巯基乙醇的预冷丙酮,充分混匀,重复洗涤3次。室温下,待丙酮挥发干净后收集干燥的蛋白质干粉,于-20℃下保存。
SDS提取法参照舒灿伟等[22]的方法,略作修改。如前所述,将2 g干燥的菌丝研磨成细粉后转入50 mL离心管,立刻加入30 mL预冷的SDS缓冲液(含30%甘油、4% SDS、5%巯基乙醇、0.1 mol/L,pH 6.8 TrisHCI),涡旋振荡混匀;在80℃下恒温水浴5 min;随后4℃、12 000 r/min离心20 min,弃沉淀;将所得的上清液加入含体积分数0.07% 巯基乙醇的预冷丙酮,涡旋振荡混匀,-20℃过夜。4℃、12 000 r/min离心20 min,弃上清,获得的沉淀再用预冷丙酮洗涤1次。室温下,待丙酮挥发干净后收集干燥的蛋白质干粉,于-20℃下保存。
TCA/丙酮SDS/酚联合抽提法参照舒灿伟等[22]和Wang等[26]的方法,略作修改。如前所述,将2 g干燥的菌丝研磨成细粉后转入50 mL离心管,立刻加入30 mL预冷的质量分数为10% TCA丙酮溶液(含体积分数0.07%的巯基乙醇),涡旋振荡混匀,-20℃ 过夜沉淀蛋白质。4℃、12 000 r/min离心20 min,弃上清;再分别用体积分数80%甲醇溶液(含100 mmol/L醋酸铵)和体积分数80%丙酮溶液各洗涤1次,沉淀通风干燥10 min。向所得沉淀中同时加入5 mL水饱和酚和5 mL SDS缓冲液(水饱和酚与SDS缓冲液1∶1混合),振荡混匀,室温静置5 min;离心,吸取上层酚相转移至新的50 mL离心管中,再加入5倍体积预冷的100 mmol/L醋酸铵甲醇溶液,-20℃ 过夜沉淀。4℃、12 000 r/min离心20 min,弃上清;沉淀用上述甲醇和丙酮溶液再各洗涤1次,收集干燥后的蛋白质干粉,于-20℃下保存。
1.2.3 蛋白质溶解
分别称取上述4种方法获得的蛋白质样品干粉50 mg加入1 000 μL裂解液(8 mol/L 尿素,2 mol/L硫脲,4% W/V CHAPS,1% W/V DTT,0.2% V/V BioLyte pH 3~10)中,涡旋混匀后室温放置3~4 h,每30 min轻轻摇匀1次,然后在4℃、12 000 r/min离心20 min,收集上清液,将样品分装后于-80℃下保存或直接用于电泳。
1.2.4 蛋白质定量
制备的蛋白样品均参照 Bradford 法[27]测定蛋白质的含量。以牛血清白蛋白(BSA)作为标准蛋白,在595 nm下测定不同浓度标准液的吸光度制作标准曲线,标准方程为y=0.007 9x+0.015 9,R2=0.997 8,然后根据样品的吸光度、稀释倍数计算出不同提取方法获得的蛋白质浓度,结果分别用mg/mL表示。
1.2.5 SDSPAGE分析
采用等体积上样的方法,将裂解后的蛋白质样品与2× SDSPAGE上样缓冲液按1∶1的体积比充分混合,100℃下沸水浴 3~5 min,将各方法所得到的蛋白样品调整至同一浓度后移取10 μL样品混合液进行上样,开始时用80 V电泳至浓缩胶部分成一水平线后,提高电压到120 V电泳至溴酚蓝到达距胶底1 cm处时停止电泳,电泳结束后将凝胶转移至盛有20 mL考马斯亮蓝R250染色液的容器内,在水平摇床上缓慢振荡1 h,使凝胶颜色与染色液颜色一致为止。染色完毕后,将凝胶转移至含有适量脱色液的容器内,水平摇床缓慢振荡4~8 h至条带清晰为止。
1.2.6 双向电泳分析
双向电泳试验参照张小泉[25]的方法,略作修改。蛋白样品与水化液(8 mol/L 尿素,2 mol/L硫脲、4% W/V CHAPS,65 mmol/L DTT,0.2% V/V BioLyte pH 3~10,0.001%溴酚蓝)充分混合,蛋白质上样量为400 μg/泳道,上样总体积350 μL,选用IPG胶条(17 cm、pH 3~10、非线性)。等电聚焦程序设置为:20℃,50 V水化12 h;除盐:250 V线性0.5 h,500 V快速0.5 h,750 V快速1 h,1 000 V快速1 h;升压:5 000 V线性2 h,10 000 V线性3 h;聚焦: 10 000 V快速60 000 Vh;保持:500 V快速,任意时间。聚焦结束后,胶条依次在含有 2% DTT的平衡缓冲液(0.375 mol/L TrisHCl pH 8.8,6 mol/L尿素,20%甘油,2% SDS)和含有2.5%碘乙酰胺的平衡缓冲液中进行平衡,每次平衡15 min。采用12%的分离胶进行SDSPAGE,电泳参数设置为50 V/gel、1.5 h,200 V/gel、8 h,待溴酚藍指示剂到达距底部边缘1 cm处时即可停止电泳。
1.2.7 凝胶染色与图像处理
电泳结束后,先将凝胶用超纯水漂洗3次,再转入考马斯亮蓝染色液中,置于水平摇床上,室温下缓慢染色10 h(或过夜)左右。再将凝胶转入脱色液I(甲醇∶水∶冰乙酸=45∶45∶10)中,水平摇床上缓慢脱色1 h,再转入脱色液Ⅱ(乙醇∶水∶冰乙酸=45∶45∶10)中缓慢脱色4~8 h,期间更换脱色液Ⅱ 2~3次,直到蓝色背景消失。染色后的凝胶采用BIORAD GS800 Calibrated Imaging Densitometer型彩色扫描仪扫描,并用Quantity one软件获取图片。扫描后的凝胶图像用PDQuest 8.0.1软件进行图谱分析。
1.2.8 数据处理与分析
所有试验数据采用Excel 2016、IBM SPSS 21.0软件统计分析与作图分析。
2 结果与分析
2.1 蛋白质提取效果的比较
不同提取方法均能获得菌丝蛋白,且获得蛋白的浓度差异显著。由表1可知,磷酸TCA丙酮法获得蛋白质浓度最低,为3.447 mg/mL,TCA丙酮法和SDS提取法提取蛋白浓度较高,分别为6.027 mg/mL和11.124 mg/mL,而获得最高蛋白质浓度方法为TCA/丙酮SDS/酚联合抽提法,为15.900 mg/mL,分别是TCA丙酮法、磷酸TCA丙酮法和SDS提取法的2.64、4.61和1.43倍。
2.2 SDSPAGE电泳效果分析
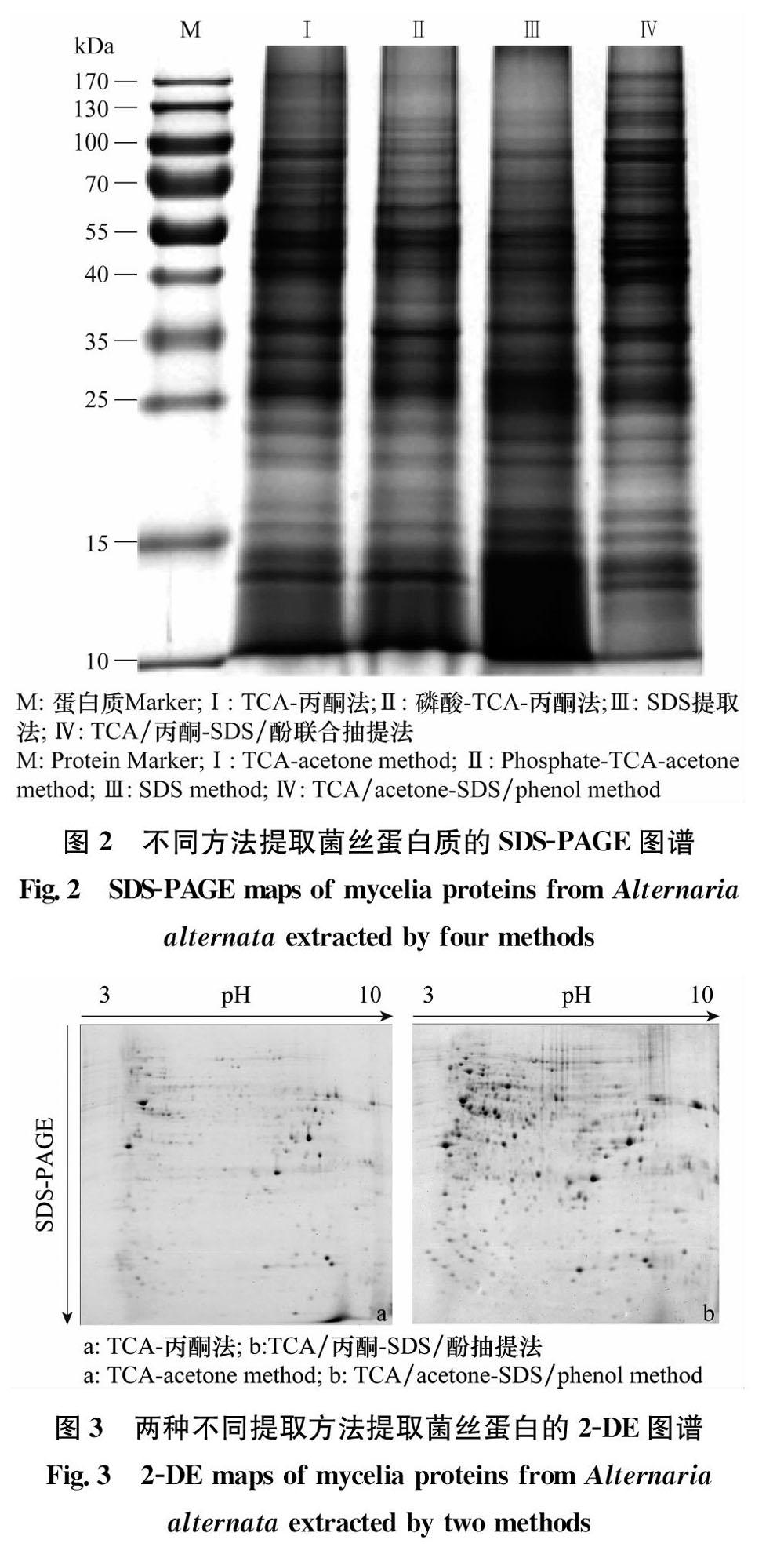
从这4种提取方法所制备的菌丝蛋白的SDSPAGE电泳图谱(图2)可以看出,4种方法提取的菌丝蛋白的样品颜色、条带数目、清晰程度都存在较大差异。采用TCA丙酮法获得的蛋白质粉末呈现浅灰色,含有少量色素杂质,蛋白提取率较高,条带较清晰,约有25条;相比于TCA丙酮法,磷酸TCA丙酮法所获得的蛋白质粉末呈深灰色,含色素杂质较多,蛋白提取率不高,条带相对较浅,尤其是分子量较大的蛋白质丰度较差,约有26条;SDS提取法所获得的蛋白质为白色粉末,条带背景较模糊,条带数约为27条,高分子量蛋白质条带微弱,而低分子量蛋白质条带颜色较深,且背景十分模糊。而TCA/丙酮SDS/酚抽提法相比其他3种方法所获得的蛋白条带数目更多、更清晰,尤其是高分子量蛋白质条带,总共约有28条。因此,从SDSPAGE电泳的比较结果可以初步筛选出TCA丙酮法和TCA/丙酮SDS/酚抽提法更适合于进一步进行双向电泳检测。
2.3 两种方法提取蛋白的双向电泳比较
通过SDSPAGE电泳初步筛选出TCA丙酮法和TCA/丙酮SDS/酚抽提法为较好的提取方法,再在严格控制双向电泳参数和方法相同的条件下,分别对这两种方法所提取的蛋白质进行双向电泳检测,试验结果如图3所示。
从图中可以看出,两种蛋白提取方法效果有明显的差异。从蛋白质的分辨率来看,采用TCA/丙酮SDS/酚抽提法所提取蛋白质的双向电泳图谱的蛋白质分辨率明显优于TCA丙酮法的蛋白质样品图谱。从双向电泳图谱中可分辨点的数目来看,TCA丙酮法所提取的蛋白质样品较少,2DE图谱中蛋白点数较少,为603个,且图谱横纹较多,分辨率较低(图3a)。相比而言,TCA/丙酮SDS/酚抽提法所得到的电泳图谱背景干净,几乎没有明显的拖尾现象,蛋白点独立清晰圆润,分布较均匀,没有弥散的蛋白质点,且点数明显多于TCA丙酮法,为1 138个。说明该提取方法获得的蛋白样品杂质较少,得到了理想的分离效果。由此表明,TCA/丙酮SDS/酚抽提法所获得的蛋白质更适合于链格孢菌丝蛋白的双向电泳分析。
[8] 袁惠君,李虎军,贾鸿震,等.永登枸杞鲜果晾晒过程中霉腐病原真菌的分离鉴定[J].食品工业科技,2016,37(21):135138.
[9] 刘瑜,王海,王艳丹,等.枸杞鲜果霉变菌种分离鉴定及其生物学特性[J].农业工程学报,2017,33(S1):374380.
[10]谢东锋,毕阳,邓建军,等.采前壳聚糖对厚皮甜瓜果实潜伏侵染及其采后主要病害的控制[J].甘肃农业大学学报,2008(2):9699.
[11]吴仁锋,汪志红.番茄早疫病研究概述[J].中国植保导刊,2009,29(3):1618.
[12]王婧,翟伟卜,高环,等.链格孢引起的病害严重危害农作物生产并危及农产品安全[J].植物保护,2017,43(4):915.
[13]刘娟.柑桔园链格孢菌的鉴定与防治[D].重庆:西南大学,2001.
[14]HYON G S, IKEDA K, HOSOGI N, et al. Inhibitory effects of antioxidant reagent in reactive oxygen species generation and penetration of appressoria of Alternaria alternata Japanese pear pathotype [J].Phytopathology,2010,100(9):840847.
[15]VLZ H, GLROOK N J, DAUB M E, et al. Mannitol biosynthesis is required for plant pathogenicity by Alternaria alternata[J]. FEMS Microbiology Letters, 2008, 285(1): 122129.
[16]蘇玉斌.金龟子绿僵菌致病力与发育的差异蛋白质组学研究[D].福州:福建农林大学,2012.
[17]BHADAURIA V, ZHAO Wensheng, WANG Lixia, et al. Advances in fungal proteomics[J].Microbiological Research,2007,167: 193200.
[18]CARPENTIER S C, WITTERS E, LAUKENS K, et al. Preparation of protein extracts from recalcitrant plant tissues: An evaluation of different methods for twodimensional gel electrophoresis analysis [J]. Proteomics, 2005, 5(10): 24972507.
[19]江珊,周晓罡,苏源,等.氮胁迫条件下稻瘟病菌菌丝体蛋白质组学研究[J].扬州大学学报(农业与生命科学版),2012,33(4):7276.
[20]FERNNDEZACERO F J, JORGE I, CALVO E, et al. Twodimensional electrophoresis protein profile of the phytopathogenic fungus Botrytis cinerea[J]. Proteomics, 2006, 6(S1): S88S96.
[21]GONZLEZ F R, ALORIA K, VALERO G J, et al. Proteomic analysis of mycelium and secretome of different Botrytis cinerea wildtype strains [J]. Journal of Proteomics, 2014, 97: 195.
[22]舒灿伟,陈健仪,赵美,等.一种优化的适用于双向电泳的水稻纹枯病菌蛋白质提取方法[J].华中农业大学学报,2017,36(5):1519.
[23]赵明治,杨秀芬,张明,等.一种促进植物根系生长的极细链格孢菌蛋白质分离、纯化和生物功能[J].中国生物防治,2007(2):170173.
[24]DAMERVAL C, DE VIENNE D, ZIVY M, et al. Technical improvements in twodimensional electrophoresis increase the level of genetic variation detected in wheatseedling proteins[J]. Electrophoresis, 2010, 7(1): 5254.
[25]张小泉.丙烷脒对灰葡萄孢作用的蛋白质组学初步研究[D].杨凌:西北农林科技大学,2009.
[26]WANG Wei, VIGNANI R, SCALI M, et al. A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis [J].Electrophoresis,2006,27: 27822786.
[27]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding [J]. Analytical Biochemistry,1976,72(1/2):248254.
[28]陈晶瑜,郭宝峰,何付丽,等.适合双向电泳的植物全蛋白提取方法比较[J].中国农学通报,2010,26(23):97100.
[29]WU Fangsheng, WANG Mengyun. Extraction of proteins for sodium dodecyl sulfatepolyacrylamide gel electrophoresis from proteaserich plant tissues [J]. Analytical Biochemistry, 1984, 139(1): 100103.
[30]LAKSHMAN D K, NATARAJAN S S, LAKSHMAN S, et al. Optimized protein extraction methods for proteomic analysis of Rhizoctonia solani [J]. Mycologia,2008,100(6):867875.
[31]CARPENTIER S C, WITTERS E, LAUKENS K, et al. Preparation of protein extracts from recalcitrant plant tissues: An evaluation of different methods for twodimensional gel electrophoresis analysis [J]. Proteomics, 2005, 5: 24972507.
[32]FERNNDEZACERO F J, COLBY T, HARZEN A, et al. Proteomic analysis of the phytopathogenic fungus Botrytis cinerea during cellulose degradation [J]. Proteomics, 2009, 9(10):28922902.
[33]冯浩,王海英,冯雅琼,等.苹果树腐烂病菌菌丝蛋白双向电泳体系的建立[J].西北农林科技大学学报(自然科学版),2017,45(6):155162.
[34]劉原志,章强强.iTRAQ技术在真菌研究中的应用进展[J].中国真菌学杂志,2015,10(3):185189.
[35]谢秀枝,王欣,刘丽华,等.iTRAQ技术及其在蛋白质组学中的应用[J].中国生物化学与分子生物学报,2011,27(7):616621.
(责任编辑:田 喆)
