羟乙基纤维素与再生氧化纤维素止血纱布理化性质的对比研究
2016-03-14刘白璐林少辉郝艳丽李展韬郑明广通讯作者zhengmingguangnkbpcombmuxieyingbjmueducn
刘白璐 史 青 林少辉 郝艳丽 仲 亮 李展韬 郑明广通讯作者:zhengmingguang@nkbp.com;bmuxieying@bjmu.edu.cn 谢 英
羟乙基纤维素与再生氧化纤维素止血纱布理化性质的对比研究
刘白璐①北京大学药学院药剂学系 北京 100191史 青②辽宁诺康医药(北京)有限公司 北京 100088林少辉①郝艳丽①仲 亮①李展韬①郑明广②**通讯作者:zhengmingguang@nkbp.com;bmuxieying@bjmu.edu.cn谢 英①*

[摘要]目的:研究比较羟乙基纤维素止血纱布(HEC-AHG)和氧化再生纤维素止血纱布(ORCAHG)两者的理化性质,为临床应用提供支持。方法:实验测定HEC-AHG与ORC-AHG两者的溶解度、溶解速率、pH值、电导率和纤维素酶作用下的降解动力学。结果:HEC-AHG在去离子水和生理盐水中的溶解度和溶解速率分别为12%~15%和6.5~7.2 mg·ml-1·min-1,明显高于ORC-AHG0.08%~0.1,4×10-5~64×10-5mg·ml-1·min-1。HEC-AHG的pH值为6~7,在去离子水中的电导率与纯水(14 μS/cm)接近,而ORC-AHG的pH值为2~3,具有较高的电导率(250~450(μS/cm)。室温下HEC-AHG在0.1%纤维素酶作用下降解速率高于ORC-AHG。结论:与ORC-AHG比较,HEC-AHG有更好的溶解性能和较小酸性,降解较快,是一种有前景的新型止血材料。
[关键词]羟乙基纤维素;氧化再生纤维素;溶解度;pH值;电导率;降解速率
[First-author’s address] Peking University's College of Pharmacy, Department of Pharmacy, Beijing 100191, China.
外科手术中常伴有出血发生,选择适宜的止血材料十分重要。目前临床常用的可吸收止血材料主要为氧化纤维素和氧化再生纤维素(oxidized regenerated cellulose,ORC)类、纤维蛋白胶、α-氰基丙烯酸酯类组织胶以及壳聚糖等[1]。
ORC由再生纤维素经二氧化氮氧化而得,近10年广泛应用于临床。ORC-再生纤维素纱布(ORC-absorbable hemostatic gauze,ORC-AHG)为一种无菌可吸收的编织物,为白色带浅黄色内衬,有轻微焦糖味,其结构中含有羟基和羧基,止血机制主要来源于羧基与血红蛋白中铁离子结合,从而形成棕色胶块,封闭毛细血管末端止血,而不依赖于生理性止血[2-3]。同时,由于ORC-AHG羧基含量在16%~24%,显酸性,具有广谱杀菌性,可降低术后感染[4-5]。有报道表明,ORC-AHG生物降解性较好,在体内一般可在2~4周完全降解[6]。然而近期的研究发现,ORC-AHG在临床应用方面存在一定的缺憾,如可引起组织坏死,并有可能穿过椎间孔,造成脊髓压迫[7];强酸性导致的神经毒性,而引起延迟性下肢麻痹和神经系统疾病等[8]。
羟乙基纤维素(hydroxyethyl cellulose,HEC) 与ORC具有类似的主体结构,均为纤维素衍生物。HEC是一种应用十分广泛的纤维素醚,在医药领域主要用作增稠剂、胶体保护剂、黏合剂、分散剂、稳定剂、助悬剂、成膜剂以及缓释材料,可应用于局部用药的乳剂、软膏、滴眼剂以及口服液、固体片剂、胶囊等多种剂型[9-10]。ORC和HEC的分子结构如图1所示。

图1 ORC和HEC的分子结构示图
目前,HEC应用于止血领域,并申请了一项发明专利,成为一种新型水溶性全吸收纤维素多糖止血医用新材料[11]。为此,本研究探讨羟乙基纤维素纱布(HEC-AHG)的相关理化性质,并与临床外科上最常用的ORC-AHG进行对比,为止血材料的临床应用提供数据支持。
1 材料和方法
1.1 材料和仪器
HEC-AHG(批号:14090901,云南德华生物药业有限公司出品);ORC-AHG(批号:HDB3001,辽宁诺康生物制药有限责任公司提供出品);纤维素酶(Biotopped),葡萄糖(北京化工厂出品),3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)(CP,购自华威锐科),NaOH(北京化工厂出品),硫酸铜(北京化工厂出品),酒石酸钾钠四水合物(Greagent,购自银河天虹出品),苯酚(北京化工厂出品),无水亚硫酸钠(北京化工厂出品)。
NDJ-1型旋转粘度计(上海精密科学仪器有限公司),DDSJ-308型电导率仪(上海雷磁精科),XMT615智能PID温度控制仪(上海任重仪表电器有限公司),Sartorius PB-10 pH计。
1.2 HEC-AHG和ORC-AHG在生理盐水中的溶解状态
将HEC-AHG和ORC-AHG在室温下,分别在50 ml烧杯中加入30 ml生理盐水。分别称取一片HECAHG(300 mg),1/5片速即沙(30 mg),放入恒温后的生理盐水中。每隔0.5 min振摇一次,静置,观察样品的状态。
1.3 粘度法测定HEC-AHG溶解度
称取适量HEC-AHG,加入约5 ml溶剂,配制浓度约为5%的溶液,准确记录浓度。置于恒温水浴中达温度恒定后,用旋转黏度计测定其黏度。然后加入少量HEC-AHG,充分溶解,记录其浓度,再次测定其黏度,直至其浓度达到15%左右。溶剂分别为生理盐水和去离子水,测定温度分别为37 ℃和25 ℃。每组平行实验3次,绘制粘度-浓度曲线,根据粘度变化拐点所对应的浓度,确定HEC-AHG分别在37 ℃和25 ℃下在去离子水和生理盐水中的溶解度。
1.4 电导率法测定ORC-AHG溶解度
称取适量ORC-AHG,精确称重W1(g),置恒温水浴中达到平衡温度,加入恒温的去离子水W0(g),打表计时。分别于15 min,30 min,1 h,2 h,4 h,6 h,24 h,48 h,96 h,120 h,144 h,168 h,216 h,264 h,288 h,318 h,336 h,360 h和384 h测定电导率,直至电导率不再变化。过滤、干燥至恒重,得到未溶解的ORC-AHG质量W2(g),根据公式1计算溶解度:

测定温度分别为37 ℃和25 ℃,每组平行测定3次。ORC-AHG在生理盐水中溶解度采用同法测定,溶解平衡时间参考去离子水体系。
1.5 HEC-AHG和ORC-AHG的溶解速率
取一片HEC-AHG,准确称重(m),加入5 ml溶剂,静置于恒温水浴中,观察其溶解过程和完全溶解所需的时间(t)。取适量ORC-AHG,准确称重(m0),加入5 ml去离子水,静置于恒温水浴中,用电导率仪监测其溶解过程和达到溶解平衡所需的时间(t)。过滤、干燥至恒重,称量未溶解ORC-AHG质量(m1)。溶解的ORC-AHG质量m=m0-m1。溶剂分别为去离子水和生理盐水,恒温水浴温度分别为25 ℃和37 ℃。每个样品平行试验3次。根据公式2计算溶解速率:
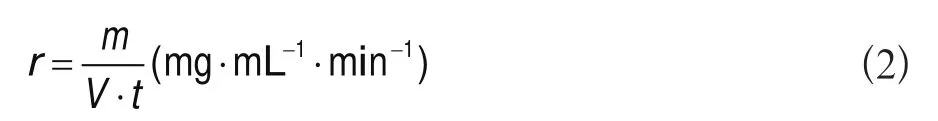
1.6 HEC-AHG和ORC-AHG的pH值及电导率
用去离子水或生理盐水配制0.6%HEC-AHG溶液,饱和HEC-AHG溶液和饱和ORC-AHG溶液。采用pH计和电导率仪分别测定25 ℃和37 ℃的pH值及其在去离子水中的电导率。每个样品平行测定3次。
1.7 HEC-AHG和ORC-AHG的降解
1.7.1 降解产物的鉴别
室温下分别在1%HEC-AHG生理盐水溶液和饱和ORC-AHG生理盐水溶液中加入纤维素酶溶液(终浓度为0.2%),反应120 h。取反应液200 μl,分别加入200 μl斐林A液(NaOH 0.05 g/ml)和200μl斐林B液(CuSO4
0.1 g/ml)。100℃水浴中加热,观察颜色变化。以1%葡萄糖溶液为阳性对照,以1%HEC-AHG生理盐水溶液,饱和ORC-AHG生理盐水溶液和1%纤维素酶溶液为阴性对照。
1.7.2 DNS法定量测定葡萄糖含量
(1)DNS试剂配制:50 ml蒸馏水中加入0.3 g DNS至完全溶解,45 ℃下加入1.6g NaOH,3 g酒石酸钾钠,0.5 g结晶酚,0.5 g无水亚硫酸钠搅拌溶解,冷却后用蒸馏水定容至100 ml,静置7~10 d后使用。
(2)葡萄糖在105 ℃下烘干2 h至恒重,配制1.0 mg/ml、0.5 mg/ml、0.25 mg/ml、0.125 mg/ml、0.0625 mg/ml及0.0313 mg/ml标准葡萄糖水溶液。取标准品2 ml,加入0.5 mL DNS试剂,摇匀后在沸水中放置5 min,取出用流水迅速冷却,用去离子水定容至20 ml,充分摇匀后静置20 min。在紫外波长为540 nm处测吸光值A。以A~C作图,得到葡萄糖含量测定标准曲线。
1.7.3 HEC-AHG和ORC-AHG降解过程的监测
室温下,用蒸馏水配制3 mg/ml的HEC-AHG和ORC-AHG溶液,分别加入纤维素酶溶液(至其终浓度为0.1%),加入一半时打表计时,分别在1 min、3 min、5 min、10 min、15 min、30 min、60 min、120 min、420 min、720 min及1560 min时取出1 ml反应液,加热终止反应。采用DNS法定量测定葡萄糖含量的方法测定葡萄糖浓度。
2 结果
2.1 HEC-AHG和ORC-AHG的溶解状态
室温下,HEC-AHG在生理盐水中迅速吸水,由白色网眼型纱布变为透明凝胶状,漂浮于液体中(如图2A所示)。约3 min时,溶液开始变得粘稠,粘度开始增加(如图2B所示)。约10 min时,凝胶完全溶解,整个溶液成透明状,具有一定粘度(如图2C所示)。由此可见,HEC-AHG的溶解过程分为溶胀和溶解两个过程,溶胀时间约为3 min,溶解时间约为10 min。ORC-AHG在生理盐水中迅速吸水,由白色网眼型纱布变为丝状(如图2D所示)。静置状态下,其吸水后逐渐分散于溶液中,成棉丝状。约3 min时,逐渐分散,未溶解(如图2E所示)。约10 min后,尚可见白色丝状物质(如图2F所示)。

图2 HEC-AHG和ORC-AHG在生理盐水中不同时间的溶解状态示图
2.2 HEC-AHG和ORC-AHG的理化性质
HEC-AHG溶液粘度随浓度的变化如图3A所示。HEC-AHG为易溶型高分子材料,其粘度随浓度增加而增加,当在低浓度范围内,其溶解过程为溶胀-溶解,粘度随浓度变化率较小;当达到其饱和溶解度,粘度随浓度变化率显著增加,此时HECAHG不再以溶液形式存在,而是形成了半固体凝胶态。ORC-AHG溶解性能较差,但在去离子水中可发生电离,其电导率随着ORC-AHG的溶解而增加,当达到溶解平衡时,电导率不再随时间而增加,如图3B所示。
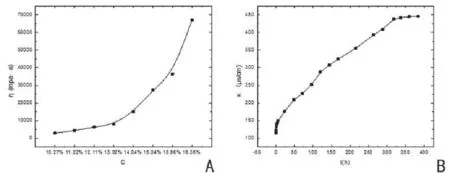
图3 HEC-AHG溶液粘度的浓度变化曲线图
HEC-AHG或ORC-AHG在25 ℃和37 ℃下分别于生理盐水和去离子水中的溶解度数据见表1。表中数据显示,HEC-AHG溶解度明显高于ORC-AHG,提高了近140倍。ORC-AHG溶解度较小,在不同温度下以及在不同溶剂中的溶解度无显著性差异。HECAHG在25 ℃下生理盐水中的溶解度低于去离子水中的溶解度,可能与高分子的盐析作用有关;但37 ℃下,两者无显著性差异,可能由于温度升高,溶剂分子的热运动加强,离子强度的影响不足以改变高分子的聚集状态,因此溶解度无明显变化。
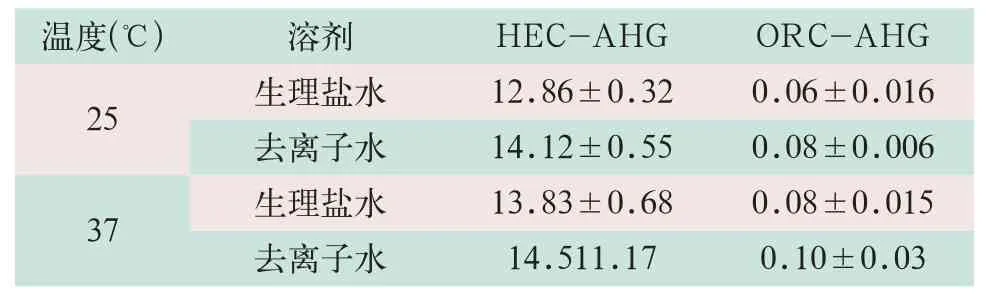
表1 HEC-AHG和ORC-AHG的溶解度及方差分析(%)(x-±s)
2.3 HEC-AHG和ORC-AHG的溶解速率
HEC-AHG和ORC-AHG在25 ℃和37 ℃下分别于生理盐水和去离子水中的溶解速率见表2。表中数据显示,HEC-AHG溶解速率明显大于ORCAHG,ORC-AHG的溶解速率仅为HEC-AHG的十万分之一。分析其原因,HEC-AHG的溶解速率高于ORC-AHG与两者的分子结构有关(如图1所示)。HEC-AHG的组成成分羟乙基纤维素中富含乙二醇(CH2CH2O),醚键中的氧原子易于和H2O中的氢原子发生氢键相互作用,形成水化层,有助于提高纤维素的溶解速率和溶解度。而再生氧化纤维素由于其多支链纤维结构,在水中的溶解速率和溶解度均较低。

表2 HEC-AHG和ORC-AHG的溶解速率(mg/ml·min)(x-±s)
2.4 HEC-AHG和ORC-AHG的pH值
HEC-AHG和ORC-AHG在25 ℃和37 ℃下分别于生理盐水和去离子水中的pH值见表3。表中数据显示,HEC-AHG在去离子水、生理盐水中的pH值在6.13~7.33范围内,属于中性。HEC-AHG饱和溶液的pH值略>0.6%溶液,其浓度提高了20余倍,但pH值无明显差异,表明HEC-AHG在去离子水和生理盐水中基本上以分子形式存在。ORC-AHG主要成分为氧化再生纤维素,在水环境下羧基极易电离出H+,而呈现出酸性。ORC-AHG在去离子水和生理盐水中的溶解度虽然只有0.1%左右,但其溶液pH值为2.5~3.5,呈现出较强的酸性。

表3 HEC-AHG和ORC-AHG的pH值(n=3)(x-±s)
HEC-AHG和ORC-AHG在生理盐水中的pH值均低于去离子水中的pH值,可能与NaCl的离子效应有关。溶液的离子数目增加,介电常数增加,促进纤维素中-CH2OH中H+的解离。
2.5 HEC-AHG和ORC-AHG的电导率
纯水的电导率为1.0 μS/cm,溶液中离子数目的增多,其电导率增加。实验测得HEC-AHG和ORCAHG在去离子水中的电导率见表4。表中数据显示,HEC-AHG在水中不电离,其与溶剂的电导率相差无几。虽然其电导率随着温度升高略有增加,但也明显低于ORC-AHG。
ORC-AHG溶解度<0.1%,但其电导率高于溶剂约20~30倍,而且随着温度的升高,其电导率显著增加,说明ORC-AHG为离子型高分子材料,在水中易电离。
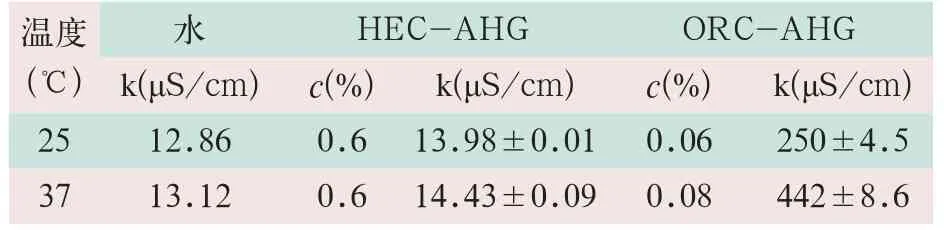
表4 HEC-AHG和ORC-AHG在去离子水中的电导率(x-±s)
2.6 HEC-AHG和ORC-AHG的降解
斐林试剂是检测葡萄糖的专一试剂,HEC-AHG 或ORC-AHG在纤维素酶作用下降解产物的显色如图4所示。由图4可见,HEC-AHG主要降解产物为葡萄糖,ORC-AHG无明显的葡萄糖产生。HEC-AHG 和ORC-AHG原液(未经纤维素酶处理)均无明显的葡萄糖产生。
DNS法测定葡萄糖的线性方程为A=0.11044 m(mg)-0.00948,R2=0.9993,表明该法可以用于葡萄糖的定量测定。

图4 HEC-AHG或ORC-AHG的斐林试剂显色反应示图
HEC-AHG在纤维素酶催化作用下,先生成葡萄糖,然后发生二级降解,如图5A所示。在此连续反应中,初期葡萄糖生成速率约为0.015 mg/(ml·min),达峰时间为30~60 min,峰浓度水平为0.783 mg/ ml,是初始HEC浓度水平的25%~30%,最终葡萄糖浓度水平为0.493 mg/ml,是初始HEC浓度水平的15%~20%。由此可见,葡萄糖是HEC-AHG代谢过程中的中间产物,生成葡萄糖的反应速度较快,而葡萄糖进一步转化的速率较慢。HEC-AHG主要成分羟乙基纤维素属于纤维素类,纤维素酶可作用于HEC链末端,释放葡萄糖或纤维二糖,葡萄糖可能会进一步转化。
ORC-AHG在纤维素酶的催化作用下缓慢降解,在其降解曲线上,未发现葡萄糖的二级降解反应,如图5B所示。该降解反应初期葡萄糖生成速率为(3.57×10-4)mg/(ml·min),后期为(4.54×10-6)mg/ (ml·min)。ORC-AHG降解速率明显低于HECAHG。有研究表明,ORC-Na在体内的降解与血液弱碱性pH值有关[12]。ORC中C2和C3氧化形成羰基,由于烯醇化作用形成醇式结构,使附近的葡糖苷发生β-消除,然后在巨噬细胞和水解酶的作用下,低聚糖进一步降解,经新陈代谢转化为葡萄糖和葡萄糖醛酸的钠盐。由于正常生物体内缺乏纤维素酶,HECAHG和ORC-AHG的生物降解尚需进一步研究。
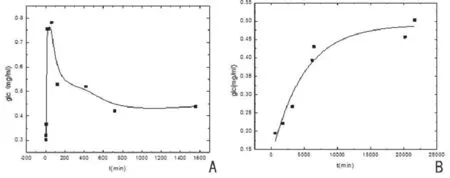
图5 HEC-AHG和ORC-AHG降解反应中产生的葡萄糖含量与时间关系示图
3 结论
HEC-AHG与ORC-AHG具有类似的纤维素结构,但在理化性质中存在较大差异。HEC-AHG与ORC-AHG比较而言,具有更好的溶解度和溶解速率,溶解后具有一定的粘度,有利于伤口的粘合,而且在止血后不用取出,能够生物降解,提高了患者的依从性。此外,HEC-AHG的pH值接近中性,不发生电离,以中性分子形式存在,临床使用中HEC-AHG对伤口的刺激性小,不会产生神经刺激,具有更广阔的应用前景。
参考文献
[1]张少峰,洪加源.医用生物可吸收止血材料的研究现状与临床应用[J].中国组织工程研究,2012,16(21):3941-3944.
[2]Alkan A,Inal S,Yildirim M,et al.The Effects of Hemostatic Agentson Peripheral Nerve Function:An Experimental Study[J].J Oral Maxillofac Surg,2007,65(4):630-634.
[3]于美丽,杜智.可吸收止血材料的研究现状及临床应用[J].北京生物医学工程,2008,27(2):208-213.
[4]Yadong Wu,Jinmei He,Weilu Cheng,et al. Oxidized regenerated cellulose-based hemostat with microscopicallygradient structure[J]. Carbohydr Polym,2012,88(3):1023-1032.
[5]彭承宏.肝切除术中肝脏创面保护和再生氧化纤维素应用[J].中国实用外科杂志,2014,34(8):780-782.
[6]王春,董思远,谷天祥,等.骨蜡与再生氧化纤维素材料在老年女性心内直视术胸骨止血中的应用[J].中国组织工程研究与临床康复,2011,15(21):3905-3908.
[7]周维.可吸收止血材料安全性评价的技术要求[J].中国药理学与毒理学杂志,2013,27(3):532-533.
[8]Pampu AA,Yildirim M,Tüzüner T,et al. Comparison of the effects of new folkloric hemostatic agent on peripheral nervefunction:an electrophysiologicstudy inrats[J].Oral surg Oral Med Oral Pathol Oral Radiol,2013,115(4):e1-6.
[9]赵明,邵自强,敖玲玲.羟乙基纤维素的性能、应用与市场现状[J].纤维素科学与技术,2013,21(2):70-79.
[10]张光杰,王大林,刘明孙,等.药用辅料应用技术[M].北京:中国医药科技出版社,1991:325.
[11]郑颖,郑明义,吴迁,等.羟乙基可溶性止血纱布的止血性能及安全性实验研究[J].西南国防医药,2009(1):13-15.
[12]Muench TR,Kong W,Harmon AM.The performance of a hemostatic agent based on oxidized regenerated cellulose–polyglactin 910 composite in a liver defect model in immunocompetent and athymic rats[J].Biomaterials, 2010,31(13):3649-3656.
Research on physical and chemical properties of hydroxyethyl cellulose hemostatic gauze compared to oxidized regenerated cellulose hemostatic gauze/LIU Bai-lu, SHI Qing, LIN Shaohui, et al// China Medical Equipment,2016,13(1):114-118.
[Abstract]Objective: To compare the physical and chemical properties of Hydroxyethyl celluloseabsorbable hemostatic gauze (HEC-AHG) and oxidized regenerated celluloseabsorbable hemostatic gauze (ORC-AHG) and provide support for clinical application. Methods: To test the solubility, dissolution rate, pH, conductivity and the degradation kinetics under cellulase enzyme. Results: The study shows that the solubility and dissolution rate of HEC-AHG(12%~15%, 6.5~7.2 mg·ml-1·min-1) are higher than that of ORC-AHG(0.08%~0.1%, 4×10-5~64×10-5mg·ml-1·min-1). The pH value of HEC-AHG is 6~7, and the conductivity of HEC-AHG is close to pure water (14 μS/cm). While ORC-AHG has the pH value of 2~3 and has higher conductivity (250~450 μS/cm). In the room temperature, the degradation rate of HEC-AHG is higher than that of ORC-AHG decomposed by cellulase enzyme. Conclusion: Compared to ORC-AHG., HEC-AHG has better solubility, dissolution rate, pH and degradation that indicated HEC-AHG’s potential hemostatic materials.
[Key words]Hydroxyethyl celluloseabsorbable; Oxidized regenerated celluloseabsorbable; Dissolubility; pH value; Conductivity; Degradation rate
收稿日期:2015-07-02
DOI:10.3969/J.ISSN.1672-8270.2016.01.036
[文章编号]1672-8270(2016)01-0114-05
[中图分类号]R318.08
[文献标识码]A
作者简介
刘白璐,女,(1992- ),硕士研究生。北京大学药学院药剂学系,研究方向:新型药物载体。
