一株产生物表面活性剂耐盐碱菌株的分离及鉴定*
2016-03-13范延辉姚志刚
王 君 范延辉 姚志刚
(滨州学院生命科学系,山东省黄河三角洲野生植物资源开发利用工程技术研究中心,山东 滨州 256603)
生物表面活性剂是微生物或植物在一定条件下培养时,在其代谢过程中分泌出的具有一定表面活性的代谢产物,其种类繁多,包括糖脂、磷脂、脂肪酸、脂肽或中性类脂衍生物等[1-2]。相比化学表面活性剂,生物表面活性剂除了具有降低界面张力和表面张力外,还具有无毒、易降解、用量少及生物兼容性等特点[3],故其在石油工业的生物降黏、提高原油采收率、修复石油污染土壤等方面得到广泛应用。此外,还应用于医药、化妆品生产、造纸、重金属去除等诸多领域[4]。
近年来,随着石油与天然气资源的开发利用,石油泄露与污染事件时有发生,生物修复是一种有效的手段。大多数石油降解微生物具有产生物表面活性剂的特点,这在石油工业具有非常重要的应用。生物表面活性剂的两亲结构可促使烃类污染物乳化、分散,从而加大微生物与石油污染物的接触面,促进污染物降解[5]。
本研究从石油污染土壤中分离获得了一株产生物表面活性剂的菌株BG,经鉴定为芽孢杆菌属(Bacillussp.),研究了其产生物表面活性剂的最适温度、pH和盐度,并对其活性成分进行了提取和初步鉴定,该菌株在黄河三角洲石油污染盐渍土壤的生物治理方面有应用前景。
1 材料与方法
1.1 培养基
富集培养基:酵母膏0.1 g,葡萄糖2 g,柴油10 mL,NH4NO33 g,KH2PO40.5 g,水1 000 mL。发酵培养基:葡萄糖5 g,酵母粉1 g,蛋白胨2 g,pH=7,水1 000 mL。
1.2 菌种分离
取0.5 g石油污染盐渍土土样接种于100 mL富集培养基中,37 ℃振荡培养7 d。将富集液进行梯度稀释,涂布发酵培养基固体平板,37 ℃培养2 d,得到单菌落。取初筛后的菌株在发酵培养基中37 ℃过夜培养,使其进入对数生长期。以1%(体积分数)接种量接种于发酵培养集中,37 ℃、180 r/min下培养48 h,对发酵液表面张力变化情况进行测定[6]。
1.3 菌种鉴定
生理生化特征分析参见文献[7]。16S rRNA序列分析:以菌株基因组DNA为模板,用16S rRNA通用引物(27F:5’-GAG AGT TTG ATC CTG GCT CAG-3’,1541R:5’-AAG GAG GTG ATC CAG CCG CA-3’)扩增得到近全长的16S rRNA。聚合酶链式反应(PCR)产物测序后采用Clustal X2.0对所获得的16S rRNA序列进行比对分析,得到序列之间的相似值;用MEGA 4.1计算出序列的系统进化距离,采用邻位相连法构建系统进化树。
1.4 菌株产生物表面活性剂的特性研究
1.4.1 表面张力和生长值测定
将菌株在发酵培养基中37 ℃、180 r/min下振荡培养48 h后,使用全自动表面张力仪铂金环法测定发酵液的表面张力。以7 d为周期,每隔12 h取发酵液测定表面张力;0~36 h每2 h测定发酵液在630 nm下的吸光度(OD630),36 h后每12 h测定OD630,以表征菌株生长值。
1.4.2 菌株产生物表面活性剂最适温度测定
将菌株接种至发酵培养基中培养,分别在27、32、37、42、47 ℃下,180 r/min振荡培养48 h,测定不同发酵液的表面张力和OD630。
1.4.3 菌株产生物表面活性剂的耐碱特性
发酵培养基其他成分不变,调节pH分别为7、8、9、10、11、12、13,将菌株接种至不同pH的发酵培养基中,37 ℃、180 r/min下振荡培养48 h,测定发酵液的表面张力和OD630。
1.4.4 菌株产生物表面活性剂的耐盐特性
发酵培养基其他成分不变,按照0、1%、2%、3%、4%、5%、6%、7%、8%、9%的质量分数添加NaCl,将菌株接种至不同盐度的发酵培养基中,37 ℃、180 r/min下振荡培养48 h,测定发酵液的表面张力和OD630。
1.5 生物表面活性剂分离
采用酸沉法提取发酵液中的生物表面活性剂[8],具体方法是:将菌株接种于发酵培养基中,37 ℃、180 r/min振荡培养48 h,将发酵液在4 ℃条件下,8 000 r/min离心10 min,弃菌体。收集上清液后测定表面张力,然后用1 mol/L HCl将上清液的pH调至2,4 ℃静置过夜后,8 000 r/min下离心10 min,分离沉淀和上清液,将沉淀重溶于去离子水,测定表面张力,获得生物表面活性剂。
1.6 生物表面活性剂的定性定量分析
采用硫酸-蒽酮糖显色法进行生物表面活性剂的糖定性分析;采用茚三酮显色法进行生物表面活性剂的蛋白质定性分析;采用钼酸铵-高氯酸法进行生物表面活性剂的脂定性分析。采用二氯甲烷/甲醇法、考马斯亮蓝染色法对其中的脂类和蛋白质组分含量进行分析。
1.7 数据分析
采用GraphPad Prism软件对数据进行方差分析,并对各指标的相关性进行显著性分析。
2 结果与分析
2.1 高产生物表面活性剂菌种的分离
通过富集培养,从石油污染盐渍土壤中获得4株优势菌,分别命名为菌株BB、BF、BL、BG。对4株菌进行复筛,测得4株菌对发酵液表面张力的降低情况。菌株BB、BL、BF、BG将发酵液的表面张力从对照的51.5 mN/m,分别降低到44.5、48.0、45.2、30.7 mN/m(如图1所示),降低幅度分别为13.6%、6.9%、12.2%、40.5%,差异达显著水平(P<0.05)。菌株BG降表面张力的能力最强,作为后续实验的研究菌种。

图1 发酵液的表面张力Fig.1 Surface tension of the fermentation liquid
2.2 菌株BG的分类鉴定
参照文献[7]对菌株BG进行了初步鉴定,该菌株为革兰氏阳性菌,杆状、有芽孢、无鞭毛;在发酵培养基平板上37 ℃培养24 h,菌落呈圆形、白色、边缘整齐、不透明、表面湿润(见图2)。淀粉酶实验、纤维素降解实验、硝酸盐还原、VP实验均为阳性,甲基红(MR)实验为阴性。将16S rRNA测序获得1 448 bp序列,与GenBank数据库中的序列进行BLAST比对,菌株BG与贝莱斯芽孢杆菌(Bacillusvelezensis)的16S rRNA序列相似性为99%,构建的菌株BG和GenBank中亲缘关系较近菌属的系统发育树如图3所示。经生理生化鉴定和16S rRNA序列分析,可初步判定菌株BG属于芽孢杆菌属。

图2 菌株BG的菌落照片Fig.2 Colonies of strain BG
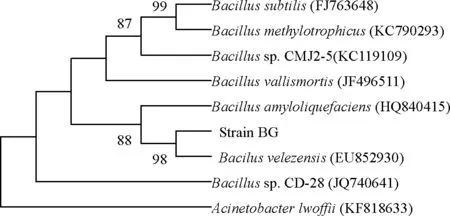
图3 菌株BG和其他相关菌株基于16S rRNA序列的系统发育树Fig.3 Phylogenetic tree based on the 16S rRNA sequence of strain BG and its related strains
2.3 菌株BG产生物表面活性剂的发酵曲线
菌株BG生长与降低表面张力的关系曲线如图4所示。0~24 h,菌株BG在14 h时OD630到达最高点,随时间延长,生长进入衰败期。0~48 h,表面张力随时间延长而降低,由初始的58.4 mN/m降低到48 h时的25.1 mN/m,差异达到显著水平(P<0.05);48~96 h,表面张力随时间延长而增加,最后稳定在37.6 mN/m。可见,发酵48 h,菌株BG发酵效果达到最佳。菌株BG在24 h内生长情况最佳,随时间的延长生物表面活性剂开始积累,48 h可将发酵液的表面张力降至最低。

图4 菌株BG生长与降低表面张力的关系曲线Fig.4 Relation between the growth of strain BG and its ability to reduce the surface tension
2.4 温度对菌株BG降低发酵液表面张力的影响
温度对菌株BG降低发酵液表面张力的影响如图5所示。当温度分别为27、47 ℃时,菌株BG的OD630分别为0.27、0.25,发酵液的表面张力从对照的51.5 mN/m(见图1)分别降至42.1、43.5 mN/m,分别降低了18.2%、15.6%,差异不显著(P>0.05);当温度分别为32、37、42 ℃时,菌株BG的OD630分别为0.32、0.34、0.29,发酵液的表面张力分别比对照(见图1)降低了39.8%、48.3%、30.8%,菌株BG的生长值差异仍不显著(P>0.05),但是表面张力降低值差异达显著水平(P<0.05)。当温度为37 ℃时,菌株BG产生的生物表面活性剂可将发酵液表面张力降低至26.6 mN/m。温度过低,菌株BG菌体生长缓慢,转化底物的效率低;而温度过高,菌体易于老化,不利于生物表面活性剂的合成。

图5 温度对菌株BG降低发酵液表面张力的影响Fig.5 Effect of temperature on reduction of surface tension by strain BG
2.5 菌株BG产生物表面活性剂的耐碱分析
pH对菌株BG降低发酵液表面张力的影响如图6所示。当pH为7~11,菌株BG降低发酵液表面张力之间、菌株生长值之间的差异均不显著(P>0.05);当pH分别为12、13时,菌体生长值之间差异仍不显著(P>0.05)。pH的增加对于生物表面活性剂的产生与表面张力的变化影响较小,可使发酵液表面张力降到26.4 mN/m左右,当pH大于12时表面张力的降低量变小,但是菌株BG降低表面张力的能力仍比对照分别降低了25.8%、18.4%,差异达到显著水平(P<0.05)。可以看出,菌株BG在碱性较高的环境中仍可产生物表面活性剂。

图6 pH对菌株BG降低发酵液表面张力的影响Fig.6 Effect of pH on reduction of surface tension by strain BG
2.6 菌株BG产生物表面活性剂的耐盐分析
NaCl对菌株BG降低发酵液表面张力的影响如图7所示。当NaCl为0~6%时,菌株BG的表面张力降低能力较强,表面张力之间和菌体生长值之间的差异均不显著(P>0.05);当NaCl大于6%时,菌株BG的生物表面活性剂产生能力和生长受到影响,但差异仍不显著(P>0.05)。当NaCl为9%时表面张力仍可降低到33.5 mN/m,可以看出菌株BG具有很强的耐盐产生物表面活性剂的特性。

图7 NaCl对菌株BG降低发酵液表面张力的影响Fig.7 Effect of NaCl on reduction of surface tension by strain BG
2.7 菌株BG产生的生物表面活性剂的提取及分析
从1 L菌株BG的发酵液中提取得到0.127 g棕褐色粉末。将该物质重溶到蒸馏水中,再次测定其表面张力,表面张力平均值为29.5 mN/m。对该物质进行定性分析,结果表明,该物质含有脂类和蛋白质,不含糖类,是一种脂蛋白类物质。定量分析结果表明,脂类和蛋白质质量分数分别为64.7%、35.3%。
3 讨 论
黄河三角洲地区是我国第二大石油基地,拥有丰富的油气资源,然而在石油开采、运输和加工过程中,造成了严重的污染。另外,该地区的土壤以滨海盐土为主,土壤含盐量高,土壤表层盐分为0.4%(质量分数,下同)~3.0%[9]。2009年,国务院已正式批复《黄河三角洲高效生态经济区发展规划》。基于此,黄河三角洲的上升发展成为国家战略,成为国家区域协调发展的重要部分。随着发展的需要,该地区的石油污染与治理问题也将引起更多的关注,而对该地区进行石油污染盐渍土壤的生物修复,需要利用耐盐微生物[10-11]。
石油烃类化合物在土壤中吸附固定,水溶性低是限制其生物修复速率的关键因素。表面活性剂能增大石油烃类物质在水相中的溶解度,提高污染物在土壤中的传质速率和生物可利用性,进而促进其降解[12-13]。生物表面活性剂与化学表面活性剂相比,除具有表面张力低、乳化性能稳定等共同特性外,还具有低毒、易于生物降解、可在原位合成等诸多优点。以特定的方式加入或利用微生物自身所产生的生物表面活性剂促进烃类物质的生物降解,已成为石油污染土壤生物修复的一个重要研究方向[14-15]。
现已报道的产生物表面活性剂耐盐菌主要有芽孢杆菌属、假单胞菌属(Pseudomonassp.)、红球菌属(Rhodococcussp.)等,但这些耐盐菌主要从油田废水和油污海水中分离得到,由于土壤环境较复杂,在高盐环境下修复石油污染土壤的应用潜力很有限。MAKKAR等[16]分离到一株芽孢杆菌,该菌株经96 h培养后,可将发酵液表面张力降至34 mN/m,但是该菌株不具有耐盐碱特性。吴涛等[17]从石油污染盐渍土壤中分离得到一株耐盐的沙雷氏菌,可将发酵液表面张力从56.5 mN/m降低到28.4 mN/m。本研究从黄河三角洲的地域实际出发,自黄河三角洲石油污染盐渍土壤中分离得到一株芽孢杆菌,该菌株培养48 h能将发酵液的表面张力从初始的58.4 mN/m降至25.1 mN/m,并且具有良好的耐盐碱特性,该菌株在实际应用中是否具有作用将会成为下一步工作的重点,下一步实验将把该菌株用于石油污染盐渍土壤的生物修复现场实验,为生物修复提供可靠的理论和实践支持。
4 结 论
(1) 从石油污染盐渍土壤中分离到一株高效产生物表面活性剂的耐盐碱菌株BG,结合菌落形态、生理生化实验和16S rRNA序列分析,确定该菌株为芽孢杆菌属。
(2) 菌株BG在37 ℃、180 r/min下振荡培养48 h,可将发酵液的表面张力由初始的58.4 mN/m降低至25.1 mN/m。
(3) 温度对菌株BG产生物表面活性剂的影响较大,最适温度是37 ℃,此温度下菌株BG有良好的耐盐碱特性,显著降低发酵液表面张力。
(4) 采用酸沉法提取了菌株BG产生的生物表面活性剂,定性分析表明,该物质是一种脂蛋白类物质,其中脂类和蛋白质质量分数分别为64.7%、35.3%。
[1] 刘虹,刘娜,毕白云,等.糖脂类生物表面活性剂去除污染含水层中石油烃的研究[J].环境污染与防治,2015,37(5):6-10.
[2] BENINCASA M,CONTIERO J,MANRESA M A.Rhamnolipid production byPseudomonasaeruginosaLBI growing on soapstock as the sole carbon source[J].Journal of Food Engineering,2002,54(4):283-288.
[3] NITSCHKE M,PASTORE G M.Production and properties of a surfactant obtained fromBacillussubtilisgrown on cassava wastewater[J].Bioresource Technology,2006,97(2):336-341.
[4] CATHERINE N,RAYMOND N M,BEMARD F Y.Heavy metal removal from sediments by biosurfactants[J].Journal of Hazardous Materials,2001,85(1/2):111-125.
[5] CAMEOTRA S S,SINGH P.Bioremediation of oil sludge using crude biosurfactants[J].International Biodeterioration and Biodegradation,2008,62(3):274-280.
[6] BELCHER R W,HUYNK K V,HOANG T V,et al.Isolation of biosurfactant-producing bacteria from the Rancho La Brea Tar Pits[J].World Journal of Microbiology and Biotechnology,2012,28(12):3261-3267.
[7] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8] RICHTER M,WILLEY M,SUESSMUTH R,et al.Streptofactin,a novel biosurfactant with aerial mycelium inducing activity fromStreptomycestendaeTue 901/8c[J].FEMS Microbiology Letters,1998,163(2):165-171.
[9] 徐化凌.黄河三角洲地区耐盐木本植物引进试验研究[D].泰安:山东农业大学,2006.
[10] KLEINSTEUBER S,RIIS V,FETZER I,et al.Population dynamics within a microbial consortium during growth on diesel fuel in saline environments[J].Applied and Environmental Microbiology,2006,72(5):3531-3542.
[11] GESHEVA V,STACKEBRANDT E,VASILEVA TONKOVA E.Biosurfactant production by halotolerantRhodococcusfasciansfrom Casey Station,Wilkes Land,Antarctica[J].Current Microbiology,2010,61(2):112-117.
[12] 司美茹,江翠翠,李桂芝,等.石油污染土壤生物修复菌Z1a-B的分离鉴定与调控效应研究[J].环境污染与防治,2010,32(4):28-33,39.
[13] DE JONGE H,FREIJER J I,VERSTRATEN J M,et al.Relation between bioavailability and fuel oil hydrocarbon composition in contaminated soils[J].Environmental Science and Technology,1997,31(3):771-775.
[14] KUYUKINA M S,IVSHINA I B,MAKAROV S O.Effect of biosurfactants on crude oil desorption and mobilization in a soil system[J].Environment International,2005,31(2):155-161.
[15] MALAVENDA R,RIZZO C,MICHAUD L,et al.Biosurfactant production by Arctic and Antarctic bacteria growing on hydrocarbons[J].Polar Biology,2015,38(10):1565-1574.
[16] MAKKAR R S,CAMEOTRA S S.Production of biosurfactant at mesophilic and thermophilic conditions by a strain ofBacillussubtilis[J].Journal of Industrial Microbiology and Biotechnology,1998,20(1):48-52.
[17] 吴涛,依艳丽,谢文军,等.产生物表面活性剂耐盐菌的筛选鉴定及其对石油污染盐渍化土壤的修复作用[J].环境科学学报,2013,33(12):3359-3367.
