丙烯腈实际废水水热碱催化产有机酸的试验研究*
2016-03-13顾敏燕张亚雷
沈 峥 张 唯 王 科 顾敏燕 缪 佳 张亚雷
(1.同济大学国家设施农业工程技术研究中心,上海 200092;2.同济大学污染控制与资源化研究国家重点实验室,上海 200092;3.浙江工业大学建筑工程学院,浙江 杭州 310014)
随着工业生产的不断发展,工业废水的大量排放导致环境污染日益严重。在各类工业废水中,含氰废水是一类毒性巨大的工业废水,主要产生于电镀、冶金、焦化、化纤等行业。通过工业污染源进入环境的氰化物属剧毒物质,包括以氢氰酸、氰化钠为代表的无机氰化物和以丙烯腈、丁二腈为代表的有机氰化物(或称腈化物)。其中,丙烯腈是典型代表,主要来源于丙烯腈的工业生产、腈纶生产和丙烯腈-丁二烯-苯乙烯(ABS)塑料生产[1-5],是三大合成材料(纤维、橡胶、塑料)生产中所用的一种重要化工原料,在有机合成工业和国民经济生活中具有非常广泛的用途。丙烯腈废水中含有的丙烯腈、乙腈、氢氰酸等物质可抑制呼吸酶的活性,毒害呼吸中枢,具有很强的生物毒性和环境危害性。由于毒性巨大,丙烯腈被列为我国确定的58种优先控制的有毒化学品之一,也是美国环境保护署(EPA)规定的114种优先控制的有毒化学品之一。

然而,需要指出的是,目前常见的水热法仅实现了丙烯腈废水的矿化处理,虽然可以有效降低出水的COD,但难以实现资源的回收利用。通过向水热反应体系中添加碱催化剂,可以有效促进腈化物水解,同时将腈化物水解产生的有机酸转化为有机盐,实现其资源化。本研究以碱作为催化剂,通过水热碱催化,利用丙烯腈实际废水生产有机酸,探讨水热碱催化的影响因素,并确定试验的最佳运行条件,实现丙烯腈实际废水的资源化利用,具有一定的经济和生态效益。
1 材料与方法
1.1 试验用水水质
本试验所用的丙烯腈实际废水取自某石油化工公司,测定得其主要水质指标如表1所示。

表1 丙烯腈实际废水的水质指标
1.2 试验装置与试验流程
配制一定浓度的NaOH溶液(0~3 mol/L),将其用作水热反应的碱催化剂。由于丙烯腈实际废水中含有的丙烯腈、乙腈等物质是重要的化工原料,故在实际生产中常采用精馏法进行预处理,以有效回收废水中的腈化物,达到节约生产成本、降低后续设备处理负荷的目的。已有研究表明,精馏法对腈化物和COD的去除率均可达90%左右[19-20]。因此,本试验中的丙烯腈实际废水在水热碱催化前先使用去离子水稀释10倍,使其中的污染物浓度接近实际出水。
水热碱催化在SUS316不锈钢制成的圆管形间歇式反应器中进行,反应器长120 mm、外径9.5 mm、壁厚1 mm、容积5.7 mL,两端分别用内径为9.5 mm的不锈钢圆管接头密封。反应开始前,将稀释好的丙烯腈实际废水和碱催化剂一次性加入反应器,使其填充率为30%(体积分数),并迅速将反应器密封。将密封好的反应器进行多次晃动使反应器内部物质充分混合,然后将反应器固定在金属支架上,水平浸入事先预热并保持在设定温度的盐浴装置中,并开始计时;同时,水平方向左右晃动进行搅拌,以保持良好的传热和传质。经过设定的反应时间后,迅速将反应器从盐浴装置中取出,放入冷水槽中冷却,并来回晃动以中止反应,整个试验装置示意图如图1所示。当反应器完全冷却后,打开反应器,取液相产物经过SCAA-114水相针式滤器(直径13 mm、孔径0.22 μm)过滤,过滤所得液体用2 mol/L的稀盐酸酸化后装入样品瓶中待分析。
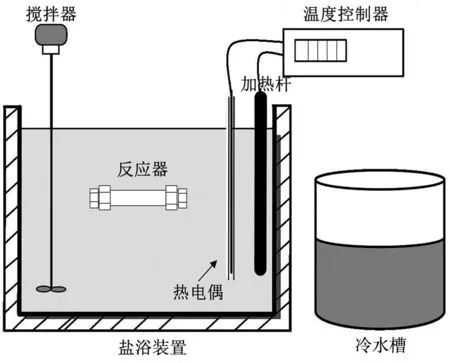
图1 试验装置示意图Fig.1 Schematic diagram of the experimental installation
1.3 分析项目与分析方法
丙烯腈实际废水的组分采用Finnigan Voyager-EI 70eV气相色谱(GC)/质谱(MS)联用仪分析,色谱柱为HP-Wax石英毛细管色谱柱(30 m×0.25 mm×0.25 μm),以氦气为载气,流速为1 mL/min。水热碱催化后的液体产物采用Agilent 1200高效液相色谱(HPLC)仪分析,色谱柱采用1根Shodex RSpark KC-G色谱柱(6.0 mm×50.0 mm)与两根Shodex RSpark KC-811色谱柱(8.0 mm×300.0 mm)串联,流动相为2 mmol/L的高氯酸溶液,流速为1 mL/min,采用紫外线(UV)检测器在210 nm波长下分析。试验中涉及的低沸点、易挥发液相产物使用Agilent 7820A GC/氢火焰离子化检测器(FID)分析,选用J & W 125-7332分析柱(30 m×530 μm×1 μm),以氮气为载气,流速为50 mL/min。
2 结果与讨论
2.1 组分分析
丙烯腈实际废水中的有机组分用GC/MS进行分析,所得GC谱图如图2所示。由图2可见,该废水中共有17种有机组分,其中的主要有机组分及质量浓度如表2所示。丙烯腈、乙腈、丁二腈是最主要的3种腈化物,也是丙烯腈实际废水中需要去除或转化的主要物质。
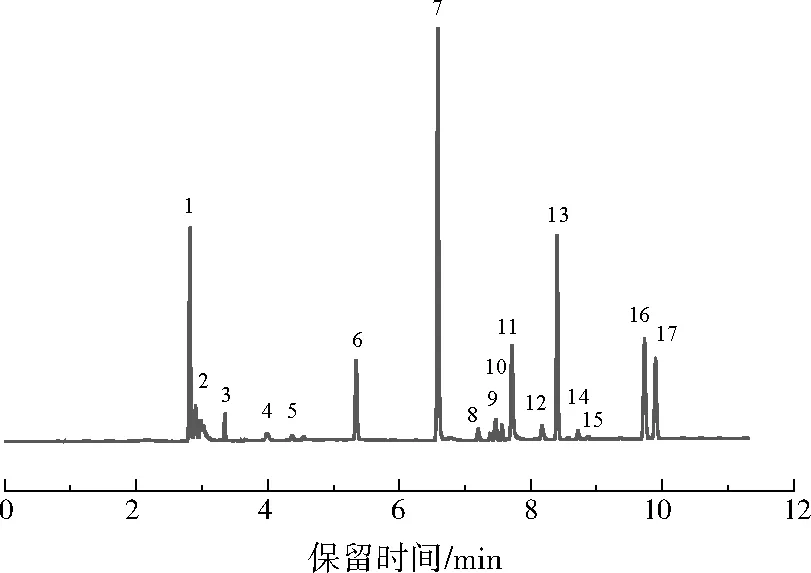
注:1—丙烯腈;2—乙腈;3—2-丁烯腈;4—2-戊烯腈;5—吡嗪;6—乙酸;7—丙烯酸;8—顺-丁烯二腈;9—尼古丁腈;10—2-(2-丁氧基乙氧基)乙醇;11—吡唑;12—2-氨基-3-甲基-2-丁烯腈;13—丙烯酰胺;14—2-乙基咪唑;15—反-丁烯二腈;16—3-咪唑丙腈;17—丁二腈。

图2 丙烯腈实际废水有机组分的GC谱图Fig.2 GC chromatogram of organic compounds in the practical acrylonitrile wastewater
2.2 水热碱催化的条件优化
丙烯腈、乙腈、丁二腈均属有毒物质,其毒性主要来自于分子中的C≡N键。这些物质可在酸或碱的催化作用下发生水解反应,最终转化为有机酸,此反应需要在加热条件下进行。在高温水环境下,酸催化剂对不锈钢反应器具有较强的腐蚀性,相比之下,碱催化剂的腐蚀性较小;此外,碱催化剂不仅能够促进水解,还能与生成的有机酸形成较稳定的有机盐。考虑到NaOH价格低廉,故选用NaOH作为碱催化剂。在水热碱催化过程中,碱初始浓度、反应时间和反应温度是重要的影响因素。在以往研究中发现,水热碱催化在300 ℃下活性最高[21-22]。因此,本试验中丙烯腈实际废水水热碱催化均在300 ℃下进行,在此反应温度下考察了初始碱浓度和反应时间对丙烯腈实际废水水热碱催化的影响。
2.2.1 碱初始浓度的影响
为探究碱初始浓度对丙烯腈实际废水水热碱催化的影响,分别配制0、1、2、3 mol/L的NaOH,反应在300 ℃下进行90 s。反应产物的HPLC谱图如图3所示,GC/FID谱图如图4所示。测定结果显示,随着碱初始浓度的增加,主要反应产物中乙酸和吡唑的峰高不断增加,甲酸和丙烯酸的峰高先增加后减小,其他物质的峰最后几乎全都消失了,这说明丙烯腈实际废水水热碱催化的主要产物为甲酸、乙酸、丙烯酸和吡唑,处理效果很明显。
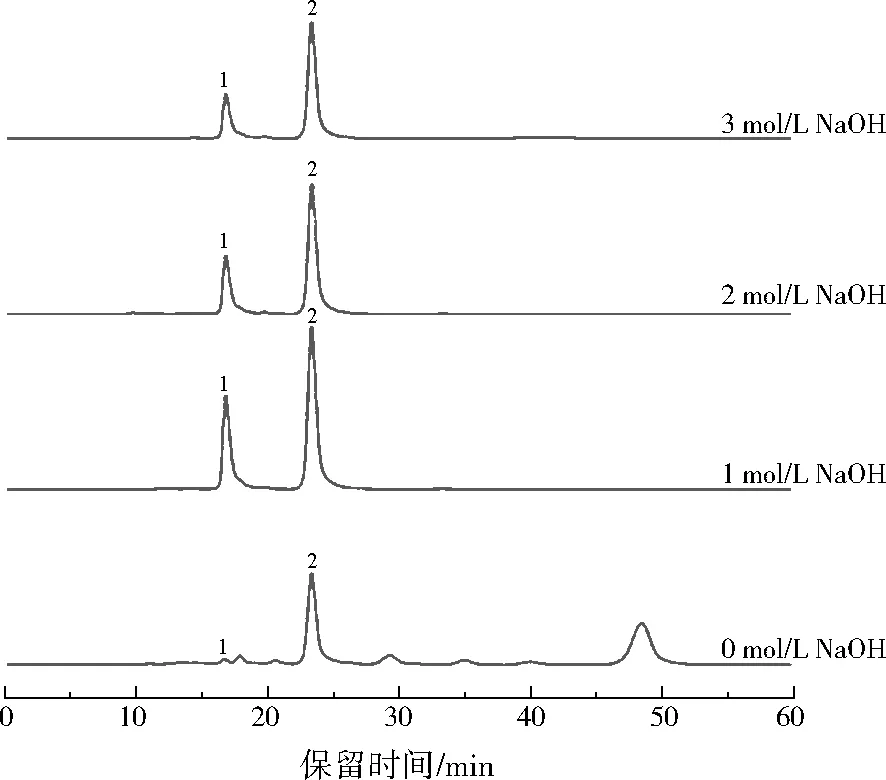
注:1—甲酸;2—丙烯酸。图3 不同碱初始摩尔浓度下产物的HPLC谱图Fig.3 HPLC chromatogram of the products under different alkaline concentrations
不同碱初始摩尔浓度下产物中的有机酸质量浓度如图5所示。从图5可以看出,随着碱初始浓度的增加,产物中丙烯酸和甲酸浓度先增大后减少,乙酸浓度一直增大。当NaOH初始为1 mol/L时,丙烯酸质量浓度最大,为13 300 mg/L,此时乙酸质量浓度为9 400 mg/L,甲酸质量浓度为19 800 mg/L,有机酸总浓度最高。因此,丙烯腈实际废水水热碱催化产有机酸的最佳NaOH初始摩尔浓度为1 mol/L。分析可知,丙烯酸浓度的增加是由丙烯腈实际废水中的丙烯腈、丙烯酰胺经过水热碱催化所得;乙酸浓度的增加主要归因于有机物中相关基团的断裂、水解等一系列化学反应;甲酸浓度先增加后减小,是因为一些有机物经过水热碱催化,转化成了甲酸,但生成的甲酸在高温高压的条件下没有乙酸稳定,容易发生进一步分解。

注:1—乙酸;2—丙烯酸;3—吡唑。图4 不同碱初始摩尔浓度下产物的GC/FID谱图Fig.4 GC/FID chromatogram of the products under different alkaline concentrations

注:已折算为丙烯腈实际废水中的有机酸质量浓度,即为实测质量浓度的10倍,图6同。
图5不同碱初始摩尔浓度下产物中的有机酸质量浓度
Fig.5 Organic acid concentrations in the products under different alkaline concentrations
2.2.2 反应时间的影响
在NaOH初始为1 mol/L和300 ℃下,为考察反应时间对丙烯酸实际废水水热碱催化的影响,在不同反应时间下测定了产物中各种有机酸的质量浓度,结果如图6所示。当反应时间为60 s时,产物中甲酸浓度达到最大值;反应时间为90 s时,丙烯酸浓度达到最大值;乙酸浓度一直呈上升趋势,但反应进行90 s后上升缓慢。计算可得,当反应时间为90 s时,甲酸、乙酸和丙烯酸的质量浓度分别为19 800、9 400、13 300 mg/L,有机酸总质量浓度最大,高达42 500 mg/L。因此,确定丙烯腈实际废水水热碱催化产有机酸的最佳反应时间为90 s。
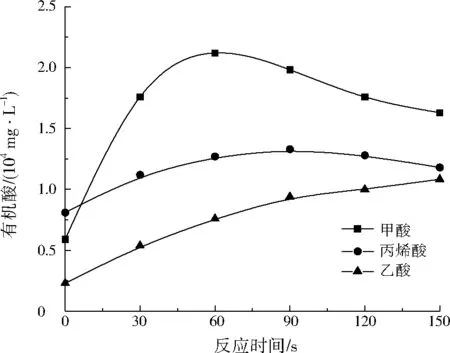
图6 不同反应时间下产物中的有机酸质量浓度Fig.6 Organic acid concentrations in the products under different reaction time
3 结 论
通过水热碱催化可以有效实现丙烯腈实际废水中腈化物的资源化。反应温度、反应时间和碱初始浓度对有机酸浓度均有一定影响,最适反应条件为:反应温度300 ℃、反应时间90 s、NaOH初始摩尔浓度1 mol/L。在此条件下,产物中丙烯酸、乙酸、甲酸分别为13 300、9 400、19 800 mg/L。
[1] WANG C C,LEE C M.Acrylic acid removal by acrylic acid utilizing bacteria from acrylonitrile-butadiene-styrene resin manufactured wastewater treatment system[J].Water Science & Technology,2006,53(6):181-186.
[2] LAI Bo,ZHOU Yuexi,YANG Ping,et al.Comprehensive analysis of the toxic and refractory pollutants in acrylonitrile-butadiene-styrene resin manufacturing wastewater by gas chromatography spectrometry with a mass or flame ionization detector[J].Journal of Chromatography A,2012,1244(12):161-167.
[3] CHANG Jingsong,CHANG C Y,CHEN A C,et al.Long-term operation of submerged membrane bioreactor for the treatment of high strength acrylonitrile-butadiene-styrene (ABS) wastewater:effect of hydraulic retention time[J].Desalination,2006,191(1/2/3):45-51.
[4] LAI Bo,ZHOU Yuexi,QIN Hongke,et al.Pretreatment of wastewater from acrylonitrile-butadiene-styrene (ABS) resin manufacturing by microelectrolysis[J].Chemical Engineering Journal,2012,179(1):1-7.
[5] LAI Bo,ZHOU Yuexi,YANG Ping.Treatment of wastewater from acrylonitrile-butadiene-styrene (ABS) resin manufacturing by Fe0/GAC-ABFB[J].Chemical Engineering Journal,2011,200/201/202(1):474-482.
参考文献:
[6] CHU Yanyang,QIAN Yi,BAI Maojuan.Three advanced oxidation processes for the treatment of the wastewater from acrylonitrile production[J].Water Science & Technology,2009,60(11):2991-2998.
[7] CARRERA J,BAEZA J,VICENT T,et al.Biological nitrogen removal of high-strength ammonium industrial wastewater with two-sludge system[J].Water Research,2003,37(17):4211-4221.
[8] WU Jinling,WANG Jianlong,LIU Haiyang,et al.Removal of cyanide from acrylonitrile wastewater using gas membrane[J].Water Science & Technology,2011,64(11):2274-2281.
[9] HAN Binbing,SHEN Zhisong,WICKRAMASINGHE S R.Cyanide removal from industrial wastewaters using gas membranes[J].Journal of Membrane Science,2005,257(1/2):171-181.
[10] LI Tinggang,LIU Junxun,BAI Renbi,et al.Membrane-aerated biofilm reactor for the treatment of acetonitrile wastewater[J].Environmental Science & Technology,2008,42(6):2099-2104.
[11] DEIBER G,FOUSSARD J N,DEBELLEFONRAINE H.Removal of nitrogenous compounds by catalytic wet air oxidation. Kinetic study[J].Environmental Pollution,1997,96(3):311-319.
[12] PAULA O,ADRIANA L,MARIO D.Kinetics and pathways of cyanide degradation at high temperatures and pressures[J].Environmental Science & Technology,2013,47(3):1542-1549.
[13] LUCK F.Wet air oxidation:past,present and future[J].Catalysis Today,1999,53(1):81-91.
[14] 芮玉兰,孙晓然,梁英华,等.丙烯腈生产废水的催化湿式氧化[J].环境科学与技术,2006,29(8):99-100.
[15] BRUNNER G.Near critical and supercritical water. Part Ⅰ. Hydrolytic and hydrothermal processes[J].Journal of Supercritical Fluids,2009,47(3):373-381.
[16] BRUNNER G.Near and supercritical water. Part Ⅱ: oxidative processes[J].Journal of Supercritical Fluids,2009,47(3):382-390.
[17] SHIN Y H,SHIN N C,VERIANSYAH B,et al.Supercritical water oxidation of wastewater from acrylonitrile manufacturing plant[J].Journal of Hazardous Materials,2009,163(2/3):1142-1147.
[18] SHIN Y H,LEE H S,LEE Y H,et al.Synergetic effect of copper-plating wastewater as a catalyst for the destruction of acrylonitrile wastewater in supercritical water oxidation[J].Journal of Hazardous Materials,2009,167(1/2/3):824-829.
[19] 闫光绪,张金辉,杨小梅.精馏法处理高浓度有机氰废水技术研究[J].当代化工,2001,30(4):199-201.
[20] 王毅,倪桂才,康守方,等.高浓度有机氰废液处理技术研究[J].抚顺石油学院学报,2001,21(3):25-27.
[21] SHEN Zheng,GU Minyan,ZHANG Min,et al.The mechanism for production of abiogenic formate from CO2and lactate from glycerine: uncatalyzed transfer hydrogenation of CO2with glycerine under alkaline hydrothermal conditions[J].Royal Society of Chemistry Advances,2014,29(4):15256-15263.
[22] ZHANG Yalei,SHEN Zheng,ZHOU Xuefei,et al.Solvent isotope effect and mechanism for the production of hydrogen and lactic acid from glycerol under hydrothermal alkaline conditions[J].Green Chemistry,2012,14(12):3285-3288.
