Mg-Fe-Al复合氧化物的制备及其对刚果红吸附性能的研究
2016-03-13王雲生陈元涛胡春联青海师范大学化学系青海西宁810008
王雲生 陈元涛 张 炜 王 建 胡春联(青海师范大学化学系,青海 西宁 810008)
刚果红是典型的联苯胺偶氮阴离子型染料,被广泛应用于棉、麻、黏胶等天然纤维素纤维的染色,以及蚕丝、锦纶、黏胶纤维和毛发纤维混纺织物、黏胶纤维和锦纶混纺织物等的染色,是印染废水中典型的污染物之一[1-2]。刚果红在偶氮还原作用下易产生难降解一级致癌物——4,4’-二氨基联苯(联苯胺)[3]。因此,有效去除水中的刚果红非常必要。
由于刚果红染料废水COD高,因此传统的好氧生物处理法不仅成本高,而且处理效果差[4],吸附法处理刚果红废水具有高效、节能、简便等优点。目前,常用的吸附剂有活性炭纤维、纤维素、蒙脱土、活性氧化铝、钢渣等[5-7],但这些吸附剂制备困难、吸附容量低。而吸附容量较高的活性炭-二氧化钛、锆氧化物、Fe-Al-Ce复合氧化物等[8-10]成本较高,且制备条件复杂,难以得到广泛应用。
Mg-Fe-Al复合氧化物克服了成本及吸附容量方面的不足,与多元铝基复合氧化物有相似的结构特征,具有高密度位错缠结的特殊结构,疏松无定型,孔径和比表面积大,有利于进行离子交换[11],但将其应用于治理染料废水的报道还不多。本研究通过共沉淀法制备了Mg-Fe-Al复合氧化物,并将其运用于刚果红模拟染料废水的吸附,考察吸附剂制备的影响因素,从吸附动力学和热力学角度探讨了Mg-Fe-Al复合氧化物对刚果红的吸附机制,希望能为Mg-Fe-Al复合氧化物在染料废水处理方面的应用提供借鉴。
1 实验部分
1.1 Mg-Fe-Al复合氧化物的制备
按3种金属离子的总物质的量为0.02 mol称取Mg(NO3)2·6H2O、Fe(NO3)3·9H2O、Al(NO3)3·9H2O于烧杯中用蒸馏水溶解,Mg∶Fe∶Al(摩尔比)按实验设计进行调整,记为待用液A。按正好能使Mg、Fe、Al完全转化成氢氧化物的化学计量比称取一定量的氢氧化钠并用蒸馏水溶解,记为待用液B。在20 ℃条件下磁力搅拌,将待用液A滴加进待用液B中。滴加完毕,继续搅拌30 min后调节混合液pH得到共沉淀物。用蒸馏水洗涤共沉淀物至中性后再用乙醇洗涤3次,最后于60 ℃下干燥12 h,高温煅烧得到Mg-Fe-Al复合氧化物。
1.2 吸附实验
取40 mL、200 mg/L的刚果红模拟染料废水加入锥形瓶中,取20 mg吸附剂,在温度为20 ℃、振荡频率为180 r/min的条件下于摇床中振荡吸附至平衡。吸附完成后离心分离,使用TU-1901紫外—可见分光光度计测定刚果红浓度。根据式(1)计算吸附剂对刚果红的吸附量。探究了Mg∶Fe∶Al、pH、煅烧温度对刚果红吸附性能的影响。
(1)
式中:qt为t时刻Mg-Fe-Al复合氧化物对刚果红的吸附量,mg/g;c0、ct分别为刚果红初始质量浓度和t时刻质量浓度,mg/L;V为刚果红模拟染料废水的体积,L;m为Mg-Fe-Al复合氧化物的质量,g。
1.3 表征手段
采用Hitachi S-4800型扫描电子显微镜(SEM)得到SEM图像。
采用 TENSOR 27型傅里叶变换红外光谱仪(FTIR)分析红外光谱,波数为500~4 000 cm-1。
采用Rigaku D/Max 2500型X射线衍射仪(XRD)分析Mg-Fe-Al复合氧化物的物相,Cu靶,Kα射线源,波长为 1.541 Å,操作电压为40 kV,电流为200 mA,扫描范围为10°~80°,扫描速度为0.1°/s。
2 结果与讨论
2.1 Mg-Fe-Al复合氧化物的制备条件
2.1.1 Mg∶Fe∶Al的影响
Mg∶Fe∶Al分别取1∶1∶1、2∶1∶1、1∶2∶1、1∶1∶2、2∶2∶1、2∶1∶2、1∶2∶2,在pH=11条件下共沉淀,400 ℃下放入马弗炉煅烧3 h后制得的Mg-Fe-Al复合氧化物用于吸附实验,结果如图1所示。结果表明,Mg∶Fe∶Al=2∶1∶1时吸附效果最佳。
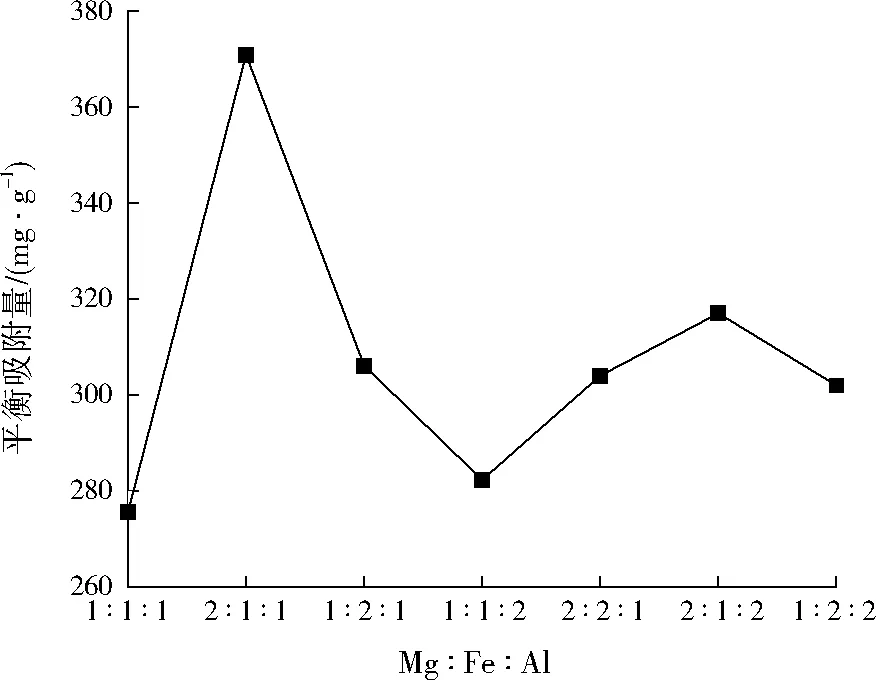
图1 Mg∶Fe∶Al对刚果红吸附的影响Fig.1 Mg∶Fe∶Al on the adsorption of Congo red
2.1.2 pH的影响
取Mg∶Fe∶Al=2∶1∶1,调节pH分别为8、9、10、11、12,得到的共沉淀物在400 ℃条件下煅烧3 h制得Mg-Fe-Al复合氧化物。不同pH条件下合成的Mg-Fe-Al复合氧化物进行吸附实验,结果如图2所示。当pH为8~10时,平衡吸附量较大且随pH的增大而增大,pH=10时平衡吸附量达到最大,之后随pH的增大平衡吸附量明显减小。这是因为Mg2+在pH=9.5~12.5,Al3+在pH=3.3~8.0,Fe3+在pH>2.3条件下能各自形成氢氧化物沉淀[12]29,当pH<10时Mg2+还不能形成沉淀,而当pH>10时Al(OH)3又会大量溶解,所以pH=10时Mg2+、Al3+、Fe3+共沉淀效果最佳。
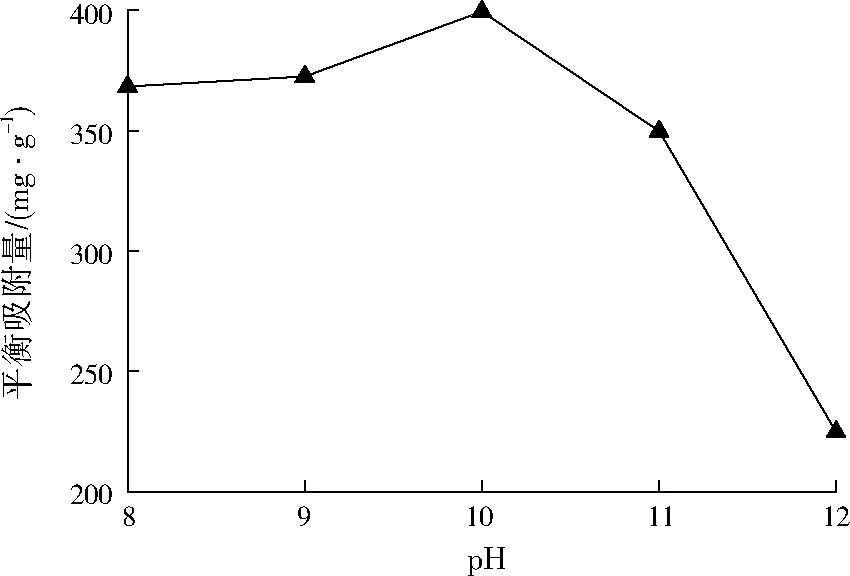
图2 pH对刚果红吸附的影响Fig.2 Effect of pH on the adsorption of Congo red
2.1.3 煅烧温度的影响
在上述优化条件下,分别于100、200、300、400、500、600、700 ℃条件下煅烧3 h得到Mg-Fe-Al复合氧化物,用于对刚果红的吸附实验,结果如图3所示。结果表明,煅烧温度为100~300 ℃时,随着煅烧温度的升高,平衡吸附量逐渐减小,300 ℃时平衡吸附量最小。这可能是因为煅烧温度较低时Mg、Fe、Al主要以层状氢氧化物的形式存在,随着温度升高,层状结构被破坏,层间空隙减少,平衡吸附量降低。
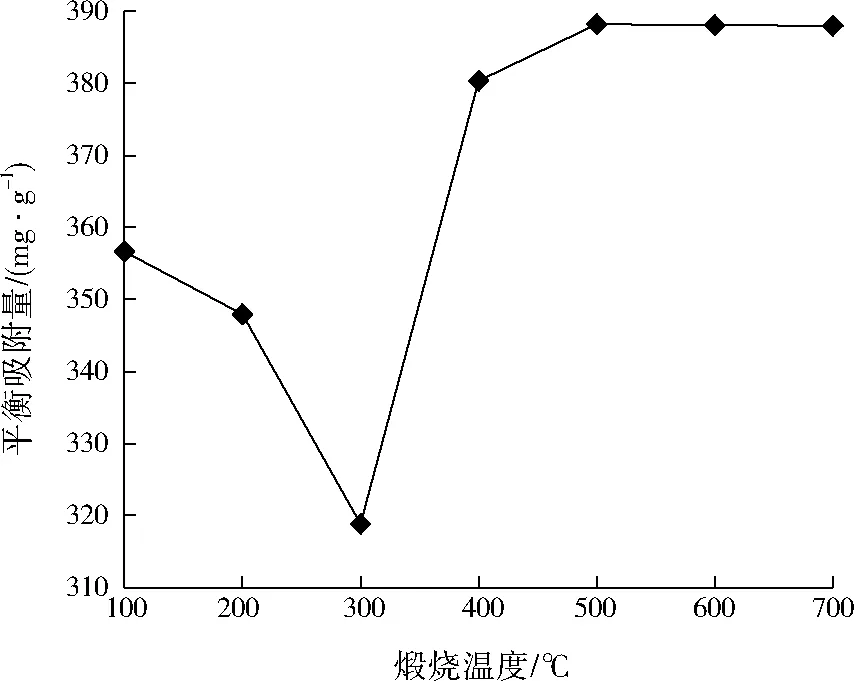
图3 煅烧温度对刚果红吸附的影响Fig.3 Effect of calcination temperature on the adsorption of Congo red
煅烧温度为400~700 ℃时吸附效果相对较好,500 ℃时平衡吸附量最大,表明Mg、Fe、Al的氢氧化物在400 ℃左右转化为金属复合氧化物,各种不同强度的活性中心生成,各活性元素呈高度均匀分散,结构脱羟以及气体的逸出使得材料比表面积增大,吸附效果增强。当煅烧温度超过500 ℃后,平衡吸附量略有降低。因此,选择500 ℃作为最佳煅烧温度。
2.2 Mg-Fe-Al复合氧化物的表征
2.2.1 SEM分析
图4(a)和图4(b)分别为Mg-Fe-Al复合氧化物放大800、35 000倍的微观结构。从图4(a)、图4(b)可以看出,Mg-Fe-Al复合氧化物呈片状结构,表面粗糙,有大量不规则孔隙分布,这些孔隙可能是煅烧时氢氧化物失水形成,空隙的存在大大增加了比表面积。

图4 Mg-Fe-Al复合氧化物的SEM图像Fig.4 SEM images of Mg-Fe-Al composite oxide
2.2.2 FTIR分析
LÜ等[13]发现,Mg-Fe-Al复合氧化物相比于单金属氧化物,M—OH(M表示金属元素)的M—O键会向短波(波数变大)方向蓝移。从图5可以看出,610、1 384 cm-1处有较强的吸收峰,比铁氧化物(458、1 042 cm-1)[14]、铝氧化物(538、904 cm-1)[15]和锰氧化物(525 cm-1)[16]发生了明显的蓝移,表明Mg-Fe-Al复合氧化物已经形成。
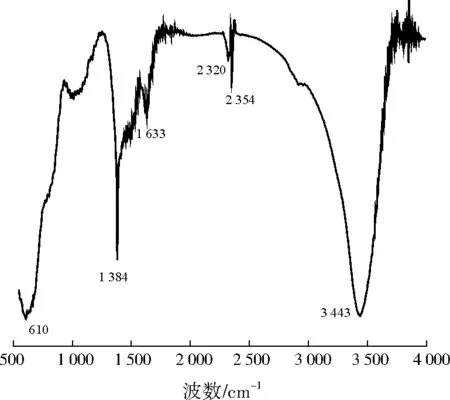
图5 Mg-Fe-Al复合氧化物的FTIR谱图Fig.5 FTIR spectra of Mg-Fe-Al composite oxide
2.2.3 XRD分析
通过图6并对照JCPDS标准图谱可以看出,煅烧前的共沉淀物中2θ=11.4°、34.9°、46.0°、61.3°为Mg2Al(OH)7的特征峰,2θ=23.5°、38.8°为Fe(OH)3的特征峰;煅烧后Mg-Fe-Al复合氧化物中2θ=42.9°、62.3°为MgO的特征峰,2θ=35.6°为Fe2O3的特征峰,2θ=34.7°、42.6°、62.1°处出现了较弱的Al2O3特征峰。因此可以断定,煅烧所得产物主要是无定型的金属复合氧化物,其中Fe2O3和 Al2O3的峰强度较弱说明铁和铝在晶格中分散较好[12]37。由于Mg-Fe-Al复合氧化物相较于共沉淀物会因为Al3+同晶取代Mg2+而拥有永久正电荷,而刚果红为阴离子型染料,因此其在水溶液中更容易与Mg-Fe-Al复合氧化物产生静电吸附作用[17]。
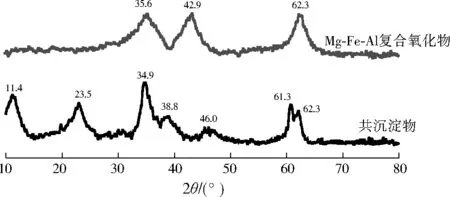
图6 共沉淀物和Mg-Fe-Al复合氧化物的XRD图谱Fig.6 XRD spetras of co-sediment and Mg-Fe-Al composite oxide
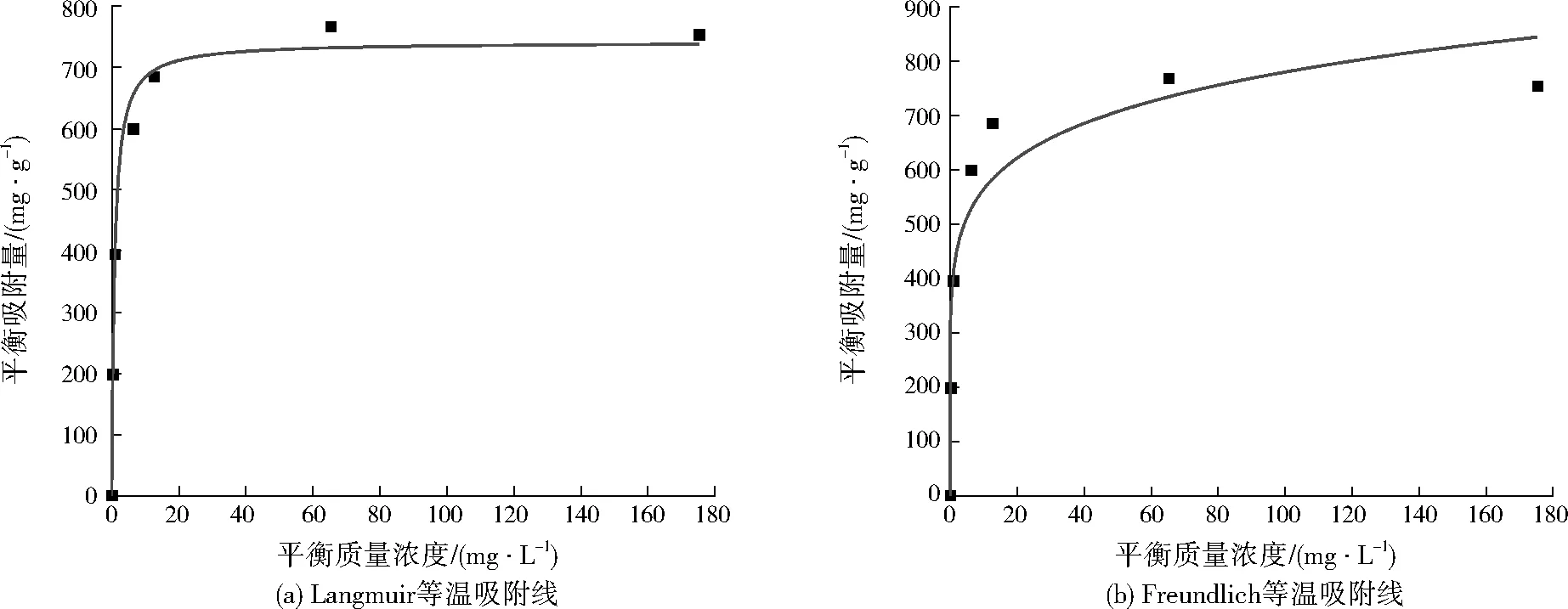
图7 Mg-Fe-Al复合氧化物的等温吸附线Fig.7 Adsorption isotherms of Mg-Fe-Al composite oxide

表1 Langmuir和 Freundlich拟合参数Table 1 Freundlich and Langmuir isotherm parameters
2.3 吸附热力学和动力学
2.3.1 吸附热力学研究
在最优条件下制备的Mg-Fe-Al复合氧化物作为吸附剂。分别向40 mL质量浓度为100、200、350、400、450、550 mg/L的刚果红模拟染料废水中加入20 mg吸附剂,在温度为20 ℃、振荡频率180 r/min的条件下吸附4 h。由图7可看出,Mg-Fe-Al复合氧化物对刚果红的平衡吸附量随刚果红平衡浓度的增加而增大。
吸附剂的吸附热力学过程采用Langmuir和Freundlich等温吸附方程来描述。Langmuir等温吸附方程属于单分子层吸附,表达式为[18]:
(2)
式中:qe为平衡吸附量,mg/g;qm为最大吸附量,mg/g;ce为刚果红平衡质量浓度,mg/L;KL为Langmuir常数,L/mg。
Freundlich等温吸附方程属于多分子层吸附,表达式为[19-20]:
qe=KFce1/n
(3)
式中:KF为Freundlich常数, mg1-1/n·L1/n/g;n为经验常数。
由表1可以看出,Langmuir等温吸附方程拟合的R2=0.995,Freundlich等温吸附方程拟合的R2=0.921,表明Mg-Fe-Al复合氧化物对刚果红的吸附过程更符合Langmuir等温吸附方程,其吸附机制为单分子层吸附[21]。通过Langmuir等温吸附方程得到Mg-Fe-Al复合氧化物的最大吸附量为768.9 mg/g。与文献中已有的吸附剂比较如表2所示,棕榈仁种皮、磁赤铁矿纳米颗粒、Fe3O4/活性炭(AC)纳米复合材料等最大吸附量较低,Mg-Fe-Al复合氧化物和介孔Fe3O4颗粒的最大吸附量较大。虽然Mg-Fe-Al复合氧化物的最大吸附量小于介孔Fe3O4颗粒,但是介孔Fe3O4颗粒制备过程需要氮气保护、水热合成,并且真空干燥时间较长,还需要十六烷基三甲基溴化铵(CTAB)和NaH2PO4分别作为稳定剂和分散剂,制备条件要求较高,过程相对复杂,同时存在微球产率不稳定等问题,Mg-Fe-Al复合氧化物采用共沉淀法制备,操作简单,因此其在刚果红吸附应用中具有明显优势。
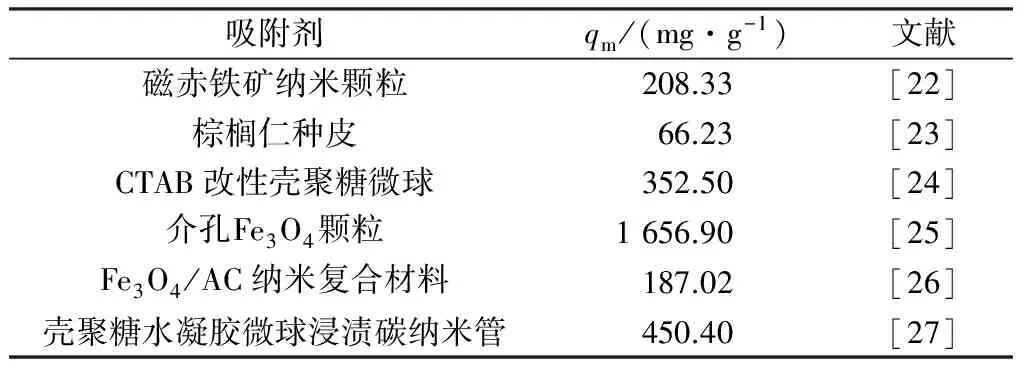
表2 不同吸附剂对刚果红的最大吸附量比较Table 2 Comparison of qm of different adsorbents on Congo red
2.3.2 吸附动力学研究
吸附动力学研究采用准二级速率方程进行拟合,表达式为[28]:
(4)
式中:t为吸附时间,min;k2为准二级速率常数,g/(mg·min)。
在最优条件下制备的Mg-Fe-Al复合氧化物作为吸附剂。刚果红初始质量浓度为400 mg/L,体积为40 mL,吸附剂投加量为20 mg,在温度为20 ℃、振荡频率为180 r/min条件下振荡吸附,每隔一段时间测定刚果红浓度,并计算吸附量。由图8可以看出,在吸附初始阶段,吸附量随时间的延长迅速增加,到t=120 min时,吸附量达到了550.8 mg/g,120 min以后吸附量趋于平衡,因此可以认为Mg-Fe-Al复合氧化物吸附刚果红达到平衡的时间为120 min。对图8中的数据用式(4)进行拟合,R2=0.987,因此Mg-Fe-Al复合氧化物吸附刚果红的动力学过程可以用准二级速率方程来描述。
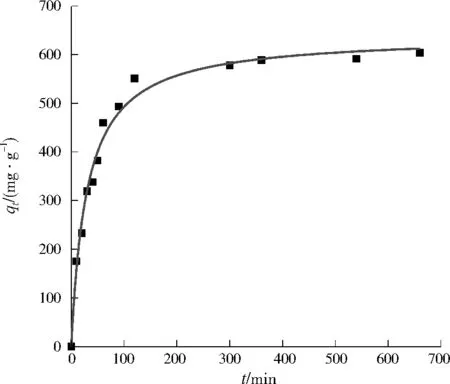
图8 准二级速率方程拟合结果Fig.8 Fitting results of pseudo-second-order reaction kinetic equation
3 结 论
(1) Mg-Fe-Al复合氧化物的最佳制备条件为:Mg∶Fe∶Al=2∶1∶1,pH=10,煅烧温度500 ℃。
(2) 经SEM、FTIR和XRD分析表明,在最佳制备条件下得到的产物确实为Mg-Fe-Al复合氧化物。
(3) Mg-Fe-Al复合氧化物对刚果红的吸附过程符合Langmuir等温吸附方程,为单分子层吸附,最大吸附量为768.9 mg/g。
(4) Mg-Fe-Al复合氧化物对刚果红的吸附动力学符合准二级速率方程,吸附平衡时间在120 min。
[1] 李计元,马玉书,王长平,等.有机海泡石吸附水中刚果红的动力学和热力学研究[J].环境污染与防治,2013,35(3):52-56.
[2] 何平,郎筠.α-MnO2纳米针的合成及其对刚果红的吸附性能[J].应用化工,2013,42(10):1875-1881.
[3] 钟金汤.偶氮染料及其代谢产物的化学结构与毒性关系的回顾与前瞻[J].环境与职业医学,2004,21(1):58-62.
[4] 方涛,徐霞,邓丽娟,等.光电催化氧化法脱色处理刚果红染料废水[J].化工环保,2014,34(6):515-519.
[5] 陈中颖,余刚,蒋展鹏,等.活性炭纤维对染料的吸附性能研究[J].环境污染与防治,2001,23(4):151-154.
[6] 龚正君,周文波,陈钰.活性炭纤维对水中酸性染料的吸附研究[J].工业水处理,2012,32(9):24-28.
[7] 王雯,谢丽,王帅,等.钢渣对阴离子染料刚果红的吸附特性和机理[J].同济大学学报(自然科学版),2010,38(8):1182-1187.
[8] 杨帆,宋小杰,王献彪.MWNTs-TiO2和AC-TiO2复合材料制备及其在染料吸附降解中的应用[J].化工新型材料,2012,40(9):129-131.
[9] DOU Xiaomin,ZHANG Yansu,WANG Hongjie,et al.Performance of granular zirconium-iron oxide in the removal of fluoride from drinking water[J].Water Research,2011,45(12):3571-3578.
[10] ZHAO Bei,ZHANG Yu,DOU Xiaomin,et al.Granulation of Fe-Al-Ce trimetal hydroxide as a fluoride adsorbent using the extrusion method[J].Chemical Engineering Journal,2012,185/186:211-218.
[11] 赵毅,朱洪涛,牛向楠,等.Mg-Al-Fe类水滑石及其焙烧产物对酸性橙Ⅱ脱色性能的实验研究[J].华北电力大学学报,2011,38(1):107-112.
[12] 王艳芹.Mg-Al-Fe类水滑石制备及其对水体中苯酚和对硝基苯酚的吸附性能研究[D].济南:山东大学,2006.
[13] LÜ Jianbo,LIU Huijuan,LIU Ruiping,et al.Adsorptive removal of phosphate by a nanostructured Fe-Al-Mn trimetal oxide adsorbent[J].Powder Technology,2013,233:146-154.
[14] KAHANI S A,JAFARI M.A new method for preparation of magnetite from iron oxyhydroxide or iron oxide and ferrous salt in aqueous solution[J].Journal of Magnetism and Magnetic Materials,2009,321(13):1951-1954.
[15] TROMBETTA M,BUSCA G,WILLEY R J.Characterization of silica-containing aluminum hydroxide and oxide aerogels[J].Journal of Colloid and Interface Science,1997,190(2):416-426.
[16] QIN Qingdong,WANG Qianqian,FU Dafang,et al.An efficient approach for Pb(Ⅱ) and Cd(Ⅱ) removal using manganese dioxide formed in situ[J].Chemical Engineering Journal,2011,172(1):68-74.
[17] MIAO Yue,WANG Ruiyu,CHEN Dan,et al.Electrospun self-standing membrane of hierarchical SiO2@γ-AlOOH (boehmite) core/sheath fibers for water remediation[J].ACS Applied Materials & Interfaces,2012,4(10):5353-5359.
[18] LANGMUIR I.The adsorption of gases on plane surfaces of glass,mica and platinum[J].Journal of the American Chemical Society,1918,40(9):1361-1403.
[19] ARAMI M,LINAEE N Y.Evaluation of the adsorption kinetics and equilibrium for the potential removal of acid dyes[J].Chemical Engineering Journal,2008,139(1):2-10.
[20] TSAI W T,HSIEN K J,YANG J M.Silica adsorbent prepared from spent diatomaceous earth and its application to removal of dye from aqueous solution[J].Journal of Colloid and Interface Science,2004,275(2):428-433.
[21] 李树生,姜绪宝,孔祥正.一步法制备聚脲多孔材料及对染料的吸附[J].高等学校化学学报,2013,34(4):992-999.
[22] WANG Xi,YUAN Fangli,HU Peng,et al.Self-assembled growth of hollow spheres with octahedron-like Co nanocrystals via one-pot solution fabrication[J].Journal of Physical Chemistry C,2008,112(24):8773-8778.
[23] SONG Yujun,MODROW H,HENRY L L,et al.Microfluidic synthesis of cobalt nanoparticles[J].Chemistry of Materials,2006,18(12):2817-2827.
[24] LI Dongdong,THOMPSON R S,BERGMANN G,et al.Template-based synthesis and magnetic properties of cobalt nanotube arrays[J].Advanced Materials,2008,20(23):4575-7578.
[25] IRAM M,GUO Chen,GUAN Yueping,et al.Adsorption and magnetic removal of neutral red dye from aqueous solution using Fe3O4hollow nanospheres[J].Journal of Hazardous Materials,2010,181(1/2/3):1039-1050.
[26] 孙铭君.磁性纳米材料合成及其对有机染料刚果红的吸附性能研究[D].长春:吉林大学,2014.
[27] LIU Shuhua,GAO Haitao,YE Enyi,et al.Graphitically encapsulated cobalt nanocrystal assemblies[J].Chemical Communication,2010,46(26):4749-4751.
[28] 彭宽宽,贾志刚,诸荣孙,等.介孔铁镁复合氧化物对Cr(Ⅵ)的吸附性能[J].盐酸盐学报,2011,39(10):1651-1658.
