甲基咪唑盐酸盐/草酸型低共熔溶剂的制备及其在模拟油中氧化脱硫中的应用
2016-03-13侯良培赵荣祥李秀萍石薇薇
侯良培,赵荣祥,李秀萍,石薇薇
甲基咪唑盐酸盐/草酸型低共熔溶剂的制备及其在模拟油中氧化脱硫中的应用
侯良培1,赵荣祥1,李秀萍2,石薇薇1
(1辽宁石油化工大学化学化工与环境学部石油化工学院,辽宁 抚顺 113001;2辽宁石油化工大学化学化工与环境学部化学与材料科学学院,辽宁 抚顺 113001)
通过简单加热并搅拌甲基咪唑盐酸盐和草酸的混合物合成了甲基咪唑盐酸盐/草酸([HMIM]Cl/H2C2O4)型酸性低共熔溶剂,以[HMIM]Cl/H2C2O4为萃取剂和催化剂、H2O2为氧化剂催化氧化法脱除模拟油中的二苯并噻吩,考察不同的脱硫体系、反应温度、催化剂加入量、氧硫比、模拟油中含硫化合物类型对脱硫率的影响。实验表明,在反应温度为40℃、模拟油量为5 ml、[HMIM]Cl/H2C2O4加入量为1.25 ml、O/S12、反应时间为140 min 的最佳反应条件下二苯并噻吩的脱除率可以达到92.2%。动力学分析表明,该氧化脱硫体系符合一级反应动力学方程。循环使用7次后催化剂的活性没有明显降低。
甲基咪唑盐酸盐;[HMIM]Cl/H2C2O4;催化剂;低共熔溶剂;氧化;反应动力学
引 言
汽车工业的迅速发展在带给人们方便的同时也对环境造成了较大的破坏[1-4],车用燃料燃烧形成的SO会污染环境及损害人体健康[5-8],因此世界各国都制定了严格的法律法规限制燃料油中的含硫量。欧洲于2007年开始推行欧Ⅴ排放标准,即燃料油硫含量低于10 µg·g-1,并出台了EN 228—2008汽油质量标准[9]。2010年,美国开始执行油品硫含量低于15 µg·g-1的标准[10]。中国于2015年开始在京津冀、长三角、珠三角推行国五燃油标准(硫含量<10 µg·g-1)。并计划于2017年1月起全面实施国五标准[11]。随着含硫标准的日趋严格,炼油企业正面临前所未有的压力。目前工业上普遍采用加氢技术对燃料油进行脱硫,该技术较为成熟,但是存在操作条件苛刻、难以脱除噻吩类硫化物、需要消耗大量的H2等弊端[12-15]。为克服加氢技术的不足,氧化脱硫技术、生物脱硫技术、吸附脱硫技术等非加氢技术成为学界研究的热点[16-19],其中氧化脱硫技术由于反应条件温和、对噻吩类硫化物具有较高的脱除率和避免使用氢气、投资小等优点而备受关注。
低共熔溶剂(deep eutectic solvent,DES)是由一定化学计量比的季铵盐和氢键供体(如酰胺、羧酸和多元醇等)组成的低共熔混合物,其特点是通过季铵盐与氢键供体之间形成的相互作用可以获得熔点远低于单一组分的混合物。低共熔溶剂具有蒸气压低、不可燃、易回收、可循环使用等优点,其性能与离子液体相似,因此又称为类离子液体。低共熔溶剂相比常规的离子液体的优势在于合成方法简单,可生物降解,而且合成过程中原子的利用率达到100%。自2003年Abbott等[20]提出低共熔溶剂以来,低共熔溶剂成为近年来研究的热点,在电化学[21-22]、纳米材料制备[23]、分离等[24-25]领域得到较多的应用。近年来,低共熔溶剂在油品萃取脱硫中得到了应用[26-29],然而低共熔溶剂直接用于萃取脱硫脱硫率不高,为提高脱硫效果,合成酸性低共熔溶剂并将其应用到油品的氧化脱硫中是一个可行的方法。Zhu等[30]研究了利用低供熔溶剂光化学氧化脱硫,在30℃、紫外光照射下,以ChCl·2CH3COOH为低供熔溶剂、空气为氧化剂可使模拟油中的二苯并噻吩脱除率达到96.4%。Lü等[31]合成了草酸基低共熔溶剂并将其应用于二苯并噻吩的脱除,在180 min的时间内二苯并噻吩的脱除率可以达到98%。Dai等[32]将甲基苯磺酸和氯化胆碱制备成低共熔溶剂,应用于将硫化物氧化成亚砜。Yin等[33]考察了ChCl/-TsOH、TBAC/-TsOH等低共熔溶剂的脱硫性能,发现无论是对模拟油还是实际柴油其脱硫效率均超过97%。
本工作以甲基咪唑盐酸盐([HMIM]Cl)为氢键受体、以草酸(H2C2O4)为氢键供体合成了一种新的酸性低共熔溶剂[HMIM]Cl/H2C2O4,以[HMIM]Cl/H2C2O4为萃取剂和催化剂、H2O2为氧化剂研究氧化脱除模拟油中的硫化物的性能,考察反应温度O/S比、低共熔溶剂加入量和硫化物类型对脱硫率的影响,并对其进行动力学分析,对反应机理进行探讨。
1 实验部分
1.1 试剂及仪器
-甲基咪唑(98%,浙江凯乐化工厂);草酸(98%, 国药集团化学试剂有限公司);盐酸(36%,国药集团化学试剂有限公司);H2O2(30%,辽宁泉瑞试剂有限公司);四氯化碳(99%,国药集团化学试剂有限公司);正辛烷(98%,国药集团化学试剂有限公司);二苯并噻吩(98%,阿拉丁试剂有限公司);苯并噻吩(97%,阿拉丁试剂有限公司);噻吩(98%,阿拉丁试剂有限公司)。微库仑综合分析仪(WK-2D,江苏江分电分析仪器有限公司);熔点仪(YRT-3型,天津市精拓仪器科技有限公司)。
1.2 低共熔溶剂甲基咪唑盐酸盐/草酸的合成与表征
低共熔溶剂的合成分两步完成(图1),首先甲基咪唑与盐酸反应生成甲基咪唑盐酸盐,然后甲基咪唑盐酸盐与草酸反应合成甲基咪唑盐酸盐/草酸([HMIM]Cl/H2C2O2)。具体过程如下:按相同的摩尔比称量-甲基咪唑和36%盐酸,边搅拌边滴加盐酸于-甲基咪唑中,在60℃下磁力搅拌混合液4.5 h以确保反应彻底完成,最后用旋转蒸发仪将多余的水分蒸出,所得到的黏稠状液体即为甲基咪唑盐酸盐。按摩尔比1:1称取甲基咪唑盐酸盐和草酸于小烧杯中,在100℃下在电热套中加热至完全溶解成液体,即为[HMIM]Cl/H2C2O4型低共熔溶剂。测得草酸、甲基咪唑盐酸盐和[HMIM]Cl/H2C2O4的熔点分别为101℃、75℃和34℃,草酸和甲基咪唑盐酸盐形成低共熔溶剂后由于氢键的存在其熔点大幅降低[34]。
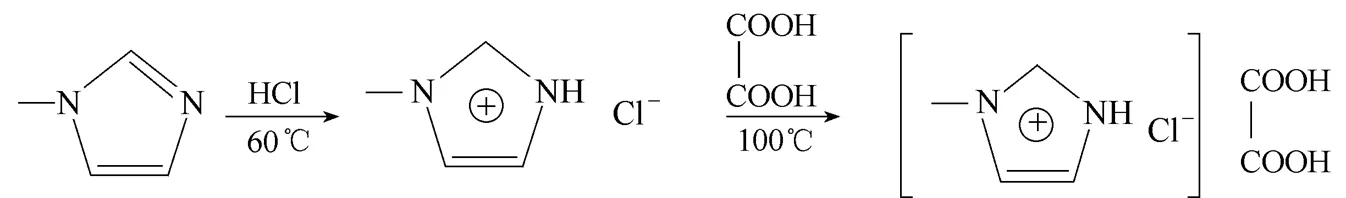
图1 [HMIM]Cl与[HMIM]Cl/H2C2O4的合成
低共熔溶剂[HMIM]Cl/H2C2O2的结构信息由AV-400 型核磁共振仪(CH3OD为溶剂,TMS为内标)和SPECTRUM-400型傅里叶红外光谱仪( KBr压片)表征。
甲基咪唑盐酸盐和甲基咪唑盐酸盐/草酸的氢谱数据如下。[HMIM]Cl的1H NMR(400 MHz,CDCl3):9.44(s,70H),8.75(s,175H),8.20(s,18H),7.38(d,1.4 Hz,246H),7.28(d,11.0 Hz,609H),7.11(s,69H),4.61~4.56(m,43H),4.24(s,23H),4.15(s,18H),4.06(s,224H),3.95(s,13H),3.88(s,8H),3.75(s,567H),3.56(s,8H),3.00~2.83(m,90H),2.44(s,7H),2.34(s,17H),2.17(s,7H),2.08(s,7H),1.99(s,12H),1.57(dd,291.6,40.2 Hz,66H),0.05~(m,384H)。[HMIM]Cl/H2C2O4的1H NMR(400 MHz,CDCl3):13.21(s,7H),8.72(s,7H),7.26(s,2H),7.21(dd,117.2,85.6 Hz,67H),7.07(d,156.7 Hz,51H),6.87(s,49H),6.67~5.54(m,1H),3.80(s,21H),2.48(s,1H),2.06~1.61(m,2H),-0.00(s,2H)。
1.3 氧化脱硫过程
称取1.437 g二苯并噻吩(DBT)、1.047 g苯并噻吩(BT)和0.656g噻吩(TH),分别溶解到500 ml正辛烷中,配成含有DBT、BT、TH的模拟油(500 µg·ml-1)。
分别将5 ml模拟油及适量[HMIM]Cl/H2C2O4和H2O2加到100 ml锥形瓶(带有冷凝装置)中,混合均匀,在一定的温度下搅拌。每隔20 min取少量上层溶液用WK-2D微库伦综合分析仪分析样品中的硫含量,并计算脱硫率。
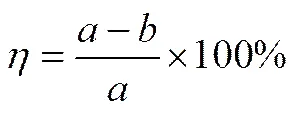
式中,为反应前油品中的硫含量,为反应后油品中的硫含量,为油品中硫化物的脱除率。
2 结果与讨论
2.1 [HMIM]Cl/H2C2O4的红外光谱和氢谱分析
图2为草酸、甲基咪唑盐酸盐和甲基咪唑盐酸盐/草酸的红外谱图。图中1686 cm-1、1437 cm-1、1260 cm-1为草酸的特征吸收峰[35],此外在3430 cm-1处的宽峰为羟基峰;1587 cm-1、1552 cm-1可归属为咪唑环的骨架振动[36],1087 cm-1可归属为咪唑环CH的面内变形振动,3418 cm-1可归属为NH的伸缩振动。从[HMIM]Cl/H2C2O4的红外谱图可以看出,相比于草酸,1686 cm-1的羰基吸收峰偏移到1747 cm-1,而CO峰从1260 cm-1偏移到1197 cm-1,并且在3200~3600 cm-1之间形成了较强的宽峰。上述现象表明[HMIM]Cl和H2C2O4形成了分子间氢键[37],氢键的形成可以大大降低离子液体和草酸的晶格能,使得两者混合物的熔点大大 降低。
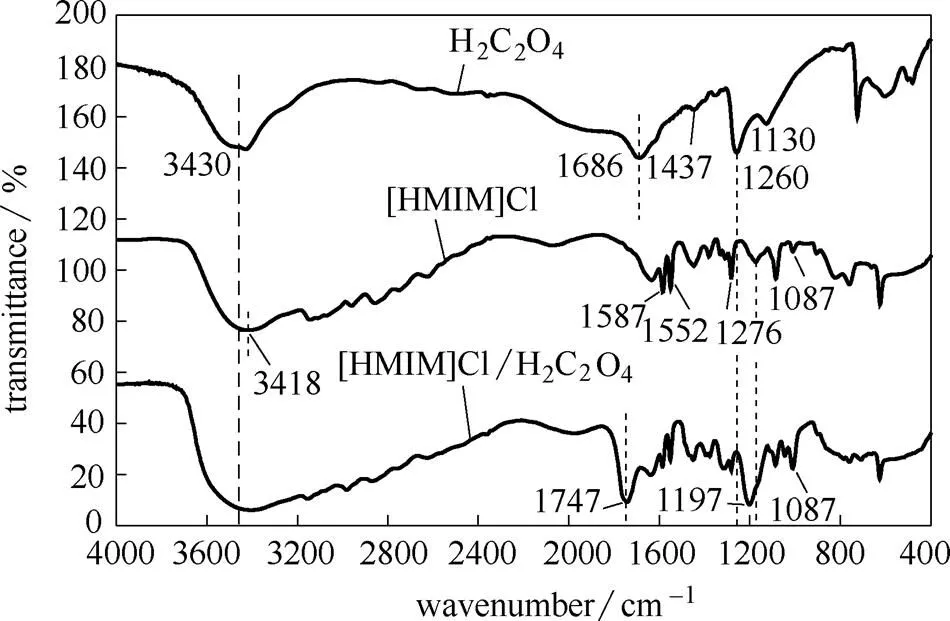
图2 草酸、甲基咪唑盐酸盐和甲基咪唑盐酸盐/草酸的红外图谱
为了进一步研究甲基咪唑盐酸盐和草酸之间的相互作用,对甲基咪唑盐酸盐、草酸及两者形成的低共熔溶剂进行了氢谱分析。图3展示了甲基咪唑盐酸盐、草酸和甲基咪唑盐酸盐/草酸的完整氢谱。中可以看出草酸仅有一个氢峰(4.75),在与甲基咪唑盐酸盐形成低共熔溶剂后在6.87、4.01和3.98附近出现了新的氢峰,而原来[HMIM]Cl图谱上的4.05和H2C2O4图谱上的4.75处的氢峰消失,这表明甲基咪唑盐酸盐和草酸形成了氢键[38]。

图3 [HMIM]Cl, H2C2O4和[HMIM]Cl/H2C2O4的氢谱
2.2 不同脱硫体系对脱硫率的影响
为了考察不同脱硫体系的脱硫效果,设计了两种脱硫体系,对其脱硫效果进行考察,结果见表1。可以看出,当用低共熔溶剂[HMIM]Cl/H2C2O4作为催化剂时体系的脱硫率高达89.8%,而用其配体[HMIM]Cl和草酸作为催化剂时体系的脱硫率仅为22.4%和17.6%。这可能源于由于草酸的引入使催化剂酸性增强,提高了催化剂的活性[39]。所以选择[HMIM]Cl/H2C2O4进行进一步研究。
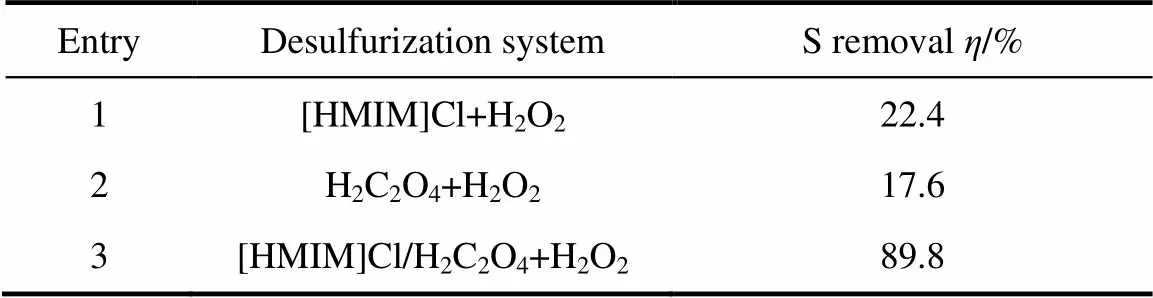
表1 不同脱硫体系对硫化物脱除效果的影响
Note: reaction condition: 5 ml model oil, 40℃, O/S10, 1 ml [HMIM]Cl/H2C2O4, 140 min.
2.3 反应温度对脱硫率的影响
反应温度是影响氧化脱硫体系脱硫效果的重要因素考察。不同温度下[HMIM]Cl/H2C2O4氧化体系的脱硫效果如图4所示。由图可知,当温度从30℃增加到40℃时DBT脱除率由82%增加到89.8%。氧化脱硫反应是吸热反应,提高温度可促进氧化反应的进行[39]。同时升高温度可以使更多的普通分子转化为活性分子,增加了分子间的有效碰撞,从而加快了反应速率。此外,低共熔溶剂是黏稠状液体,升高温度可以降低黏度,提高反应体系的传质速率。继续升高温度,脱硫率下降到83.6%(50℃)和70.6%(60℃)。这是由于较高温度可使H2O2的分解速率加快,降低双氧水的氧化活性[40]。综上所述,40℃是该反应的最佳反应温度。

图4 温度对脱硫率的影响
2.4 不同O/S比对脱硫的影响
作为氧化剂的双氧水的加入量对氧化脱硫效果影响较大。图5显示了不同氧硫比对体系脱硫率的影响。如图所示,当O/S0时,体系中仅存在萃取脱硫,无氧化作用,其脱硫率仅为13.4%。随着O/S比的不断增大,脱硫效果明显提高。当O/S12时,脱硫率为92.2%。继续增加至O/S14,脱硫率开始下降。作为氧化剂的双氧水除了可将硫化物氧化成砜类外,也存在自分解反应[41],因此一般双氧水的加入量要多于理论值(O/S2),但过多加入双氧水会稀释萃取剂[42],影响脱硫效率。这里选择O/S12。

图5 不同O/S比对脱硫率的影响
2.5 [HMIM]Cl/H2C2O4用量对脱硫的影响
[HMIM]Cl/H2C2O4用量对脱硫效果的影响见图6。由图可知,当[HMIM]Cl/H2C2O4用量从0.5 ml增加到1.25 ml时,脱硫率从88%升高到92.2%。继续增加低共熔溶剂的量,脱硫率为91%,略有下降。这与文献[43]的报道一致。在本实验中,低共熔溶剂既是萃取剂又是催化剂,增加其用量既可增强萃取脱硫能力又可增加体系中过氧酸的浓度,但是因为双氧水加入量一定,所以当低共熔溶剂达到一定量时其氧化脱硫能力逐渐达到饱和,脱硫率增加不再明显。因此选择低共熔溶剂加入量为1.25 ml。

图6 [HMIM]Cl/H2C2O4用量对脱硫率的影响
2.6 不同硫化物对脱硫率的影响
实际油品中同时含有多种硫化物,因此有必要考察低共熔溶剂对不同硫化物的脱除情况。分别配制了0.05%(500 ppm)的DBT、BT、TH的模拟油,并对不同硫化物对脱硫效果的影响进行了考察。结果如图7所示。当不加入H2O2即只有萃取脱硫过程时,[HMIM]Cl/H2C2O4对DBT、BT、TH的脱除率仅为16.6%、11.4%、9.2%。而当加入H2O2形成萃取-催化氧化脱硫体系后,[HMIM]Cl/H2C2O4对DBT、BT、TH的脱除率分别达到92.2%、54.8%、24.6%。催化剂对不同硫化物的脱除出现较大差异,这是由于3种硫化物的极性差异(DBT>BT>TH)造成的。由于DBT极性很大,S原子更多地裸漏出来,空间位阻较小,更容易被H2O2氧化成低共熔溶剂过氧物,所以DBT更易被萃取到低共熔溶剂相。此外,氧化脱硫难易程度还与硫化物上S原子的电子云密度大小成正比[44-45],DBT、BT、TH的电子云密度分别为5.758、5.739、5.696,电子云密度越大越容易被脱除,因此,DBT最容易被氧化,BT次之,TH最差。
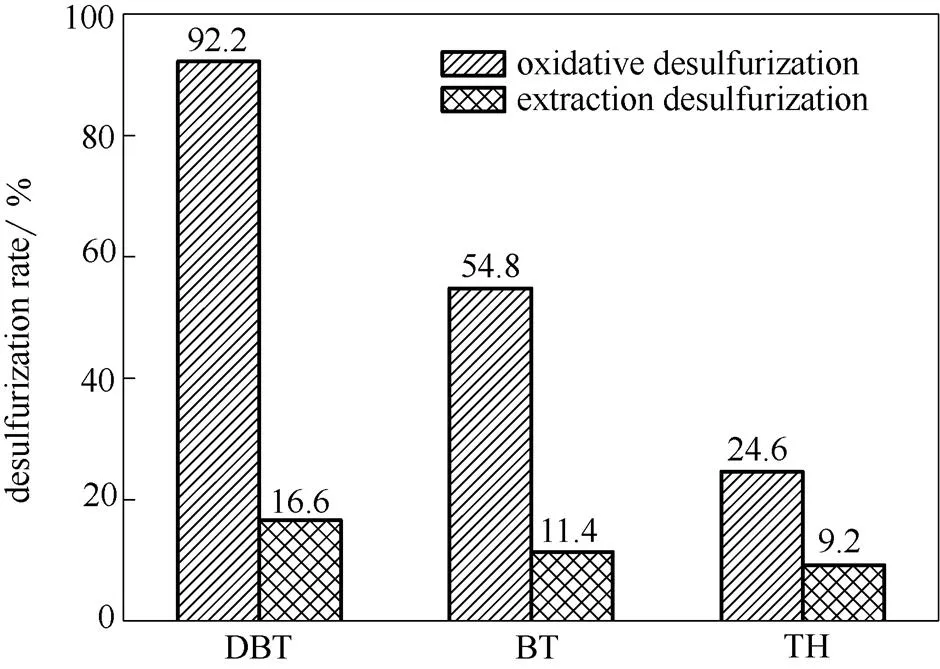
图7 对不同类型硫化物的脱除效果
2.7 不同硫化物脱除的动力学分析
化学反应动力学是研究化学反应速率和反应机理的学科,基本任务是研究各种反应因素对反应速率的影响。研究表明,低共熔溶剂氧化脱硫符合假一级动力学方程,因此可以用一级动力学方程[式(1)]进行模拟[46]
式中,0为初始模拟油浓度;c为时间时模拟油浓度;为反应时间,min;为反应速率常数,min-1。
由图8可知,当用一级动力学方程进行模拟时,DBT、BT、TH的动力学方程参数2分别为0.96885、0.95306、0.95637,所以ln(0/c)-的线性相关性良好。反应速率常数表示化学反应进行的快慢,DBT、BT、TH在反应中所对应分别为0.01857 min-1、0.00377 min-1、0.002 min-1,即DBT>BT>TH,所以根据模拟动力学方程得到的结果是:DBT最容易被氧化脱除,BT次之,TH最差。这与实验结果离子液体对DBT、BT、TH的脱除率92.2%>54.8%>24.6%相符,因此该动力学方程模型成立。

图8 不同硫化物氧化脱硫反应的动力学分析
2.8 催化剂的回收和循环利用
反应结束后,采用倾倒法分离回收低共熔溶剂,然后用等体积的CCl4反复萃取4次,用旋转蒸发仪蒸出低共熔溶剂中残留的CCl4,得到的黏稠状液体即为回收的低供熔溶剂。将回收的低共熔溶剂加入新鲜的H2O2和模拟油,按照最佳反应条件进行氧化脱硫反应,结果如图9所示。可以看出,催化剂循环使用7次后脱硫率降到90.1%,脱硫率略微下降。这可能是因为低共熔溶剂在使用过程中有损耗,而且每次CCl4也不能把低共熔溶剂中的硫化物完全萃取出来,导致硫化物的积累,从而使脱硫率下降[41]。

图9 [HMIM]Cl/H2C2O4的循环次数
2.9 低共熔溶剂催化氧化脱硫机理
有机含氧酸或含氧酸基离子液体是常用的油品脱硫催化剂[47-49],通常这种催化剂均有较高的催化氧化脱硫活性。这是因为其具有较强的酸性,更为重要的是在双氧水等氧化剂作用下含氧酸或含氧酸根被氧化成具有更强活性的过氧化物。在本实验的氧化脱硫体系中低共熔溶剂也可以被双氧水氧化成相应的过氧化态,对于氧化脱硫过程具有重要的意义。并且对反应后产物以及DBT进行红外表征,结果如图10所示,图中在1258 cm-1、1168 cm-1处的吸收峰可归属为砜的特征吸收峰[43,50-51],其他吸收峰都与DBT的吸收峰吻合。因此在本实验中可以确定DBT被氧化成相应的砜或亚砜。综上,推测低共熔溶剂氧化脱硫机理(图11)如下:低共熔溶剂[HMIM]Cl/H2C2O4与二苯并噻吩的相似相溶效应(咪唑和噻吩同为五元环)和π-π共轭效应。

图10 DBT和氧化后产物的红外图谱
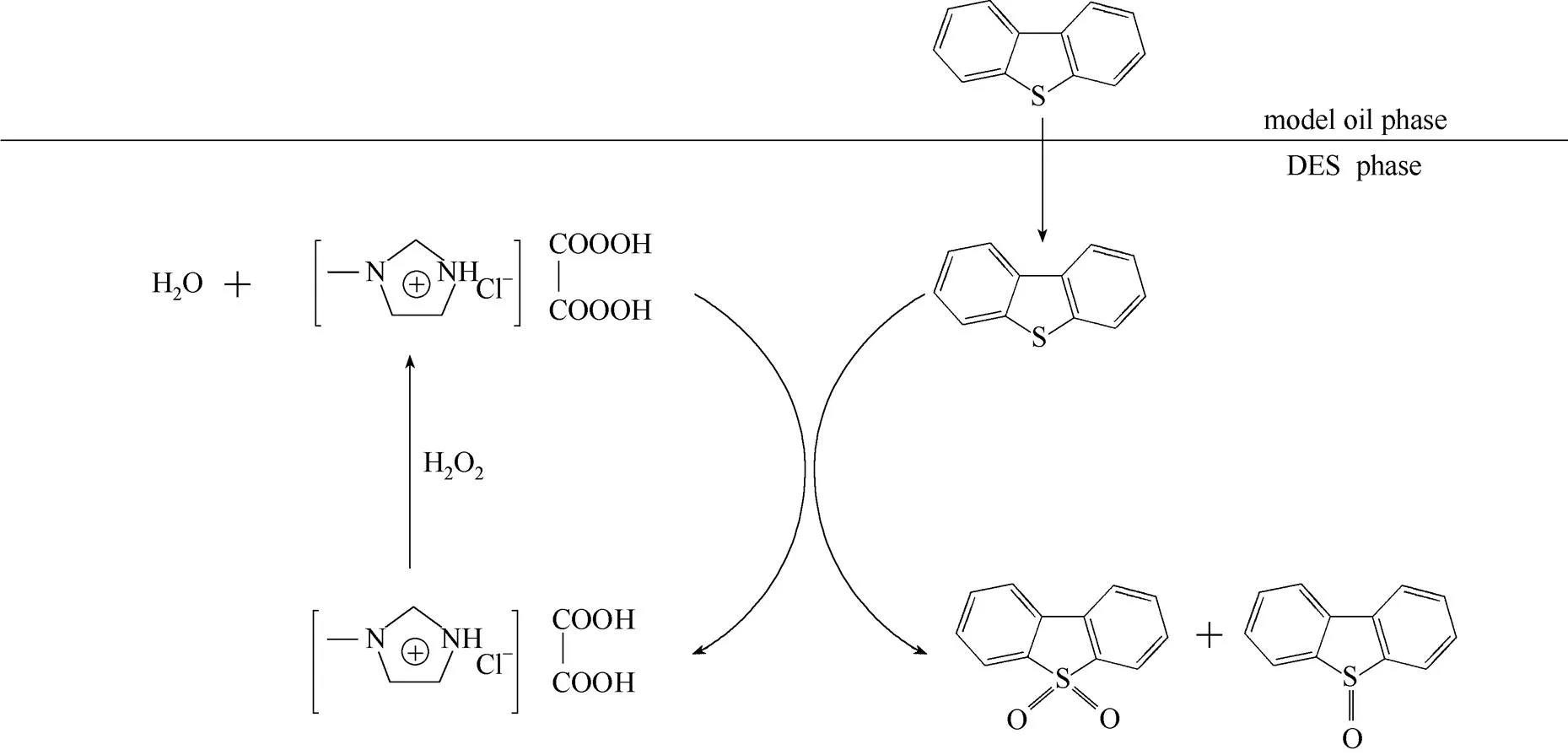
图11 [HMIM]Cl/H2C2O4型低共熔溶剂的脱硫机理
DBT很容易被萃取到低共熔溶剂相中。在双氧水作用下[HMIM]Cl/H2C2O4被氧化成相应的过氧化态,该物质具有远高于[HMIM]Cl/H2C2O4的催化氧化活性,可将DBT氧化成相应的砜和亚砜。由于存在硫化物浓度差异,油相中的DBT被不断萃取到低共熔溶剂相中被氧化。在氧化过程中[HMIM]Cl/H2C2O4的过氧化态由于双氧水的活化而一直保持较高的氧化活性,直到双氧水消耗完全。
3 结 论
分别以甲基咪唑盐酸盐和草酸为氢键的受体和供体合成了酸性低供熔溶剂[HMIM]Cl/H2C2O4。以[HMIM]Cl/H2C2O4作为催化剂和萃取剂、双氧水作为氧化剂进行氧化脱除模拟油中的二苯并噻吩研究。考察了不同类型脱硫体系、氧硫比(O/S)、反应温度、低共熔溶剂加入量等因素对脱硫效果的影响,并对不同硫化物的脱除进行了动力学分析。当模拟油量为5 ml、氧硫比为12、温度为40℃、[HMIM]Cl/H2C2O4量为1.25 ml时,反应140 min,对DBT的脱除率可以达到92.2%。催化剂循环使用7次,活性无明显降低。
References
[1] 张存, 王峰, 潘小玉, 等. 酸性离子液体萃取-氧化模拟油品脱硫研究 [J]. 燃料化学学报, 2011, 39 (9): 689-693.
ZHANG C, WANG F, PAN X Y,. Study on extraction-oxidation desulfurization of model oil by acidic ionic liquid [J]. Journal of Fuel Chemistry and Technology, 2011, 39 (9): 689-693.
[2] DAI B, WU P, ZHU W,. Heterogenization of homogenous oxidative desulfurization reaction on graphene-like boron nitride with a peroxomolybdate ionic liquid [J]. RSC Advances, 2016, 6 (1): 140-147.
[3] 范珍龙, 俞星明, 吕效平, 等. 钨酸盐/H2O2/[HNMP][HSO4]体系的催化氧化脱硫性能 [J]. 南京工业大学学报(自然科学版), 2015, 37 (1): 44-48.
FAN Z L, YU X M, LÜ X P,. Desulfurization by catalytic oxidation with tungstate /H2O2/[HNMP][HSO4] [J]. Journal of Nanjing Technology University (Natural Science Edition), 2015, 37 (1): 44-48.
[4] WANG C, ZHU W, CHEN Z,. Light irradiation induced aerobic oxidative deep desulfurization of fuel in ionic liquid [J]. RSC Advances, 2015, 5 (121): 99927-99934.
[5] ASUMANA C, YU G, LU X,. Extractive desulfurization of fuel oils with low-viscosity dicyanamide-based ionic liquids [J]. Green Chemistry, 2010, 12 (11): 2030-2037.
[6] ABRO R, ABDELTAWAB A A, AL-DEYAB S S,. A review of extractive desulfurization of fuel oils using ionic liquids [J]. RSC Advances, 2014, 4 (67): 35302-35317.
[7] YU F L, LIU C Y, XIE P H,. Oxidative-extractive deep desulfurization of gasoline by functionalized heteropoly acid catalysts [J]. RSC Advances, 2015, 5 (104): 85540-85546.
[8] LU L, CHENG S F, GAO J B,. Deep oxidative desulfurization of fuels catalyzed by ionic liquid in the presence of H2O2[J]. Energy Fuels, 2007, 21: 383-384.
[9] VALIGI M, GAZZOLI D, PETTITI I,. WO/ZrO2catalysts (Ⅰ): Preparation, bulk and surface characterization [J]. Applied Catalysis A: General, 2002, 231 (1): 159-172.
[10] 赵地顺, 孙智敏, 李发堂, 等. 酸性离子液体萃取/催化二苯并噻吩氧化脱硫反应的优化 [J]. 燃料化学学报, 2009, 37 (2):194-198.
ZHAO D S, SUN Z M , LI F T,. Optimization of oxidative desulfrization of dibenzothiophen using acidic ionic liquid as catalytic solvent [J]. Journal of Fuel Chemistry and Technology, 2009, 37 (2): 194-198.
[11] 李佳慧, 胡嘉, 赵荣祥, 等. 氯化胆碱/草酸型低共熔溶剂氧化脱除模拟油硫化物 [J]. 燃料化学学报, 2014, 42 (7): 870-876.
LI J H, HU J, ZHAO R X,. Oxidative desulfurization of model oil with choline chloride/oxalic acid as a eutectic solvent [J]. Journal of Fuel Chemistry and Technology, 2014, 42 (7): 870-876.
[12] LI F, WU B, LIU R,. An inexpensive-methyl-2-pyrrolidone-based ionic liquid as efficient extractant and catalyst for desulfurization of dibenzothiophene [J]. Chemical Engineering Journal, 2015, 274: 192-199.
[13] LI X, LIU L, WANG A,. Creation of oxygen vacancies in MoO3/SiO2by thermal decomposition of pre-impregnated citric acid under N2and their positive role in oxidative desulfurization of dibenzothiophene [J]. Catal. Lett., 2014, 144: 531-537.
[14] YAN X M, MEI Z, MEI P,. Self-assembled HPW/silica-alumina mesoporous nanocomposite as catalysts for oxidative desulfurization of fuel oil [J]. Journal of Porous Materials, 2014, 21 (5): 729-737.
[15] BAKAR W A W A, ALI R, KADIR A A A,. Effect of transition metal oxides catalysts on oxidative desulfurization of model diesel [J]. Fuel Processing Technology, 2012, 101: 78-84.
[16] LIU B S, XU D F, CHU J X,. Deep desulfurization by the adsorption process of fluidized catalytic cracking (FCC) diesel over mesoporous Al-MCM-41 materials [J]. Energy Fuels, 2007, 21 (1): 250-255.
[17] 许本静, 孙新, 田辉平, 等. 负载氧化钼催化剂催化氧化脱硫研究 [J]. 工业催化, 2009, 17 (6): 30-34.
XU B J, SUN X, TIAN H P,. Oxidative desulfurization catalyzed by supported MoO3catalysts [J]. Industrial Catalysis, 2009, 17 (6): 30-34.
[18] 赵地顺, 李发堂, 刘文丽. 催化裂化汽油光化学氧化脱硫 [J]. 石油化工, 2006, 35 (10): 963-966.
ZHAO D S, LI F T, LIU W L. Photochemical oxidative desulfrization of fluidized catalytic cracking gasoline [J]. Petrochemical Technology, 2006, 35 (10): 963-966.
[19] 唐克, 宋丽娟, 段林海, 等. 杂原子Y分子筛的二次合成及其吸附脱硫性能 [J]. 燃料化学学报, 2007, 35 (5): 1116-1120.
TANG K, SONG L J, DUAN L H,. Deep desulfurization by selective adsorption on heteroatom zeolite prepared by secondary synthesis [J]. Journal of Fuel Chemistry and Technology, 2007, 35 (5): 1116-1120.
[20] ABBOTT A P, CAPPER G, DAVIES D L,. Novel solvent properties of choline chloride/urea mixtures [J]. Chem. Commun., 2003, 1: 70-71.
[21] ABBOTT A P, CAPPER G, MCKENZIE K J,. Electrodeposition of zinc-tin alloys from deep eutectic solvents based on choline chloride [J]. Journal of Electroanalytical Chemistry, 2007, 599 (2): 288-294.
[22] ABBOTT A P, CAPPER G, DAVIES D L,. Electrodeposition of chromium black from ionic liquids [J]. Transactions of the Institute of Metal Finishing, 2004, 82: 14-17.
[23] LIU W, YU Y, CAO L,. Synthesis of monoclinic structured BiVO4spindly microtubes in deep eutectic solvent and their application for dye degradation [J]. Journal of Hazardous Materials, 2010, 181 (1): 1102-1108.
[24] ZHANG J, CHEN J, LI Q. Microwave heating synthesis and formation mechanism of chalcopyrite structured CuInS2nanorods in deep eutectic solvent [J]. Materials Research Bulletin, 2015, 63: 88-92.
[25] ABBOTT A P, CAPPER G, DAVIES D L,. Selective extraction of metals from mixed oxide matrixes using choline-based ionic liquids [J]. Inorganic Chemistry, 2005, 44 (19): 6497-6499.
[26] ABBOTT A P, CULLIS P M, GIBSON M J,. Extraction of glycerol from biodiesel into a eutectic based ionic liquid [J]. Green Chemistry, 2007, 9 (8): 868-872.
[27] GANO Z S, MJALLI F S, AL-WAHAIBI T,. Solubility of thiophene and dibenzothiophene in anhydrous FeCl3- and ZnCl2-based deep eutectic solvents [J]. Industrial & Engineering Chemistry Research, 2014, 53 (16): 6815-6823.
[28] GANO Z S, MJALLI F S, AL-WAHAIBI T,. Extractive desulfurization of liquid fuel with FeCl3-based deep eutectic solvents: experimental design and optimization by central-composite design [J]. Chemical Engineering and Processing: Process Intensification, 2015, 93: 10-20.
[29] GANO Z S, MJALLI F S, AL-WAHAIBI T,. The novel application of hydrated metal halide (SnCl2·2H2O)-based deep eutectic solvent for the extractive desulfurization of liquid fuels [J]. International Journal of Chemical Engineering and Applications, 2015, 6 (5): 367-371.
[30] ZHU W, WANG C, LI H,. One-pot extraction combined with metal-free photochemical aerobic oxidative desulfurization in deep eutectic solvent [J]. Green Chemistry, 2015, 17 (4): 2464-2472.
[31] LÜ H, LI P, DENG C,. Deep catalytic oxidative desulfurization (ODS) of dibenzothiophene (DBT) with oxalate-based deep eutectic solvents (DESs) [J]. Chemical Communications, 2015, 51 (53): 10703-10706.
[32] DAI D, WANG L, CHEN Q,. Selective oxidation of sulfides to sulfoxides catalysed by deep eutectic solvent with H2O2[J]. Journal of Chemical Research, 2014, 38 (3): 183-185.
[33] YIN J, WANG J, LI Z,. Deep desulfurization of fuels based on an oxidation/extraction process with acidic deep eutectic solvents [J]. Green Chemistry, 2015, 17 (9): 4552-4559.
[34] 李大勇, 魏莉, 蒋景阳. 离子液体在两相催化中的研究进展和应用前景 [J]. 化工进展, 2004, 23 (6): 605-608.
LI D Y, WEI L, JIANG J Y. Development and perspective of ionic liquids in biphasic catalysis [J]. Chemical Industry and Engineering Progress, 2004, 23 (6): 605-608.
[35] 李学玲, 顾烁玥, 杨项军. 草酸-硝酸盐低热固相反应法制备 (Ni0.58Cu0.2Zn0.22)Fe1.96O4铁氧体 [J]. 材料导报, 2009, 23 (18): 103-106.
LI X L, GU S Y, YANG X J. Synthesis of nanocrystalline (Ni0.58Cu0.2Zn0.22)Fe1.96O4by low-heating solid-state reaction [J]. Materials Review, 2009, 23 (18): 103-106.
[36] 卢泽湘, 袁霞, 吴剑, 等. 咪唑类离子液体的合成和光谱表征 [J]. 化学世界, 2005, 46 (3): 148-150.
LU Z X, YUAN X, WU J,. Synthesis and spectroscopic characterization of,-dialkylimidazolium-based ionic liquids [J]. Chemical World, 2005, 46 (3): 148-150.
[37] 何志强, 鄢浩, 王骑虎, 等. 温度对氯化胆碱/多元醇型低共熔溶剂物性的影响 [J]. 上海大学学报(自然科学版), 2015, 21 (3): 384-392.
HE Z Q, YAN H, WANG Q H,. Effect of temperature on physic-chemical properties of deep eutectic solvent based on chloride and polyols [J]. Journal of Shanghai University (Natural Science), 2015, 21 (3): 384-392.
[38] LÜ H, WANG S, DENG C,. Oxidative desulfurization of model dieseldual activation by a protic ionic liquid [J]. Journal of Hazardous Materials, 2014, 279: 220-225.
[39] 乔焜, 邓友全. 氯铝酸室温离子液体中缩醛和缩酮反应 [J]. 化学学报, 2002, 60 (3): 528-531.
QIAO K, DENG Y Q. Acetalization and ketalization reactions in chloroaluminate room temperature ionic liquids [J]. Acta Chimica Sinica, 2002, 60 (3): 528-531.
[40] 王利, 吴晓军, 桂建舟, 等. 酸性离子液体 [(CH2)4SO3HMIm]TSO在噻吩类氧化脱硫中的应用 [J]. 石油化工高等学校学报, 2008, 21 (3): 29-31.
WANG L, WU X J, GUI J Z,. The application of the acidic ionic liquid of [(CH2)4SO3HMIm]TSO in thiophene-based oxidative desulfurization [J]. Journal of Petrochemical Universities, 2008, 21 (3): 29-31.
[41] 李宇慧, 冯丽娟, 王景刚, 等. MoO3/Al2O3介孔催化剂在柴油氧化脱硫中的应用 [J]. 石油学报(石油加工), 2011, 27 (6): 878-883.
LI Y H, FENG L J, WANG J G,. Oxidative desulfurization of diesel oil by mesoporous catalyst MoO3/Al2O3[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2011, 27 (6): 878-883.
[42] 苏建勋, 艾东, 赵荣祥, 等. CuWO4/C复合物的制备和其在模拟油氧化脱硫中的应用 [J]. 燃料化学学报, 2015, 43 (12): 1476-1481.
SU J X, AI D, ZHAO R X,. Study of the preparation of CuWO4/C composite and its application in oxidative desulfurization of model oil [J]. Journal of Fuel Chemistry and Technology, 2015, 43 (12): 1476-1481.
[43] CHEN X, SONG D, ASUMANA C,. Deep oxidative desulfurization of diesel fuels by Lewis acidic ionic liquids based on 1--butyl-3-methylimidazolium metal chloride [J]. Journal of Molecular Catalysis A: Chemical, 2012, 359: 8-13.
[44] 张存, 马春艳, 刘晓勤. 超声强化过氧化氢/三氯乙酸催化氧化柴油深度脱硫研究 [J]. 燃料化学学报, 2009, 37 (3): 324-329.
ZHANG C, MA C Y, LIU X Q. Ultrasound enhanced catalytic oxidative deep desulfurization of diesel with H2O2-trichloroacetic acid [J]. Journal of Fuel Chemistry and Technology, 2009, 37 (3): 324-329.
[45] LÜ H, ZHANG Y, JIANNG Z,. Aerobic oxidative desulfurization of benzothiophene, dibenzothiophene and 4,6-dimethyl, dibenzothiophene using an Anderson-type catalyst [(C18H37)2N(CH3)2]5[IMo6O24] [J]. Green Chemistry, 2010, 12 (11): 1954-1958.
[46] CEDEÑO-CAERO L, GOMEZ-BERNAL H, FRAUSTRO-CUEVAS A,. Oxidative desulfurization of synthetic diesel using supported catalysts (Ⅲ): Support effect on vanadium-based catalysts [J]. Catalysis Today, 2008, 133: 244-254.
[47] SHI Z, SHANGL, ZHAO S,. Oxidative desulfurization in diese1microwave irradiation under H2O2-CH3COOH-DMF system [J]. Journal of Petrochemical Universities, 2008, 21 (4): 41-44.
[48] ZHU W, WANG C, LI H,. One-pot extraction combined with metal-free photochemical aerobic oxidative desulfurization in deep eutectic solvent [J]. Green Chemistry, 2015, 17 (4): 2464-2472.
[49] LIANG W, ZHANG S, LI H,. Oxidative desulfurization of simulated gasoline catalyzed by acetic acid-based ionic liquids at room temperature [J]. Fuel Processing Technology, 2013, 109: 27-31.
[50] SHIRAISHI Y, TACHIBANA K, HIRAI T,. Desulfurization and denitrogenation process for light oils based on chemical oxidation followed by liquid-liquid extraction [J]. Industrial & Engineering Chemistry Research, 2002, 41 (17): 4362-4375.
[51] DONG Y, NIE Y, ZHOU Q. Highly efficient oxidative desulfurization of fuels by Lewis acidic ionic liquids based on iron chloride [J]. Chemical Engineering & Technology, 2013, 36 (3): 435-442.
Preparation of methylimidazole hydrochloride/oxalic acid type deep eutectic solvent and its application in oxidative desulfurization of model oil
HOU Liangpei1, ZHAO Rongxiang1, LI Xiuping2, SHI Weiwei1
(1College of Petrochemical Engineering, Liaoning University of Petroleum & Chemical Technology, Fushun 113001, Liaoning, China;2College of Chemistry & Material Science Engineering, Liaoning University of Petroleum & Chemical Technology,Fushun 113001, Liaoning, China)
Methylimidazole hydrochloride/oxalic acid ([HMIM]Cl/H2C2O4) type deep eutectic solvent was synthesized by a simple heating and stirring mixture of methyl imidazole hydrochloride and oxalic acid. The removal of dibenzothiophene (DBT) in model oil was carried out by using [HMIM]Cl/H2C2O4as a catalyst and hydrogen peroxide as oxidant. The effect of different reaction parameters such as different desulfurization system, reaction temperature, catalyst amount, molar ratio of hydrogen peroxide to sulfur and the type of sulfur-containing compounds in oil on the desulfurization rate was investigated. The experimental results indicated that the removal rate of DBT can reach 92.2% under the optimum conditions of 5 ml model oil, 1.25 ml of [HMIM]Cl/H2C2O4and O/S mole ratio of 12 in 140 min and 40℃. The kinetics analysis showed that the oxidative desulfurization system was in accord with the first order reaction kinetics equation. The catalyst was reused for 7 times without significant decrease in activity.
methylimidazole hydrochloride; [HMIM]Cl/H2C2O4; catalysts; deep eutectic solvent; oxidation; reaction kinetics
TE 624
10.11949/j.issn.0438-1157.20160330
date: 2016-03-23.
ZHAO Rongxiang, zylhzrx@126.com
A
0438—1157(2016)09—3972—09
2016-03-23收到初稿,2016-05-03收到修改稿。
联系人:赵荣祥。第一作者:侯良(1991—),男,硕士研究生。
