冻贮温度对生食金枪鱼品质变化的影响
2016-03-12杨震贡慧史智佳刘梦李少鹏
杨震++贡慧++史智佳++刘梦++李少鹏++桂春生

摘 要:研究普通冻贮条件下金枪鱼品质变化规律。以大目、黑鳍和红鳍3 种金枪鱼前腹肉为研究对象,以高铁肌红蛋白含量、硫代巴比妥酸反应活性物质(thiobarbituric acid reaction substances,TBARs)值、鲜度指标K值、pH值为检测指标,研究其在-18、-30 ℃条件下金枪鱼品质随时间的变化规律。结果表明:随着贮藏时间的延长,3 种金枪鱼的pH值、鲜度指标K值、TBARs值及高铁肌红蛋白含量等指标均呈现上升趋势,且-18 ℃条件下贮藏的金枪鱼各项指标的变化速率明显高于-30 ℃条件下贮藏的金枪鱼;相较于TBARs和K值,高铁肌红蛋白含量更能反映金枪鱼生食产品的食用品质;-18 ℃冻贮金枪鱼14 d时高铁肌红蛋白含量已超过30%,金枪鱼颜色由红色向红褐色转变,感官品质明显劣化,而-30 ℃冻贮条件下则可达28 d。
关键词:金枪鱼;冻贮温度;食用品质
Effect of Frozen Storage Temperature on the Quality of Tuna Used for Raw Consumption
YANG Zhen1, GONG Hui1, SHI Zhijia1, LIU Meng1, LI Shaopeng2, GUI Chunsheng2,*
(1.China Meat Research Centre, Beijing 100068, China;
2.Beijing Beishuijialun Product of Water Co. Ltd., Beijing 100160, China)
Abstract: This experiment aimed to study the quality changes of tuna at low temperatures. Changes in metmyoglobin content, thiobarbituric acid-reactive substances (TBARs) value, the freshness indicator K value and pH of o-toro from Thunnus atlanticus, Thunnus obesus and Tetrapturus audax during storage at ?18 and ?30 ℃ were examined. The results showed that with the extension of storage time, the o-toro of all three tuna species exhibited an increase in pH, K value, TBARs value and metmyoglobin content, and all these parameters changed significantly faster at ?18 ℃ than at ?30 ℃. Compared with TBARs value and K value, metmyoglobin content was a better indicator of the eating quality of raw tuna, reaching a level higher than 30% after storage for 14 days at ?18 ℃. In addition, the color of tuna changed from red to reddish brown, suggesting significant deterioration of its sensory quality. But the storage period at ?30 ℃ was up to 28 days.
Key words: tuna; storage temperature; edible quality
DOI:10.15922/j.cnki.rlyj.2016.02.006
中图分类号:TS254.4 文献标志码:A 文章编号:1001-8123(2016)02-0026-05
引文格式:
杨震, 贡慧, 史智佳, 等. 冻贮温度对生食金枪鱼品质变化的影响[J]. 肉类研究, 2016, 30(2): 26-30. DOI:10.15922/j.cnki.rlyj.2016.02.006. http://rlyj.cbpt.cnki.net
YNAG Zhen, GONG Hui, SHI Zhijia, et al. Effect of frozen storage temperature on the quality of tuna used for raw consumption[J]. Meat Research, 2016, 30(2): 26-30. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.02.006. http://rlyj.cbpt.cnki.net
金枪鱼(tuna)是一种大型远洋性重要商品食用鱼类,被誉为世界三大营养鱼类之一,含有丰富的二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)、蛋白质、牛黄酸等,其肉质鲜嫩、口感细腻,因此常作为生鱼片的原料[1-2],深受消费者青睐。金枪鱼生食产品一般采用超低温冻贮,存在基建和设备投资大、运行费用高的缺点。目前,金枪鱼研究主要集中在黄鳍金枪鱼和大目金枪鱼的常规成分分析及解冻方法的研究等[3-9],对其冻贮过程中品质变化的研究较少,尤其对红鳍和黑鳍金枪鱼的冻贮过程品质变化的研究几乎没有。为此,出于节约成本和社会资源的目的,本实验以大目、红鳍和黑鳍3 种金枪鱼为研究对象,研究其在普通冻藏条件下pH值、鲜度指标K值、硫代巴比妥酸反应活性物质(thiobarbituric acid reaction substances,TBARs)值及高铁肌红蛋白含量等指标的变化规律,以期为金枪鱼普通冻贮保鲜和运输提供科学数据。
1 材料与方法
1.1 材料与试剂
金枪鱼 北京市北水嘉伦水产品市场有限责任公司。
1.2 仪器与设备
Sorvall LYNX-6000型离心机 美国赛默飞世尔科技公司;DW-50W255型冰箱 中国海尔集团;UV-2800型紫外-可见分光光度计 美国尤尼柯仪器有限公司;SG-8型便携式pH计 瑞士梅特勒-托利多国际贸易有限公司;BSA822-CW型电子天平 德国赛多利斯科学仪器有限公司;Waters 2695型高效液相色谱系统 美国沃特世科技有限公司。
1.3 方法
1.3.1 样品制备
将金枪鱼前腹肉切割为质量约为200 g肉块,分为2 组,每组18 块,分别贮藏于-18、-30 ℃条件下,每隔7 d从冰箱里各取出3 块,用于各项指标的检测。
1.3.2 pH值测定
采用SG-8便携式pH计测定,每个样品不同部位测定5 次,取其平均值为该样品的pH值。
1.3.3 脂肪氧化程度的测定(TBARs法)[3-4]
脂肪氧化程度用2-硫代巴比妥酸法测定。取10 g绞碎后金枪鱼肉样,加50 mL 7.5%的三氯乙酸(trichloroacetic acid,TBA)(含0.1% EDTA),振摇30 min,双层滤纸过滤2 次。取5 mL上清液加入5 mL 0.02 mo1/L TBA溶液,100 ℃条件下水浴30 min,取出冷却1 h,然后于2000×g、室温条件下离心5 min,上清液中加入5 mL三氯甲烷摇匀静置分层后,取上清液分别在532 nm和600 nm波长处测吸光度,记录吸光度A532 nm、A600 nm,并用式(1)计算TBARs值。
(1)
式中:TBARs含量以每100 g肉中丙二醛的毫克数来表示。
1.3.4 高铁肌红蛋白(metmyoglobin,MetMb)的测定[5-9]
取金枪鱼样20 g,加入20 mL 0.04 mo1/L、pH 6.8的磷酸钠缓冲剂,用均质机在室温下以转速10 800×g均质30 s。将均质液置于冰浴中静置1 h,然后于1 000×g、室温条件下离心30 min。过滤得上清液,用同样的缓冲液补足至25 mL。使用分光光度计测定在525、545、565、572 nm波长处的吸光度,按照式(2)计算MetMb含量。
高铁肌红蛋白含量(MetMb)/%=(-2.514R1+0.777R2+0.800R3+1.098)×100 (2)
式中:R1=A572 nm/A525 nm,R2=A565 nm/A525 nm,R3=A545 nm/A525 nm。
1.3.5 鲜度指标(K值)的测定
参考水产品行业标准SC/T 3048—2014《鱼类鲜度指标K值的测定 高效液相色谱法》[10]及Yoloyama等[11]的方法并略有改动。称取均质后的金枪鱼肉样2.0 g放入离心管内,加入10%高氯酸溶液20 mL,漩涡振荡60 s,在4 ℃条件下8 000×g离心10 min,取出上清液。再用10%高氯酸溶液10 mL提取沉淀物中的待测物,在4 ℃条件下8 000×g离心10 min,重复操作1次,合并上清液。用10 mol/L的氢氧化钠溶液调节上清液pH值至6.5。将已调节pH值后的溶液移至经预冷处理的容量瓶中,用4 ℃的双蒸水定容至50 mL。最后用0.22 μm微孔滤膜过滤,滤液于4 ℃条件下保存,待测[12-15]。
RP-HPLC检测条件:Waters 2695-2998液相色谱仪、Athena C18-WP色谱柱(25 cm×4.6 mm,5 μm),流动相为20 mmol/L磷酸二氢钾-磷酸氢二钾(pH 7.0)-甲醇溶液(95∶5,V/V);流速1.0 mL/min,波长254 nm,上样量10 μL。在相同条件下测定腺苷三磷酸(adenosine triphosphate,ATP)、腺苷二磷酸(adenosine diphosphate,ADP)、腺苷酸(adenine nucleotides,AMP)、肌苷酸(inosine monphosphate,IMP)、次黄嘌呤核苷(inosine,HxR)和次黄嘌呤(hypoxanthine,Hx)单标及混合标准液的种类和浓度,绘制标准曲线,通过比较样品和标准品的保留时间和峰面积来确定各标准品的种类和含量。按式(3)计算K值[16-17]。
(3)
式中:MATP、MADP、MAMP、MIMP、MHxR、MHx分别为样品中ATP、ADP、AMP、IMP、HxR、Hx的含量/(μmol/g)。
1.4 数据处理及分析
使用IBM Statistics SPSS 19.0和Excel 2013进行实验数据处理。
2 结果与分析
2.1 贮藏条件对金枪鱼pH值的影响
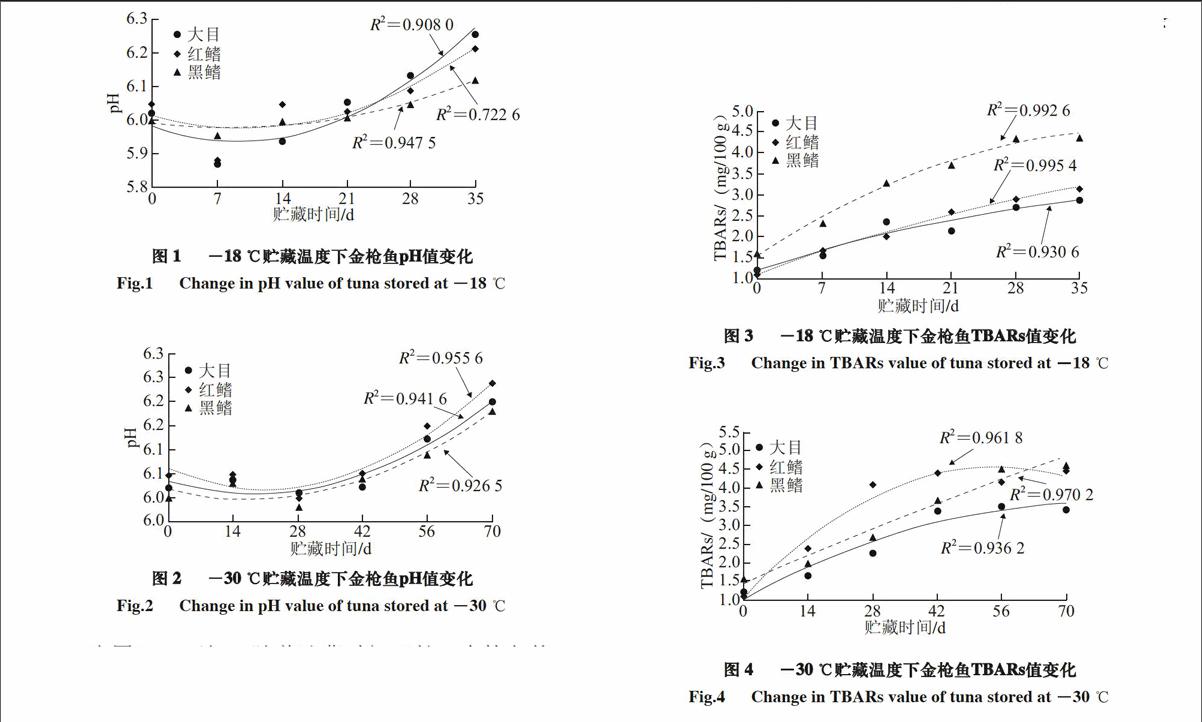
已有研究表明,金枪鱼肉的pH值大概在6.0~6.5之间[18],鱼肉呈偏酸性[19]。在-18、-30 ℃冻贮条件下大目、黑鳍和红鳍3 种金枪鱼的pH值变化如图1~2所示。
图 1 -18 ℃贮藏温度下金枪鱼pH值变化
Fig.1 Change in pH value of tuna stored at -18 ℃
图 2 -30 ℃贮藏温度下金枪鱼pH值变化
Fig.2 Change in pH value of tuna stored at -30 ℃
由图1~2可知,随着贮藏时间延长,金枪鱼的pH值均呈现先下降后上升的趋势,且-18 ℃贮藏的金枪鱼pH值变化速率高于-30 ℃贮藏的金枪鱼。究其原因,可能是贮藏初期金枪鱼肉中糖原、脂肪和ATP等分解成乳酸、脂肪酸和磷酸等酸性物质,导致pH值略有下降;其后随着时间的延长,金枪鱼肉新鲜度降低,导致碱性物质生成,pH值缓慢上升;而温度的不同对金枪鱼肉的理化反应有着不同程度的延缓作用。郑斌等[2]研究亦发现随着贮藏时间的延长,金枪鱼肉pH值出现先下降后上升的趋势,且在同一时间内冷藏条件下pH值增长最快,与本实验的研究结果相一致。
2.2 贮藏条件对金枪鱼脂肪氧化(TBARs值)的影响
脂质氧化主要包括3 种类型,分别是脂质的酶促氧化、自动氧化和光氧化。与酶促氧化不同,降低脂质存储温度并不能大幅降低自动氧化和光氧化的速率,因为其反应所需的能阀很低。自动氧化是脂质贮藏在黑暗中发生氧化的主要路径,是食品和空气中的氧在未加任何催化剂等条件下的完全自发的氧化反应,又称自动催化氧化。
金枪鱼中含有丰富的DHA和EPA等多种不饱和脂肪酸,很容易发生脂质氧化。脂质氧化产物丙二醛可与硫代巴比妥酸反应生成粉红色化合物,在532 nm波长处有吸收峰值,因此可通过其反应物颜色的吸光值测定来衡量脂肪氧化程度[3-4]。本研究中,金枪鱼贮藏在冷冻和无光照条件下,因此自动氧化是其TBARs值升高的主要原因。由图3~4可知,随着贮藏时间的延长,金枪鱼的TBARs值呈先上升后趋稳的趋势,其原因可能与包装内氧气逐渐耗尽有关。另外,-30 ℃与-18 ℃相比,在第35天时金枪鱼的TBARs值基本一致,进一步说明冻贮条件下导致金枪鱼脂质氧化的主要原因是自动氧化。
图 3 -18 ℃贮藏温度下金枪鱼TBARs值变化
Fig.3 Change in TBARs value of tuna stored at -18 ℃
图 4 -30 ℃贮藏温度下金枪鱼TBARs值变化
Fig.4 Change in TBARs value of tuna stored at -30 ℃
2.3 贮藏条件对金枪鱼高铁肌红蛋白含量的影响
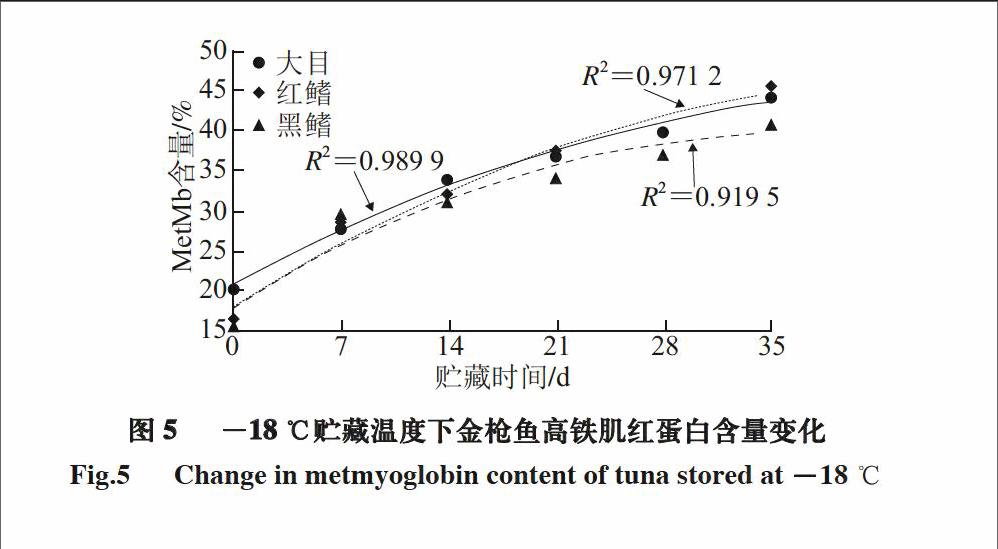
肌红蛋白是一种复合型的色素蛋白质,由一分子珠蛋白和一分子亚铁血红素结合而成。血红素基由一个卟啉环和一个铁离子组成,铁离子可以和O2、H2O、NO等结合[20]。正常情况下,肌红蛋白处于还原状态,此时铁离子处于二价状态(Fe2+),肌肉颜色为紫红色。当肌红蛋白与氧气结合后,形成氧合肌红蛋白(oxymyoglobin,MbO2),此时铁离子处于二价、三价共存状态(Fe2+/Fe3+),肌肉颜色为鲜红色;当肌红蛋白完全氧化后,此时铁离子全部转变为三价状态(Fe3+),形成高铁肌红蛋白(metmyoglobin,MetMb),此时肌肉颜色为红褐色。因此MbO2和MetMb二者的相对含量赋予了肌肉不同的色泽,且反映了肌肉的氧化程度[21]。有研究表明,高铁肌红蛋白含量在20%以下呈鲜红色,30%呈红色,50%呈褐红色,70%以上呈褐色[24-25]。
图 5 -18 ℃贮藏温度下金枪鱼高铁肌红蛋白含量变化
Fig.5 Change in metmyoglobin content of tuna stored at -18 ℃
图 6 -30 ℃贮藏温度下金枪鱼高铁肌红蛋白含量变化
Fig.6 Change in metmyoglobin content of tuna stored at -30 ℃
由图5~6可知,与金枪鱼TBARs值变化规律相似,-18 ℃条件下高铁肌红蛋白含量逐步升高,而
-30 ℃条件下呈现先迅速升高后趋于平稳的趋势。金枪鱼高铁肌红蛋白含量的快速升高,与真空包装后金枪鱼处于低氧分压条件下,肌红蛋白极易发生氧化有关;而后期趋缓,又与真空包装内部氧化逐步耗尽有关。此外,冻贮期末时,不同温度下金枪鱼高铁肌红蛋白含量均接近50%,金枪鱼颜色呈现褐红色,品质明显劣化。
2.4 贮藏条件对金枪鱼鲜度指标(K值)的影响
K值是一种广泛用于评价水产品新鲜度的指标,其反映的是鱼体死亡后鱼肉中ATP的降解程度,K值越小,产品鲜度越高,K值越大,产品的腐败程度越高[22-24]。一般认为,即杀鱼的K值是低于10%的,K值小于20%的新鲜鱼肉适合加工生鱼片,K值在20%~50%的鱼属于二级鲜度,K值在60%~80%的鱼已经初期腐败,不可接受[25-26]。研究表明,当K值达到50%时即达到鱼肉鲜度上限。不同贮藏温度下3 种金枪鱼的K值变化规律如图7~8所示。
图 7 -18 ℃贮藏温度下金枪鱼鲜度指标(K值)变化图
Fig.7 Change in K value of tuna stored at -18 ℃
图 8 -30 ℃贮藏温度下金枪鱼鲜度指标(K值)变化图
Fig.8 Change in K value of tuna stored at -30 ℃
由图7~8可知,随着贮藏时间的延长,金枪鱼的K值均呈现上升趋势,且-18 ℃条件下金枪鱼K值上升速度约为-30 ℃条件下的2 倍。杨文鸽等[12]研究发现冰藏期间大黄鱼鱼肉的鲜度指标(K值)一直呈现上升趋势,在冰藏4 d内大黄鱼处于一级鲜度范围,冰藏11 d后鱼肉出现腐败,不可食用,这与本实验研究结果相近。
3 结 论
-18 ℃和-30 ℃贮藏条件下金枪鱼的品质变化规律研究结果表明,贮藏期间,随着贮藏时间的延长,3 种金枪鱼的pH值、鲜度指标K值、TBARs值及高铁肌红蛋白含量等指标均发生了不同程度的变化,其中pH值呈先轻微下降再上升的趋势,K值、TBARs值和高铁肌红蛋白含量呈现上升趋势,且-18 ℃条件下贮藏的金枪鱼各项指标的变化速率明显高于-30 ℃条件下贮藏的金枪鱼。研究期内,3 种金枪鱼的K值均未超过20%,符合一级鲜度要求,但其高铁肌红蛋白含量已经超过30%,解冻后金枪鱼颜色劣化严重,因此相较于K值和TBARs值,高铁肌红蛋白含量更能直接反映产品感官品质。综合各项指标,建议生食金枪鱼在-18 ℃冻贮条件下贮藏期不宜超过14 d,而在-30 ℃条件下不宜超过28 d。上述研究结果对于指导生食金枪鱼加工企业制定科学合理的生产、贮运和销售计划具有积极意义。
参考文献:
[1] 沈长春, 苏新红, 戴天元. 世界主要经济金枪鱼的资源概况[J]. 福建水产, 2005(2): 81-91. DOI:10.14012/j.cnki.fjsc.2000.02.016.
[2] 郑斌, 王坚强, 王传堂, 等. 冷藏温度对金枪鱼品质变化的影响研究[J]. 浙江海洋学院学报(自然科学版), 2009(3): 315-318.
[3] 马丽珍. 冷却猪肉的生物和物理综合保鲜技术及保鲜机理研究[D]. 北京: 中国农业大学, 2003.
[4] 布冠好. 肌肽抗氧化性及其在肉品冷藏中的应用研究[D]. 郑州: 河南农业大学, 2006.
[5] 黄丽娟, 韩剑众. 生肉新鲜度评定方法研究进展[J]. 肉类研究, 2007, 21(6): 37-39.
[6] 王国永, 林乐杰. 远洋金枪鱼钓船的超低温制冷系统[J]. 渔业现代化, 2001(6): 34-35.
[7] Krzywicki K. The determination of haem pigments in meat[J]. Meat Science, 1982, 7(1): 29-36. DOI:10.1016/0309-1740(82)90095-X.
[8] Trout G R. Variation in myoglobin denaturation and color of cooked beef, pork, and turkey meat as influenced by pH, sodium chloride, sodium tripolyphosphate, and cooking temperature[J]. Journal of Food Science, 1989, 54(3): 536-540. DOI:10.1111/j.1365-2621.1989.tb04644.x.
[9] Thiansilakul Y, Benjakul S, Richards M P. Effect of phenolic compounds in combination with modified atmospheric packaging on inhibition of quality losses of refrigerated Eastern little tuna slices[J]. LWT-Food Science and Technology, 2013, 50(1): 146-152. DOI:10.1016/j.lwt.2012.06.009.
[10] 福建省水产研究所, 南海水产研究所, 农业部渔业产品质量检验检测中心, 等. SC/T 3048-2014 鱼类鲜度指标K值的测定高效液相色谱法[S]. 北京: 全国标准化技术委员会水产品加工分技术委员会, 2014.
[11] Yoloyama Y, Sakaguchi M, Kawai F, et al. Changes in concentration of ATP-related compounds in various tissues of oyster during ice storage[J]. Nippon Suisan Gakkaishi, 1992, 58(11): 2125-2136. DOI:org/10.2331/suisan.58.2125.
[12] 杨文鸽, 薛长湖, 徐大伦, 等. 大黄鱼冰藏期间ATP关联物含量变化及其鲜度评价[J]. 农业工程学报, 2007, 23(6): 217-222.
[13] Guizani N, Al-Busaidy M A, Al-Belushi I M, et al. The effect of storage temperature on histamine production and the freshness of yellowfin tuna (Thunnusalbacares)[J]. Food Research International, 2005, 38(2): 215-222. DOI:10.1016/j.foodres.2004.09.011.
[14] Kamalakanth C K, Ginson J, Bindu J, et al. Effect of high pressure on K-value, microbial and sensory characteristics of yellowfin tuna (Thunnusalbacares) chunks in EVOH films during chill storage[J]. Innovative Food Science & Emerging Technologies, 2011, 12(4): 451-455. DOI:10.1016/j.ifset.2011.06.001.
[15] Losada V, Pi?eiro C, Barros-Velázquez J, et al. Inhibition of chemical changes related to freshness loss during storage of horse mackerel (Trachurustrachurus) in slurry ice[J]. Food Chemistry, 2005, 93(4): 619-625. DOI:10.1016/j.foodchem.2004.09.041.
[16] ?zogul Y, ?zogul F, G?kbulut C. Quality assessment of wild European eel (Anguilla anguilla) stored in ice[J]. Food Chemistry, 2006, 95(3): 458-465. DOI:10.1016/j.foodchem.2005.01.025.
[17] 高志立, 谢晶, 施建兵, 等. 不同贮藏条件下带鱼品质的变化[J]. 食品科学, 2013, 34(16): 311-315.
[18] Chow C J, Ochiai Y, Hashimoto K. Effects of freezing and thawing on the autoxidation of bluefin tuna myoglobin[J]. Nippon Suisan Gakkaishi, 1985, 51(12): 2073-2078. DOI:org/10.2331/suisan.51.2073.
[19] TAO Z, SATO M, YAMAGUCHI T, et al. Formation and diffusion mechanism of histamine in the muscle of tuna fish[J]. Food Control, 2009, 20(10): 923-926.DOI:10.1016/j.foodcont.2009.01.011.
[20] 王海燕, 彭增起. 肌红蛋白的功能特性[J]. 肉类工业, 2001(7): 36-40.
[21] 刘芳, 朱金媛, 戴瑞彤. 肌肽对牛肉糜肉色及脂肪氧化的影响[J]. 食品工业科技, 2009(11): 140-143. DOI:10.13386/j.issn1002-0306.2009.11.035.
[22] 董彩文. 鱼肉鲜度测定方法研究进展[J]. 食品与发酵工业, 2004, 30(4): 99-103.
[23] Ryder J M. Determination of adenosine triphosphate and its breakdown products in fish muscle by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry, 1985, 33(4): 678-680.
[24] 边涛, 赵艳, 张虹, 等. 凡纳滨对虾在不同冷藏条件下的品质变化研究[J]. 水产科学, 2009, 28(9): 493-497.
[25] 包海蓉, 奚春蕊, 刘琴, 等. 两种解冻方法对金枪鱼品质影响的比较研究[J]. 食品工业科技, 2012, 33(17): 338-341. DOI:10.13386/j.issn1002-0306.2012.17.048.
[26] 励建荣, 李婷婷, 李学鹏. 水产品鲜度品质评价方法研究进展[J]. 北京工商大学学报(自然科学版), 2010, 28(6): 1-6.
