非超低温冻藏金枪鱼理化变化及相关性
2016-03-12贡慧杨震李梦瑶刘梦李少鹏
贡慧++杨震++李梦瑶++刘梦++李少鹏++王守伟
摘 要:研究马苏和剑鳍金枪鱼生食产品在-18 ℃与-30 ℃非超低温条件下的K值和高铁肌红蛋白相对含量的变化规律,并进行K值与感官品质的相关性分析。结果表明:-18 ℃条件下金枪鱼生食产品冻藏期内K值和高铁肌红蛋白相对含量上升和感官品质劣化更快;冻藏期间产品滋味、气味变化不明显,但组织结构和口感劣化明显;以感官评价为依据,在-18 ℃条件下生食终点约为14 d,而-30 ℃条件下可达70 d以上,此时K值均小于10%,因此以K值作为产品新鲜度评价在特定条件下需要重新审视。
关键词:金枪鱼;K值;高铁肌红蛋白;反相高效液相色谱
Changes in Physicochemical Properties of Meat from Two Different Tuna Varieties during Frozen Storage at
Non-Ultralow Temperatures and Correlation Analysis
GONG Hui1, YANG Zhen1, LI Mengyao1, LIU Meng1, LI Shaopeng2, WANG Shouwei1,*
(1.China Meat Research Centre, Beijing Academy of Food Sciences, Beijing 100068, China;
2.Beijing Beishuijialun Product of Water Co. Ltd., Beijing 100160, China)
Abstract: At present, limited research is reported on changes in the sensory quality and physicochemical properties of raw and processed tuna products frozen at non-ultralow temperatures. Most previous research focused on bigeye and yellowfin tuna; however, other tuna varieties have been scarcely researched. In this work, changes in K value and metmyoglobin content of meat from southern bluefin tuna and swordfish during frozen storage at non-ultralow temperatures (?18 and ?30 ℃) were detected, and correlation analysis of the K value and sensory quality was carried out. The results showed that during frozen storage at ?18 ℃, K value and metmyoglobin content increased faster and the sensory quality deteriorated more rapidly. Although the flavor and odor did not change obviously, the texture and taste deteriorated significantly. Based on sensory evaluation, the storage period at ?18 ℃ of tuna to be raw eaten was 14 days, while that at ?30 ℃ was more than 70 days. K values after storage at both temperatures were less than 10%. As a result, the use of K value to evaluate fish freshness under certain conditions needs to be reconsidered.
Key words: tuna; K value; metmyoglobin; reversed phase-high performance liquid chromatography (RP-HPLC)
DOI:10.15922/j.cnki.rlyj.2016.02.005
中图分类号:TS254.4 文献标志码:A 文章编号:1001-8123(2016)02-0021-05
引文格式:
贡慧, 杨震, 李梦瑶, 等. 非超低温冻藏金枪鱼理化变化及相关性[J]. 肉类研究, 2016, 30(2): 21-25. DOI:10.15922/j.cnki.rlyj.2016.02.005. http://rlyj.cbpt.cnki.net
GONG Hui, YANG Zhen, LI Mengyao, et al. Changes in physicochemical properties of meat from two different tuna varieties during frozen storage at non-ultralow temperatures and correlation analysis[J]. Meat Research, 2016, 30(2): 21-25. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.02.005. http://rlyj.cbpt.cnki.net
金枪鱼因其营养丰富、口感鲜美和远洋捕捞受污染少的特点,日益受到消费者青睐。可生食的金枪鱼品种主要有蓝鳍、马苏、大目、黄鳍、剑鳍、红鳍和黑鳍等。通常情况下,金枪鱼在远洋捕捞之后在渔船上经过初级加工后即进行超低温冻藏[1-2],以保证其适于生食的新鲜度与口感不发生变化。但超低温冻藏存在设施设备投资和能源消耗大的问题,销售终端一般不具备超低温冻藏条件。目前,有关非超低温冻藏条件下生食金枪鱼产品宜食用终点判定的研究较少,现有报道主要集中在大目和黄鳍金枪鱼上[3-4],对马苏与剑鳍金枪鱼的研究较鲜见[5-6]。
鱼类新鲜度的评价方法很多,包括感官评价、微生物、生化指标、物理指标等[7-8]。在冻藏条件下,微生物生长繁殖受到抑制,物理指标的变化是结果,因此本研究选用生化指标和感官评价相结合的方式,对非超低温冻藏条件下(-18 ℃与-30 ℃)马苏和剑鳍两种金枪鱼生食产品宜食用终点进行了研究,具体的选用K值、高铁肌红蛋白(methemoglobin,MetMb)含量和感官评价等指标,分析研究冻藏期间金枪鱼品质变化规律,确定不同冻藏条件下最大贮藏时间,以期为非超低温冻藏条件下金枪鱼生食产品的贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
金枪鱼材料由北水嘉伦食品有限公司提供。
腺苷三磷酸(adenosine triphosphate,ATP)、腺苷二磷酸(adenosine diphosphate,ADP)、腺苷酸(adenine nucleotides,AMP)、肌苷酸(inosine monphosphate,IMP)、次黄嘌呤核苷(inosine,HxR)和次黄嘌呤(hypoxanthine,Hx)标准品,磷酸二氢钾、磷酸氢二钾(色谱纯) 美国Sigma-Aldrich公司;甲醇(色谱纯) 德国Meker公司;高氯酸、盐酸、氢氧化钠(分析纯) 北京化工厂;所有实验用水均为二次过滤超纯水。
1.2 仪器与设备
Waters 2695高效液相色谱系统(配有可变波长紫外检测器2998) 美国Waters公司;-18、-30 ℃冰箱 海尔集团;离心机 美国Thermo Fisher公司。
1.3 方法
1.3.1 样品处理
将质量约为100 g的马苏和剑鳍金枪鱼切块各24 块,分别真空包装并置于-18、-30 ℃条件下。-18 ℃条件间隔7 d取样,-30 ℃条件间隔14 d取样。取出的样品在4 ℃条件下过夜解冻,3/4绞碎后4 ℃条件下贮藏备用,1/4用于感官评价。
1.3.2 新鲜度指标(K值)的测定[9-10]
样品处理:称取绞碎后的金枪鱼肉样2.0 g放入离心管内,加入10%高氯酸溶液20 mL,漩涡振荡60 s,在4 ℃条件下8 000×g离心10 min,取出上清液。再用5%高氯酸溶液10 mL提取沉淀物中的待测物,在4 ℃条件下8 000×g离心10 min,重复操作1次,合并上清液。用10 mol/L的氢氧化钠溶液调节上清液pH值至6.5。将已调节pH值后的溶液移至经预冷处理的容量瓶中,用4 ℃的双蒸水定容至50 mL。最后用0.22 μm微孔滤膜过滤,滤液于4 ℃条件下保存,待测。
反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)检测条件:Waters 2695-2998液相色谱仪;Athena C18-WP色谱柱(25 cm×4.6 mm,5 μm);流动相为20 mmol/L磷酸二氢钾/磷酸氢二钾(pH7.0)-甲醇溶液(95%~5%);流速1.0 mL/min;波长254 nm;上样量10 μL。在相同条件下测定ATP、ADP、AMP、IMP、HxR、Hx单标及混合标准液的种类和浓度,绘制标准曲线,通过比较样品和标准品的保留时间和峰面积来确定各标准品的种类和含量。按式(1)计算K值[13-14]。
(1)
式中:MATP、MADP、MAMP、MIMP、MHxR和MHx分别为样品中ATP、ADP、AMP、IMP、HxR和Hx的
含量/(μmol/g)。
1.3.3 MetMb含量的测定[11]
取金枪鱼样20 g,加入20 mL 0.04 mo1/L、pH 6.8的磷酸钠缓冲剂,用均质机在室温下以转速10 800×g均质30 s。将均质液置于冰浴中静置1 h,然后于1 000×g、室温条件下离心30 min。过滤得上清液,用同样的缓冲液补足至25 mL。使用分光光度计测定在525、545、565、572 nm波长处的吸光度。按式(2)计算MetMb含量[15]。
MetMb含量/%=(-2.514R1+0.777R2+0.800R3+1.098)×100 (2)
式中:R1=A572 nm /A525 nm,R2=A565 nm/A525 nm,R3=A545 nm/A525 nm。
1.3.4 感官评价
感官评定由专门培训的感官评定小组(10 人)组成,参照徐慧文等[12]的感官评定表加以改进,对金枪鱼的色泽、气味、滋味、组织结构进行评定,结果取综合评分值。
2 结果与分析
2.1 RP-HPLC方法测定金枪鱼K值
K值是ATP降解产物间的比值,是评价鱼类新鲜度的一个重要指标[16-17]。鱼类死后肌肉ATP降解途径一般按ATP→ADP→AMP→IMP→HxR→Hx进行,ATP降解为ADP、AMP和IMP会在几小时至几天内完成,使IMP达到峰值,而IMP进一步降解为HxR和Hx的过程相对比较缓慢[17-18]。IMP和Hx是ATP降解过程的中间产物和终产物,与鱼肉的鲜味和异味有密切关系,IMP是鱼类主要的呈鲜味物质,Hx则是呈腥苦味物质。K值则是HxR与Hx两种呈腥苦味物质含量与ATP降解产物总和的比值,可以作为反应鱼类不良滋味、气味的指标。
2.1.1 金枪鱼K值的RP-HPLC测定结果
图 1 K值中6 种ATP相关物混合标准品的RP-HPLC图谱
Fig.1 RP-HPLC chromatogram of mixed standards of ATP degradation compounds associated with K value
图1为K值中6 种ATP相关物混合标准品的RP-HPLC图谱,在该色谱条件下25 min内6 个标准品均得到良好分离,基线漂移小,峰型对称,没有干扰峰。除了HxR最低检测线为1 μg/mL,其他均为0.1 μg/mL;各标准品梯度质量浓度与峰面积的回归系数均在0.98以上;因此本方法可用于定量,且检测速度快。
图 2 剑鳍(a)和马苏(b)K值中6 种ATP相关物RP-HPLC图谱
Fig.2 RP-HPLC chromatogram of ATP degradation compounds associated with K value of swordfish and southern bluefin tuna
图2为剑鳍和马苏两种金枪鱼K值RP-HPLC图谱,可以看出两个种类的金枪鱼经前处理后进行K值测定时,
6种ATP相关物的分离情况良好,且无明显杂质干扰。
2.1.2 金枪鱼ATP及其降解产物变化规律
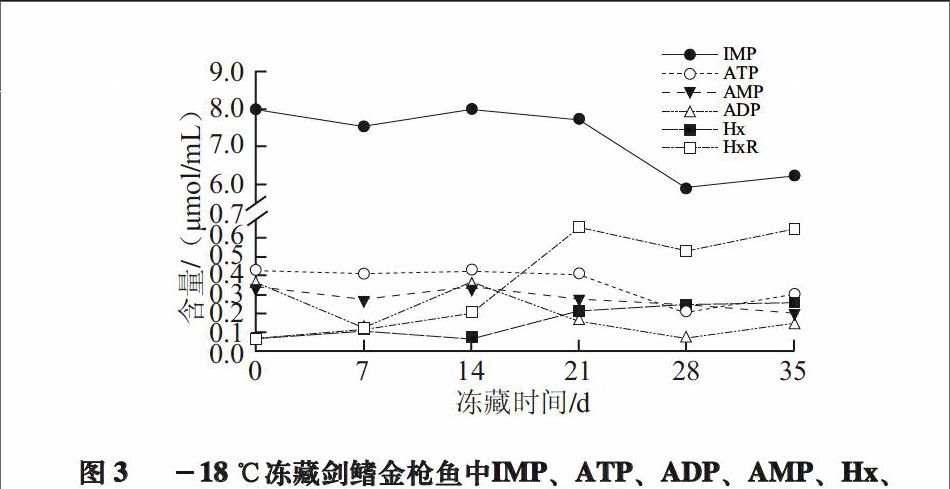
由于金枪鱼在远洋捕捞之后经过初级加工后在远洋渔船上即进行-55 ℃以下的深冷冻藏,ATP降解为ADP、AMP和IMP的过程在深冷冻藏之前已基本完成,故本实验进行时已是金枪鱼IMP达到峰值的状态,而IMP是重要的鲜味物质,新鲜鱼肉鲜甜味与高含量的IMP密切相关。所以初始条件下的IMP含量最高,而ATP降解的终产物Hx与HxR,也是鱼类不良滋气味主要来源,其含量最低。
图 3 -18 ℃冻藏剑鳍金枪鱼中IMP、ATP、ADP、AMP、Hx、
HxR的变化
Fig.3 Changes in IMP, ATP, ADP, AMP, Hx and HxR contents in swordfish frozen at ?18 ℃
由图3可知,在-18 ℃贮藏条件下的剑鳍金枪鱼在14 d之后,IMP含量急剧下降,HxR和Hx急剧上升。有研究表明IMP是在5-核苷酸酶作用下分解的[18],在本实验中其分解原因有可能是此酶活性在-18 ℃条件下活性可维持14 d。HxR和Hx的含量积累达到峰值后基本不变,也就说明此后的剑鳍金枪鱼K值会逐渐升高,新鲜度随之降低。
2.2 金枪鱼在不同冻藏温度下的K值变化规律
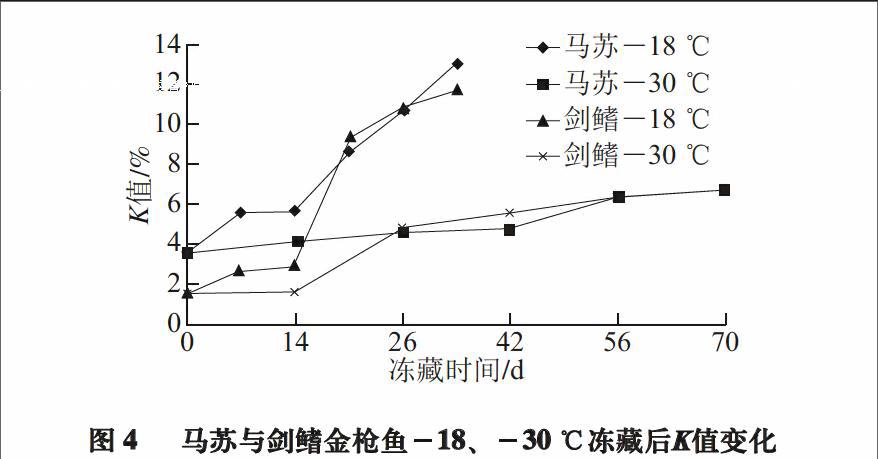
有研究表明,超低温-55 ℃条件下金枪鱼的鲜度可以基本保持在活杀鱼的状态,故以-55 ℃冻藏的鱼样各项指标为实验零点[19]。马苏金枪鱼分别在-18、-30 ℃冻藏,由于-18 ℃条件对金枪鱼新鲜度影响较大,故选择每7 d取样一次,而为了突出对比效果,-30 ℃则选择每14 d取样一次,之后在相同条件下解冻,进行K值测定,结果如图4所示。
图 4 马苏与剑鳍金枪鱼-18、-30 ℃冻藏后K值变化
Fig.4 Changes in K value of southern bluefin tuna and swordfish frozen at ?18 ℃ and ?30 ℃
由图4可知,在-18 ℃条件下马苏金枪鱼、剑鳍金枪鱼K值均上升迅速,增长速率分别达3.82%/7 d(R2=0.96)、4.76%/7 d(R2=0.90)。14 d之后两种金枪鱼K值均呈直线上升趋势,到28 d时K值超过10%。而在-30 ℃条件下,马苏金枪鱼、剑鳍金枪鱼K值上升均较平缓,增长速率分别为0.66%/7 d(R2=0.94)、1.19%/7 d(R2=0.90),直至70 d时K值仍未超过10%。此外,在相同冻藏温度条件下,剑鳍金枪鱼的K值增长率均高于马苏金枪鱼,这与不同种类金枪鱼ATP酶、5-核苷酸酶的含量与活性有关[20-21]。
2.3 金枪鱼MetMb相对含量的变化
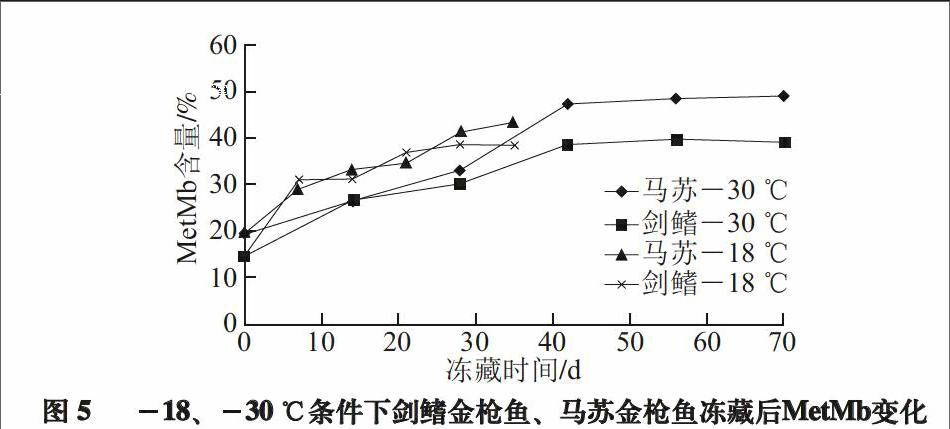
MetMb含量是评价红肉色泽的主要手段之一[21-22]。研究发现,肌红蛋白是一种复合型的色素蛋白质,正常情况下肌红蛋白处于还原状态,此时铁离子处于二价状态(Fe2+),肌肉颜色为紫红色,当肌红蛋白与氧气结合后,形成氧合肌红蛋白(oxymyoglobin,MbO2),此时铁离子处于二价、三价共存状态(Fe2+/Fe3+),肌肉颜色为鲜红色,当肌红蛋白完全氧化后,此时铁离子全部转变为三价状态(Fe3+),形成MetMb,此时肌肉颜色为红褐色[22]。因此MbO2和MetMb二者的相对含量赋予了肌肉不同的色泽,可以反映肌肉的氧化程度[15,23]。有研究表明,MetMb含量在20%以下呈鲜红色、30%呈红色、50%呈褐红色、70%以上呈褐色[24-25]。
图 5 -18、-30 ℃条件下剑鳍金枪鱼、马苏金枪鱼冻藏后MetMb变化
Fig.8 Changes in MetMb content of swordfish and southern bluefin tuna frozen at ?18 ℃ and ?30 ℃
由图5可知,贮藏温度对金枪鱼MetMb含量的变化产生了显著影响。在-18 ℃条件下冻藏14 d,马苏金枪鱼、剑鳍金枪鱼在4 ℃条件下隔夜解冻后,MetMb含量均超过30%,而在-30 ℃条件下需28 d。但是两种金枪鱼在实验冻藏期内,隔夜解冻后的MetMb含量均未超过50%。而两种金枪鱼之间的差异,可能与其肌肉蛋白类型有关。剑鳍金枪鱼肌肉属于快缩肌纤维,含较多的肌原纤维,而肌红蛋白和细胞色素较少;而马苏金枪鱼与之相反。
2.4 不同种类金枪鱼不同冻藏温度下感官评价分析
由图6可知,-18 ℃条件下贮藏的金枪鱼在14 d后品质明显劣化,此时MetMb含量和K值分别为30%和9.0%,至28 d后感官评分低于4 分,已不适合生食食用,此时MetMb含量和K值分别为40%和10%左右;-30 ℃条件下冻藏直至70 d时,两种金枪鱼感官评分仍高于6 分,可以生食食用,此时K值均为6.7%,MetMb含量分别为50%和40%左右。由此可见,K值和MetMb含量在特定条件下并不能完全反映生食金枪鱼的食用品质。
图 6 马苏金枪鱼、剑鳍金枪鱼-18、-30 ℃冻藏后感官评价变化
Fig.6 Changes in sensory evaluation of bluefin tuna and swordfish frozen at ?18 ℃ and ?30 ℃
在感官评价过程中,评价小组一致认为金枪鱼品质劣化的主要问题并非在于不良滋味、气味,而是肌肉结构与弹性的劣化影响口感,造成感官评价品质的降低。究其原因,可能与金枪鱼肉蛋白的冷冻变性有关。
2.5 K值与感官评价相关性分析
图 7 不同温度下剑鳍金枪鱼、马苏金枪鱼冻藏后鱼肉感官评定结果与K值的关系
Fig.7 Relationship between sensory scores and K values of swordfish and bluefin tuna frozen at different temperatures
由图7可知,金枪鱼的K值与其感官品质显著相关,二者呈线性相关。综合两种金枪鱼的K值与感官评价相关性分析,可以看出,当K值高于10%时,感官评分低于4 分,不适合生食。有研究表明,当鱼类的K值低于20%时可评价为新鲜[18-19],但本研究在进行感官评价后发现虽然K值未超过20%,但肌肉组织弹性与口感已明显变差,其原因可能与金枪鱼蛋白的冷冻变性有关。同时也说明,在特定条件贮藏的金枪鱼产品,在以K值为新鲜度评价依据时或需重新审视。
3 结 论
通过对两种不同类型金枪鱼,即马苏金枪鱼(红肉)与剑鳍金枪鱼(白肉)在不同冻藏温度下K值的测定,可以看出,在相同贮藏温度下剑鳍金枪鱼的K值增长率均高于马苏金枪鱼,这可能与不同种类金枪鱼参与ATP逐级分解酶的种类与数量有关。在-18 ℃冻藏条件下两种金枪鱼都在14 d之后急剧劣化,K值接近10%,28 d后K值超过10%;-30 ℃冻藏条件下两种金枪鱼均在28 d之后加速劣化,但K值在70 d之后仍未超过10%,这可能与不同温度下参与ATP逐级分解的酶活性有关。在相同冻藏条件下,马苏金枪鱼的劣化较剑鳍金枪鱼更平稳,剑鳍金枪鱼IMP降解更迅速,但在相同保藏条件下两种金枪鱼冻藏终点的K值趋于一致。通过MetMb的测定发现,在相同温度条件下的贮藏周期中,含肌红蛋白和细胞色素较多的马苏金枪鱼测定结果较剑鳍金枪鱼高,最高点可达10%;当同样MetMb含量达到30%时,
-18 ℃条件下可贮藏14 d,而-30 ℃条件下则可保藏28 d以上。可见MetMb可以作为红肉金枪鱼新鲜度,尤其是色泽方面一个重要的参考依据。本研究在进行感官评价后发现在这两种金枪鱼的K值超过10%时,肌肉组织弹性与口感上已明显变差,MetMb含量也达到40%,已不适合生食食用。故在特定条件贮藏的金枪鱼产品时,以K值为新鲜度评价标准时的具体量化值或需重新审视。
由本实验结果可知,金枪鱼在普通冻藏条件下
(-18 ℃)保藏生食终点为14 d,为普通消费者及没有超低温冻藏条件的餐饮企业提供短期贮藏金枪鱼的理论依据。此外,由于马苏金枪鱼有鲜红的色泽,在生食时也是评价其新鲜程度的重要指标,而白肉金枪鱼(剑鳍)较红肉金枪鱼(马苏)更有可能因脂肪氧化而劣化,故可以在较常见的贮存条件下以降低脂肪氧化的角度延长其保藏时间。
参考文献:
[1] 于刚, 张洪杰, 杨少玲, 等. 金枪鱼保鲜方法及其贮藏期品质变化研究进展[J]. 食品工业科技, 2013, 34(21): 381-389. DOI:10.13386/j.issn1002-0306.2013.21.035.
[2] 刘书臣, 廖明涛, 赵巧灵, 等. 不同贮藏温度下大目金枪鱼鲜度及组胺变化[J]. 食品与发酵工业, 2013, 39(5): 213-218. DOI:10.13995/j.cnki.11-1802/ts.2013.05.015.
[3] 罗殷, 王锡昌, 刘源. 黄鳍金枪鱼食用品质的研究[J]. 食品科学, 2008, 29(9): 476-480.
[4] KAEWDANG O, BENJAKUL S, KAEWMANEE T, et al. Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares)[J]. Food Chemistry, 2014, 155: 264-270. DOI:10.1016/j.foodchem.2014.01.076.
[5] ?ZOGUL Y, ?ZOGUL F, G?KBULUT C. Quality assessment of wild European eel (Anguilla anguilla) stored in ice[J]. Food Chemistry, 2006, 95(3): 458-465. DOI:10.1016/j.foodchem.2005.01.025.
[6] 徐慧文, 谢晶. 金枪鱼保鲜方法及其鲜度评价指标研究进展[J]. 食品科学, 2014, 35(7): 258-263. DOI:10.7506/spkx1002-6630-201407051.
[7] HWANG C C, LEE Y C, HUANG Y R, et al. Biogenic amines content, histamine-forming bacteria and adulteration of bonito in tuna candy products[J]. Food Control, 2010, 21(6): 845-850. DOI:10.1016/j.foodcont.2009.11.011.
[8] OGURI S, OKUYA Y, YANASE Y, et al. Post-column derivatization capillary electrochromatography for detection of biogenic amines in tuna-meat[J]. Journal of Chromatography A, 2008, 1202(1): 96-101. DOI:10.1016/j.chroma.2008.06.034.
[9] 刘旭, 王军, 张纹, 等. 6种鱼类肌肉组织肌苷酸的检测分析[J]. 海洋科学, 2008, 32(2): 22-35.
[10] 杨文鸽, 薛长湖, 徐大伦, 等. 大黄鱼冰藏期间ATP关联物含量变化及其鲜度评价[J]. 农业工程学报, 2007, 23(6): 217-222.
[11] 尚艳丽, 杨金生, 霍健聪, 等. 运输过程中金枪鱼生鱼片色泽变化的模拟[J]. 食品工业, 2012, 33(11): 60-62.
[12] 徐慧文, 谢晶, 汤元睿, 等. 冰藏和冷藏条件下金枪鱼品质变化的研究[J]. 食品工业科技, 2014, 35(13): 321-326. DOI:10.13386/j.issn1002-0306.2014.13.061.
[13] 刘寿春, 钟赛意, 李平兰, 等. 三磷酸腺苷降解产物评价冷鲜罗非鱼片新鲜度[J]. 食品科学, 2013, 34(4): 230-235.
[14] KAMALAKANTH C K, GINSON J, BINDU J, et al. Effect of high pressure on K-value, microbial and sensory characteristics of yellowfin tuna (Thunnus albacares) chunks in EVOH films during chill storage[J]. Innovative Food Science & Emerging Technologies, 2011, 12(4): 451-455. DOI:10.1016/j.ifset.2011.06.001.
[15] 纪春涛, 汪之和. 金枪鱼肌红蛋白稳定性和贮藏条件的研究[J]. 安徽农业科学, 2008, 36(10): 4244-4245.
[16] 董彩文. 鱼肉鲜度测定方法研究进展[J]. 食品与发酵工业, 2004, 30(4): 99-103.
[17] 刘燕, 王锡昌, 刘源. 金枪鱼解冻方法及其品质评价的研究进展[J]. 食品科学, 2009, 30(21): 476-480.
[18] 尚艳丽, 杨金生, 霍健聪, 等. 不同解冻方式对金枪鱼新鲜度的影响研究[J]. 浙江海洋学院学报(自然科学版), 2011, 30(5): 405-409.
[19] 尚艳丽, 杨金生, 霍健聪, 等. 运输过程中金枪鱼生鱼片鲜度变化的模拟[J]. 食品工业科技, 2012, 33(12): 349-351. DOI:10.13386/j.issn1002-0306.2012.13.101.
[20] 包海蓉, 奚春蕊, 刘琴, 等. 两种解冻方法对金枪鱼品质影响的比较研究[J]. 食品工业科技, 2012, 33(17): 338-341. DOI:10.13386/j.issn1002-0306.2012.17.048.
[21] 励建荣, 李婷婷, 李学鹏. 水产品鲜度品质评价方法研究进展[J]. 北京工商大学学报(自然科学版), 2010, 28(6): 1-6.
[22] GUIZANI N, AL-BUSAIDY M A, AL-BELUSHI I M, et al. The effect of storage temperature on histamine production and the freshness of yellowfin tuna (Thunnus albacares)[J]. Food Research International, 2005, 38(2): 215-222. DOI:10.1016/j.foodres.2004.09.011.
[23] KLOMKLAO S, BENJAKUL S, KISHIMURA H, et al. Trypsin inhibitor from yellowfin tuna (Thunnus albacores) roe: effects on gel properties of surimi from bigeye snapper (Priacanthus macracanthus)[J]. LWT-Food Science and Technology, 2016, 65: 122-127.
[24] CHOW C J, OCHIAI Y, HASHIMOTO K. Effects of freezing and thawing on the autoxidation of bluefin tuna myoglobin[J]. Nippon Suisan Gakkaishi, 1985, 51(12): 2073-2078.
[25] WANG B, VONGSVIVUT J, ADHIKARI B, et al. Microencapsulation of tuna oil fortified with the multiple lipophilic ingredients vitamins A, D3, E, K2, curcumin and coenzyme Q10[J]. Journal of Functional Foods, 2015, 19: 893-901.
