HPLC法测定生物羊膜浸泡5—氟尿嘧啶药物吸收量
2016-03-12周扬赵爽张晨明
周扬 赵爽 张晨明
[摘要]目的 建立生物羊膜(面积为8mm×10mm)中5-氟尿嘧啶(5-Fu)浓度的HPLC测定法以观察不同浸泡时间生物羊膜浸泡5-Fu药物吸收量。 方法 色谱柱为Diamonsil(钻石)C18(4.6mm×250mm,5?m),流动相为甲醇-水(2︰98),流速为1.0mL/min,紫外检测波长为266nm,生物羊膜吸收液为5-氟尿嘧啶注射液(标示量为10mL;0.25g),吸收后用流动相提取,进样测定。 结果 以5-氟尿嘧啶峰面积为纵坐标,5-氟尿嘧啶浓度为横坐标,5-Fu在2~100?g/mL浓度范围内线性关系良好(r=0.9995),浸泡5min,吸收5-Fu为59.004μg/片,浸泡5min,吸收5-Fu为75.839μg/片。 结论 生物羊膜能够吸附一定量的5-氟尿嘧啶,通过测定羊膜中吸收的5-氟尿嘧啶的量,为临床以及基础合理用药提供依据。
[关键词]高效液相色谱法;5-氟尿嘧啶;生物羊膜
[中图分类号] R927.2 [文献标识码] A [文章编号] 2095-0616(2016)01-42-03
[Abstract]Objective To establish a HPLC method for determination the concentration of 5-fluorouracil(5-Fu) in biological amniotic membrane (area was 8mm×10mm) to observe the absorption of 5-Fu different soaking time in biological amniotic membrane. Methods Determination was achieved on a Diamonsil (diamonds) C18 (4.6mm×250mm, 5 ?m) with the mobile phase of methanol-water (volume ratio of 2︰98). The flow rate was 1.0mL/min, the UV detection wavelength was set at 266nm and biological amniotic membrane absorption liquid for 5-Fu injection (mark is 10mL, 0.25g). The sample was detercted after absorption. Results Ordinate was 5-Fu peak area and abscissa was the concentration of 5-Fu. The linear relationship of 5-Fu in 2-100 ?g/mL concentration range was good (r=0.999 5). 5min immersion, absorbing 5-FU for 59.004μg/piece, soak 5 minutes, absorbing 5-FU for 75.839μg/piece. Conclusion Biological amniotic membrane can absorb a certain amount of 5-FU.By determinating amount of 5-FU absorbed in the amniotic membrane, provide the basis for clinical and rational use of drugs.
[Key words] High performance liquid chromatography; 5-FU; Biological amniotic membrane
羊膜来源于胚胎。由于没有人体白细胞抗原的表达,其抗原性很低,无血管、神经和淋巴管。羊膜上皮细胞具有分化的潜能,在特定条件下可分毛囊上皮和皮肤上皮,对促进上皮愈合和降低基质炎症及溃疡发挥作用[1-3]。
5-氟尿嘧啶是一种抗代谢抗肿瘤药,能抑制胸腺嘧啶核苷酸合成酶、阻断脱氧嘧啶核苷酸转换成胸腺嘧啶核苷酸,干扰DNA的合成,此外尚能抑制RNA的形成。5-氟尿嘧啶通过无特异性地抑制细胞,减少滤过道瘢痕形成,从而抑制成纤维细胞增生,有利于功能性滤过泡的形成和保持,使术后眼压保持较好,提高手术成功率而用于青光眼手术[4]。5-氟尿嘧啶对角、结膜细胞有毒性作用,可导致泪膜功能明显受损,表现为泪液分泌量减少,泪膜稳
定性下降,易患干眼症。因此在使用时要正确掌握用药适应证、严格控制安全使用剂量。本实验通过将羊膜在5-氟尿嘧啶注射液中浸泡,采用高效液相方法对羊膜吸收的5-氟尿嘧啶含量进行测定[5]。
1 仪器与药品
Waters高效液相色谱仪(Waters2695)KFP-486GE/F,Empower工作站,Waters2996紫外检测器,干燥器,梅特勒-托利多AX205 Delta Range 电子天平(瑞士梅特勒公司),XW-80A型旋涡混合器(上海精科实业有限公司)。
5-氟尿嘧啶标准品(批号:08052897),5-Fu注射液(标示量为10mL;0.25g,上海旭东海普药业有限公司),生物羊膜(江西瑞济生物工程技术有限公司),甲醇为色谱纯(批号:LOT H02E73,美国J.T.Baker公司),水为娃哈哈纯净水。
2 方法与结果
2.1 色谱条件
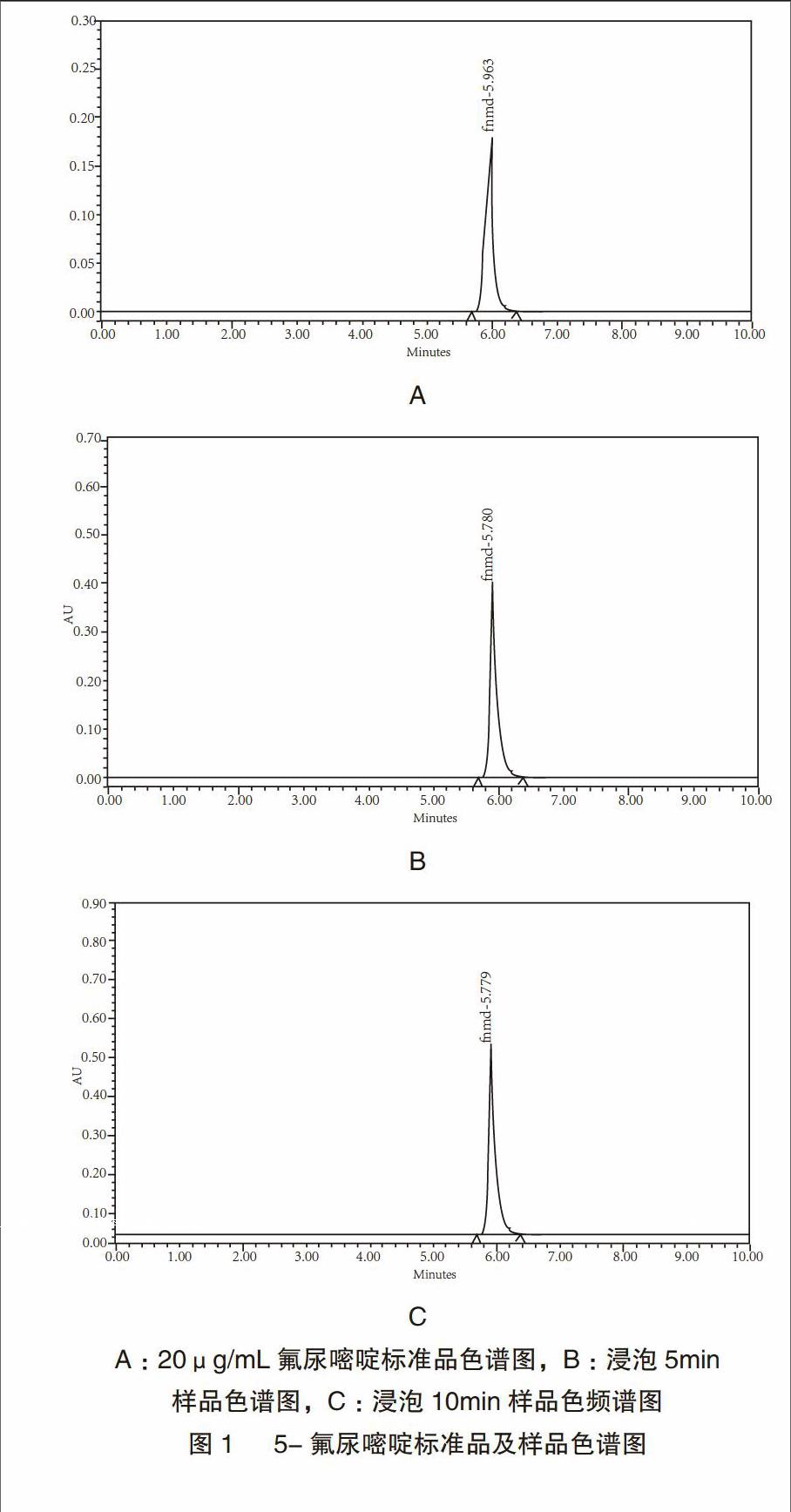
色谱柱:Diamonsil(钻石)C18色谱柱(5?m,4.6mm×250mm);流动相:甲醇-水(2︰98);流速:1.0mL/min;柱温:30℃;进样量:20?L;检测波长:266nm。色谱图见图1。
2.2 标准溶液的制备
精密称量5-氟尿嘧啶标准品0.0103g,置于10mL容量瓶中,加甲醇溶解至刻度得1mg/mL母液。然后从中精密量取1mL置于另一10mL容量瓶中,用流动相(甲醇-水2︰98)稀释至刻度,得100?g/mL标准溶液。
2.3 标准曲线的制备
取标准溶液用流动相稀释,分别配置2,5,10,20,50,100?g/mL标准品系列溶液,分别进样20?L,连续进样5次。以5-氟尿嘧啶的峰面积为纵坐标,以浓度为横坐标,得直线方程为Y=6.37×104X+3.59×104,r=0.9995。表明5-氟尿嘧啶在2~100?g/mL浓度范围内线性关系良好。
2.4 精密度实验
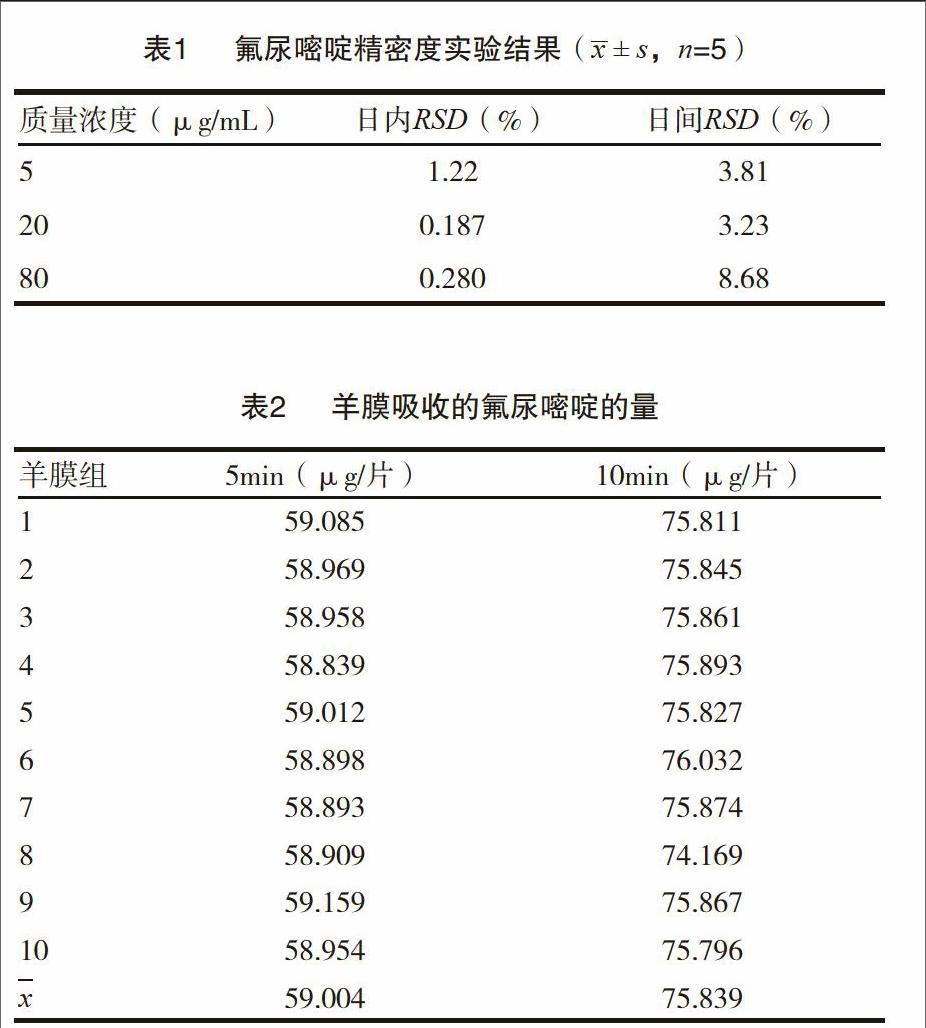
取5-氟尿嘧啶对照品,分别制成低、中、高3种不同浓度(5,20,80?g/mL)的对照品溶液,各连续进5次。同样方法做3d,记录5-氟尿嘧啶峰面积,并计算峰面积的RSD%值。见表1。
2.5 样品测定
取生物羊膜(面积为8mm×10mm)放入2mL 5-氟尿嘧啶注射液(标示量为10mL;0.25g)中浸泡,其中生物羊膜的数量为20个,10个浸泡5min,10个浸泡10min。将羊膜取出后,加流动相1.0mL,漩涡混匀2min,离心,取上清液,进样20μL,记录峰面积。记录峰面积带入上述方程中,求得羊膜吸收的量。见表2。
3 讨论
3.1 流动相的选择
根据5-氟尿嘧啶的物理和化学性质(即5-Fu在水中略溶,在乙醇中微溶,在氯仿中几乎不溶,在稀盐酸或氢氧化钠溶液中微溶)初步选定流动相为甲醇-水。又以各种体积比的甲醇-水(2︰98,5︰95,10︰90,15︰85,20︰80)进行色谱实验,结果发现,当以2︰98甲醇-水作为流动相时,所得5-氟尿嘧啶的峰形,峰高最佳。故最终选择2︰98的甲醇-水作流动相[6-8]。
3.2 5-氟尿嘧啶的提取
文献报道,对5-氟尿嘧啶的提取应用乙酸乙酯提取,离心取上清液,吹干后复溶[9-10]。本实验发现,当羊膜在注射液中浸泡后,用流动相提取的效果比乙酸乙酯提取的效果好,峰面积更大,故本次试验5-氟尿嘧啶的提取用流动相,此法简便,省时。
3.3 羊膜吸收量与浸泡时间
本实验所得结果,浸泡5min的羊膜吸收5-氟尿嘧啶的量比浸泡10min的羊膜吸收的5-氟尿嘧啶的量少,说明羊膜吸收量与浸泡时间相关。但由于羊膜数量较少,未能计算出精确的比例关系,若想进一步求证,还需较多数量的羊膜进行试验。
3.4 药物复合型羊膜的应用前景
羊膜抗原性甚微[11-12],同时具有清除炎性细胞,减轻炎症反应和血管化的作用,可以减少创面的瘢痕增生[12-13]。利用羊膜的生物学特点,通过生物工程技术手段,人为改变羊膜特定的结构(去羊膜上皮细胞或改变上皮细胞性质)及成分(吸附特定的药物,使羊膜原有化学成分发生变化),使其在保持羊膜基本生理特性的同时赋予其更多的生物学功能,我们称其为羊膜的生物学改良,过去已经有关于羊膜吸附氧氟沙星等药物的报道[14-15]。 新鲜羊膜通过冷冻干燥技术、钴60辐照灭菌等操作步骤制成生物羊膜,是一种透明的、有一定韧性且无神经、血管和淋巴管的组织,保持了羊膜原有的组织结构、原有的基本化学组成、适用于临床要求的组织韧性和生理pH值、含水量低适于常温长期保存。经过对生物羊膜的超微结构研究发现,羊膜基底膜富含胶原纤维和网状纤维,交织排列成网状,网孔间隙约0.5~15?m[8],能容纳大量药物 ,可吸附药液作为“药库”,且因胶原降解时间较慢,所以可在较长时间内逐步释放出药物,并维持较长时间,同时维持局部有效药物浓度,成为良好的膜控半定量释药系统。任何微粒大小小于生物羊膜微孔的物质均能被储存其中。我们将生物羊膜置于25g/L 5-Fu溶液中,生物羊膜中也就储存了一定数量的5-Fu,本实验结果也显示,生物羊膜可以吸附一定量的5-Fu,同时羊膜吸收量与浸泡时间相关。因此,我们认为在能够将这种药物复合型的羊膜应用到小梁切除术中,生物羊膜在巩膜瓣下被逐渐的溶解和吸收,储存其中的5-Fu被逐渐的稀释和释放出来,与生物羊膜一起发挥抑制滤过通道细胞增殖的作用,因此可以认为生物羊膜在本研究中起到了“天然缓释装置”的作用。这将大大提高青光眼手术的成功率。
[参考文献]
[1] 魏庆华,石浔.生物羊膜在眼科的应用[J].江西医药,2009,44(4):374-376.
[2] 叶芬,吴艳,施宇华,等.羊膜匀浆提取液对大鼠碱烧伤后角膜瘢痕形成的抑制作用[J].眼科新进展,2014,34(3):222-225.
[3] 叶芬,夏元,施宇华,等.共聚焦显微镜观察人羊膜内浆提取液对大鼠碱烧伤后角膜超微结构的影响[J].临床眼科杂志,2014,22(2):180-183.
[4] 章政,周克相,陈燕芳.小梁切除联合生物羊膜移植治疗难治性青光眼[J].眼外伤职业眼病杂志,2009,31(3):221-223.
[5] 胡义珍,蔡世佳,胡燕华.青光眼滤过术中环孢霉素A与5-氟尿嘧啶的疗效对比观察[J].中国实用眼科杂志,2003,21(12):948-950.
[6] 侯晓虹,范岩,杨颖,等.HPLC法测定复方氟尿嘧啶多相脂质体口服液中5-氟尿嘧啶含量[J].药物分析杂志,2004,24(2):203-204.
[7] 俞敏,王世亮,王小董,等.高效液相色谱法测定人血浆中5-Fu浓度[J].安徽医药,2014,18(8):1433-1436.
[8] 王璐璐,陈少华,相莉,等.高效液相色谱法测定5-氟尿嘧啶复乳原位凝胶的含量[J].中国药业,2014,23(22):53-55.
[9] 施宪宝,郑志昌.高效液相色谱法测定胃癌周围淋巴结中5-氟尿嘧啶[J].中国医院药学杂志,2008,28(23):1989-1991.
[10] 陈碧.HPLC法测定人血清中5-氟尿嘧啶浓度[J].医药沙龙,2005,29(7):332-334.
[11] 康凤英,陶靖,李前进,等.准分子激光屈光性角膜切削术后兔角膜基质细胞凋亡及其防治的研究[J].中华眼科杂志,2002,38(7):433-437.
[12] 马晓峰,董乐乐.人羊膜的研究进展[J].中国医药指南,2013,11(26):51-52.
[13] Baldwin HC,Marshall J.Growth factors in corneal wound healing following refractive surgery[J].Acta Ophthalmol,2002,80(3):238-247.
[14] 赵愈敏,袁南荣,袁志兰,等.丝裂霉素C 与地塞米松治疗PRK 后角膜上皮下雾状混浊的对比实验研究[J].眼科新进展,2002,22(2):88-90.
[15] 景聪荣.羊膜移植治疗轻度真菌性角膜溃疡24例疗效观察[J].中华实用诊断与治疗杂志,2014,28(6):574-575.
(收稿日期:2015-10-19)